刺梨多酚对NG-硝基-L-精氨酸甲酯诱导小鼠高血压的影响及机制
徐 青,谭书明*,俞 露,袁 梦,谭芸芸,张丽群
(贵州大学酿酒与食品工程学院,贵州省刺梨研究院,贵州 贵阳 550025)
高血压由动脉压持续升高造成[1],它是一种死亡率极高的心脑血管疾病[2]。全球范围内高血压患者约有11.3亿 人,其中80%的患者未得到妥善的健康管理[3]。引发高血压的主要原因大多归结于遗传、高脂高盐膳食和心理因素,其发病机制复杂,并伴随脑、心脏和肾脏等脏器损伤,发现不及时或治疗不当可能导致心肌梗死、中风、肾功能衰竭甚至死亡[4]。目前常见的降血压药物大多是化学合成类药物,不仅依赖性大且伴有副作用,这导致高血压患者接受治疗依从性差[5]。而从天然植物中提取的降血压活性成分可代替合成类药物用于高血压的治疗,并能减少副作用、增加安全性[6]。
刺梨是落叶灌木缫丝花(Rosa roxburghii,RR)的果实,又名刺莓果、送春归,是一种功能性食品,它主要分布在云贵高原、湖南及四川西部高原,尤其在贵州省产量最为丰富[7]。刺梨果实营养丰富,富含多酚、黄酮、多糖等成分[8]。研究表明,植物多酚提取物具有降血压作用[9-11];王著等[12]研究发现石榴多酚能显著降低高血压大鼠收缩压和舒张压,其作用机制可能与改善血管舒张作用,上调NO、下调血管紧张素II(angiotensin II,Ang II)和内皮素-1(endothelin-1,ET-1)水平有关。Moreno-Luna等[13]研究发现橄榄油多酚能提高NO的生物利用度,食用富含多酚的橄榄油可显著降低血压和改善内皮功能。Yuan Yao等[14]研究发现富含多酚的荔枝种子提取物可通过抑制炎症、减少氧化应激和调节肠道菌群来降低血压和改善高血压引发的肾损伤。有研究表明,刺梨多酚(Rosa roxburghiifruit polyphenols,RRP)具有解酒护肝、改善高脂膳食小鼠脂代谢和预防糖尿病等功效[15-17],但目前对RRP降血压作用的研究欠缺,故本研究进一步探讨刺梨多酚提取物对NG-硝基-L-精氨酸甲酯(NG-nitro-L-arginine methyl ester,L-NAME)诱导的小鼠高血压的影响。
1 材料与方法
1.1 动物、材料与试剂
50 只SPF级雄性KM小鼠((35±2)g,生产许可证号:SCXK(湘)2019-0014),购自长沙市天勤生物技术有限公司。
刺梨(‘贵农5号’)由贵州宏财聚农投资有限公司提供;标准饲料与垫料购自重庆腾鑫生物技术有限公司。
没食子酸标准品 上海麦克林生化科技有限公司;L-NAME 上海源叶生物科技有限公司;卡托普利贵州一树药业股份有限公司; 白细胞介素- 6(interleukin-6,IL-6)试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、一氧化氮(nitric oxide,NO)试剂盒、ET-1试剂盒、Ang II试剂盒、肾素试剂盒、醛固酮(aldosterone,ALD)试剂盒 泉州市睿信生物科技有限公司。
1.2 仪器与设备
BT-100-02恒流泵 苏州辰傲电子科技有限公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;SpectraMax190酶标仪 美国Molecular Devices公司;UV9000S紫外分光光度计 上海元析仪器有限公司;BP-2010A智能无创血压计 北京软隆生物技术有限公司;H1-16KR高速冷冻离心机 湖南可成仪器设备有限公司;DY89-II匀浆机 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 RRP的制备
取适量刺梨果剁碎真空冷冻干燥72 h,料理机高速研磨后得到刺梨粉若干待用。
RRP的提取与纯化:参考文献[18-20]的方法并稍作调整,称取适量刺梨粉倒入烧杯,加入0.25%(以刺梨粉质量计)的纤维素酶粉末,按料液比1∶5加入纯水搅拌均匀后40 ℃酶解2 h,随后按料液比1∶15加入体积分数80%乙醇溶液搅拌均匀,在超声条件下(温度40 ℃、超声时间50 min、超声功率300 W)提取完成后经抽滤除去固体杂质,随后在50 ℃条件下旋转蒸发除去乙醇即得RRP粗提液。RRP粗提液在常温下经AB-8大孔树脂吸附10 h后解吸(80%乙醇、上样量500 mL、洗脱液用量2 500 mL),洗脱液经旋转蒸发、真空冷冻干燥后得RRP备用。
1.3.2 RRP中多酚纯度的测定
参考刘祖望等[21]的方法略有修改,配制质量浓度0.1 mg/mL没食子酸标准品溶液备用;分别吸取没食子酸标准品溶液60、80、100、120、140、160、180、200、220 μL于5 mL棕色离心管中,纯水定容至500 μL后加入500 μL福林-酚试剂,混匀后避光反应2 min,随后再加入2 mL、质量分数10% Na2CO3溶液,最后加入1 mL纯水,摇匀,40 ℃恒温水浴30 min后于760 nm波长处检测OD值。标准曲线方程为:y=21.045x+0.057 4,R2=0.999,利用标准曲线方程计算可得RRP中多酚纯度为68%。
1.3.3L-NAME诱导小鼠高血压模型的建立与分组
小鼠适应性喂养1 周((25±1)℃,12 h光暗循环)后,除空白组(n=10)外其余组开始诱导建模(L-NAME,15 mg/(kgmb·d)腹腔注射4 周),每周用BP-2010A智能无创血压仪测量清醒小鼠的收缩压(systolic blood pressure,SBP),SBP连续3 d大于140 mm Hg并稳定则视为建模成功[22]。
将建模成功的小鼠分为4 组(n=10):模型组(9 g/L生理盐水)、阳性组(50 mg/(kgmb·d)卡托普利)、RPP低剂量组(250 mg/(kgmb·d)RPP)、RPP高剂量组(500 mg/(kgmb·d)RPP),对各组小鼠进行灌胃,空白组灌胃生理盐水(质量浓度9 g/L)[23];持续干预4 周,每周测量血压并记录。第56天对小鼠进行末次血压测量后禁食不禁水12 h。采用眼眶取血置于离心管中,高速冷冻离心(4 ℃、3 500 r/min、5 min),取上清液于-80 ℃冰箱中保存;解剖后摘取心、肝、肾称质量并记录(以其质量表征相应的脏器指数);心脏和其中的一个肾脏放入4%多聚甲醛固定液中保存,用于病理学分析;肝脏均分为3 份后,与另一个肾脏用液氮暂存后转入-80 ℃冰箱中保存。
1.3.4 生理指标测定
3.贫困人口获得健康能力低下,直接降低了健康扶贫政策的实际绩效。单纯疾病治疗缺乏可持续效果,贫困者自身不能在扶贫中发挥有效作用,这也是目前健康扶贫的突出问题。阿玛蒂亚·森充分强调了个人可行能力的重要性,“仅仅关注人们如何实现功能性活动是不够的,关注一个人是否有能力去实现功能性活动也是同等重要的”。[12]世界卫生组织《阿拉木图宣言》也提出了初级卫生保健九个部分内容,健康教育,食品供给及适当的营养,安全饮用水,基本卫生设施,妇幼保健,免疫接种、地方性疾病预防,普通疾病和受伤的治疗,基本药物供给等,这些政策体现了以提升贫困者健康可行能力为基础的整体性政策建构。
1.3.4.1 NO、ET-1、Ang II、肾素和ALD水平的测定
采用酶联免疫吸附试验(e n z y m e l i n k e d immunosorbent assay,ELISA)测定血清中NO、ET-1、Ang II、肾素和ALD水平,以上实验均严格按照试剂盒说明书进行。
1.3.4.2 炎症标志物和氧化应激标志物水平的测定
采用ELISA法测定血清中IL-6和TNF-α的质量浓度,采用生化法检测小鼠肾脏和肝脏组织匀浆中SOD、GSH-Px和MDA水平,操作步骤均严格按照试剂盒说明书进行。
1.3.5 肾脏和心脏组织切片病理学分析
采用苏木精-伊红(hematoxylin-eosin,HE)染色法分别对心脏和肾脏组织进行染色,并在光学显微镜下观察其结构,从而对其病理学变化进行评价。
1.4 数据统计与分析
采用SPSS 26.0软件进行数据分析,实验数据用平均值±标准差表示,组间显著性差异采用单因素方差分析(ANOVA),P<0.05表示具有统计学意义。利用Origin 2021软件作图。
2 结果与分析
2.1 RRP对高血压小鼠血压和脏器指数的影响
2.1.1 RRP对高血压小鼠血压的影响

图1 RRP对小鼠血压的影响Fig.1 Effect of RRP on systolic blood pressure in mice
2.1.2 RRP对高血压小鼠脏器指数的影响
心脏质量增加与高血压引起的心肌肥大有关[24],肾脏质量减轻与肾脏损伤和血压升高密切相关[25]。如表1所示,与空白组相比,模型组心脏指数上升51.8%(P<0.05),肾脏指数降低32.4%(P<0.05)。与模型组相比,阳性组、RRP低剂量组、RRP高剂量组心脏指数分别降低30.5%、17.9%、24.8%(P<0.05),肾脏指数分别上升25.0%、10.3%、18.9%(P<0.05)。说明阳性药物及卡托普利低、高剂量RRP均能显著改善高血压对心脏和肾脏带来的不良影响,改善效果依次为阳性药物>高剂量RRP组>低剂量RRP。

表1 RRP对小鼠脏器指数的影响Table 1 Effect of RRP on organ indexes of mice
2.2 RRP对高血压小鼠血清NO、ET-1、Ang II、肾素和ALD水平的影响
NO的缺乏和ET-1水平的增加会导致血压升高[26-27]。如表2所示,与空白组相比,模型组NO浓度降低53.0%,ET-1质量浓度上升51.7%(P<0.05)。与模型组相比,阳性组、RRP低剂量组、RRP高剂量组NO浓度分别上升90.7%、47.0%、63.4%(P<0.05),ET-1质量浓度分别降低25.2%、7.0%、15.9%(P<0.05)。说明阳性药物和低、高剂量RRP均能显著改善NO和ET-1水平,改善效果依次为阳性组>RRP高剂量组>RRP低剂量组,这为RRP能改善血管收缩和内皮功能障碍提供了理论依据。

表2 RRP对高血压小鼠血清中NO、ET-1、Ang II、肾素和ALD水平的影响Table 2 Effect of RRP on serum NO, ET-1, Ang II, renin and ALD levels
Ang II、肾素和ALD是肾素-血管紧张素-醛固酮系统(renin angiotensin aldosterone system,RAAS)的组成成分,在高血压患者中通常表现为Ang II、肾素和ALD水平升高[28]。由表2可知,与空白组相比,模型组Ang II质量浓度升高63.2%(P<0.05),肾素质量浓度升高56.6%(P<0.05),ALD质量浓度升高74.5%(P<0.05)。与模型组相比,阳性组Ang II、肾素和ALD质量浓度分别下降26.5%、29.86%、34.3%(P<0.05);RRP低剂量组上述指标分别下降6.5%、5.9%、9.7%(P<0.05);RRP高剂量组分别下降14.8%、13.3%、16.2%(P<0.05)。说明阳性药物和低、高剂量RRP均能显著改善Ang II、肾素和ALD水平,改善效果依次为阳性药物>高剂量组RRP>低剂量RRP。
2.3 RRP对高血压小鼠血清炎症标志物IL-6和TNF-α质量浓度的影响
如图2所示,与空白组相比,模型组IL-6质量浓度升高55.0%,TNF-α质量浓度升高157.2%(P<0.05)。与模型组相比,阳性组、RRP低剂量组、RRP高剂量组IL-6质量浓度分别降低22.3%、7.4%、13.3%,TNF-α质量浓度分别降低43.5%、15.8%、24.3%(P<0.05)。说明阳性药物及低、高剂量RRP均能显著缓解高血压小鼠炎症,缓解效果依次为阳性药物>高剂量组RRP>低剂量RRP。
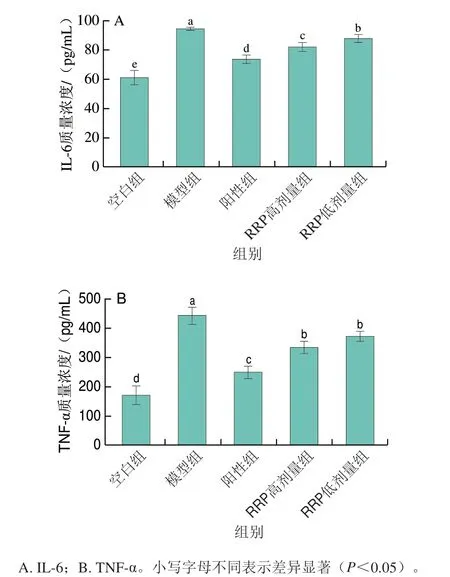
图2 RRP对血清炎症标志物的影响Fig.2 Effect of RRP on inflammatory markers in serum
2.4 RRP对高血压小鼠肝脏和肾脏氧化应激标志物的影响
如图3 所示,与空白组相比,模型组肾脏组织中SOD、GSH-P x 活力分别降低71.3%、28.9%(P<0.05),MDA水平上升112.5%(P<0.05);肝脏组织中SOD、GSH-Px活力分别降低65.1%、29.9%(P<0.05),MDA水平上升117.0%(P<0.05)。与模型组相比,阳性组肾脏组织中SOD、GSH-Px活力分别升高161.0%、30.2%(P<0.05),MDA水平降低28.2%(P<0.05);肝脏组织中SOD、GSH-Px活力分别升高142.0%、32.4%(P<0.05),MDA水平降低43.3%(P<0.05)。与模型组相比,RRP低剂量组肾脏组织中SOD、GSH-Px活力分别升高10.2%、14.7%,MDA水平降低13.7%(P<0.05);肝脏组织中SOD、GSH-Px活力分别升高64.9%、8.4%(P<0.05),MDA水平降低9.6%(P<0.05)。与模型组相比,RRP高剂量组肾脏组织中SOD、GSH-Px活力分别升高33.5%、19.4%,MDA水平降低18.9%(P<0.05);肝脏组织中SOD、GSH-Px活力分别升高113%、18.4%(P<0.05),MDA水平降低31.0%(P<0.05)。说明阳性药物及低、高剂量RRP均可显著改善肾脏和肝脏中的脂质过氧化,减少氧化应激,改善效果依次为阳性药物>高剂量RRP>低剂量RRP。

图3 RRP对小鼠氧化应激标志物的影响Fig.3 Effect of RRP on biomarkers of oxidative stress in mice
2.5 肾脏和心脏组织切片病理学分析
2.5.1 肾脏组织病理学分析
由图4可见,空白组肾小球、肾小管组织结构正常,形态结构完整,未见明显病理损伤变化。模型组肾小管、肾小球囊壁的基膜增厚,肾脏组织坏死,出现蓝染矿化灶和肾间质纤维细胞增生,伴有炎性细胞浸润。经阳性药物和RRP干预后病理症状明显减轻,表现为阳性组仅少量肾小管上皮细胞见轻微肿胀,肾小管内可见有丝网状蛋白沉积;RRP高剂量组肾小球结构正常,肾小管上皮细胞肿胀,肾小管内可见少量蛋白管型;RRP低剂量组可见纤维细胞增生,肾小管内可见均匀分布的蛋白管型、上皮细胞核空泡状。说明RRP治疗能显著改善高血压小鼠肾脏组织病理学表现、减少蛋白沉积。
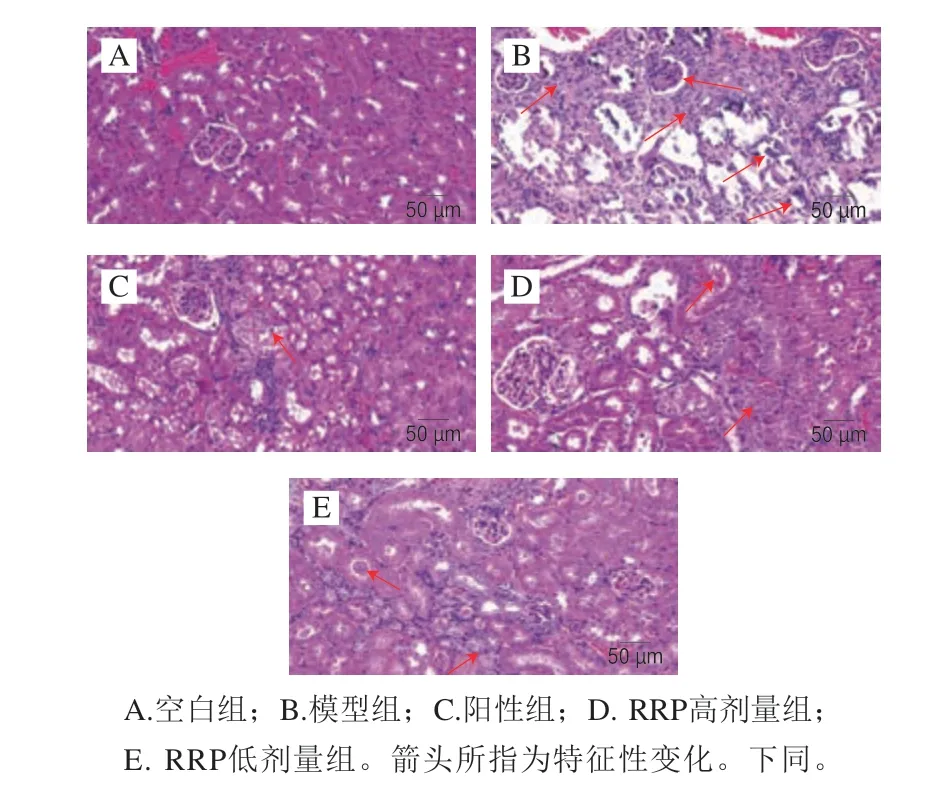
图4 L-NAME诱导的高血压小鼠肾脏组织切片(×400)Fig.4 Renal tissue sections of mice with L-NAME-induced hypertension (× 400)
2.5.2 心脏组织病理学分析
由图5可知,空白组心肌细胞排列整齐、结构完整,未见有明显病理损伤改变。模型组心肌细胞排列紊乱,肌细胞梭形改变,心肌细胞肿大,组织内黑色素沉积。阳性组心脏细胞排列整齐,横纹清晰可见,损伤不明显。RRP高剂量组心肌细胞排列整齐,心肌组织内有较大空泡。RRP低剂量组局部心肌细胞纤细、排列紧密,染色效果较周围心肌细胞浅。说明RRP治疗能改善高血压小鼠心脏组织病理症状、缓解心肌细胞肿大。
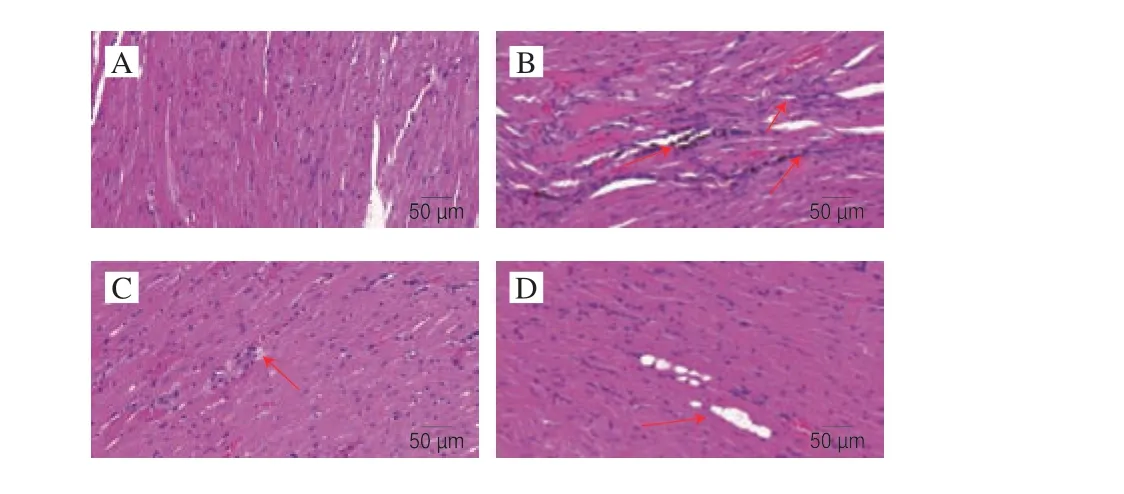
图5 L-NAME诱导的高血压小鼠心脏组织切片(×400)Fig.5 Heart tissue sections of mice with L-NAME-induced hypertension (× 400)
3 讨 论
血压升高是导致高血压患者死亡率上升的重要因素,它会造成机体一系列靶器官受损,如心脏肥大、肾脏疾病和动脉粥样硬化[29]等。改善高血压最直接的办法是降低血压,从而减少心脑血管疾病的发生,本实验结果表明RRP对高血压小鼠血压可起到显著的改善作用。
NO是一种有效的血管扩张剂[30],能介导血管舒张的最小气态胞间信号分子,可维持血管内的正常张力[31]。NO缺乏会导致全身血管收缩和血压升高;ET-1是人体作用最持久、最强的血管收缩肽和细胞增殖的驱动因子,会引起血管壁增生和狭窄,导致血管平滑肌肥大和增生[32]。本实验结果显示,与模型组相比,RRP处理能显著提升NO浓度,显著降低ET-1质量浓度,说明RRP处理能改善高血压小鼠的内皮功能障碍。
RAAS的过度激活是导致血压升高的重要原因之一[33],在调节血压和血管功能中至关重要,也是探究高血压降压机制和开发降血压药物的关键靶点。肾素裂解血管紧张素原的N端形成Ang I,Ang I在内皮细胞中血管紧张素转换酶(angiotensin converting enzyme,ACE)的作用下转化为Ang II;Ang II是RAAS的主要效应物,它能收缩血管引发高血压、激活结缔组织生长因子和刺激肾上腺ALD的分泌。血清中Ang II水平降低代表着血管收缩剂活性下降,从而导致ALD分泌减少、血压降低[34]。而ALD水平过高会导致内皮功能障碍,它与血管平滑肌的增殖、血管外基质沉积、纤维细胞活化有关[35]。总地来说,抑制Ang II、肾素和ALD的产生能避免RAAS的过度激活,从而降低血压和保护心血管器官[36]。本研究结果显示,与模型组相比,高、低剂量RRP能显著降低Ang II、肾素和ALD质量浓度。从肾脏和心脏的组织切片可看出,高剂量RRP可改善肾脏组织纤维细胞增生和蛋白沉积,缓解心肌细胞肿大等病理症状,这可能与RRP降低了Ang II、ALD和ET-1水平相关。降血压效果由高到低分别为阳性药物>高剂量RRP>低剂量RRP,说明RRP能抑制L-NAME引起的RAAS过度激活,一定程度上缓解高血压导致的胶原沉积和纤维化。RRP对NO和ET-1水平的改善程度明显优于RASS,由此可知,RRP主要通过提高NO水平、改善内皮功能障碍来降低L-NAME诱导的血压升高;此外,RRP能抑制RAAS过度激活,减少靶器官损伤。
高血压常伴有低程度的炎性反应,血液的炎症反应会增加诱发高血压的可能性[37]。IL-6和TNF-α是尤为关键的两种炎症因子,过量表达会增加血液中的阻力,使血压升高。IL-6是具有多种作用的细胞因子,它可以降低内皮细胞中前列环素的含量,提高Ca2+的渗入和浓度,同时也会引起动脉学管收缩和血压的上升[38]。TNF-α是造成人体炎症的最主要因子,其主要作用是促进IL-6的产生,从而促进血小板源生长因子的分泌、细胞的纤维化和血管平滑肌细胞的增殖,造成血管壁直径减小、血管阻力增大,最终导致血压上升[39]。本实验结果显示,高、低剂量RRP均可显著降低高血压小鼠IL-6和TNF-α水平(P<0.05),减轻高血压小鼠机体炎症。此外,IL-6和TNF-α水平的升高会增加活性氧(reactive oxygen species,ROS)水平,而ROS过量产生引起的氧化应激在高血压的发病机制中发挥关键作用,氧化应激或受损的内皮细胞会激活免疫系统的促炎状态,而炎症会导致内皮功能障碍[40]。本研究结果显示,高、低剂量RRP均能显著改善高血压小鼠肾脏和肝脏中SOD、MDA、GSH-Px水平(P<0.05),表明RRP能减轻高血压小鼠氧化应激反应。
综上,RRP能降低高血压小鼠血压,提高NO含量,降低ET-1、AngII、肾素和ALD质量浓度,这与王著等[12]对石榴多酚的降血压作用研究结果一致,且对比得出RRP对NO水平的改善效果突出;同时,RRP能减轻伴随血压升高出现的炎症和氧化应激,保护高血压小鼠心脏和肾脏,缓解其脏器损伤。本研究结果表明,RRP具有降血压效果,这主要与RRP能够提高高血压小鼠NO水平、改善内皮细胞功能、抑制RAAS过度激活有关,RRP降血压作用的确切单体成分以及具体作用通路有待进一步研究。

