界面蛋白对水酶法提取植物油脂过程中乳状液稳定性影响的研究进展
李天赐,陈毅保,刘昆仑,陈复生,杨趁仙*,段晓杰,朱婷伟
(河南工业大学粮油食品学院,河南 郑州 450001)
水酶法以水作为萃取和分离的介质,通过酶水解植物细胞壁和油体界面膜结构从而破坏植物细胞,根据非油成分对油、水的亲和力差异以及油、水的比重不同,实现同时分离油脂和蛋白质。与传统的油脂提取方法(压榨法和溶剂萃取法)相比,其反应条件温和、产品安全、能耗低、所得油脂质量高且可以最大程度保留蛋白质,避免植物蛋白资源浪费[1-5]。近年来,水酶法作为一种高效、安全、环保的提取植物油脂的方法,已经得到了大量的研究[6-10]。然而,水酶法提取植物油脂过程中,经酶水解作用后,部分油体被破坏释放出油脂,油滴进入水相,油料蛋白质吸附至油脂表面,在搅拌作用下形成稳定的乳状液,大部分油以乳状液的形式存在,少部分留存在水相和渣相中[11-13]。乳状液中含有少量的蛋白质、磷脂、碳水化合物等成分,其中蛋白质和磷脂以表面活性剂的形式存在,可以形成具有黏弹性的界面膜结构,防止油滴聚集,从而限制了油脂的提取[14-16]。因此,对水酶法提取植物油脂形成的乳状液进行破乳是提高油产量的关键[17-19]。目前,对乳状液进行破乳的方法主要包括物理法[20]、化学法[21]、酶法[22]以及复合法[23];关于不同植物(如以花生[24-25]、大豆[21,26]、菜籽[27-28]等为原料)油脂乳状液破乳工艺流程的研究也相对成熟;然而,乳状液破乳的机理亟需进一步深入研究,这就需要对维持乳状液稳定的界面膜成分进行分析。
蛋白质作为一种天然的表面活性剂,在水酶法提取植物油的过程中,其非极性亲油基团会迅速吸附在油滴表面,形成一层或者几层界面膜,通过降低界面张力使油滴之间相互分离,阻碍了油滴的聚集;同时,蛋白质的极性亲水基团会与连续的水相结合,使得油滴稳定地分布在水相之中,形成稳定的水包油(O/W)乳状液[29-30]。本文将介绍乳状液的组成及其稳定性机理,并重点阐述界面蛋白浓度、结构和性质对乳状液稳定性的影响,从界面蛋白结构的变化角度分析其破乳机理,为探明乳状液的破乳机理提供理论依据。
1 乳状液的组成及其稳定机理
水酶法提取植物油脂过程中形成的乳状液的主要成分是油和水,此外还含有少量的表面活性剂——蛋白质和磷脂等其他成分。其中,蛋白质是组成乳状液界面膜最主要的大分子物质,在水酶法提取植物油脂的过程中,具有两亲性的蛋白质作为表面活性剂吸附至油-水界面(图1A),在界面上展开重排,暴露出内部的疏水性氨基酸,再通过共价交联和非共价相互作用形成具有扩张性、抗压缩性和高黏弹性的界面膜(图1B),在静电相互作用(图1C)和空间位阻作用(图1D)下可以有效地防止油滴聚并,维持乳状液的稳定性[31-33]。乳状液油-水界面膜上的蛋白质由油体内源蛋白、贮藏蛋白和一些小分子质量蛋白组成[14,34-35];其中,油体内源蛋白对维持油体乳液稳定性起到关键性作用,主要包括油体蛋白(15~26 kDa)、油体钙蛋白(27 kDa)和油体甾醇蛋白(39~41 kDa)[36-38]。激光扫描共聚焦显微镜(confocal laser scanning microscopy,CLSM)是观察乳状液中蛋白质和油脂分布最常用的方法。Niu Ruihao等[16]利用CLSM观察到在花生乳状液中蛋白质分散在油脂体的表面,而油脂体的内部则被油脂填充,这表明蛋白质形成了一层界面膜包裹着油脂,阻碍了油脂的释放,维持了乳状液的稳定性,图2为油体的立体结构和3 种蛋白质的镶嵌模型。Li Pengfei等[39]采用CLSM观察了花生乳状液在破乳过程中的变化,原始乳状液中油滴被紧密地包裹在蛋白质内部,随着酶解时间的延长,油滴的粒径逐渐增大,包裹油滴的蛋白膜被破坏。Miriani等[40]利用荧光法研究了大豆乳状液中和油-水界面上β-伴大豆球蛋白和大豆球蛋白的结构性质,发现这两种蛋白质的结构在油-水界面膜上都发生了变化。这些结果表明蛋白质对维持乳状液的稳定性起着关键性的作用。
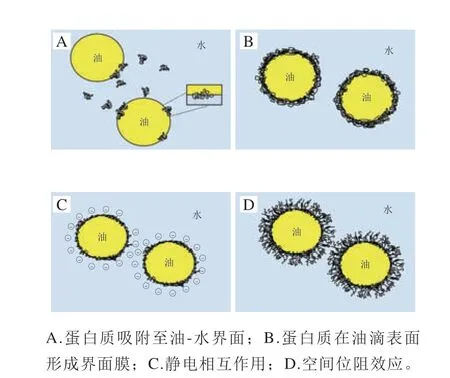
图1 乳状液的稳定机理[31]Fig.1 Stability mechanism of emulsion[31]

图2 油体立体结构以及油体蛋白镶嵌模型[41-44]Fig.2 Stereoscopic structure of oil body and mosaic model of oil body protein[41-44]
2 界面蛋白对乳状液稳定性的影响
乳状液的稳定性很大程度上取决于吸附在油-水界面膜上的表面活性剂的浓度、结构和性质。在乳状液形成的过程中,具有两亲性的蛋白质吸附在油-水界面上,形成一层或者多层界面膜,同时,界面蛋白分子的相互重叠及其双电层的重叠产生了空间相互作用和静电相互作用,这两种排斥力可以有效地防止油滴的絮凝和聚集,从而维持乳状液的稳定性[45-46]。
2.1 界面蛋白浓度对乳状液稳定性的影响
界面蛋白浓度是决定乳状液稳定的重要参数之一。界面蛋白浓度越高,油滴表面覆盖程度越高,越有利于降低两相界面张力,从而使蛋白质乳化性更强,乳状液更稳定[47]。Tcholakova等[48]认为由单层蛋白膜稳定的乳状液所需的最低界面蛋白浓度为1~2 mg/m2。Chabrand等[21]测定得到水酶法提取大豆油过程中形成的乳状液中界面蛋白浓度为14.64 mg/m2,明显高于1~2 mg/m2,这一结果表明水酶法提取过程中可以形成多层膜、稳定性强的乳状液。同样地,Zhang Shaobing等[49]利用水酶法提取花生油时,所得乳状液的界面蛋白浓度为7.92 mg/m2,也明显高于稳定乳状液所需的最低蛋白浓度,说明花生油的表面可能覆盖多层蛋白质,可以有效防止油滴之间的聚集,从而形成稳定的乳状液。Liu Chen等[47]对花生原料分别进行干法粉碎和湿法粉碎,研究这两种预处理对水酶法提取花生油过程中乳状液的影响,两种方法得到的乳状液界面蛋白浓度分别为(7.02±0.21)mg/m2和(10.71±0.19)mg/m2,两种预处理方法得到的乳状液油滴表面均形成了多层蛋白膜,且湿法粉碎得到的乳状液稳定性更强。
2.2 界面蛋白结构对乳状液稳定性的影响
2.2.1 界面蛋白分子质量分布对乳状液稳定性的影响
乳状液的稳定性与其油-水界面膜上蛋白质的类型和结构有着密切的关系。Chabrand等[21]对大豆乳状液采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析,发现乳状液中含有两种大豆蛋白:一种是含有α-、α’-和β-亚基的β-伴大豆球蛋白(分子质量120~200 kDa);另一种是含有酸性和碱性亚基的大豆球蛋白(300~380 kDa)。另外,还发现了几条由两亲性N-末端、C-末端和疏水中心组成的油球蛋白(分子质量18~24 kDa)。在水酶法提取大豆油的过程中,高分子质量蛋白质和油球蛋白形成多层界面膜共同维持乳状液的稳定。胡淼等[50]通过比较大豆分离蛋白和乳状液界面蛋白的亚基分布,发现在水酶法提取植物油脂过程中,由于蛋白酶的作用,与大豆分离蛋白相比,乳状液界面蛋白亚基分布条带变窄,48~63 kDa范围内的条带全部消失,17~20 kDa条带颜色变浅,乳状液的多肽谱图显示留存的最主要条带分子质量为11~17 kDa。Dias等[51]通过SDS-PAGE分析了杏仁原始乳状液及对其进行化学破乳和酶法破乳后界面蛋白的低分子质量多肽谱,发现原始乳状液和化学破乳乳状液都含有高分子质量的杏仁蛋白(含α-亚基和β-亚基)和较小的油球蛋白,由分子质量分别为38~40 kDa和20 kDa的两条主带组成,这两条主带约占泳道面积的52%,而经过酶法破乳后,杏仁蛋白的碱性亚基完全降解,酸性亚基的含量也显著减少,且大部分多肽分子质量都小于10 kDa。酶处理可以通过水解界面蛋白降低蛋白质的分子质量,有效地破坏界面蛋白的结构,破坏界面膜的完整性,从而促进油滴的聚集[52-53]。Schroder等[54]比较了小分子肽(<5 kDa)和大分子肽(>5 kDa)对乳状液稳定性的影响,发现大分子肽比小分子肽更容易吸附至界面膜上,相对分子质量较大的界面吸附肽具有较长的侧链结构,能够在油滴表面形成保护层,表现出较好的抗絮凝和抗聚集作用,从而易于形成稳定的乳状液[20]。
2.2.2 界面蛋白的二硫键含量对乳状液稳定性的影响
在水酶法提取植物油脂形成乳状液的过程中,界面膜上的蛋白质通过巯基-二硫化物的交换作用与连续相中蛋白质发生聚合,因此二硫键含量的升高有助于形成稳定性强的黏弹性膜。Zhang Shaobing等[49]分别比较了花生蛋白和花生乳状液中界面蛋白、乳状液中未吸附蛋白、破乳后乳状液中肽和水相中肽的二硫键含量,发现乳状液中界面蛋白的二硫键含量显著高于其他来源的蛋白质,经酶解破乳后乳脂层中肽的二硫键含量高于水相中二硫键含量。迟延娜[55]通过比较界面蛋白亚基在还原态和非还原态下的差异发现,花生乳状液中的大分子界面蛋白在酶解后降解为小分子的亚基,这些亚基在二硫键的作用下形成了肽段聚集体(分子质量10~50 kDa),然后吸附在油滴表面,形成了具有黏弹性的界面膜,从而维持乳状液的稳定性。这些结果表明二硫键在维持乳状液稳定上发挥重要的作用。二硫键是维持蛋白质结构的共价键,存在于蛋白质和多肽中,可以通过氧化还原反应与巯基相互转化影响蛋白质的结构及其功能性质,从而影响乳状液的稳定[56-57]。Wu Mangang等[58]研究发现油脂体界面蛋白与周围蛋白质之间形成的二硫键有助于维持乳状液的稳定,并且可以增强其流变性和机械性。刘向军[59]研究花生乳状液中二硫键以及巯基含量的变化,发现花生乳状液界面吸附蛋白巯基含量低于花生分离蛋白的巯基含量,但二硫键含量显著高于花生分离蛋白。通过对花生乳状液界面吸附蛋白的分子质量分布研究发现,油体蛋白与分子质量较大的蛋白质分子在二硫键的作用下结合,使更多的蛋白质吸附至油滴表面,同时,蛋白质中氨基酸疏水残基围绕着二硫键形成了局部疏水区域,这都有利于提高乳状液油-水界面稳定性。
2.2.3 界面蛋白的二级结构变化对乳状液稳定性的影响
界面蛋白的结构与功能有着密切的联系。蛋白质的二级结构主要包括大量的折叠片状结构以及少量的α-螺旋和无规卷曲,其中折叠片状结构包括β-折叠和β-转角。Li Pengfei等[60]发现与原始花生乳状液界面蛋白的二级结构相比,经蛋白酶酶解后乳状液中界面蛋白的α-螺旋、β-折叠和β-转角含量均出现降低的现象,而无规卷曲含量明显上升。同样地,胡淼等[50]研究发现,大豆乳状液界面蛋白的α-螺旋和β-折叠的含量较高,而β-转角和无规卷曲相对含量较少。Dias等[52]比较了水剂法和水酶法两种方法对蛋白质二级结构的影响,发现水酶法处理组蛋白质的无规卷曲结构含量显著高于水剂法处理组,而α-螺旋结构含量低于水剂法处理组,β-折叠和β-转角含量不存在显著性差异。乳状液界面吸附蛋白有序结构以α-螺旋和β-折叠为主,而β-转角和无规卷曲为无序结构,由于酶的作用,乳状液中蛋白质无序结构含量增加,形成的分子结构则更为疏松,蛋白质结构稳定性下降,乳状液稳定性也随之降低[61-63]。
2.3 界面蛋白的性质对乳状液稳定性的影响
2.3.1 界面蛋白的水解度与乳状液稳定性的关系
界面蛋白的理化性质对乳状液的稳定性起着关键的作用,界面蛋白的水解度可影响其表面疏水性从而影响乳状液的稳定性。Zhang Shaobing等[64]选用了多种蛋白酶对水相萃取技术提取花生油过程形成的乳状液进行破乳研究,测定了不同酶处理条件下乳状液中游离油含量和水解度。结果表明,这些蛋白酶都不同程度地降低了乳状液的稳定性,并且游离油得率随着界面蛋白水解度的增加而升高,说明油脂提取率与蛋白质的水解度呈正相关。界面蛋白经蛋白酶酶解后,分子质量减小并从界面膜上脱落,乳状液界面膜结构的完整性遭到破坏,从而引起油滴聚集导致破乳发生。Zhang Shaobing等[28]利用水酶法同时提取菜籽中油脂和蛋白质,研究了水酶法提取过程中乳状液的稳定性与水解度的关系。结果表明,在较低水解度(degree of hydrolysis,DH)(≤10%)条件下并未得到游离油,但与对照(未添加Alcalase 2.4L)相比,乳状液的油回收率略有提升,且有限水解可以提高乳状液的乳化能力;当DH≥10%(尤其是10%~12%的范围内),游离油的含量显著增高。当蛋白质被充分水解后,乳状液稳定性下降,乳状液中的油脂得以释放。Li Pengfei等[60]分别利用3 种碱性蛋白酶(Alcalase 2.4L、Preotex 6L、Protex 7L)及木瓜蛋白酶和风味蛋白酶(Protex 50FP)对花生乳状液进行酶法破乳,并且对破乳过程中乳状液中蛋白质的水解度和分子质量分布进行了研究。结果表明,随着水解时间的延长,各种酶处理的蛋白质水解度均增加,在120 min时,风味蛋白酶(Protex 50FP)的水解度和油回收率最高;然而,对分子质量分布的研究发现,低分子质量(<1 000 kDa)占比最高的是木瓜蛋白酶,而风味蛋白酶(Protex 50FP)的占比最低,且在高分子质量(>3 000 kDa)和中分子质量(1 000~3 000 kDa)中,风味蛋白酶的占比均最高,该结果表明风味蛋白酶(Protex 50FP)的水解效率低于木瓜蛋白酶(Papain),这一结果与水解度的结果相矛盾。作者认为产生这一差异有两个原因:一是风味蛋白酶在pH 4.5条件下易形成聚集体从而降低了水解效率;二是由于风味蛋白酶(Protex 50FP)是一种内肽酶-外肽酶复合体,相较于其他内肽酶更易于将蛋白质水解成游离的氨基酸,而水解度是根据游离氨基酸含量测定的,因此经风味蛋白酶处理的蛋白质的水解度更高。值得注意的是,研究界面蛋白对乳状液稳定性影响时,需要同时测定蛋白质的水解度和分子质量分布,以便更好地理解乳状液的稳定机制[65-67]。
2.3.2 界面蛋白的表面疏水性与乳状液稳定性的关系
表面疏水性与蛋白质的水解度有着紧密的关联,酶水解作用对蛋白质的表面疏水性有着双重影响。一方面,在酶水解作用条件下,埋藏在蛋白质内部的疏水基团在水解作用下暴露,增加了其表面疏水性;另一方面,蛋白质埋藏的疏水基团暴露,蛋白质与蛋白质之间在疏水相互作下发生聚集,疏水基团重新埋藏,这可能会导致表面疏水性的降低[68]。Zhang Shaobing等[49]研究了不同来源蛋白质的表面疏水性,发现乳状液中界面蛋白的表面疏水性最高,这是界面蛋白中的主要成分油球蛋白所致,因为油球蛋白含有一个由72 个氨基酸残基组成的高度保守的中心疏水区,而非油球蛋白在界面上发生变形,暴露其埋藏的疏水性氨基酸,从而增强了其表面疏水性。Li Pengfei等[39]分别使用木瓜蛋白酶和风味蛋白酶(Protex 50FP)对花生乳状液进行处理,木瓜蛋白酶处理组乳状液的表面疏水性显著低于风味蛋白酶处理组,然而,两组界面蛋白的表面疏水性都随着水解时间的延长而降低,说明在酶水解的作用下,蛋白质间相互作用增强,导致了分子重排,将大部分的疏水键限制在聚集体的内部。该研究同时表明,风味蛋白酶处理组界面蛋白的疏水性之所以更高,是由于在pH 4.5时发生了蛋白质的聚集,阻碍了蛋白酶的水解效率,使得碱性花生蛋白(分子质量18~24 kDa)具有更多的疏水基团,表现出更高的表面疏水性。
2.3.3 界面蛋白的乳化性质与乳状液稳定性的关系
蛋白质的乳化性质是指蛋白质能够作为乳化剂促进油与水形成稳定的乳状液,包括乳化活性和乳化稳定性。在促进油、水混合的过程中,单位质量蛋白质能够稳定油-水界面的面积称为蛋白质的乳化活性,而乳化稳定性是指蛋白质维持油、水不分离的乳化特性[69]。胡存书等[29]比较了花生乳状液中界面吸附蛋白与3 种分离蛋白(花生分离蛋白、菜籽分离蛋白和大豆分离蛋白)的乳化性质,其中,界面吸附蛋白的乳化活性显著高于其他3 种分离蛋白,其乳化稳定性与花生分离蛋白没有显著性差异,却显著高于菜籽分离蛋白和大豆分离蛋白,表现出较好的乳化性质。刘向军[59]分别提取花生乳状液中的界面蛋白、水相中的非吸附蛋白和分离蛋白,以不同蛋白质作为乳化剂,构建了水与花生油模拟体系,考察不同种类蛋白质的乳化性质的差异,发现界面吸附蛋白的乳化活性和乳化稳定性显著高于水相中非吸附蛋白和花生分离蛋白,表明界面吸附蛋白具有更好的乳化活性,在油-水界面更易形成单层或者多层的表面膜,将油滴紧密地包裹在内部,并且可以使油滴稳定地分布在水相之中,形成稳定的水包油型乳状液。
3 水酶法提取植物油脂乳状液破乳机理研究进展
3.1 物理方法破乳
物理破乳主要采用加热、微波、冷冻-解冻、高压CO2和高压蒸汽等方法对乳状液进行破乳。王文睿等[70]对水酶法提取的大豆乳状液进行微波处理,在微波电磁场的作用下,乳状液的油-水界面膜发生薄化,油滴在电场作用下逐渐聚集,从而发生破乳。李丽红等[71]对核桃油乳状液进行加热处理,随着温度的升高,乳状液的破乳率也增加,这是由于温度升高,乳状液分子的热运动加剧,同时,界面上的蛋白质发生变性,促进了油滴的聚集和蛋白质的沉淀,导致界面膜的黏度下降,乳状液的破乳率也随之增加。王瑛瑶等[20]分别利用微波、加热和冷冻-解冻方法对花生乳状液进行破乳研究,发现冷冻-解冻的破乳效果最好,破乳率高达91.6%,这可能是由于在冷冻时乳状液中的油滴发生结晶现象,相邻两油滴的脂肪结晶体会穿透水相,进而刺破界面膜,导致油滴的聚集[72]。高压CO2是一种新兴的物理破乳方法,主要通过使界面蛋白发生沉淀而实现破乳。韩宗元等[73]通过透射电子显微镜观察经过高压CO2处理后的乳状液,发现界面蛋白膜发生破裂,蛋白质之间发生聚集沉淀,被界面蛋白包裹的油脂得以释放,并且逐渐聚集,从而发生破乳。高压蒸汽破乳法主要是作用于界面蛋白,一方面通过蒸汽放热使界面蛋白变性;另一方面通过施加压力使界面蛋白的空间结构发生变化,以此来破坏界面膜的稳定性,达到破乳的目的[74]。
3.2 化学方法破乳
化学法破乳是利用无机盐、酸碱或者乙醇对乳状液进行处理,通过影响乳状液的黏度、Zeta-电位、平均粒径及其分布等性质,破坏界面膜组成的结构及其性质,从而影响乳状液的稳定性。无机盐的种类和浓度可以显著影响乳状液的稳定性。吴海波等[75]研究CaCl2、CaSO4、MgCl2和NaCl对大豆乳状液的破乳效果,并分析了CaCl2对乳状液黏度、Zeta-电位和粒径的影响,发现CaCl2的破乳率最高,且乳状液的黏度、Zeta-电位和粒径都受到Ca2+浓度的影响。由于界面蛋白可以在油-水界面发生解离,因此乳状液油滴表面存在电位差和双电层[31],Ca2+与界面蛋白解离形成的负电荷结合发生离子反应,使乳状液的负电荷量下降;乳状液的黏度随Ca2+浓度的升高而下降,促进了油滴间的聚集,油滴的粒径逐渐增大,乳状液的稳定性下降。蛋白质在等电点处易发生沉淀,包裹油滴的蛋白膜完整性被破坏,因此,通过调节pH值可以有效提高破乳率。Gao Yuhang等[76]研究发现,在碱性条件下,花生乳状液油-水界面的外源性蛋白质被洗脱,界面蛋白含量下降,相邻的油滴之间发生聚集,花生乳状液的稳定性下降。Liu Chen等[30]分别考察了pH值和NaCl浓度对乳状液的Zeta-电位影响,随着pH值的升高,乳状液的正电荷数量逐渐减少,并且在等电点时正负电荷数量相同,之后随着pH值增加,负电荷的数量逐渐提升;NaCl浓度对乳状液的Zeta-电位有重要影响,Na+的加入抵消了界面蛋白的负电荷,降低了静电排斥力,从而可以降低乳状液的稳定性,并且Na+离子还可以通过改变界面蛋白的结构和氨基酸的含量来影响乳状液的稳定性。乙醇法破乳利用乙醇通过以下两方面的作用破坏界面膜的稳定性来提高破乳率:一方面通过乙醇亲水端对界面蛋白亲水端的吸附作用;另一方面利用乙醇使界面膜上的蛋白质发生变性[77]。李杨等[78]分别比较了常温乙醇、乙醇冷浴和冷冻解冻破乳,发现乙醇冷浴破乳率可以达到93.64%,通过光学显微镜观察乙醇浴破乳后乳状液的微观结构发现,界面蛋白发生变性沉淀,油滴粒径显著增加,油脂得到最大程度的释放。综上所述,化学法破乳是通过酸碱度或者有机溶剂破坏油-水界面的蛋白质,使蛋白质从界面膜上脱离;或者通过添加带正电荷的离子,中和油-水界面的负电荷,减弱油滴之间的静电排斥作用,促进油滴之间的聚集。
3.3 生物酶法破乳
酶法破乳是水酶法提取植物油脂过程中最经常使用的生物方法。两亲性的蛋白质作为界面膜上的主要组成成分,其含量、组成和结构对乳状液的稳定性起着决定性的作用,因此,蛋白酶的加入可以有效地改变界面膜的结构,提高乳状液的破乳率。Niu Ruihao等[79]研究了木瓜蛋白酶对水酶法提取的花生乳状液破乳效果的影响,在最优条件(酶解温度55 ℃、料液比1∶3、酶活力1 400 U/g、酶解时间3 h)下,游离油得率最高可达92.39%。在木瓜蛋白酶的作用下,油滴表面的外源蛋白和固有蛋白被水解为小分子肽,油滴的外表面不再受到界面蛋白提供的静电斥力和空间位阻的保护,油滴之间相互吸引、融合,从而使游离油的得率提高,如图3所示。Wu等[2]分别使用风味蛋白酶(Protex 50FP)和磷脂酶对乳状液进行破乳研究,结果发现蛋白酶的破乳效果更好,蛋白酶可以将界面蛋白进一步水解为短肽,破坏了界面膜的完整性,界面膜的强度不足以防止油滴的絮凝而发生破乳。
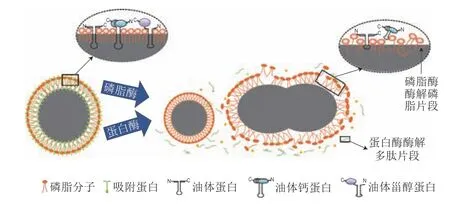
图3 油体乳状液酶法破乳机理Fig.3 Instability mechanism of oil body emulsion
3.4 复合破乳法
复合破乳法是将物理、化学和酶法破乳技术两两联合或者多种结合在一起处理乳状液。胡丽丽等[27]将离心法和无水乙醇法联用对菜籽油乳状液进行破乳,经正交试验得到最优提取条件:无水乙醚添加量为70%,调节pH 4.0,9 000 r/min下离心30 min。最优条件下游离油的提取率为98.05%。张根生等[80]对南瓜籽乳状液首先进行了酶法破乳,经酶法破乳后,蛋白膜被水解,小油滴被释放聚集成更大的油滴,破乳率达到了88.39%;然后对经酶法破乳的乳状液进行酸化处理,将pH值调节至南瓜籽蛋白的等电点4.5,乳状液的稳定性进一步降低,油脂得到了更充分的释放,破乳率达到了95.47%。
4 结 语
破坏乳状液的稳定性是提高水酶法提取植物油脂含量的关键,因此需要对维持乳状液稳定性的机理进行深入了解,基于乳状液油-水界面膜上的成分及其结构和特性等方面的研究,可以更好地理解乳状液的稳定机制。维持乳状液的稳定性不是单一因素起决定性作用,而是多因素共同作用的结果。界面蛋白作为一种蛋白质,其结构决定了功能,在破乳研究过程中,蛋白质的空间结构和化学键的变化必然引起蛋白质性质(水解度、表面疏水性和乳化能力)的改变,同时也是导致乳状液的理化性质和流变性质发生变化的原因。然而,针对乳状液界面蛋白与其他组分的交互作用对乳状液稳定性影响机制还需要深入研究,目前仍缺乏对油脂、界面蛋白和磷脂三者交互作用对乳状液稳定性影响的研究;其次,虽然已有大量关于乳状液破乳方法(如物理法、化学法和生物酶法)的研究,但是未来仍需要寻求破乳率更高、成本更低、更适合工业化生产的破乳方法;此外,对水酶法提取植物油脂乳状液破乳分子机理研究都是未来研究重点,这都有助于提高乳状液的破乳率,实现水酶法提取植物油脂和蛋白质的推广应用。

