抑制酸奶后酸化产细菌素乳酸菌的筛选及其产细菌素条件优化
黄 倩,万 倩,刘 爽,李启明,朱成林,蔡自建,陈 娟,邹立扣,朱鹏程,唐俊妮
(1.西南民族大学食品科学与技术学院,四川 成都 610041;2.乳品营养与功能四川省重点实验室,新希望乳业股份有限公司,四川 成都 610000;3.四川农业大学资源学院,四川 成都 611830;4.四川中烟工业有限责任公司,四川 成都 610021)
酸奶是指以原料乳为发酵底物,并以保加利亚乳杆菌和嗜热链球菌为主要菌种发酵而成的乳制品,因其具有营养丰富、风味独特等优点而广受消费者的喜爱[1].然而,酸奶产品在储存、运输及销售环节中并不能保证完全的冷链条件,即容易出现脱冷现象,进而使得乳酸菌继续发酵残存乳糖产生乳酸,此过程称为酸奶的后酸化.后酸化不仅会造成酸奶感官质量严重降低,缩短酸奶的保质期,同时也会影响益生菌的存活,使其失去保健益生的作用[2].过去,大量研究表明[3-6]酸奶后酸化的主要原因是保加利亚乳杆菌在后期继续发酵代谢乳糖产生乳酸所造成.酸奶发酵结束后,保加利亚乳杆菌利用自身质膜H+-ATPase 形成跨膜pH 梯度差,维持胞内中性环境,使β-半乳糖苷酶保持原有活性,代谢乳糖继续产酸[4].目前,解决酸奶后酸化问题的方法主要包括以下三个方面:一是采用物理方法控制温度,保持运输过程中的冷链完整、控制温度波动;二是采用化学方法,按照国标添加适量化学防腐剂;三是通过诱变育种和基因工程筛选弱后酸化突变菌株.但上述三种办法存在着大量能源消耗、存在健康隐患、消费者认可度低等问题[7].如何通过绿色安全有效以及低成本的方式控制酸奶在储运、销售环节中的后酸化已经成为目前奶制品行业学者研究的热点.
细菌素是一种由细菌在生长代谢过程中通过核糖体合成而产生的抗菌肽,抑菌范围的宽窄存在菌株特异性,并且多数细菌素是由乳酸菌这一种属所产生的[8].长期以来,乳酸菌以其公认的安全(Generally recognized as safe,GRAS)微生物的地位在世界范围内被广泛应用于食品发酵[9],因此,乳酸菌细菌素被认为是一种绿色、安全以及高效的天然抑菌物质,并且由乳酸乳球菌乳酸亚种所产生乳酸链球菌素(Nisin)是目前唯一通过FDA/WHO 认证的细菌素.不少学者研究发现将这类天然抑菌物质添加于食品中可以使其免受致病菌的污染[10-12],还能改善酸奶的品质.尚楠[13]等人发现产细菌素的双歧杆菌L-SN 在添加水平为(2×106~5×106)cfu/mL 时可以有效抑制酸奶后酸化;杨慧等[14]人发现植物乳杆菌Q7 对保加利亚乳杆菌和嗜热链球菌的生长有一定的抑制作用,不仅可以缩短酸奶发酵时间,还能延缓酸奶后酸化;细菌素bifidocin A 不仅能在28 d 贮藏期内维持酸度小于110 °T,还能显著提高酸奶的持水力和挥发性物质成分[15].将其应用于酸奶时还能达到缓解酸奶后酸化的效果[14].综上可见,细菌素的引入不仅能很好地解决酸奶后酸化问题,还能缩短发酵时间,提高酸奶的持水力、改善其品质.
因此,本研究拟从实验室前期分离鉴定的16 株乳酸菌中,筛选出可以对酸奶后酸化起到抑制作用的菌株,同时对其发酵条件进行优化以提高细菌素的产量.以期开发出一种能够缓解酸奶后酸化,延长产品货架期的天然防腐剂,同时为其大规模工业化应用提供数据支撑.
1 材料与方法
1.1 试验材料
1.1.1 菌株来源
试验所用16 株乳酸菌、1 株嗜热链球菌(Q019)由新希望乳业股份有限公司乳品营养与功能四川省重点实验室所提供,从后酸化较为严重酸奶产品中分离鉴定的保加利亚乳杆菌(A0)作为指示菌.
1.1.2 试剂与培养基
胃蛋白酶,购自德国Biofroxx 公司;胰蛋白酶,购自国药集团化学试剂有限公司;碳酸钙、蔗糖、硫酸铵,购自成都金山化学试剂有限公司;乳糖酶,购自帝斯曼(中国)有限公司;乳酸链球菌素(NISAPLIN)、Sephadex G-50 葡聚糖凝胶,购自丹尼斯克(中国)有限公司;MRS 肉汤,购自广东环凯微生物科技有限公司;浓缩乳清蛋白粉(E300),购自戴纬林国际贸易(上海)有限公司;大豆蛋白胨,购自青岛海博生物技术有限公司;脱脂乳粉,购自伊利(内蒙古)有限公司.
1.1.3 仪器与设备
INC821C 两槽式恒温培养箱,购自雅马拓科技贸易(上海)有限公司;MLS-3020 电热自动灭菌锅,购自日本SANYO 公司;TGL-1650 高速冷冻离心机,四川蜀科仪器有限公司;PTC-200PCR 仪,购自美国Bio-Rad 公司;Bioscreen 全自动生长曲线分析仪,购自芬兰Oy Growth Curves Ab Ltd 公司;FiveEasy PlusTM pH计,购自北京铭成基业科技有限公司.
1.2 试验方法
1.2.1 发酵上清液的制备
将(16 株乳酸菌)甘油菌按2% 接种量接种于MRS 培养基,37 ℃培养18~24 h,将发酵菌液离心(10 000 rpm,10 min,4 ℃)获上清液,再用0.22 μm水系滤器除菌得无菌上清液.
1.2.2 产细菌素乳酸菌的筛选
1.2.2.1 微孔板初筛
参考张明[16]等方法略作修改,以本试验从发酵剂中分离鉴定的保加利亚乳杆菌(A0)为指示菌,将其接入MRS 肉汤培养基中活化两代后,按3%接种量接入MRS 肉汤培养基中制成待用指示菌悬液(106CFU/mL).取250 μL 无菌发酵上清液与2.25 mL 指示菌菌悬液充分混合均匀后,加样于100 孔板中,用全自动生长曲线分析仪测定不同样品0~24 h 的OD600nm,每隔1 h 测定一次,同时作阴性对照与阳性对照.
1.2.2.2 琼脂扩散牛津杯法复筛
选取明显抑制保加利亚乳杆菌生长的乳酸乳球菌进一步复筛.采用琼脂扩散法[17],吸取指示菌菌悬液(108CFU/mL)100 μL 于提前倒好的MRS 固体平板上,用涂布棒均匀涂布后,放入无菌牛津杯,往牛津杯中加入200 μL 发酵上清液,同时作阴性对照与阳性对照.
1.2.3 乳酸乳球菌发酵上清液抑菌特性
1.2.3.1 酸排除试验
参照Fan 等[18]方法来排除有机酸干扰,取经过初筛、复筛后仍有抑菌效果的菌株发酵上清液,用1M NaOH 溶液将其pH 值调至6.0 后,按1.2.2.2 步骤做抑菌试验,以未调pH 的无菌发酵上清液作为阳性对照,以MRS 肉汤培养基作阴性对照.
1.2.3.2 过氧化氢排除试验
采用刘书亮等[19]的方法来排除过氧化氢干扰,取经过酸排除试验的菌株发酵上清液,于80 ℃中水浴10 min,按1.2.2.2 步骤做抑菌试验,以未调pH 的无菌发酵上清液作为阳性对照,以MRS 肉汤培养基作阴性对照.
1.2.3.3 蛋白酶敏感试验
按照Amrita 等[20]的方法进行蛋白酶酶解试验,将排除酸、过氧化氢后仍有抑菌效果的发酵上清液分别加入总浓度为1 000 IU/mL 的胃蛋白酶和胰蛋白酶,并将pH 分别调至2.0 和8.1,充分混合均匀于37 ℃处理1 h 后,将pH 调至6.0,按1.2.2.2 步骤做抑菌试验,以未调pH 的无菌发酵上清液为阳性对照,以MRS 肉汤培养基作阴性对照.
1.2.3.4 热稳定性
将乳酸乳球菌Q13 发酵上清液分别按40、50、60、70、80、90、100 ℃处理30 min,冷却至室温,同时以未经处理Q13 上清液和经过相同处理的无菌培养液作对照[21],按照步骤1.2.2.2 对指示菌进行抑菌试验.
1.2.3.5 酸碱稳定性
用1 M HCl 或NaOH 溶液将乳酸乳球菌Q13 上清液pH 分别调节为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,于4 ℃作用12 h后,将所有组样品pH 调至6.0.以未经处理Q13 发酵上清液和经过相同处理的无菌培养液为对照,按照步骤1.2.2.2 对指示菌进行抑菌试验.
1.2.4 乳酸乳球菌Q13 产细菌素培养条件优化
1.2.4.1 抑菌活性测定方法
取乳酸乳球菌Q13 发酵液,4 ℃,10 000 rpm 离心15 min,将上清液使用0.22 μm 滤器过滤得到无菌发酵上清液,利用微量稀释法对其进行稀释[22].将活化两代后的指示菌保加利亚乳杆菌按3%接种量接入MRS 肉汤培养基(106CFU/mL).取250 μL 无菌上清液与2.25 mL 指示菌菌悬液充分混匀后加样于100孔板中,利用生长曲线分析仪培养6 h后测定OD600nm.根据Turcotte 等[23]的方法绘制标准效价曲线,以保加利亚乳杆菌为指示菌,以乳酸链球菌素为阳性对照.将上述获得的OD600nm代入效价回归方程,计算出无菌上清液中细菌素的效价,本试验测得回归方程为:
y= 4.5323x-2.7247,y 表示相对抑菌效价(AU/mL);x 表示OD600nm的负对数,R2=0.9902.
1.2.4.2 单因素试验
称取79 g 乳清蛋白粉,21 g 大豆蛋白胨,加热溶解于1 000 mL 去离子水中,105 ℃高压灭菌10 min制得发酵培养基.选取接种量、发酵温度、初始pH 和培养时间作为影响抑菌活性的主要因素进行单因素试验.
①不同接种量对抑菌活性的影响
以1%、2%、3%、4%、5%、6%、7%和8%的接种量将乳酸乳球菌Q13 接种于发酵培养基中,37 ℃培养24 h,培养结束后,测定无菌上清液的抑菌效价.
②不同发酵温度对抑菌活性的影响
将Q13 以3%接种量接入发酵培养基,分别在20、25、30、35、37 和42 ℃条件下静置培养24 h,培养结束后,测定无菌上清液的抑菌活性.
③不同发酵初始pH 对抑菌活性的影响
将发酵培养基用1 M NaOH 或盐酸溶液将初始pH 值调至5、6、7、8、9.以3%接种量接入乳酸乳球菌Q13,37 ℃培养24 h 后,测定无菌上清液的抑菌活性.
④不同培养时间对抑菌活性的影响
以3%接种量在发酵培养基中接入乳酸乳球菌Q13,置于37 ℃分别培养8、12、16、20、24、28、36 和48 h,培养结束后,测定各时间点无菌上清液的抑菌效价.
1.2.4.3 响应面优化乳酸乳球菌代谢产细菌素的发酵条件
根据单因素试验结果,选取接种量(A)、初始pH值(B)、培养温度(C)3 个主要因素,每个因素设置3个水平,响应面因素及水平设计见表1,用Design Expert 12 中的Box-Behnken 法进行响应面设计与分析,以抑菌效价为响应值,利用多元回归拟合试验数据,分析影响菌株抑菌活性的主效应和交互效应,确定乳酸乳球菌Q13 最佳产细菌素条件.以最优条件进行试验验证模型是否有效.
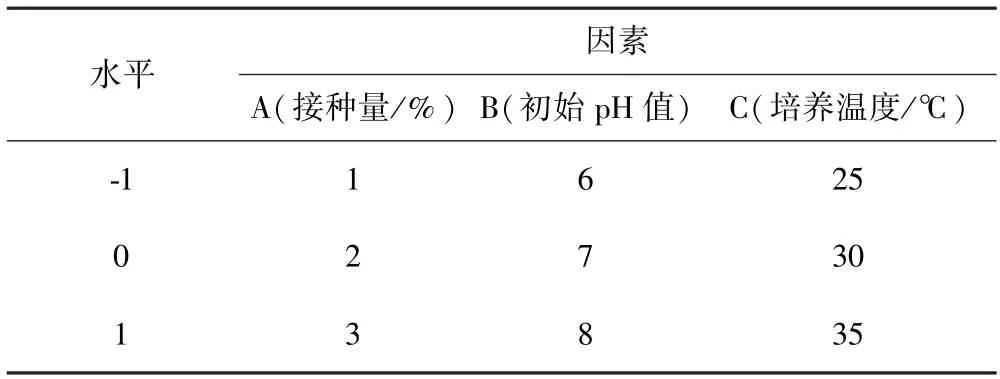
表1 响应面试验因素及水平设计Table 1 Factors and levelsin for Box-Behnken design
1.2.5 乳酸乳球菌Q13 所产细菌素的提取
参照万倩等[24]的方法对乳酸乳球菌Q13 所产的细菌素进行分离抽提,并冷冻干燥制成干粉备用.
1.2.6 乳酸乳球菌Q13 所产细菌素对发酵酸奶酸度和pH 的影响
1.2.6.1 发酵菌株制备
发酵菌株制备:将保加利亚乳杆菌(A0)、嗜热链球菌(Q019)接入MRS 肉汤培养基中活化两代后,分别按10%的接种量接入灭菌脱脂乳中,于42 ℃静置发酵直至凝乳,并调节菌液浓度为5×106CFU/mL.
1.2.6.2 酸奶基料样品制备
去离子水加热至60 ℃→在水中添加12%的脱脂乳粉和7%的蔗糖,水合30 min→均质2 次(60 ℃,20 MPa)→巴氏杀菌(95 ℃,5 min)→冷却至37 ℃~42 ℃后接入10%(v/v)的发酵菌种(A0∶Q019 为1∶1)→于42 ℃发酵至滴定酸度为70°T→破乳(于冰水浴中每隔10 min 搅拌1 次至温度降低为4 ℃左右)→后熟(2 ℃~6 ℃冰箱中过夜).
含乳酸乳球菌Q13 所产细菌素酸奶样品制备:在酸奶基料样品中添加1.2.5 中纯化后的细菌素,使其浓度为8 mg/mL(W1)、17 mg/mL(W2)、33 mg/mL(W3)、50 mg/mL(W4),同时以未添加细菌素的酸奶基料为空白对照(W0),将各组样品分装至50 mL 灭菌的离心管中以便后续试验取样.
1.2.6.3 酸度和pH 值的测定
参照GB5009.239-2016 食品安全国家标准食品酸度的测定中的电位滴定法来测定酸度[25];利用Five Easy Plus TM pH 计检测酸奶样品pH 值.
1.2.7 数据分析与处理
数据录入、整理和分析釆用Excel 2022,结果以平均值±标准差表示,统计学处理采用SPSS 26.0,使用Origin 2022 软件绘图.
2 结果与分析
2.1 产细菌素乳酸乳球菌的筛选
从16 株乳酸菌中初步筛选出对保加利亚乳杆菌生长有抑制作用的菌株13 株(见图1),其中以Q13 无菌上清液和乳酸链球菌素对指示菌的生长起到完全抑制的作用.对13 株菌发酵上清液利用琼脂扩散法进一步复筛,结果显示仅有Q13 上清液和乳酸链球菌素在含保加利亚乳杆菌固体平板上产生较大抑菌圈(见图2),最后选择乳酸乳球菌Q13 进行后续试验研究.
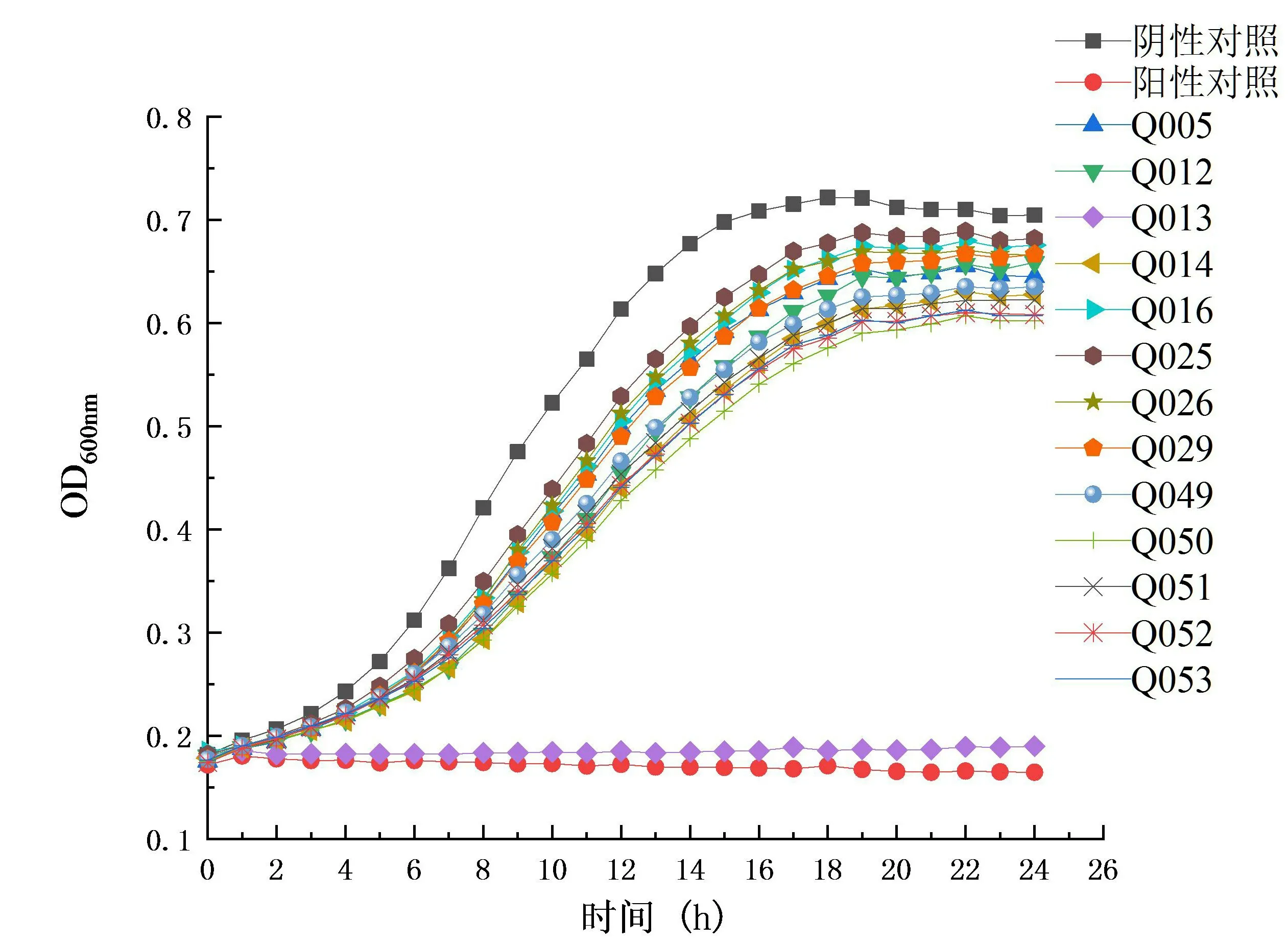
图1 不同处理条件下保加利亚乳杆菌的生长曲线Fig.1 Growth curve of Lactobacillus bulgaricus under different treatment conditions

图2 琼脂扩散法筛选结果Fig.2 Screening results of agar diffusion method
2.2 乳酸乳球菌Q13 发酵上清液生物学特性
2.2.1 酸和过氧化氢的排除及蛋白酶敏感性
如图3所示,用NaOH 溶液将乳酸菌Q13 发酵上清液pH 调节为6,排出乳酸等有机酸对抑菌效果的干扰.研究结果显示,酸中和处理过的乳酸菌Q13 发酵上清液抑菌圈直径仍能达到14.25 mm,阳性对照(未经任何处理)的抑菌直径为14.50 mm,二者间无显著性差异(P>0.05),这说明发酵液中除了有机酸还存在着其他抑菌物质.排除有机酸的干扰后,利用过氧化氢的热不稳定性对Q13 发酵上清液进行过氧化氢排除试验.研究结果显示,与阳性对照相比,80 ℃处理过的发酵上清液抑菌圈直径为14.50 mm,与阳性对照组无显著性差异(P>0.05).乳酸菌Q13发酵上清液对保加利亚乳杆菌有一定的抑菌作用,但与其所产的有机酸无显著相关性,该乳酸菌所产的过氧化氢对保加利亚乳杆菌的抑制作用可以忽略不计,该菌株的上清液中存在着其他有机抑菌化合物.
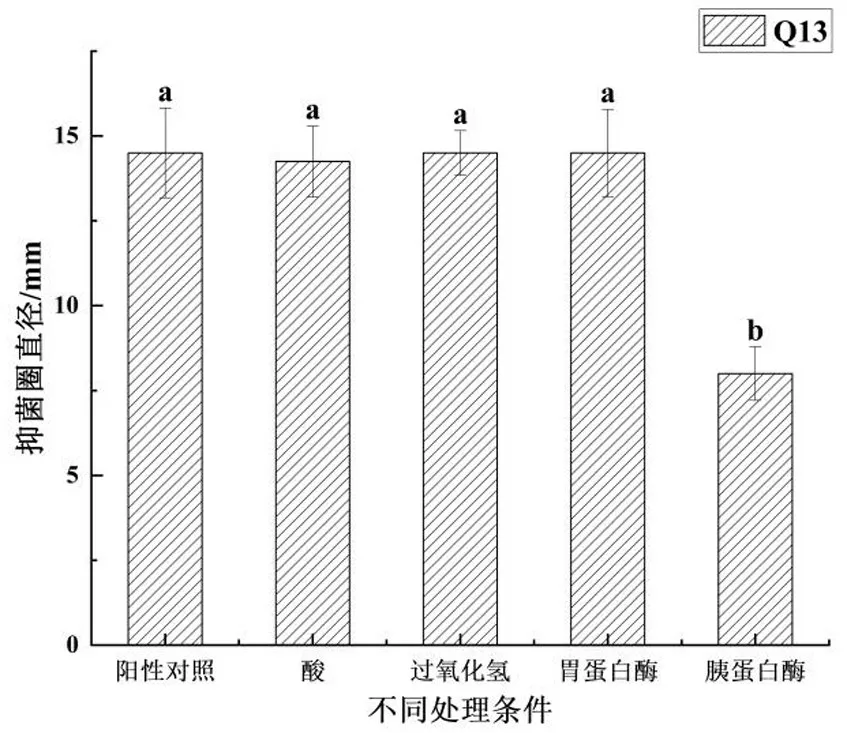
图3 发酵上清液在不同处理条件下的抑菌活性Fig.3 Antibacterial activity of fermentation supernatant under different treatment conditions
使用胃蛋白酶和胰蛋白酶酶解Q13 发酵上清液,发现胃蛋白酶对上清液的抑菌效果没有显著降低(P>0.05),而经过胰蛋白酶处理的上清液并没有检测到抑菌活性,说明Q13 产生的抑菌物质是一种肽或蛋白质,即可能是细菌素或类似物,该抑菌物质对胃蛋白酶不敏感,但遇到胰蛋白酶时抑菌活性消失.
2.2.2 热稳定性
菌株Q13 发酵上清液经过不同温度处理后的抑菌活性和阳性对照相比并无明显区别(图4),即使在100 ℃高温条件下处理30 min 后仍具有较好抑菌效果,温度对乳酸乳球菌Q13 上清液的抑菌活性影响并不显著(P>0.05).这可能主要与两种因素有关,其一是该菌株产生的抑菌物质本身具有良好的热稳定性;其二是与发酵上清液低pH 值(4.5)有关,而在酸性条件下乳酸链球菌素(Nisin)对温度较为稳定[26].

图4 不同温度条件处理对Q13 抑菌活性影响Fig.4 The influence of different temperature conditions on the antibacterial activity of Q13
2.2.3 酸碱稳定性
乳酸乳球菌Q13 发酵上清液经过不同pH 条件下处理后,再将pH 值调至6.0,利用琼脂扩散法检测各处理组的抑菌圈直径,如图5所示,在pH 3.0~10.0 范围内处理后上清液抑菌效果并未受到影响.pH为7 时,抑菌活性最强,抑菌圈直径可达20.87 mm,与pH 为3 的抑菌圈直径18.38 mm 相比抑菌能力提升了13.55%,有显著性差异(P<0.05).该发酵液在中性偏碱(pH 5~11)的环境中能够保持较好的抑菌活性,在偏酸的环境中的抑菌活性会有所下降,但总体而言该菌株所产生的抗菌肽具有较好的酸碱稳定性,该结果与Yu 等[27]所研究的新型细菌素Pediocin Z-1抑菌特性相似.
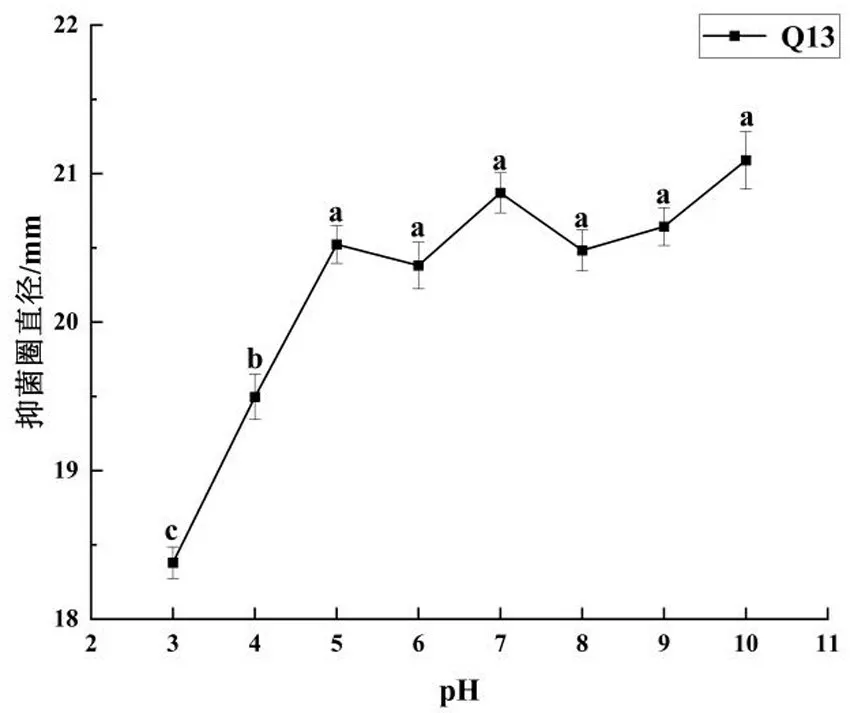
图5 不同pH 条件处理对Q13 抑菌活性影响Fig.5 The influence of different pH conditions on the antibacterial activity of Q13
2.3 乳酸乳球菌Q13 产细菌素单因素试验
2.3.1 接种量对乳酸乳球菌Q13 产细菌素影响
接种量的大小决定乳酸乳球菌的生长周期,较大的接种量可以使菌体快速进入稳定期,缩短生产时间,迅速积累大量代谢物.但较大的接种量同样也会造成培养基中营养物质被迅速消耗、限制菌体后期生长等问题.此外,还有学者研究发现乳酸链球菌素的结构本身就是一种信息素,可高水平诱导其自身产生[28],不同接种量即往下一代培养液中添加不同浓度的自诱导剂(细菌素)以诱导细菌素的产生.本研究中接种量对Q13 细菌素效价影响如图6所示,随着接种量的增加,发酵液的相对抑菌效价呈现先上升后下降的趋势,当接种量为2%时发酵液中相对抑菌效价达到最大值(213.33 AU/mL),随后开始缓慢下降;当接种量增加至6%时,相对抑菌效价最低,为147.05 AU/mL,抑菌能力下降了45.07%,相对抑菌效价下降显著(P<0.05).因此选择接种量为2%进行后续响应面试验设计.
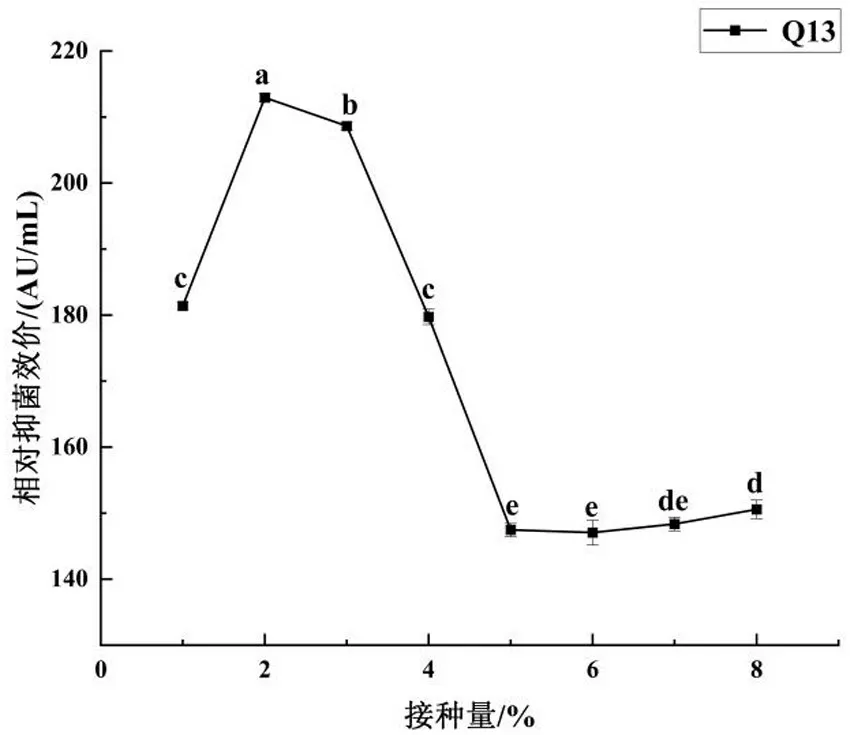
图6 接种量对乳酸乳球菌Q13 产细菌素影响Fig.6 Effects of inoculation amount on bacteriocin production by Lactococcuslactis Q13
2.3.2 发酵温度对乳酸乳球菌Q13 产细菌素的影响
细菌素属于蛋白质类似物,培养温度对于微生物的生长和细菌素的合成来说是至关重要的.培养温度过低,乳酸菌会生长缓慢甚至停止生长;培养温度过高,细菌素易变性失活.如图7所示,温度为25 ℃时,发酵液抑菌活性达到最大值(519.97 AU/mL),这与匡珍[29]等的研究结果相类似,并且随着温度升高(25 ℃~42 ℃),细菌素效价和菌落数量均呈现逐渐下降趋势.温度上升至30 ℃和35 ℃时,相对抑菌效价分别为443.62 AU/mL 和286.61 AU/mL,在此温度范围内还能保持较高的抑菌活性;温度进一步上升至37 ℃时,相对抑菌效价只有83.82 AU/mL,与25 ℃相比,相对抑菌效价下降了429.25%,有显著性差异(P<0.05);当温度到达42 ℃时,细菌素相对效价为1.11 AU/mL,此时基本丧失抑菌活性.乳酸乳球菌Q13 在25 ℃时相对抑菌活性最高,因此选择温度为25 ℃进行响应面试验.
2.3.3 培养基初始pH 对乳酸乳球菌Q13 产细菌素的影响
作为一种产酸菌株,乳酸乳球菌在不同pH 条件下的生长情况不相同,因此培养液的初始pH 对于菌株细菌素的合成影响较大.如图8所示,当初始pH 在5~8 时,抑菌活性呈现逐渐上升趋势,pH 为8 时,乳酸乳球菌Q13 的相对抑菌效价最高,为533.23 AU/mL;而pH 超过8.0 时,细菌素合成受到抑制,当pH 为9时,相对抑菌效价降至334.81 AU/mL,与pH 为8 相比,相对抑菌效价下降了59.26%,有显著性差异(P<0.05).本试验选择pH 8.0 进行后续响应面试验设计.
2.3.4 培养时间对乳酸乳球菌Q13 产细菌素的影响
先前文献[29]报道细菌素合成与细菌所处生长阶段存在一定联系,有的菌株在生长迟缓期就开始产生细菌素,而有的菌株则在对数生长期和稳定期才会大量产生和积累细菌素.如图9所示,在8~20 h 内细菌素效价并没有明显差异(P>0.05),发酵时间为20 h时,发酵液的相对抑菌效价可达491.59 AU/mL;当时间超过20 h 时(24~48 h),抑菌活性出现下降趋势,这可能是因为前期产生的细菌素被吸附至产生菌株细胞表面,发酵液中细菌素含量减少,相对抑菌效价下降[30].考虑到工业化操作的方便性,因此后期不以发酵时间作为响应面优化的影响因素.

图9 培养时间对乳酸乳球菌Q13 产细菌素影响Fig.9 Effects of culture time on bacteriocin production by Lactococcuslactis Q13
2.4 响应面试验优化乳酸乳球菌Q13 产细菌素条件
响应面试验方案及结果见表2.利用Design Expert 12.1 软件对试验数据进行多元回归拟合,获得相对抑菌效价(Y)与自变量A(接种量)、B(初始pH)和C(培养温度)的二次多项式回归模型方程(见表4):
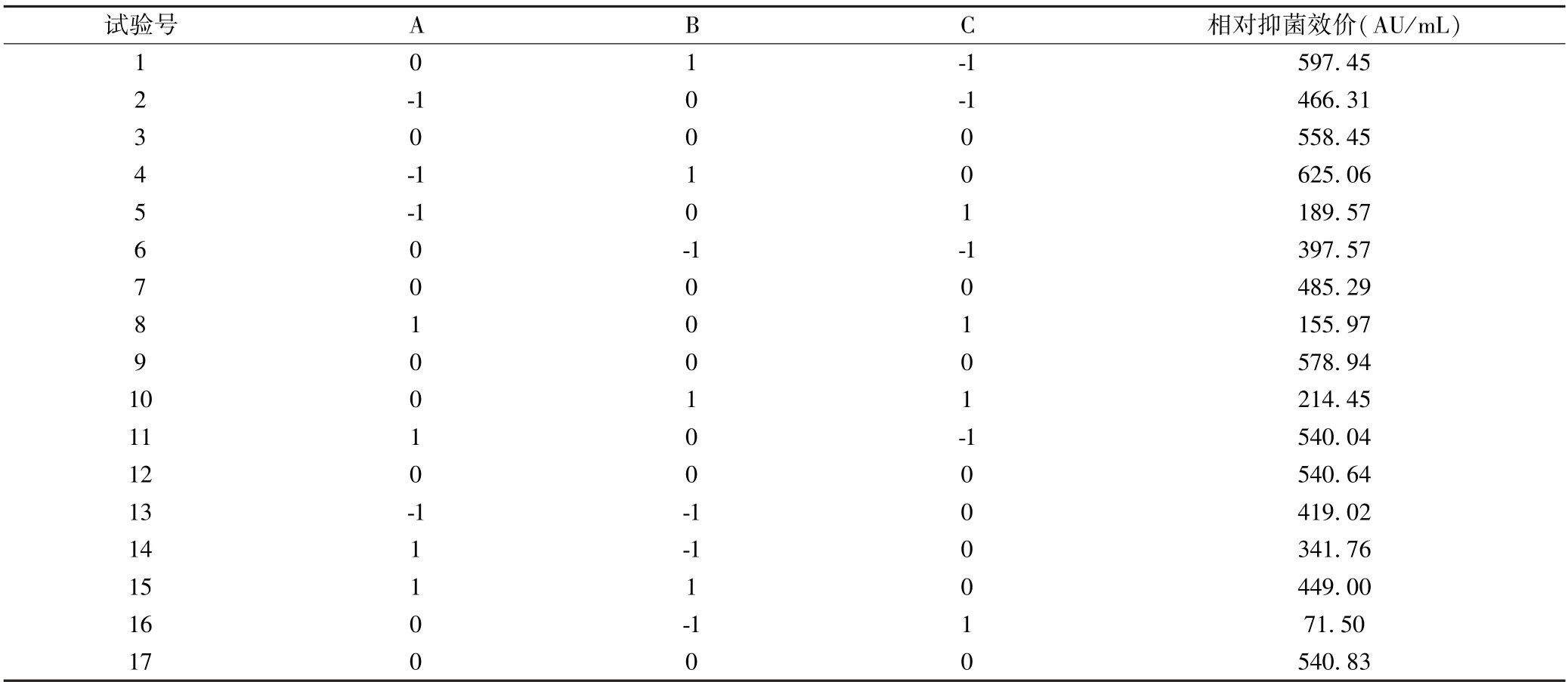
表2 响应面试验设计及试验结果Table 2 Design and results of response surface tests
Y=540.83-26.65A +82.02B-171.23C-24.7AB-26.83AC-14.23BC-32.19A2-49.93B2-170.66C2.
回归模型方差分析结果见表3,模型是显著的(P<0.05),失拟项不显著(P=0.153 4),回归模型的决定系数R2=0.965 3,说明该模型能够解释96.53%的变化,仅有3.47%不能用该模型来解释,自变量与因变量线性关系显著,该模型拟合程度良好.因此可用此模型对乳酸乳球菌产细菌素的发酵条件进行分析和预测.

表3 回归模型的方差分析结果Table 3 Analysis of variance results of the regression model
回归模型显著性分析见表4,模型一次项C 极显著,B 显著,A 不显著;二次项C2显著,A2、B2不显著;交互项均不显著.通过回归模型系数绝对值大小分析各个因素的改变对乳酸乳球菌Q13 代谢产细菌素的影响程度.回归方程一次项的回归系数绝对值依次为C、B、A,结果表明:3 个因素对菌株Q13 代谢产细菌素的影响大小依次是发酵温度、初始pH、接种量.
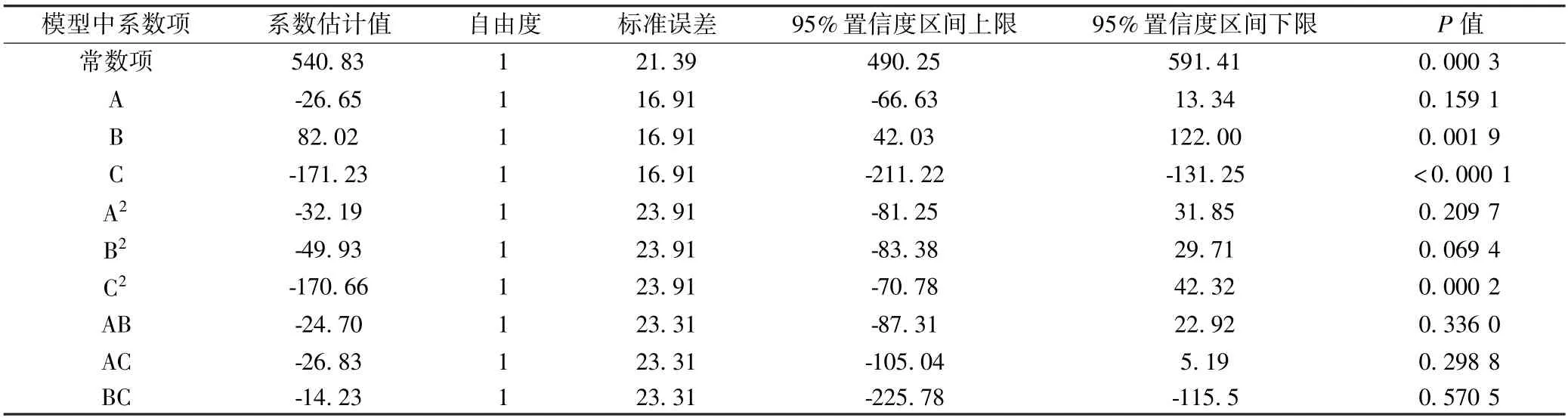
表4 回归方程系数显著性检验表Table 4 Significance test for regression coefficients
利用响应面软件对表2 试验数据进行二次多元回归拟合,所得到二次回归方程的响应面分别见图10~12.图10~12 表示了影响乳酸乳球菌Q13 产细菌素的接种量、初始pH 和培养温度3 个因素两两交互作用,由图可知,对细菌素合成影响最为显著的是培养温度,培养液初始pH 对细菌素产量有一定影响,而接种量在1%~3%范围内对细菌素合成没有显著影响.Design Expert12.0 根据试验结果给出了最优培养条件:接种量为1.4%,初始pH 为8.0,培养温度为27.5 ℃.为进一步验证模型的可靠性,对给出优化条件进行两次重复性验证试验,得到实际抑菌效价平均值为618.51 AU/mL,与预测值(634.16 AU/mL)的相对误差为2.5%,即拟合程度良好,该模型可靠.同时优化后细菌素抑菌效价(618.51 AU/mL)比优化前(200 AU/mL)提高了3 倍左右,说明本试验所设计试验方案合理,得到试验条件能够明显提高细菌素产量.但是本研究对细菌素产量进行优化提高时只考虑了发酵条件,未把培养基成分作为考虑对象,在一定程度上未达到最优效果,后续试验中还应进一步加强发酵培养基优化工作,为实际应用提供更可靠的科学依据.
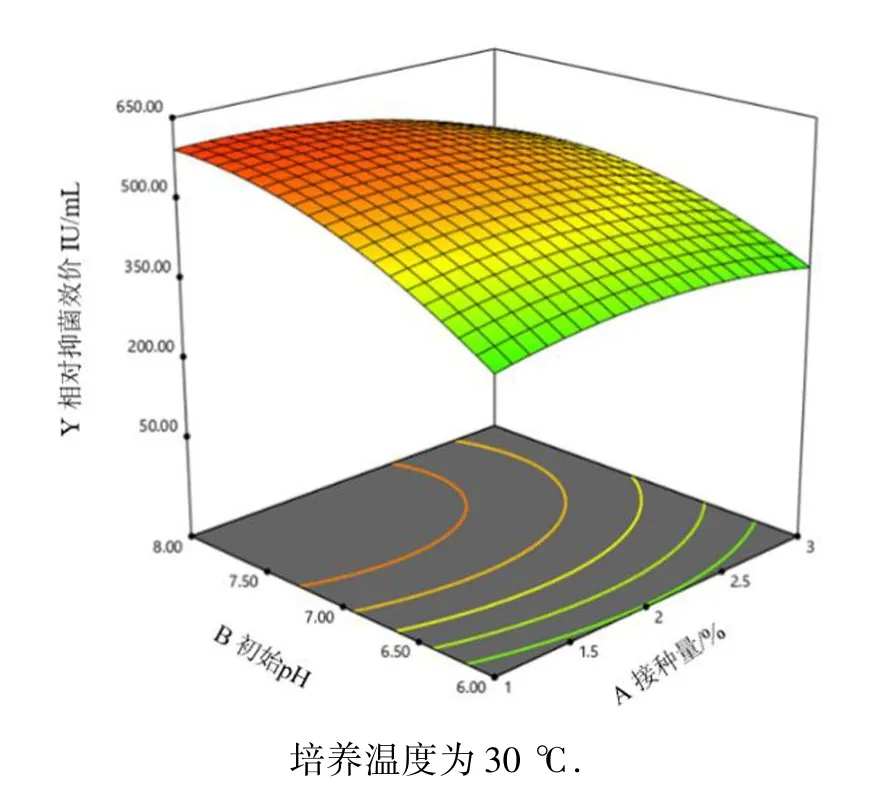
图10 接种量和初始pH 值对乳酸乳球菌Q13所产细菌素抑菌效果影响的响应面Fig.10 Response surface of the influence of inoculation amount and initial pH value on the antibacterial effect ofbacteriocin produced by Lactococcuslactis Q13
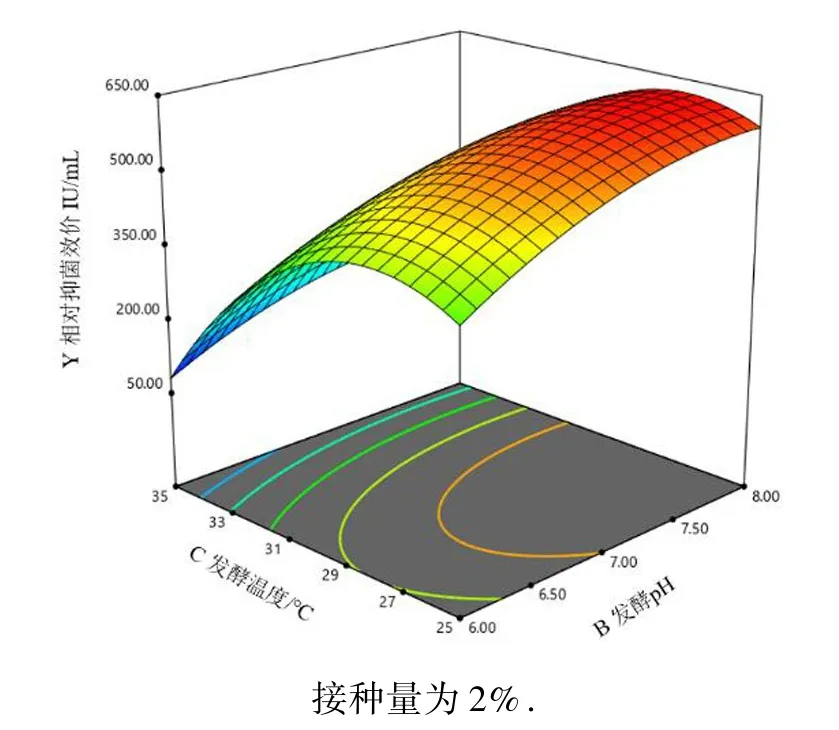
图12 初始pH 和培养温度对乳酸乳球菌Q13所产细菌素抑菌效果影响的响应面Fig.12 Response surface of the influence of initial pH and culture temperature on the antibacterial effect of bacteriocin produced by Lactococcuslactis Q13
2.5 乳酸乳球菌Q13 所产细菌素对酸奶后酸化的影响
2.5.1 乳酸乳球菌Q13 所产细菌素对贮藏期酸奶样品酸度影响
本试验为验证乳酸乳球菌Q13 所产细菌素是否具有防止酸奶酸度增加以及延缓酸奶后酸化的应用潜力,在酸奶中添加不同浓度纯化后的细菌素,将所有样品置于15 ℃条件下储存21 d,每隔3 d 取样,检测样品酸度增加情况.如图13所示.随着贮藏时间的延长,5 组样品的可滴定酸度都呈现上升趋势,且在第12 d 酸度到达峰值,随后缓慢下降并趋于稳定.随着乳酸乳球菌Q13 所产细菌素添加量的增加,酸度增加值逐渐下降.当添加量为50 mg/mL(W4)时,第12 d时可滴定酸度仅增加6.2 °T,而未添加细菌素的空白组(W0),在第12 d 可滴定酸度增加了16.4 °T,与W4 相比增长率为164.52%,差异显著(P<0.05).结果显示,Q13 所产细菌素的加入可以抑制酸奶后酸化、延缓酸奶酸度的增加,且随着添加剂量的增加,抑制效果逐渐增强.
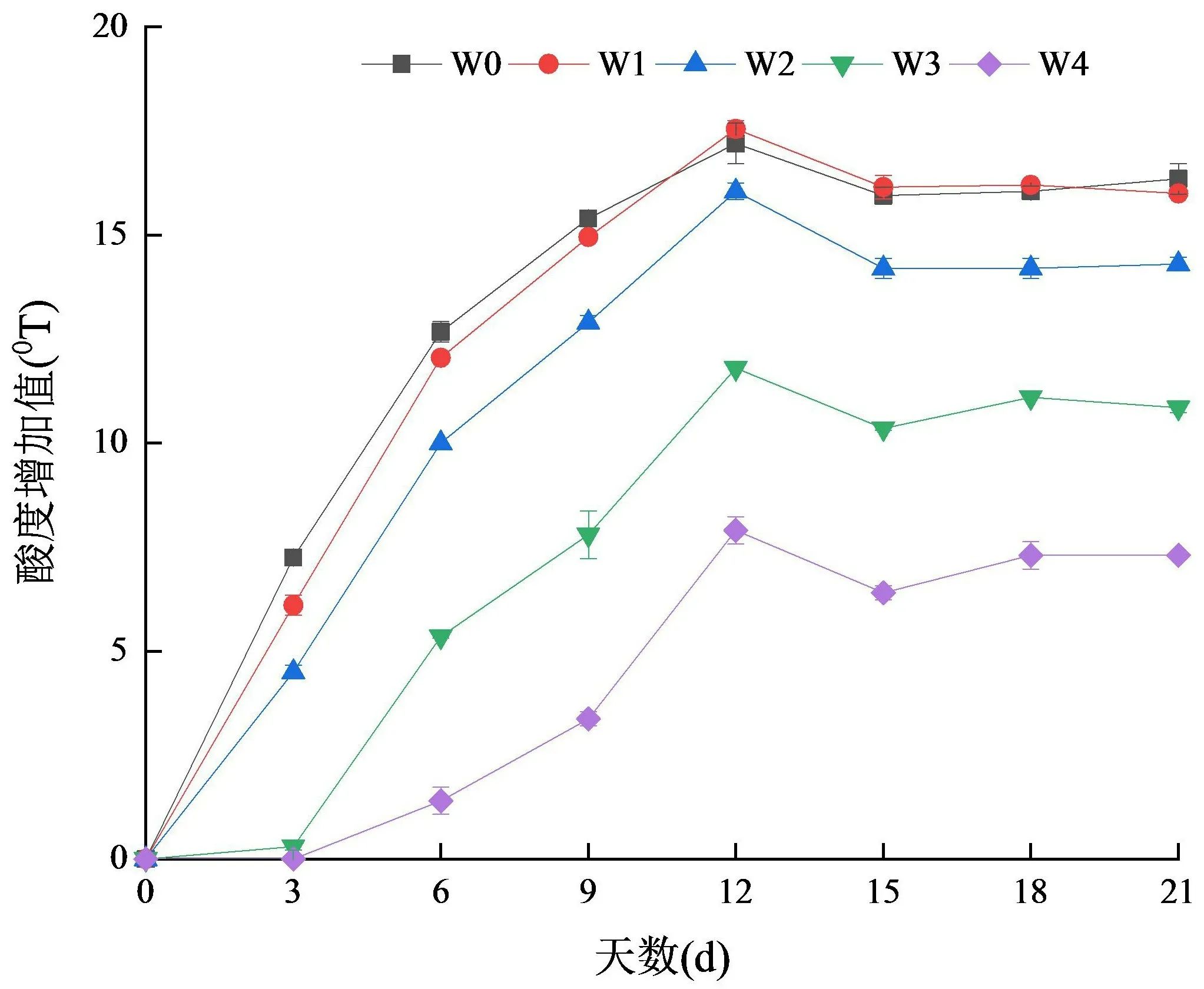
图13 贮藏期间样品酸度的变化Fig.13 Changes in acidity of samples during storage
2.5.2 乳酸乳球菌Q13 所产细菌素对贮藏期酸奶样品pH 的影响
5 组发酵酸奶在21 d 贮藏期内的pH 变化如图14所示.在贮藏的前6 d,pH 下降明显,且在之后的贮藏期内趋于稳定.当乳酸乳球菌Q13 所产细菌素的添加量为50 mg/mL(W4)时,pH 在21 d 达到最低值,从最初的4.38 下降为4.30,下降率仅为1.83%,无显著差异(P>0.05);而未添加Q13 所产细菌素的发酵酸奶(W0)在21 d 贮藏期内pH 由最初的4.28 降至4.02,下降率为6.07%.相关研究表明,商业酸奶的pH 应该控制在4.20 至4.50 之间,这样才能保证酸奶在贮藏过程中不会出现刺激性酸味[31].本研究中添加了Q13 所产细菌素的酸奶,pH 下降缓慢,在一定程度上缓解了酸奶的后酸化.
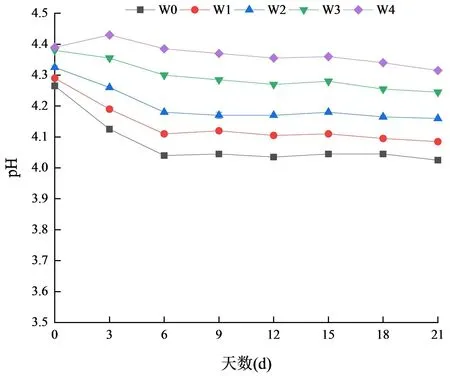
图14 贮藏期内样品pH 值变化Fig.14 Changes in pH value of samples during storage
3 结论
本研究以实验室前期从传统发酵食品中所分离鉴定的16 株乳酸菌作为研究对象,并将其作用于酸奶产品中的保加利亚乳杆菌,筛选出一株具有明显抑菌效果的乳酸乳球菌Q13.经过排酸及排除过氧化氢实验、胃蛋白酶处理、以及耐热和耐酸碱实验,确定该抑菌成分为一种蛋白类物质.通过单因素实验和响应面优化得到最佳发酵条件,且在该条件下模型预测值和真实值基本吻合.将乳酸乳球菌Q13 所产的细菌素添加于发酵酸奶中,能显著影响酸奶贮藏期的酸度变化.乳酸菌所产的细菌素应用价值较高,可作生物防腐剂、抗生素替代品,本研究分离的细菌素有望被开发为一种新型天然绿色安全抑菌剂,应用于发酵乳制品行业,打破酸奶后酸化技术瓶颈,改善发酵乳品质.

