川续断皂苷Ⅵ调控Notch1 信号通路对大鼠正畸牙移动及骨改建的作用
李光辉,周碟,王茜
(郑州大学第一附属医院口腔医学中心,河南 郑州 450000)
牙齿、颌面部畸形常会造成咀嚼困难、咬合创伤等问题,而且引起牙颌与颅面关系不协调等美观问题,给患者带来自卑等不良心理问题[1]。正畸治疗是临床上牙齿畸形的主要治疗手段,通过佩戴矫形器,在适当持续的压力作用下,使牙位移动从而达到治疗效果,在此过程中牙周膜在持续应力刺激下不断形成新的骨性结构,促进牙槽骨改建,从而达到矫正目的[2-3]。但是牙移动速度较慢,往往需要2 年以上恢复时间,长时间的矫正增加了牙周炎、牙根吸收等并发症,因此需要积极寻找可以在不损伤牙周膜、牙髓等的前提下加速牙体移动速度,缩短矫正周期的有效药物[4]。传统中药川续断具有活血化瘀、强筋健骨、滋补肝肾等功效,川续断皂苷Ⅵ是川续断的主要活性成分,其可促进大鼠正畸牙周组织破骨细胞分化,加快牙周改建[5]。关于川续断皂苷Ⅵ在大鼠正畸牙移动及牙周组织骨改建的研究有限,且其发挥作用的具体机制尚不清楚。Notch 1信号通路作为一种进化保守的细胞间相互作用机制,在细胞增殖、分化和凋亡中发挥重要作用。研究发现,机械牵张应力通过促进Piezo1 蛋白表达,以Ca2+为第二信使,激活Notch 1 信号通路,可促进人牙周膜干细胞成骨分化[6]。基于以上研究,本研究探讨川续断皂苷Ⅵ是否能通过调节Notch 1 信号通路发挥促大鼠正畸牙移动和骨改建,旨在为缩短临床矫正颌面畸形周期提供参考。
1 材料与方法
1.1 实验动物
清洁级SD 大鼠50 只,8 周龄,体质量200~220 g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006。饲养期间大鼠自由饮食饮水,环境温度20~25℃,空气湿度50%~60%。该实验经郑州大学第一附属医院伦理委员会审核批准,伦理号:2022-KY-0285。
1.2 试剂和仪器
川续断皂苷Ⅵ购自上海远慕生物科技有限公司(批号:10614);Notch 1 信号通路抑制剂DAPT 购自美国MedChemExpress 公司(批号:HY-13027);HE 染色试剂盒购自北京索莱宝科技有限公司(批号:G1120);TRAP染色试剂盒购自北京百奥莱博科技有限公司(批号:HR0561);引物序列均由广州锐博生物科技有限公司提供;Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1 蛋白抗体购自美国Abcam 公司(批号分别为:ab236639、ab209484、ab133612、ab52627、ab109536);正畸镍钛螺旋拉簧购自北京有研医疗器械有限公司。
1.3 模型制备[7]与分组给药
随机取40 只大鼠分为模型组、川续断皂苷Ⅵ组、抑制剂组和抑制剂+川续断皂苷Ⅵ组,腹腔注射1%戊巴比妥钠麻醉,固定于鼠板上,在大鼠左右侧上中切牙和上颌第一磨牙之间用0.2 mm 的结扎丝将正畸镍钛螺旋拉簧固定,使其对第一磨牙产生50 g 的持续牵引力,并在上中切牙和上颌第一磨牙根颈部磨出一深约0.5 mm 的小凹槽,并用流体树脂固定结丝线以防脱落,每天检查一次加力装置,如有脱落应及时重新结扎,另外10 只作为对照组,只在上中切牙和上颌第一磨牙之间放置结扎丝,但不加持续牵引力。
造模后当天,川续断皂苷Ⅵ组大鼠在双侧上颌第一磨牙近中牙龈黏膜下局部注射川续断皂苷Ⅵ10 mg/kg(3.6 g川续断皂苷Ⅵ溶于200 mL生理盐水制成质量浓度为18 mg/mL 的川续断皂苷Ⅵ溶液),1次/2 d,共注射7次;抑制剂组大鼠在同样位置局部注射DAPT 溶液0.6 mL/kg(1 g DAPT 粉末溶于50 mL DMSO制成质量浓度为20 mg/mL的溶液),1次/2 d,共注射7次;抑制剂+川续断皂苷Ⅵ组大鼠在同样位置局部注射DAPT溶液0.6 mL/kg,1 h后再注射川续断皂苷Ⅵ10 mg/kg,1 次/2 d,共注射7 次;对照组和模型组大鼠在同样位置局部注射等量生理盐水。
1.4 第一磨牙移动距离测量
建模14 d后各组大鼠心脏灌注4%(φ)多聚甲醛处死,分离左侧整个上颌组织,由同一名实验人员使用游标卡尺测量第一磨牙和第二磨牙领面接触点的距离,每个标本测量5次,取平均值作为最终结果。
1.5 牙周组织标本制备
取右侧上颌第一磨牙及牙周颌骨组织,4%多聚甲醛中固定,10% EDTA 溶液脱钙3 个月(每3 天更换1次脱钙液),梯度乙醇脱水、石蜡包埋,切成厚度为4 μm的切片备用。
1.6 HE染色观察牙周组织病理学改变
取“1.5”中的石蜡切片,按照试剂盒说明书进行HE 染色,显微镜下每张切片取5 个互不重叠的视野,观察牙周组织病理学改变。
1.7 TRAP染色观察破骨细胞数
取“1.5”中的石蜡切片,梯度乙醇脱水,二甲苯透明,TRAP 染液避光孵育1 h,双蒸水冲洗,苏木素核染,流水反蓝,脱水,中性树胶封片。显微镜下观察破骨细胞数。
1.8 RT-PCR法检测牙周组织中Nfatc、CTSK、MMP-9、Notch 1、Jagged 1 mRNA水平
取各组大鼠部分左侧第一磨牙牙周颌骨组织,Trizol 试剂进行组织裂解,提取RNA,逆转录成cDNA,进行荧光定量PCR 反应,反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,进行40个循环。2-△△Ct法计算目的基因相对于内参的表达量。引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.9 蛋白印迹法检测牙周组织中Nfatc、CTSK、MMP-9、Notch 1、Jagged 1蛋白水平
取各组大鼠部分左侧第一磨牙牙周颌骨组织,RIPA 裂解液裂解,离心收集上清液,BCA 法测定蛋白浓度。取30 μg 蛋白样品,120 v 恒压电泳2 h 使蛋白分离,将蛋白湿转到PVDF 膜上,5%脱脂奶粉封闭1 h,GAPDH、Nfatc、CTSK、MMP-9、Notch 1、Jagged 1 蛋白抗体(1∶1 000)4℃孵育过夜,二抗(1∶5 000)室温孵育1 h,洗膜,ECL发光液显影,Image J分析条带灰度值,目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.10 统计学分析
采用SPSS21.0 统计学软件分析数据,符合正态分布的定量资料均以表示,多样本间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 第一磨牙移动距离测量结果
与对照组比较,模型组大鼠第一磨牙移动距离增长(P<0.05);与模型组比较,川续断皂苷Ⅵ组大鼠第一磨牙移动距离增长(P<0.05);与川续断皂苷Ⅵ组比较,抑制剂+川续断皂苷Ⅵ组大鼠第一磨牙移动距离缩短(P<0.05);与抑制剂组比较,抑制剂+川续断皂苷Ⅵ组大鼠第一磨牙移动距离增长(P<0.05)。见表2。
表2 各组大鼠第一磨牙移动距离Table 2 Comparison of the distance of first molar movement of rats in each group(±s,n=10)
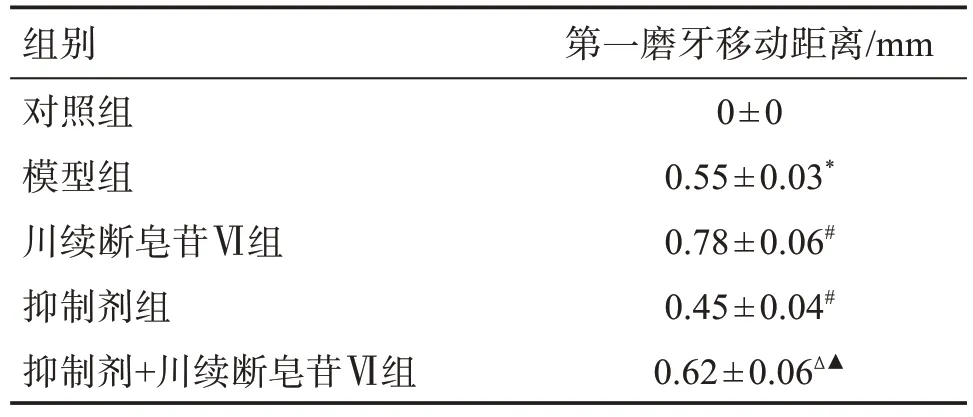
表2 各组大鼠第一磨牙移动距离Table 2 Comparison of the distance of first molar movement of rats in each group(±s,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与川续断皂苷Ⅵ组比较:ΔP<0.05;与抑制剂组比较:▲P<0.05。
组别对照组模型组川续断皂苷Ⅵ组抑制剂组抑制剂+川续断皂苷Ⅵ组第一磨牙移动距离/mm 0±0 0.55±0.03*0.78±0.06#0.45±0.04#0.62±0.06Δ▲
2.2 HE染色结果
对照组牙周膜纤维排列整齐,宽度无变化;模型组和抑制剂组大鼠牙周膜纤维排列紊乱,宽度增加,骨吸收陷窝少,抑制剂组表现的更明显;川续断皂苷Ⅵ组和抑制剂+川续断皂苷Ⅵ组牙周膜纤维排列较规则,增宽不明显,骨吸收陷窝增多,川续断皂苷Ⅵ组大鼠以上各变化更显著。见图1。
2.3 TRAP染色结果
与对照组比较,模型组破骨细胞数增多(P<0.05);与模型组比较,川续断皂苷Ⅵ组破骨细胞数增多(P<0.05);与川续断皂苷Ⅵ组比较,抑制剂+川续断皂苷Ⅵ组破骨细胞数减少(P<0.05);与抑制剂组比较,抑制剂+川续断皂苷Ⅵ组破骨细胞数增多(P<0.05)。见表3,图2。

图2 牙周组织TRAP染色(200×)Figure 2 TRAP staining of periodontal tissue (200×)
表3 各组大鼠牙周组织破骨细胞数比较Table 3 Comparison of the number of osteoclasts in periodontal tissue of rats in each group(±s,n=10)
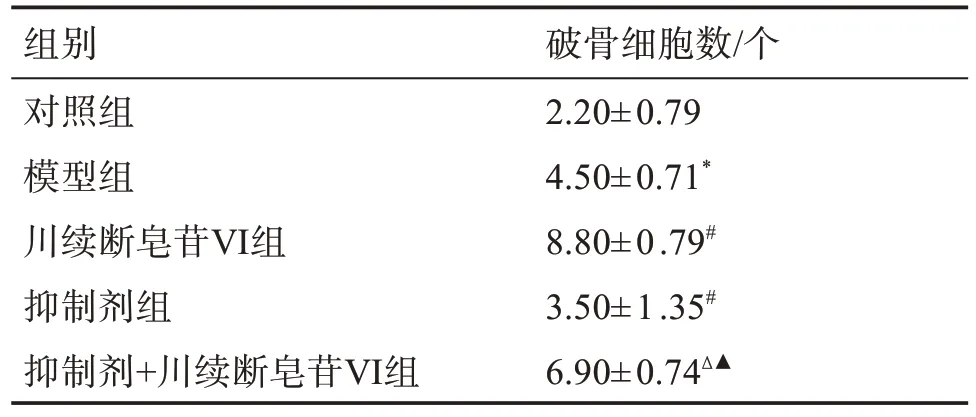
表3 各组大鼠牙周组织破骨细胞数比较Table 3 Comparison of the number of osteoclasts in periodontal tissue of rats in each group(±s,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与川续断皂苷Ⅵ组比较:ΔP<0.05;与抑制剂组比较:▲P<0.05。
组别对照组模型组川续断皂苷Ⅵ组抑制剂组抑制剂+川续断皂苷Ⅵ组破骨细胞数/个2.20±0.79 4.50±0.71*8.80±0.79#3.50±1.35#6.90±0.74Δ▲
2.4 RT-PCR检测结果
与对照组比较,模型组Nfatc、CTSK、MMP-9、Notch 1 和Jagged1 mRNA 表达水平升高(P<0.05);与模型组比较,川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch 1和Jagged 1 mRNA 表达水平升高(P<0.05);与川续断皂苷Ⅵ组比较,抑制剂+川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1 mRNA表达水平降低(P<0.05);与抑制剂组比较,抑制剂+川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1 mRNA表达水平升高(P<0.05)。见表4。
表4 各组大鼠牙周组织中Nfatc、CTSK、MMP-9、Notch 1和Jagged 1 mRNA表达水平比较Table 4 Comparison of mRNA expression levels of Nfatc,CTSK,MMP-9,Notch 1 and Jagged 1 in periodontal tissues of rats in each group(±s,n=10)
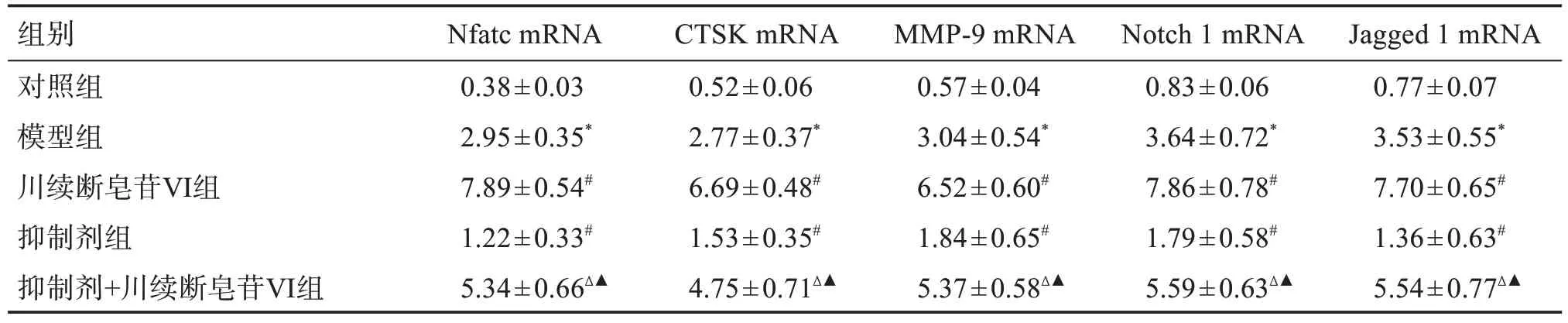
表4 各组大鼠牙周组织中Nfatc、CTSK、MMP-9、Notch 1和Jagged 1 mRNA表达水平比较Table 4 Comparison of mRNA expression levels of Nfatc,CTSK,MMP-9,Notch 1 and Jagged 1 in periodontal tissues of rats in each group(±s,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与川续断皂苷Ⅵ组比较:ΔP<0.05;与抑制剂组比较:▲P<0.05。
组别对照组模型组川续断皂苷Ⅵ组抑制剂组抑制剂+川续断皂苷Ⅵ组Nfatc mRNA 0.38±0.03 2.95±0.35*7.89±0.54#1.22±0.33#5.34±0.66Δ▲CTSK mRNA 0.52±0.06 2.77±0.37*6.69±0.48#1.53±0.35#4.75±0.71Δ▲MMP-9 mRNA 0.57±0.04 3.04±0.54*6.52±0.60#1.84±0.65#5.37±0.58Δ▲Notch 1 mRNA 0.83±0.06 3.64±0.72*7.86±0.78#1.79±0.58#5.59±0.63Δ▲Jagged 1 mRNA 0.77±0.07 3.53±0.55*7.70±0.65#1.36±0.63#5.54±0.77Δ▲
2.5 蛋白印迹法检测结果
与对照组比较,模型组Nfatc、CTSK、MMP-9、Notch1 和Jagged1 蛋白表达水平升高(P<0.05);与模型组比较,川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch1 和Jagged 1 蛋白表达水平升高(P<0.05);与川续断皂苷Ⅵ组比较,抑制剂+川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1 蛋白表达水平降低(P<0.05);与抑制剂组比较,抑制剂+川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch 1和Jagged 1蛋白表达水平升高(P<0.05)。见表5,图3。

图3 牙周组织中Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1蛋白表达电泳图Figure 3 Electrophoretic expression of Nfatc, CTSK, MMP-9,Notch 1 and Jagged 1 proteins in periodontal tissues
表5 各组大鼠牙周组织中Nfatc、CTSK、MMP-9、Notch1和Jagged1 蛋白表达水平比较Table 5 Comparison of protein expression levels of Nfatc,CTSK,MMP-9,Notch 1 and Jagged 1 in periodontal tissues of rats in each group(±s,n=10)
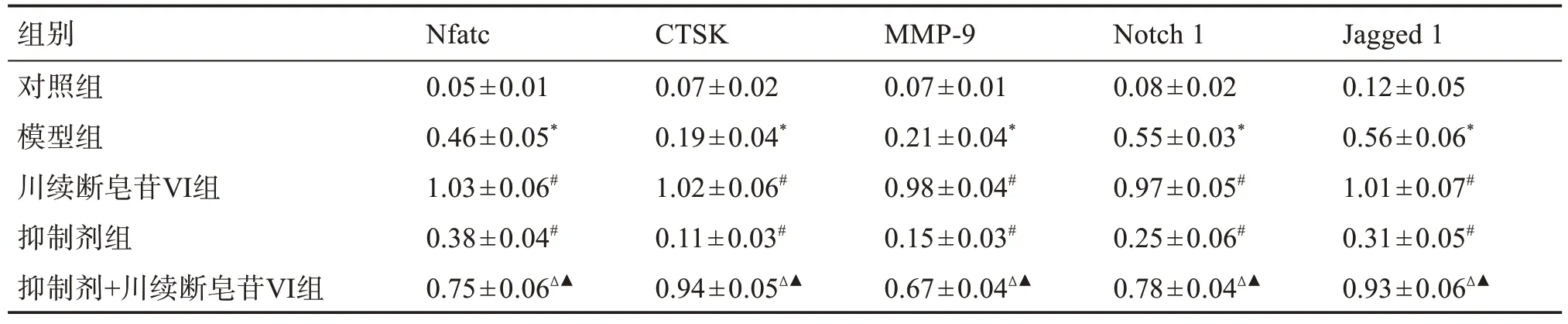
表5 各组大鼠牙周组织中Nfatc、CTSK、MMP-9、Notch1和Jagged1 蛋白表达水平比较Table 5 Comparison of protein expression levels of Nfatc,CTSK,MMP-9,Notch 1 and Jagged 1 in periodontal tissues of rats in each group(±s,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与川续断皂苷Ⅵ组比较:ΔP<0.05;与抑制剂组比较:▲P<0.05。
组别对照组模型组川续断皂苷Ⅵ组抑制剂组抑制剂+川续断皂苷Ⅵ组Nfatc 0.05±0.01 0.46±0.05*1.03±0.06#0.38±0.04#0.75±0.06Δ▲CTSK 0.07±0.02 0.19±0.04*1.02±0.06#0.11±0.03#0.94±0.05Δ▲MMP-9 0.07±0.01 0.21±0.04*0.98±0.04#0.15±0.03#0.67±0.04Δ▲Notch 1 0.08±0.02 0.55±0.03*0.97±0.05#0.25±0.06#0.78±0.04Δ▲Jagged 1 0.12±0.05 0.56±0.06*1.01±0.07#0.31±0.05#0.93±0.06Δ▲
3 讨论
牙槽骨吸收和新骨形成的骨改建过程是正畸牙移动的基础,牙周膜干细胞在该过程中扮演重要角色,它连接牙槽骨和牙骨质,是一层机械敏感的纤维软组织,可将机械应力从牙齿传导至牙槽骨,从而为参与压力侧牙槽骨吸收和张力侧新骨沉积的细胞提供必要的微环境[8]。牙周组织改建是一个十分复杂的过程,涉及多种效应细胞和细胞因子,张力侧牙槽骨内侧面受到牙周膜纤维的牵引诱导,大量成骨细胞产生,沿牙槽骨产生和沉积新生骨组织,而在压力侧受到牵引力的作用,牙周膜细胞成分向破骨细胞分化,大量破骨细胞聚集,使牙槽骨吸收,破骨细胞形成、吸收邻近牙槽骨是牙移动的先决条件[9]。低能量微波照射可促进正畸牙移动大鼠牙周膜细胞向破骨细胞分化,加快正畸牙移动过程,促进牙周组织改建[10]。异丙肾上腺素在大鼠正畸牙移动过程中可增加压力侧破骨细胞数量,加快正畸牙移动速度[11]。早期研究表明,灌服川续断水煎液可促进大鼠正畸牙移动过程中破骨细胞的增殖和分化,促进牙槽骨吸收和修复重建,但是川续断成分复杂,具体是何种成分发挥作用尚不清楚[12]。研究发现,川续断皂苷Ⅵ具有促进成骨细胞分化潜能,李燕燕等[13]报道其可促进人颌骨骨髓间充质干细胞成骨分化。因此,本研究选用川续断皂苷Ⅵ研究其对大鼠正畸牙移动的影响。
人牙周膜干细胞是一种具有良好成骨分化活性的间充质干细胞,而Notch 1信号通路与间充质干细胞早期分化具有密切联系。Zhong 等[14]研究发现,在牙周膜干细胞成骨分化过程中,Notch 1 表达上调。因此,本研究通过Notch 1抑制剂DAPT和川续断皂苷Ⅵ联用探讨川续断皂苷Ⅵ对大鼠正畸牙移动的影响以及是否通过Notch 1 信号通路发挥作用。结果显示:川续断皂苷Ⅵ组大鼠第一磨牙移动距离较模型组增长,抑制剂组较模型组缩短;与川续断皂苷Ⅵ组比较,抑制剂+川续断皂苷Ⅵ组大鼠第一磨牙移动距离缩短;与抑制剂组比较,抑制剂+川续断皂苷Ⅵ大鼠第一磨牙移动距离增长,由此可见川续断皂苷Ⅵ可加快大鼠正畸牙移动速率,而抑制Notch 1信号通路后第一磨牙移动距离缩短,在使用抑制剂的基础上联用川续断皂苷Ⅵ可拮抗抑制剂对第一磨牙移动速率的阻碍作用。HE 染色和TRAP 染色结果显示:模型组和抑制剂组大鼠压力侧破骨细胞数量增加,并出现骨吸收陷窝,但是少于川续断皂苷Ⅵ组和抑制剂+川续断皂苷Ⅵ组,而抑制剂+川续断皂苷Ⅵ组破骨细胞数量多于抑制剂组,以上结果说明:川续断皂苷Ⅵ可促进大鼠正畸牙压力侧破骨细胞生成,且可抵抗Notch 1信号通路抑制剂对破骨细胞生成的抑制作用。
Nfatc、CTSK 和MMP-9 是参与破骨细胞分化成熟、促进骨基质吸收降解的重要调控因子,直接反映破骨细胞的功能状态[15]。研究发现,抑制Notch1 信号通路后,骨髓腔巨噬细胞破骨细胞分化的能力减弱,抑制骨吸收[16]。葛根素抑制Notch信号通路可抑制RAW264.7细胞破骨分化能力[17]。本研究结果显示:模型组Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1蛋白表达水平较对照组升高;川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1 蛋白表达水平较模型组升高;抑制剂+川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1 蛋白表达水平较川续断皂苷Ⅵ组降低;抑制剂+川续断皂苷Ⅵ组Nfatc、CTSK、MMP-9、Notch 1 和Jagged 1 蛋白表达水平较抑制剂组升高,此结果说明:川续断皂苷Ⅵ可促进破骨细胞生成和成熟,而抑制Notch1 信号通路后发挥相反作用,但是川续断皂苷Ⅵ可逆转Notch 1信号通路对破骨细胞生成和成熟的抑制作用。此外,川续断皂苷Ⅵ可激活Notch 1信号通路关键蛋白表达。
综上所述,川续断皂苷Ⅵ可加快大鼠正畸牙移动速率,促进破骨细胞的生成和成熟,其可能是通过激活Notch 1 信号通路发挥作用。本研究结果为临床缩短牙齿、颌面畸形矫正周期提供了实验依据。

