宠物源性大肠杆菌分离鉴定和耐药性分析
赵勇,杨丁龙,高感,武书杰,向斌,和凤平,李 蕾,杨亮宇**,张立梅**
宠物源性大肠杆菌分离鉴定和耐药性分析
赵勇1,2,杨丁龙1*,高感1,2,武书杰1,2,向斌1,2,和凤平1,2,李 蕾1,2,杨亮宇1,2**,张立梅1,2**
1. 云南农业大学动物医学院, 云南 昆明 650201 2. 云南农业大学家禽疫病防控中心, 云南 昆明 650201
为了分析昆明市宠物源性大肠杆菌的耐药情况,并为临床合理使用抗菌药物提供依据,本研究对采自昆明市3家宠物医院犬猫的26份棉拭子和5份灌洗液样品进行大肠杆菌的分离鉴定,并基于肠杆菌基因间重复共有序列(ERIC-PCR)对分离株进行分型;使用纸片扩散法检测分离菌株的耐药性,并检测了其耐药基因携带情况。共分离到30株大肠杆菌,分离率为96.77%,其中犬源性14株,猫源性16株;ERIC-PCR分型显示将30株大肠杆菌可分为9个亚型,健康犬猫与非健康犬猫源性大肠杆菌分型差异较大。耐药性实验显示分离株对氨苄西林(93.33%)耐药率最高,其次较高的是红霉素(90.00%)、四环素(83.33%)、复方新诺明(76.67%),而对多粘菌素B、亚胺培南均不耐药;分离株中26株菌(86.67%)为多重耐药菌,且具有多种耐药谱;ESBLs基因检出率:(70%)、(36.67%)其它耐药基因检出率分别为(73.33%),(33.33%),(26.67%),(26.67%)。综上健康与非健康犬猫源性大肠杆菌基因型差异明显;昆明宠物源性大肠杆菌多重耐药形势严峻,临床中对氨苄西林、红霉素、四环素、和复方新诺明应减少或停止使用。
宠物; 大肠杆菌; 耐药基因
20世纪40年代以来,以青霉素为代表的抗生素药物被广泛运用于感染性疾病的治疗[1]。但是随着抗生素的不恰当使用,病原菌的耐药问题越来越突出[2]。细菌耐药性的产生,引起了全世界各界的广泛关注,被世界卫生组织认为是21世纪最大的公共卫生安全问题之一[3]。随着国内宠物产业的蓬勃发展,宠物用抗生素的使用量与日俱增,宠物源性抗生素耐药问题越来越突出,严重威胁公共卫生安全[4]。大肠杆菌作为条件致病菌,在自然环境中广泛存在,一般认为其对大部分常规使用的抗生素药物均较为敏感,但研究却发现普遍存在大肠杆菌耐药菌[5]。人类感染大肠杆菌一部分被归因于在宠物动物园、开放式农场和动物表演中与狗、羊、等动物的直接接触[6]。由于大肠杆菌普遍存在且容易携带多种耐药基因,所以在治疗和预防疾病的过程中给人们带来了很大困难[7]。为了了解昆明市宠物源性大肠杆菌的耐药情况,本研究从3家宠物医院共收集了31份健康或患病犬猫的泄殖腔棉拭子或灌洗液样品,用于大肠杆菌的分离鉴定和耐药性分析,本研究对于规范和指导宠物医院抗生素的正确使用具有重要的意义。
1 材料与方法
1.1 主要试剂与耗材
LB肉汤、MH琼脂、伊红美蓝琼脂、麦康凯琼脂均购自广东环凯微生物科技有限公司,革兰氏染色试剂盒购自北京索莱宝科技有限公司,细菌DNA提取试剂盒购艾克瑞生物公司,链霉素(STR)、四环素(TET)、复方新诺明(SXT)、氧氟沙星(OFX)、多粘菌素B(PB)、氨苄西林(AMP)、头孢西叮(FOX)、庆大霉素(GEN)、红霉素(EM)、头孢他啶(CTA)、氟苯尼考(FIC)、亚胺培南(IPM)12种药敏片,购自杭州滨和微生物试剂有限公司,ESBLs检测试剂盒购自北京普纳德科技有限公司,比浊管购自广东环凯微生物科技有限公司、DNA Marker DL2000 、premix Tap购自北京康润诚业生物科技有限公司。
1.2 主要仪器与设备
电热恒温培养箱购(DHP-500BS)自北京市永光明医疗仪器有限公司、气浴恒温震荡器(THZ-82B)购自常州市国旺仪器制造有限公司、梯度PCR仪(T100)购自BIORAD欣博盛生物科技有限公司、凝胶成像系统(SH-510)购自杭州申花科技有限公司。
1.3 方法
1.3.1样品的来源 宠物取自昆明市3家宠物所,一次性无菌棉签采集犬猫肛腔拭子或直肠灌洗液(表1)。

表1 样品类型及来源
1.3.2大肠杆菌的分离采集样品加入到肉汤中,以37 ℃、220 rpm的条件培养24 h。培养后的样品划线接种于麦康凯琼脂,37 ℃培养18~24 h。挑取(粉)红色、边缘光滑的可疑菌落划线接种于伊红美蓝琼脂进行纯化,分离获得的大肠杆菌使用LB肉汤甘油于-20 ℃冰箱保存[8]。
1.3.3 特异性PCR鉴定对疑似大肠杆菌菌株进行特异性PCR鉴定,分离菌株DNA提取采用细菌DNA提取试剂盒。引物序列见表2,引物由生工生物工程(上海)股份有限公司合成,预计扩增片段长度为756 bp。配置25 μL的PCR反应体系:2 μL DNA模板,上下引物各1 μL,12.5 μL Premix Taq,8.5 μL ddH20。退火温度:55 ℃。扩增产物经1%琼脂糖凝胶电泳检测后,阳性产物送生工生物工程(上海)股份有限公司测序,测序结果在NCBI进行比对。

表2 大肠杆菌鉴定及ERIC分型引物
1.3.4 革兰氏染色和镜检革兰氏染色后记录细菌在镜下的形态特征。
1.3.5 肠杆菌基因间重复共有序列-聚合酶链式反应(ERIC-PCR条带聚类分析)对大肠杆菌进行ERIC-PCR扩增,扩增引物见表2[9],配置25 μL的PCR反应体系:2 μL DNA模板,上下引物各1 μL,12.5 μL Premix Taq,8.5 μL ddH20。退火温度:54 ℃。扩增产物经1%琼脂糖凝胶电泳检测,分析电泳图条带,有条带记作“1”,无条带记作“0”。使用NTsys2.10e软件分析确定菌株间的相似性,对ERIC产物进行聚类分析。
1.3.6 耐药表型试验采用K-B纸片扩散法测定分离菌株对12种抗菌药物的敏感性,测量并记录抑菌圈直径,结果判断参照CLSI(2018标准)[10]。待检测的细菌对三类或者超过三类的抗生素表现耐药,就可将其判定是多重耐药菌(MDR)[11]。
1.3.7 大肠杆菌耐药基因的检测7类9种耐药基因的引物参照文献[12-16]设计,耐药基因引物序列见表3。配置10 μL的PCR反应体系:0.5 μL DNA模板,上下引物各0.5 μL,5 μL mix,3.5 μL ddH20。
2 结果与分析
2.1 大肠杆菌培养特性及形态
大肠杆菌接种选择性培养基后的菌落形态如图1所示。麦康凯琼脂平板上呈大颗菌落,淡粉色突起;伊红美蓝琼脂平板上呈金属光泽黄绿色且边缘整齐的菌落。
2.2 大肠杆菌镜下的形态鉴定及PCR鉴定结果
将上述菌落进行革兰氏染色镜检,可看到红色、点状、短杆状密集分布的菌体(图2)。使用大肠杆菌鉴定引物进行PCR扩增,电泳后可见约765 bp的条带(图3),PCR产物测序后在NCBI BLAST比对后鉴定为大肠杆菌。

图2 革兰氏染色镜检结果

图3 部分菌株的鉴定引物PCR扩增结果
2.3 大肠杆菌分离结果
31份样品中共分离出30株大肠杆菌,检出率为96.77%。猫中检出16株,犬中检出14株,其中非健康猫分出11株菌(35.48%),非健康犬分出10株菌(32.26%),健康猫分出5株菌(16.13%),健康犬分出4株菌(12.90%),综合来看,非健康犬猫来源的大肠杆菌占比更高(图4)。
2.4 大肠杆菌ERIC-PCR图谱分析
ERIC-PCR扩增序列用NTsys2.10e软件进行聚类分析,总相似度介于0.35~1.0,相似度0.84处可以分为9个基因型(图5)。除了II型、VI型和IX型外,犬猫来源的大肠杆菌分型差别不大;而健康与非健康犬猫来源的大肠杆菌基因型差异较大。其中,健康犬源性大肠杆菌分为III型和VIII型,非健康犬源性大肠杆菌为I、IV、V、VII和IX型;健康猫源性大肠杆菌以II型、VII型为主,非健康猫源性大肠杆菌为I、IV、V和VI型(表4)。
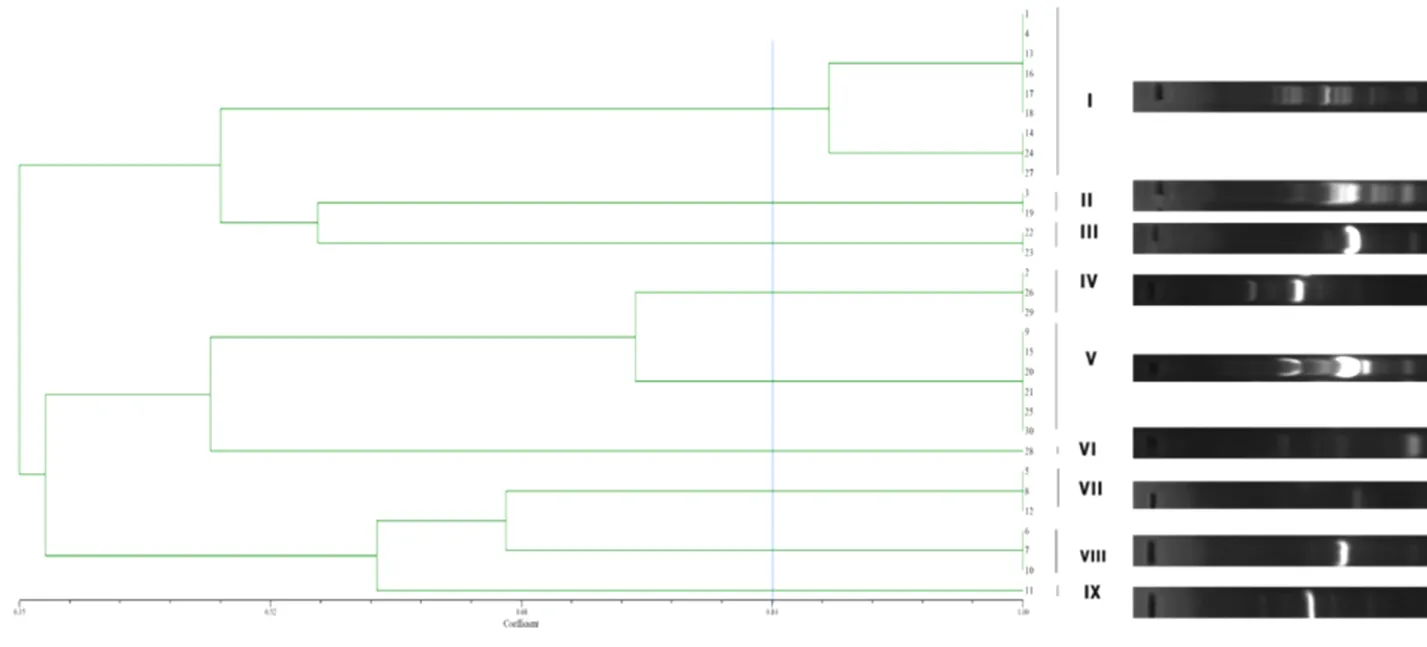
图5 菌株UPGMA树状图

表4 大肠杆菌ERIC基因分型的分布
2.5 大肠杆菌药物敏感性实验
30株菌对于AMP、EM、TET、SXT的耐药率已超过70%,分别为93.33%、90.00%、83.33%、76.67%,对FOX、CTA、FIC、GEN 、STR、OFX耐药性较低,耐药率不超过50%,对IPM和PB不耐药(图6)。

图6 分离菌株对12种药敏纸片的耐药率
健康犬猫与非健康犬猫源性大肠杆菌对AMP、EM、TET耐药率均在80%以上,对PB、IPM耐药率均为0,表明犬猫来源的大肠杆菌耐药性差异不大(表5)。

表5 不同来源大肠杆菌的耐药性比较
2.6 多重耐药分析
有26株菌株属于多重耐药菌株,占比86.67%。30株大肠杆菌共存在8种耐药类型,17个耐药谱,其中6耐占比高达56.67%。耐药谱为TET-SXT-AMP-GEN-EM-CTA,占比最大,为23.33%(表6)。
2.7 大肠杆菌耐药基因检测结果
用9对耐药基因引物对30株大肠杆菌进行耐药基因检测,结果六种耐药基因可被检测到,PCR扩增后的耐药基因产物片段与预期片段大小基本一致(图7)。
M.DL2000 DNA Marker;-.阴性对照;1-8(1-3).PCR扩增产物
M.DL2000 DNA Marker; -.negative control; 1-8(1-3).PCR amplification product
2.8 大肠杆菌耐药基因的统计分析
的检出率最高,为73.33%,其次的检出率为70%,的检出率为36.67%,的检出率为33.33%,sul1和的检出率为26.67%,而、和均未检出(图8)。共存在10种耐药基因谱,其中(20%)(20%)为主要耐药基因谱,同时含有3种以上耐药基因谱的菌株有19株(63.33%),提示本研究中分离的菌株具有较高的多重耐药潜力(表7)。
健康犬猫大肠杆菌耐药基因谱以(33.3%)、(44.4%)为主,非健康犬猫大肠杆菌耐药基因谱以(28.6%)、(28.6%)为主,健康犬猫与非健康犬猫源性大肠杆菌基因型差异明显。(表8)

图8 分离菌耐药基因检测结果

表7 大肠杆菌耐药基因谱
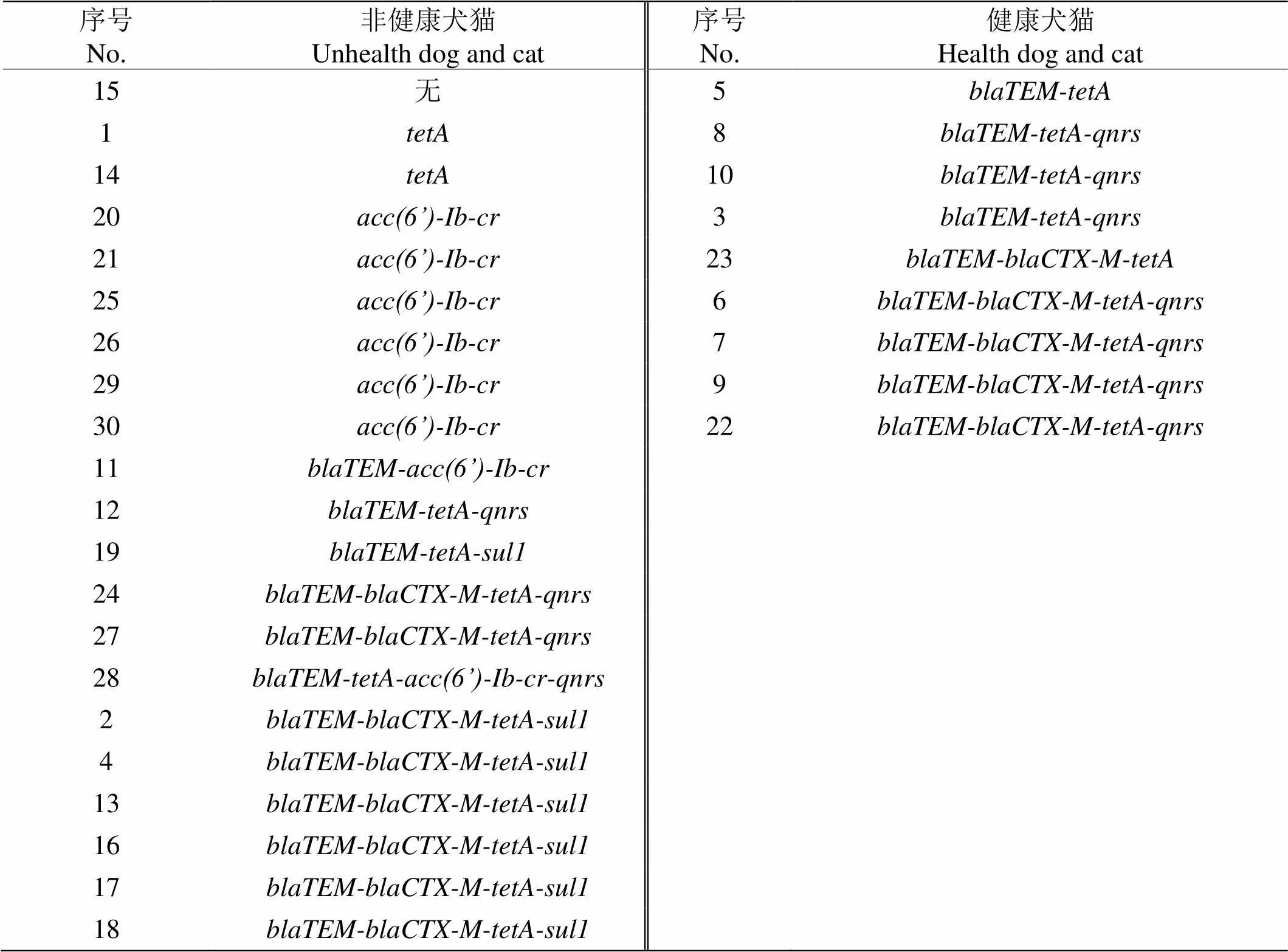
表8 不同健康情况犬猫分离菌耐药基因谱对比
3 讨 论
本研究从昆明市宠物医院采集了健康或非健康犬猫的肛拭子和灌洗液共 31份样品,共分离到 30 株大肠杆菌。ERIC-PCR将大肠杆菌分为9个亚型,犬猫源性大肠杆菌基因型差异不显著,而健康犬猫与非健康犬猫源性的大肠杆菌的基因型差异明显,提示大肠杆菌基因型与宿主无关,而与宿主的健康状态相关。
30株大肠杆菌对氨苄西林、四环素、红霉素的耐药率均在80%以上,可能与宠物医院常用β-内酰胺类和四环素类药物可能有关,因为抗生素的压力是细菌产生耐药的主要驱动力[17]。其中非健康犬猫源性大肠杆菌对四环素、复方新诺明、氨苄西林、红霉素耐药性更高,这可能与其用药有关。
产ESBLs菌株最早于1982年在英格兰发现,此后世界各地均相继报道,且各地的ESBLs类型的流行情况各不相同[18]。研究发现我国以CTX-M型ESBLs为主[19],本研究中blaCTX-M(36.67%)较少,而blaTEM(70%)较多。本研究中86.67%的菌株为多重耐药菌,耐药谱多达13种,提示本地宠物源性大肠杆菌抗生素耐药现状严峻。
4 结 论
昆明地区健康犬猫与非健康犬猫源性大肠杆菌耐药表型大致相同,而基因型差异明显;大肠杆菌多重耐药形势严峻,临床中对氨苄西林、红霉素、四环素、和复方新诺明应减少或停止使用。
[1] 刘玉庆,张玉忠,颜世敢,等.大肠杆菌和益生菌对抗生素和化学药物的敏感性试验[J].山东农业大学学报(自然科学 版),2003(2):83-86
[2] 吴立婷.扬州地区宠物源大肠杆菌耐药性分析及耐药基因检测[D].扬州:扬州大学.2017:74
[3] 寇宏.细菌耐药性研究进展[J].畜禽业,2020,31(3):37
[4] 宋超慧,胡燕,吴慧敏,等.乌鲁木齐市宠物猫源大肠杆菌耐药性及耐药基因检测[J].畜牧与兽医,2022.54(1):43-48
[5] Jang HG, Sadowsky JM, Byappanalli NM,. Environmental: ecology and public health implications-A review [J]. Journal of Applied Microbiology, 2017,123(3):570-581
[6] Amezquita-Lopez BA, Soto-Beltrán M, Lee BG,Isolation, genotyping and antimicrobial resistance of Shiga toxin-producing[J]. J Microbiol Immunol Infect, 2018,51(4):425-434
[7] 邓翔文,郑婷婷,陈璐,等.福州地区宠物犬源大肠杆菌耐药性及耐药基因调查[J].福建农林大学学报(自然科学版), 2022.51(6):815-821
[8] Caliskan D, Bakkalolu Z, Cevik YN,. Maldi-TOF MS identification and antibiotic resistance ofisolated from playground [J]. Microbial Pathogensis, 2021,159:105155
[9] Park D, Arabyan N, Williams CC,. Salmonella typhimurium enzymatically landscapes the host intestinal epithelial cell (iec) surface glycome to increase invasion [J]. Molecular & Cellular Proteomics, 2016,15(12):3653-3664
[10] 李瑞波.泰安市宠物源产ESBLs革兰氏阴性菌的分离鉴定及耐药与毒力基因分析[D].泰安:山东农业大学,2022:70
[11] Humphries R. Overview of changes to the clinical and laboratory standards institute performance standards for antimicrobial susceptibility testing [J]. Journal Clinic Microbiololy, 2021,59(12):e0021321
[12] De Oliveira DMP, Forde BM, Kidd TJ,. Antimicrobial resistance in ESKAPE pathogens [J]. Clinical Microbiology Reviews, 2020,33(3):e00181-19
[13] 田国宝,王红宁,张安云,等.大肠杆菌-内酰胺酶耐药基因bla_(TEM),bla_(SHV),bla_(CTX-M)三重PCR检测方法建 立[J].中国兽医杂志,2013,49(1):3-5
[14] Gilliane G, Dirk V, Marie-Louise CL,. PCR typing of tetracycline resistance determinants (Tet A–E) inserotype Hadar and in the microbial community of activated sludges from hospital and urban wastewater treatment facilities in Belgium [J]. FEMS Microbiology Ecology, 2000,32(1):77-85
[15] Liu YY, Wang Y, Walsh TR,. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study [J]. The Lancet Infectious Diseases, 2015,16(2):161-168
[16] Boerlin P, Travis R, Glyes CL,. Antimicrobial resistance and virulence genes ofisolates from swine in Ontario [J]. Applied and Environmental Microbiology, 2005,71(11):6753-6761
[17] Sfaciotte RAP, Parussolo L, Melo FD,. Identification and characterization of multidrug-resistant extended- spectrum beta-lactamase-producing bacteria from healthy and diseased dogs and cats admitted to a veterinary hospital in Brazil [J]. Microbial Drug Resistance, 2021,27(6):855-864
[18] 张玲,黄留玉, 革兰阴性杆菌产超广谱β-内酰胺酶研究进展[J].中华医院感染学杂志,2008,18(6):897-900
[19] Brenwald NP, Jevons G, Andrews JM,An outbreak of a CTX-M-type beta-lactamase-producing: the importance of using cefpodoxime to detect extended-spectrum beta-lactamases [J]. Journal of Antimicrobial Chemotherapy, 2003,51(1):195-196
Isolate, Identify and Drug Resistance Analysis offrom Pets
ZHAO Yong1,2, YANG Ding-long1*, GAO Gan1,2, WU Shu-jie1,2, XIANG Bin1,2, HE Feng-ping1,2,LI Lei1,2, YANG Liang-yu1,2**, ZHANG Li-mei1,2**
1.650201,2.650201,
In order to analyze the drug resistance of pet-derivedin Kunming and to provide a basis for the rational use of antimicrobial drugs in clinical practice, 26 cotton swabs and 5 irrigation fluid samples collected from dogs and cats in three pet hospitals in Kunming were used for the isolation and identification of, and the isolates were typed based on intergenic repetitive shared sequences ( ERIC-PCR ) of;the drug resistance of the isolated strains was detected using the paper diffusion method, and their drug resistance gene carriage was examined. A total of 30strains were finally isolated, with an isolation rate of 96.77%, including 14 strains of canine origin and 16 strains of feline origin;ERIC-PCR typing showed that 30 strains ofcould be classified into nine subtypes, with large differences in the typing of healthy and non-healthy canine- and cat-derived.Resistance assays showed that the isolates were most resistant to ampicillin ( 93.33% ), followed by erythromycin ( 90.00% ), tetracycline ( 83.33% ), cotrimoxazole ( 76.67% ), while they were not resistant to polymyxin B and imipenem;26 of the isolates (86.67%) were multi-drug resistant bacteria with multiple resistance profiles;the detection rates of ESBLs genes: blaTEM (70%), blaCTX-M (36.67%) and other resistance genes were tetA ( 73.33% ), qnrS ( 33.33% ), acc(6')-Ib-cr (26.67%), and sul1 ( 26.67% ), respectively.In summary healthy and non-healthy dog and cat-derived E. coli genotype differences are obvious; Kunming pet-derived E. coli multi-drug resistance situation is serious, clinical use of ampicillin, erythromycin, tetracycline, and cotrimoxazole should be reduced or discontinued.
Pet;; drug resistance
S855.1
A
1000-2324(2023)04-0530-09
10.3969/j.issn.1000-2324.2023.04.008
2023-07-03
2023-08-04
云南省“万人计划”产业技术领军人才专项(YNWR-CYJS-2019-020)
赵勇(2000-),男,硕士研究生,主要从事动物临床疾病研究. E-mail:3067916283@qq.com
同等贡献作者:杨丁龙(2000-),男,本科生,主要从事动物疫病的检测工作. E-mail:1730174087@qq.com
通讯作者:Authors for correspondence. E-mail:745863086@qq.com; 20073175@163.com

