红芪多糖通过调控HIF-1 信号通路对急性放射性肺炎小鼠的保护作用
王 艺,王 强,张 莉,尚 芸,杜籼芹,李 爽,李亮亮,蔺兴遥,2*
(1.甘肃中医药大学基础医学院,甘肃 兰州 730000; 2.敦煌医学与转化教育部重点实验室,甘肃 兰州 730000)
红芪为甘肃省优质道地药材,具有补气升阳、固表止汗、利水消肿等功效,主要用于气虚乏力、食少便溏、中气下陷等症[2],具有提高免疫力、抗氧化、抗肿瘤、抗炎、降血糖以及保护肝肾等多种药理活性[3-6]。大量研究表明,红芪水煎液、复方以及其提取物均有不同程度的抗氧化活性[4,7-9]。含红芪的中药复方在肺损伤治疗中发挥重要作用,可以改善肺损伤小鼠炎症反应及纤维化小鼠肺功能,调节细胞因子等,从而抑制纤维化进程[10-12]。
因此,本研究选用单次16 Gy 的X 线照射小鼠全胸以建立急性放射性肺炎模型,并依据病理形态学、CT 影像学、肺功能来验证急性放射性肺炎小鼠模型构建成功与否。再通过Western blot、PRqPCR、ELISA 等研究手段,探讨红芪多糖防治急性放射性肺炎的作用机制,揭示红芪防治早期可逆性放射性肺炎的科学内涵,为临床防治该病提供理论依据,为红芪药物的开发提供研究基础。
1 材料
1.1 动物 SPF 级C57BL/6J 雌性小鼠56 只,6 ~8 周龄,体质量18~22 g,由斯贝福(北京) 生物技术有限公司提供[实验动物生产许可证号SCXK(京) 2019-0010],饲养于甘肃中医药大学[实验动物使用许可证号SYXK (甘) 2020-0009],换气量10 ~20 次/h,日光灯照射,12 h/12 h 明暗交替,自由摄食(高温高压灭菌常规饲料,由北京科澳协力饲料有限公司提供)、饮水[纯水,经MF-RO-10 型实验动物饮用水处理器(杭州永洁达净化科技有限公司) 处理],温度20~25 ℃,相对湿度40% ~52%,适应性饲养3 d。实验经甘肃中医药大学动物实验伦理委员会审查通过(伦理号2021-241 号)。
1.2 药物 红芪饮片购于甘肃省定西市宕昌县药材市场,经甘肃省药品检验研究院马潇主任药师鉴定为豆科植物多序岩黄芪的干燥根,煎煮2 次,每次1.5 h,合并2 次滤液并浓缩,离心后进行4 次醇沉(70%、70%、80%、90%),每次间隔24 h,然后用10%三氯乙酸脱蛋白,50 ℃烘箱中干燥得多糖。以无水葡萄糖为对照品,采用紫外分光光度计测定其含量,绘制标准曲线,测得红芪多糖纯度为83.3%。
1.3 试剂 吡非尼酮胶囊(国药准字H20133376,100 mg/粒,北京康蒂尼药业股份有限公司)。D-无水葡萄糖对照品(货号B21882,上海源叶生物科技有限公司); 小鼠TNF-α、GSH-Px、IL-6、SOD ELISA 试剂盒 (批号2019M73、2019M09、2019M52、2019M6,江苏菲亚生物科技有限公司); 小鼠MDA 检测试剂盒(货号A003-1-1,南京建成生物工程研究所); GAPDH 抗体、TNF-α抗体、mTOR 抗体、HRP-羊抗兔 IgG ( 货号B1501、B7201、N1301、B0201,美国ImmunoWay公司); HIF-1α 抗体 (批号GR3368586-5,英国Abcam 公司); VEGF 抗体 (批号43866,美国GeneTex 公司)。
1.4 仪器 UV-power 紫外可见分光光度计(北京瑞利分析仪器有限公司); X-RAD 225 OptiMAX 辐照仪 (pxi)、Inlivew-3000B 动物PET/SPECT/CT(北京永新医疗设备有限公司); WPB PLT-UNRRT-2 动物肺功能仪(北京艾慕卡生物技术有限公司); SCIENTZ-48 高通量组织研磨器(宁波新芝生物科技股份有限公司); NanoDrop 2000C 超微量分光光度计(香港基因有限公司)。
2 方法
2.1 分组、造模及给药 小鼠随机分为空白组、模型组、吡非尼酮组(200 mg/kg)、红芪水煎液组(5 000 mg/kg) 和红芪多糖低、中、高剂量组(15、30、60 mg/kg,临床等效剂量的0.5、1、2倍),每组24 只。预防给药7 d,于第7 天给药后30 min,小鼠腹腔注射3%戊巴比妥钠(40 mg/kg)麻醉,除空白组外其余各组小鼠仰卧位固定于鼠板上,用加速器进行单次肺脏平面照射,铅块遮挡保护其余未照射部分,照射距离48 cm,单次照射剂量2 Gy/min,连续照射8 min,总剂量16 Gy,通过肺组织HE 染色判断模型是否建立成功。造模后继续给药7 d,于第7 天给药30 min 后取材,每组8 只。
潮汕地区是广东省汕头市、潮州市、揭阳市的统称。地域面积并不广阔。拿小城汕头来说,这里的海洋面积是陆地的五倍。然而,牛肉火锅却打败了海鲜,一举拿下潮汕美食扛把子的地位,凭什么?或许,这只能用潮汕人对料理的诚意,还有对美味的热爱才能解释得清吧。
2.2 一般状态、体质量、肺系数检测 观察各组小鼠活动情况、皮毛改变情况、对外界刺激的灵敏性、进食进水量、体质量改变情况、死亡情况,并详细记录。取材时小心分离肺组织,称量并记录质量,计算湿肺系数,公式为湿肺系数= (湿肺质量/小鼠体质量) ×100%[13]。
2.3 肺功能指标检测 取肺组织前,将各组小鼠分批放入动物体积描记箱中进行清醒状态(rf) 下检测,指标包括吸气时间(Ti)、呼气时间(Te)、潮气量(TV)、每分钟通气量(MV)、吸气气流高峰(PIF)、呼气气流高峰(PEF)[13]。
2.4 肺部CT 影像学检测 各组小鼠在造模前及造模后第6 天进行肺功能检测后,每组取8 只,腹腔注射戊巴比妥钠麻醉,俯卧位固定于小动物PET/CT 床位上,每次2 只,平行放置,进行肺部CT 扫描。
2.5 肺组织病理学检测 小鼠左肺组织去除周围结缔组织后用生理盐水冲洗干净,滤纸吸干多余水分,于10% 多聚甲醛中固定,梯度乙醇脱水,二甲苯透明,脱脂后包埋于石蜡中,经切片、展片、烤片后置于二甲苯、梯度乙醇中脱蜡至水,进行苏木素、伊红染色,经脱水、透明、封片后,于显微镜下观察肺组织的炎症情况。根据Szapiel 方法[14]评价肺组织肺泡炎,分级标准见表1。

表1 肺组织肺泡炎分级标准Tab.1 Classification standard for pulmonary tissue alveolitis
2.6 Western blot 法检测肺组织TNF-α、mTOR、VEGF、HIF-1α 蛋白表达 提取小鼠肺组织蛋白,煮沸进行变性,通过BCA 法测定浓度,经上样、电泳、转膜、封闭、孵育一抗、孵育二抗后进行曝光,分析条带灰度值,以GAPDH 为内参,计算TNF-α、mTOR、VEGF、HIF-1α 蛋白相对表达。
2.7 RT-qPCR 法检测肺组织mTOR、VEGF、HIF-1αmRNA 表达 按照细胞/组织总RNA 提取试剂盒说明书提取各组小鼠肺组织总RNA,按照反转录试剂盒说明书将RNA 逆转录为cDNA,再进行PCR 扩增反应,获得CT值,以GAPDH为内参,采用2-ΔΔCT法计算各基因mRNA 表达。引物序列见表2。

表2 引物序列Tab.2 Primer sequences
2.8 ELISA 法检测血清TNF-α、IL-6、MDA 水平及SOD、GSH-Px 活性 取小鼠全血,离心分离血清,按照ELISA 试剂盒说明书进行操作,在酶标仪450 nm 波长处测定吸光度(A),绘制标准曲线,计算TNF-α、IL-6、MDA 水平及SOD、GSHPx 活性。
2.9 统计学分析 通过SPSS 21.0 软件进行处理,符合正态分布的计量资料以(±s) 表示,组间比较采用单因素方差分析,方差齐时采用LSD 法检验,方差不齐时采用Tamhane’s T2 法检验; 若不符合正态分布则用中位数、四分位数间距表示,组间比较采用秩和检验; 量效关系采用线性趋势检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 红芪多糖对小鼠一般状态、体质量、肺系数的影响
3.1.1 一般状态 各组小鼠在实验过程中均无死亡。空白组小鼠活动正常,皮毛光滑浓密有光泽;模型组小鼠在造模后总体精神状态较空白组略差,蜷卧扎堆,食量、活动减少; 吡非尼酮组小鼠在初次给药后立刻出现精神萎靡、倦怠乏力、蜷卧扎堆、活动迟钝等现象,随着给药时间的推移逐渐好转,但较其他药物干预组状态差; 其他药物干预组小鼠在造模前表现正常,状态佳,在造模后与模型组、吡非尼酮组比较活动状态较好,各组之间无明显差异。
3.1.2 体质量 模型组小鼠体质量与空白组比较增长较为缓慢,在实验第8 天后呈现下降趋势(P<0.05,P<0.01); 随着干预时间延长,与模型组比较,各给药组小鼠体质量增长有不同程度的增加,红芪多糖高剂量组在第8、10 天增长明显(P<0.05,P<0.01),红芪多糖中剂量组在第10天增长明显(P<0.01),红芪水煎液组、红芪多糖低剂量组在第10 天增长明显(P<0.05),见表3。
表3 各组小鼠体质量比较(±s,n=8)Tab.3 Comparison of mouse body weight in each group (±s,n=8)
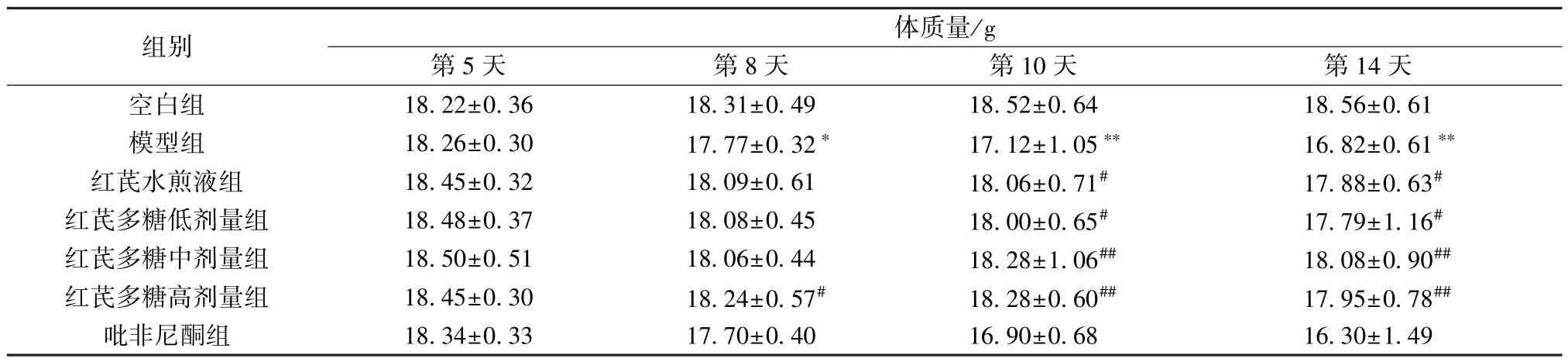
表3 各组小鼠体质量比较(±s,n=8)Tab.3 Comparison of mouse body weight in each group (±s,n=8)
注: 与空白组比较,*P<0.05,**P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别体质量/g第5 天第8 天第10 天第14 天空白组18.22±0.3618.31±0.4918.52±0.6418.56±0.61模型组18.26±0.3017.77±0.32*17.12±1.05**16.82±0.61**红芪水煎液组18.45±0.3218.09±0.6118.06±0.71#17.88±0.63#红芪多糖低剂量组18.48±0.3718.08±0.4518.00±0.65#17.79±1.16#红芪多糖中剂量组18.50±0.5118.06±0.4418.28±1.06##18.08±0.90##红芪多糖高剂量组18.45±0.3018.24±0.57#18.28±0.60##17.95±0.78##吡非尼酮组18.34±0.3317.70±0.4016.90±0.6816.30±1.49
3.1.3 肺系数 模型组小鼠肺系数较空白组升高(P<0.01),红芪多糖高剂量组、吡非尼酮组小鼠肺系数较模型组降低(P<0.05),见表4。
表4 各组小鼠湿肺系数比较(±s,n=8)Tab.4 Comparison of mouse wet lung coefficient in each group (±s,n=8)
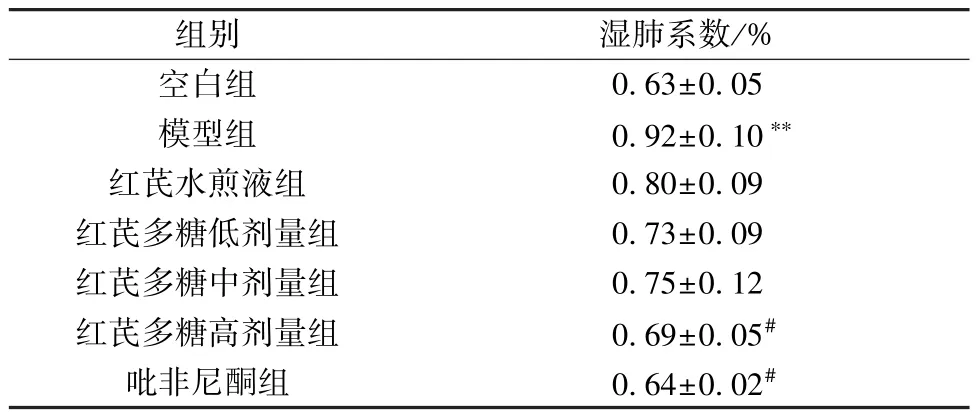
表4 各组小鼠湿肺系数比较(±s,n=8)Tab.4 Comparison of mouse wet lung coefficient in each group (±s,n=8)
注: 与空白组比较,**P<0.01; 与模型组比较,#P<0.05。
组别湿肺系数/%空白组0.63±0.05模型组0.92±0.10**红芪水煎液组0.80±0.09红芪多糖低剂量组0.73±0.09红芪多糖中剂量组0.75±0.12红芪多糖高剂量组0.69±0.05#吡非尼酮组0.64±0.02#
3.2 红芪多糖对小鼠肺组织病理学的影响 空白组小鼠肺组织中肺泡和支气管壁厚度正常,血管排列规则,未见明显炎症细胞浸润,为正常组织结构; 模型组小鼠肺组织病理改变主要以炎性渗出为主,肺泡腔有较为严重的充血、出血,肺间质水肿明显,气管上皮细胞脱落、坏死,主要呈急性炎性反应的改变,肺泡炎病理学分级较空白组升高(P<0.01); 与模型组比较,各给药组小鼠肺脏组织炎性反应均有一定程度的减轻,其中吡非尼酮组和红芪多糖高、中剂量组更明显,肺泡炎病理学分级较模型组降低(P<0.05,P<0.01),见图1、表5。
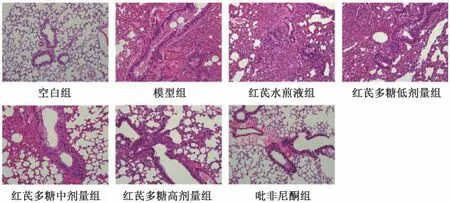
图1 各组小鼠肺组织病理情况(HE 染色,×200)Fig.1 Pulmonary tissue pathological condition of mice in each group (HE staining,×200)
表5 各组小鼠肺泡炎病理学分级比较(±s,n=8)Tab.5 Comparison of pathological grade of mouse alveolitis in each group (±s,n=8)
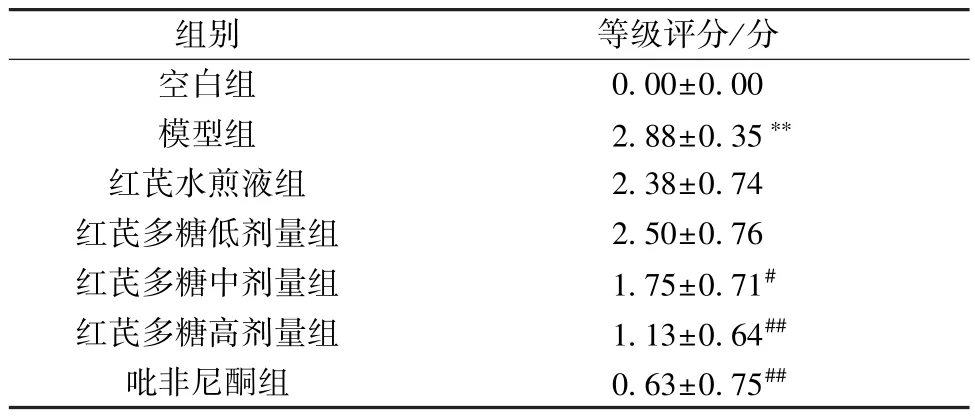
表5 各组小鼠肺泡炎病理学分级比较(±s,n=8)Tab.5 Comparison of pathological grade of mouse alveolitis in each group (±s,n=8)
注: 与空白组比较,**P <0.01; 与模型组比较,#P <0.05,##P<0.01。
组别等级评分/分空白组0.00±0.00模型组2.88±0.35**红芪水煎液组2.38±0.74红芪多糖低剂量组2.50±0.76红芪多糖中剂量组1.75±0.71#红芪多糖高剂量组1.13±0.64##吡非尼酮组0.63±0.75##
3.3 红芪多糖对小鼠肺功能的影响 与空白组比较,模型组小鼠吸气时间、呼气时间延长(P<0.05,P<0.01),吸气气流高峰、呼气气流高峰、每分钟通气量降低(P<0.05,P<0.01); 与模型组比较,红芪多糖高剂量组小鼠每分钟通气量增加(P<0.01),吡非尼酮组小鼠吸气气流高峰、呼气气流高峰、每分钟通气量增加(P<0.05,P<0.01),见表6。
表6 各组小鼠肺功能比较(±s,n=8)Tab.6 Comparison of mouse lung function in each group (±s,n=8)
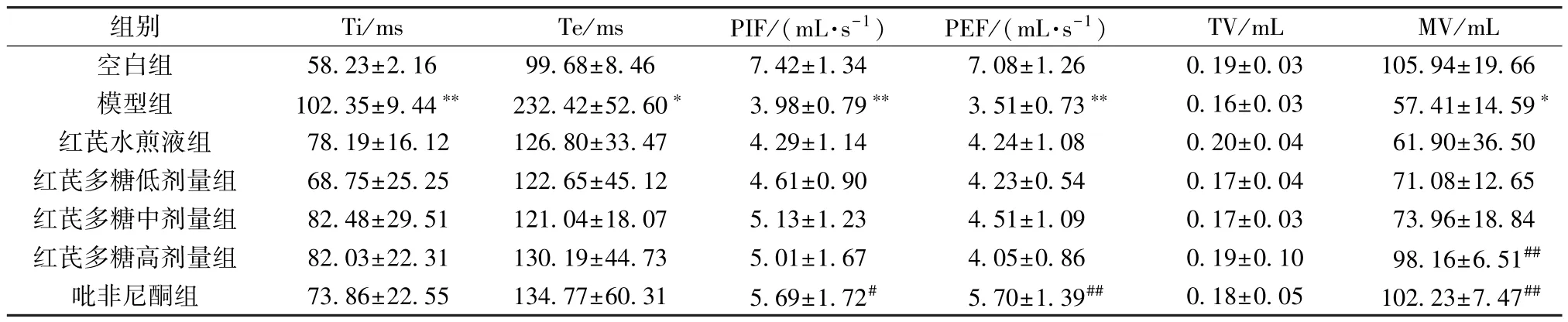
表6 各组小鼠肺功能比较(±s,n=8)Tab.6 Comparison of mouse lung function in each group (±s,n=8)
注: 与空白组比较,*P<0.05,**P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别Ti/msTe/msPIF/(mL·s-1)PEF/(mL·s-1)TV/mLMV/mL空白组58.23±2.1699.68±8.467.42±1.347.08±1.260.19±0.03105.94±19.66模型组102.35±9.44**232.42±52.60*3.98±0.79**3.51±0.73**0.16±0.0357.41±14.59*红芪水煎液组78.19±16.12126.80±33.474.29±1.144.24±1.080.20±0.0461.90±36.50红芪多糖低剂量组68.75±25.25122.65±45.124.61±0.904.23±0.540.17±0.0471.08±12.65红芪多糖中剂量组82.48±29.51121.04±18.075.13±1.234.51±1.090.17±0.0373.96±18.84红芪多糖高剂量组82.03±22.31130.19±44.735.01±1.674.05±0.860.19±0.1098.16±6.51##吡非尼酮组73.86±22.55134.77±60.315.69±1.72#5.70±1.39##0.18±0.05102.23±7.47##
3.4 红芪多糖对小鼠CT 影像学的影响 造模前,各组小鼠肺组织CT 值无明显差异(P>0.05)。造模后,模型组小鼠肺组织CT 值较空白组升高(P<0.05); 红芪多糖高剂量组、吡非尼酮组小鼠肺组织CT 值较模型组降低(P<0.05),见表7。
表7 造模前后各组小鼠肺组织CT 值比较(±s,n=8)Tab.7 Comparison of CT value of mouse pulmonary tissue in each group before and after modeling(±s,n=8)
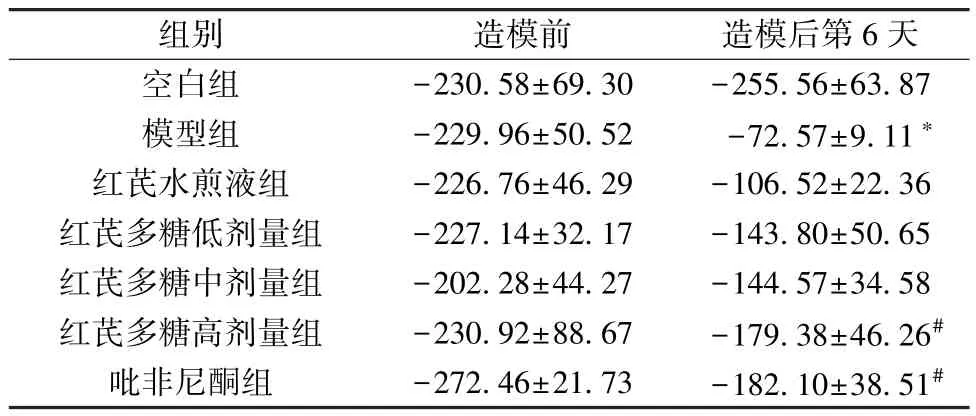
表7 造模前后各组小鼠肺组织CT 值比较(±s,n=8)Tab.7 Comparison of CT value of mouse pulmonary tissue in each group before and after modeling(±s,n=8)
注: 与空白组比较,*P<0.05; 与模型组比较,#P<0.05。
组别造模前造模后第6 天空白组-230.58±69.30-255.56±63.87模型组-229.96±50.52-72.57±9.11*红芪水煎液组-226.76±46.29-106.52±22.36红芪多糖低剂量组-227.14±32.17-143.80±50.65红芪多糖中剂量组-202.28±44.27-144.57±34.58红芪多糖高剂量组-230.92±88.67-179.38±46.26#吡非尼酮组-272.46±21.73-182.10±38.51#
3.5 红芪多糖对小鼠血清TNF-α、IL-6、MDA 水平及SOD、GSH-Px 活性的影响 与空白组比较,模型组小鼠血清TNF-α、IL-6、MDA 水平升高(P<0.01),SOD、GSH-Px 活性降低(P<0.01);与模型组比较,红芪多糖中、高剂量组和吡非尼酮组小鼠血清TNF-α、IL-6、MDA 水平降低 (P<0.05,P<0.01),SOD、GSH-Px 活性升高 (P<0.05,P<0.01),见表8。
表8 各组小鼠血清TNF-α、IL-6、MDA 水平及SOD、GSH-Px 活性比较(±s,n=8)Tab.8 Comparison of mouse serum TNF-α,IL-6,MDA levels and SOD,GSH-Px activities in each group (±s,n=8)

表8 各组小鼠血清TNF-α、IL-6、MDA 水平及SOD、GSH-Px 活性比较(±s,n=8)Tab.8 Comparison of mouse serum TNF-α,IL-6,MDA levels and SOD,GSH-Px activities in each group (±s,n=8)
注: 与空白组比较,**P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别TNF-α/(ng·L-1)IL-6/(pg·mL-1)MDA/(nmol·mL-1)SOD/(pg·mL-1)GSH-Px/(ng·L-1)空白组247.85±50.1115.02±1.689.63±2.038.73±0.8331.10±2.85模型组631.70±32.30**35.37±3.28**14.94±2.99**4.20±0.35**19.26±4.01**红芪水煎液组598.43±23.3334.09±2.3813.72±5.094.79±0.2320.63±6.24红芪多糖低剂量组598.16±28.2633.96±2.5312.75±2.044.70±0.6122.41±2.99红芪多糖中剂量组550.74±18.38#32.14±2.04#11.33±1.04#4.99±0.66#24.63±2.94#红芪多糖高剂量组371.50±84.13##27.64±2.07##10.26±1.94##6.09±0.77##26.35±3.70##吡非尼酮组286.94±7.55##18.15±2.65##10.11±1.13##7.23±0.50##29.87±2.90##
3.6 红芪多糖对小鼠肺组织mTOR、VEGF、HIF-1αmRNA 表达的影响 与空白组比较,模型组小鼠肺组织mTOR、VEGF、HIF-1αmRNA 表达升高(P<0.01); 与模型组比较,红芪多糖中、高剂量组和吡非尼酮组小鼠肺组织mTOR、VEGF、HIF-1αmRNA 表达降低(P<0.05,P<0.01),见表9。
表9 各组小鼠肺组织mTOR、VEGF、HIF-1α mRNA 表达比较(±s,n=8)Tab.9 Comparison of mouse pulmonary tissue expressions of mTOR,VEGF and HIF-1α mRNA in each group(±s,n=8)
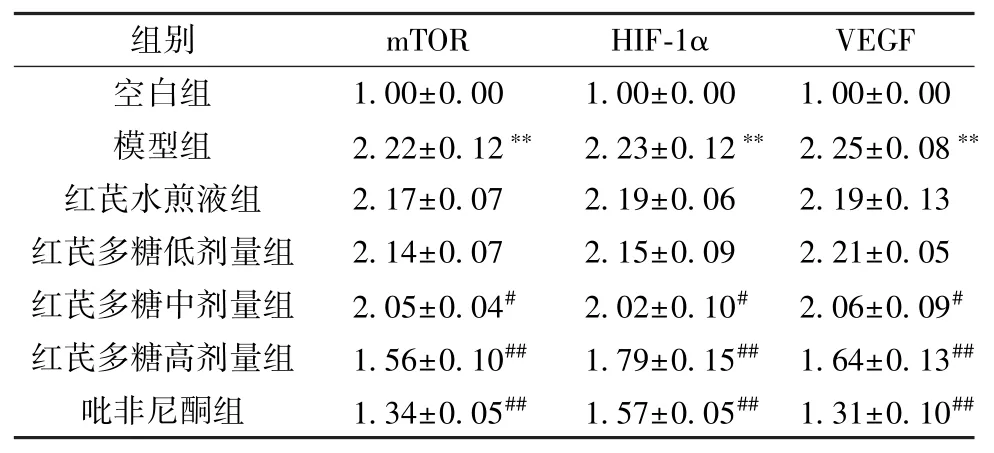
表9 各组小鼠肺组织mTOR、VEGF、HIF-1α mRNA 表达比较(±s,n=8)Tab.9 Comparison of mouse pulmonary tissue expressions of mTOR,VEGF and HIF-1α mRNA in each group(±s,n=8)
注: 与空白组比较,**P <0.01; 与模型组比较,#P <0.05,##P<0.01。
组别mTORHIF-1αVEGF空白组1.00±0.001.00±0.001.00±0.00模型组2.22±0.12** 2.23±0.12** 2.25±0.08**红芪水煎液组2.17±0.072.19±0.062.19±0.13红芪多糖低剂量组2.14±0.072.15±0.092.21±0.05红芪多糖中剂量组2.05±0.04#2.02±0.10#2.06±0.09#红芪多糖高剂量组1.56±0.10##1.79±0.15## 1.64±0.13##吡非尼酮组1.34±0.05##1.57±0.05## 1.31±0.10##
3.7 红芪多糖对小鼠肺组织TNF-α、mTOR、VEGF、HIF-1α 蛋白表达的影响 与空白组比较,模型组小鼠肺组织TNF-α、mTOR、HIF-1α、VEGF蛋白表达升高(P<0.01); 与模型组比较,红芪多糖中、高剂量组和吡非尼酮组小鼠肺组织TNF-α、mTOR、HIF-1α、VEGF 蛋白表达降低(P<0.05,P<0.01),见图2、表10。
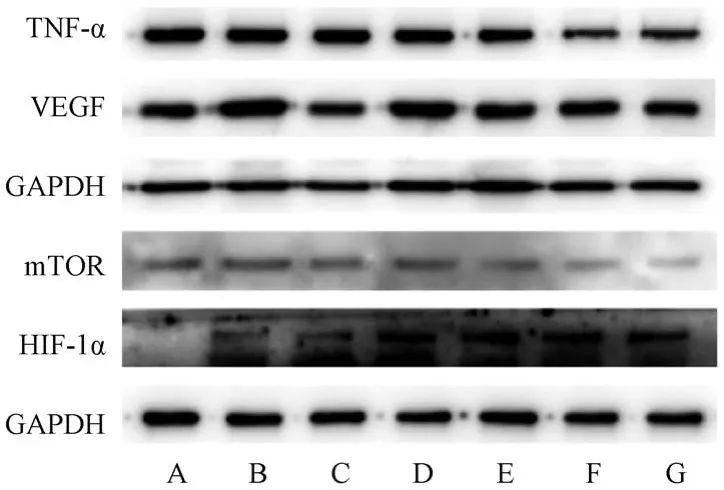
图2 各组小鼠肺组织TNF-α、mTOR、VEGF、HIF-1α 蛋白条带Fig.2 Pulmonary tissue protein bands of TNF-α,mTOR,VEGF and HIF-1α in mice of each group
表10 各组小鼠肺组织TNF-α、mTOR、VEGF、HIF-1α 蛋白表达比较(±s,n=8)Tab.10 Comparison of mouse pulmonary tissue TNF-α,mTOR,VEGF and HIF-1α protein expressions in each group (±s,n=8)

表10 各组小鼠肺组织TNF-α、mTOR、VEGF、HIF-1α 蛋白表达比较(±s,n=8)Tab.10 Comparison of mouse pulmonary tissue TNF-α,mTOR,VEGF and HIF-1α protein expressions in each group (±s,n=8)
注: 与空白组比较,**P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别TNF-α/GAPDHmTOR/GAPDHHIF-1α/GAPDHVEGF/GAPDH空白组0.70±0.060.55±0.080.80±0.050.68±0.12模型组1.36±0.04**1.26±0.03**1.48±0.02**1.44±0.17**红芪水煎液组1.33±0.051.24±0.041.47±0.031.42±0.17红芪多糖低剂量组1.31±0.061.21±0.041.47±0.031.40±0.19红芪多糖中剂量组1.21±0.05#1.17±0.05#1.40±0.07#1.19±0.10#红芪多糖高剂量组1.03±0.10##1.12±0.01##1.10±0.05##1.09±0.09##吡非尼酮组0.90±0.09##0.94±0.07##0.91±0.03##0.98±0.02##
4 讨论
本实验通过单次16 Gy 的X 线照射小鼠全胸部建立急性放射性肺炎模型,通过病理切片、肺功能以及CT 影像学结果综合评价模型是否建立成功。HE 染色显示模型组小鼠肺脏组织病理学主要为急性炎性反应,病变主要以炎性渗出为主,而各给药组小鼠肺部炎性反应均有不同程度减轻,提示单次16 Gy 的X 线照射小鼠全胸部可以建立早期可逆性放射性肺炎小鼠模型,而红芪多糖可以减轻模型小鼠炎症反应且效果较好。
早期可逆性放射性肺炎的发生、发展与氧化损伤后产生的大量炎症因子释放密切相关,而炎症因子如TNF-α、IL-6 等的释放进一步加重了肺部的损伤状况。MDA、GSH-Px 和SOD 是经典的反映氧化应激反应的指标。本实验中红芪多糖可有效降低小鼠血清TNF-α、IL-6 水平,升高SOD、GSH-Px 活性并降低MDA 水平,提示红芪多糖具有抗炎以及抗氧化作用,可有效改善模型小鼠肺部的炎症状况。
缺氧诱导因子是与缺氧适应、炎症发展相关的靶基因[15],主要由HIF-1α 调控[16]。缺氧是肺部炎症反应持续性加重的重要因素[17-20],一般认为缺氧主要通过HIF-1 信号通路来加重炎症反应[21-22]。而炎症反应又通过大量渗出炎症因子进而加重组织微环境的缺氧状况,形成一个难以逆转的恶性循环,使炎症反应持续放大[23]。已有研究报道证明HIF-1α 是控制和减轻炎症反应发生发展的一个重要药物靶点[24-26]。雷帕霉素(mTOR) 信号通路的激活可以调节HIF-1α 从细胞质向细胞核内转移,提高VEGF 表达,增加炎症因子的浸润,并加重肺损伤[27-28]。由此推测,在放射引起缺氧、ROS 累积状态下,通过抑制HIF-1 信号通路可减少细胞因子的释放,减轻肺部的损伤程度。本实验结果表明,红芪多糖可降低小鼠肺组织TNF-α、mTOR、HIF-1α、VEGF 蛋白表达及mTOR、HIF-1α、VEGFmRNA 表达,提示下调HIF-1 信号通路上关键蛋白及mRNA 的表达可发挥防治急性放射性肺炎的作用。
目前,临床上RILI 的发生率较高,一旦发展成为肺纤维化则不可逆。课题组前期研究证明红芪多糖具有抗炎、抗氧化作用,可以有效治疗肺间质纤维化,减轻肺泡炎症,但基础研究与临床研究数据较少,样本量不足,故未得到广泛的认可。本实验结果提示红芪多糖可能通过调控HIF-1 信号通路防治急性放射性肺炎的发生和发展,但放射性肺损伤是一个长期过程,炎症持续存在,可能发生放射性肺纤维化,后续机制有待进一步探索。
致谢 感谢甘肃中医药大学提供的科研平台以及课题组所有成员的辛勤付出。

