Box-Behnken设计—响应面法优化地参总三萜酸纯化工艺
李金金 叶明燕 姚欢 吴应梅 周浓




DOI:10.3969/j.issn.2095-1191.2023.06.011
摘要:【目的】建立响应面模型优化合适树脂下地参总三萜酸的纯化工艺,为研究地参总三萜酸活性提供技术参考。【方法】运用Box-Behnken设计方法,采用大孔树脂吸附纯化地参总三萜酸,以吸附率和解吸率为指标,测定5种大孔树脂(AB-8、D101、HPD600、DA201和S-8型)对地参总三萜酸的纯化效果。以上样浓度、上样流速、洗脱浓度和洗脱流速为自变量,回收率为因变量,运用响应面法优化地参总三萜酸纯化工艺參数。【结果】最佳显色条件:显色温度60℃,5%香草醛—冰乙酸0.2 mL,高氯酸0.4 mL,检测波长545 nm。AB-8型树脂对地参总三萜酸的吸附和解吸效果最佳,解吸率为88.61%,吸附率为70.54%。上样体积在40 mL,80%乙醇100 mL为最佳洗脱体积。建立的回归方程:Y=0.6887+0.0196A-0.0085B-0.0287C+0.0052D+0.0299AB-0.0107AC-0.0122AD+0.0128BC+0.0211BD+0.026A2-0.0765B2-0.0877C2-0.0932D2(A为上样浓度,B为上样流速,C为洗脱浓度,D为洗脱流速,Y为总三萜酸回收率)。由Box-Behnken方差分析结果可得,上样浓度和洗脱浓度2个因素,以及上样浓度与上样流速的交互作用、洗脱浓度与洗脱流速的交互作用对地参总三萜酸回收率影响极显著(P<0.01),上样流速与洗脱流速的交互作用对总三萜酸回收率影响显著(P<0.05),4个因素对地参总三萜酸回收率影响顺序为洗脱浓度>上样浓度>上样流速>洗脱流速。优化后的地参总三萜酸纯化工艺:上样浓度0.66 mg/mL、上样流速2 BV/h、洗脱浓度80%、洗脱流速2 BV/h,在此条件下,总三萜酸平均回收率为67.37%。【结论】建立的回归模型可用于地参总三萜酸纯化工艺的预测;AB-8型大孔树脂对地参总三萜酸的分离纯化效果较好,适用于总三萜酸物质的纯化。
关键词:地参;总三萜酸;大孔树脂;纯化工艺;响应面法
中图分类号:S567.239 文献标志码:A 文章编号:2095-1191(2023)06-1697-14
Purification process of total triterpenic acids from Lycopus lucidus Turcz. by Box-Behnken design-response surface methodology
LI Jin-jin1,2, YE Ming-yan1,2, YAO Huan1,2, WU Ying-mei1, ZHOU Nong1,2*
(1College of Biological and Food Engineering,Chongqing Three Gorges University,Chongqing 404120,China;
2Chongqing Engineering Laboratory for Green Planting and Deep Processing of Genuine Medicinal Materials in
Three Gorges Reservoir Area,Chongqing 404120,China)
Abstract:【Objective】A response surface model was established to optimize the purification process of total triterpenic acids from Lycopus lucidus Turcz. with suitable resin,so as to provide technical reference for further study on the activity of total triterpenic acids from L. lucidus. 【Method】Using the Box-Behnken design method, the total triterpenic acids of L. lucidus was purified by macroporous resin adsorption. The purification effects of macroporous resins (AB-8 type, D101 type, HPD600 type, DA201 type and S-8 type) on total triterpenic acids of L. lucidus were determined by using the adsorption rate and desorption rate as indexes. The sample concentration,sample loading speed, eluent concentration and eluentvelocity were the independent variables, and recovery rate was the dependent variable. The purification process parameters of total triterpenic acids from L. lucidus were optimized by response surface methodology. 【Result】Optimum color development conditions were: color development temperature of 60 ℃, 5% vanillin-glacial acetic acid of 0.2 mL, perchloric acid of 0.4 mL, and detection wavelength of 545 nm. The results showed that AB-8 type macroporous resin had the best adsorption and desorption effectsontotal triterpenic acids of L. lucidus, withthe desorption rate of 88.61% and the adsorption rate of 70.54%. The loading volume was 40 mL, and 80% ethanol 100 mL was the best eluent volume. A regression equation was set up:Y=0.6887+0.0196A-0.0085B-0.0287C+0.0052D+0.0299AB-0.0107AC-0.0122AD+0.0128BC+0.0211BD+0.026A2-0.0765B2-0.0877C2-0.0932D2(A:sample concentration,B:sample loading speed,C:eluent concentration,D:eluent velocity,Y:recovery rate of total triterpenic acids). According to Box-Behnken variance analysis,sample concentration, eluent concentration,the interaction between sample concentration and sample loading speed,and the interac-tion between eluent concentration and eluent velocity had extremely significant effects on the recovery rate of total triterpenic acids from L. lucidus(P<0.01), while the interaction between sample loading speed and eluent velocity had significant effects on the recovery rate of total triterpenic acids from L. lucidus(P<0.05). The four single factors affected the recovery rate of total triterpenic acids of L. lucidus in the order of eluent concentration>sample concentration>sample loading speed>eluent velocity from L. lucidus. The optimized purification process for total triterpenic acids of L. lucidus was: sample concentration of 0.66 mg/mL, sample loading speed of 2 BV/h, eluent concentration of 80% and from L. lucidus of 2 BV/h. Under these conditions, the average recovery rate of total triterpenic acids was 67.37%. 【Conclusion】The established regression model can be used to predict the purification process of total triterpenic acids from L. lucidus; the AB-8 type macroporous resin has a relatively good effect on the separation and purification of total triterpenic acids from L. lucidus, which is suitable for the purification of total triterpenic acids.
Key words: Lycopus lucidus Turcz.; total triterpenic acids; macroporous resin; purification process; response surface methodology
Foundation items:Chongqing Natural Science Foundation(cstc2019jcyj-msxmX0770);Science and Technology Research Project of Chongqing Education Commission(KJQN202201231, KJQN202002712)
0 引言
【研究意义】地参(Lycopus lucidus Turcz.)又名泽兰,是一年生草本唇形科植物,以地下部分入药,多分布于我国东北、西北及西南地区。其野生资源环境适应性强,不仅生命力顽强,虫害也极易防治,栽种资源丰富(罗孟禹和董开居,2006)。总三萜酸因具有抗肿瘤、抗炎、调节血糖血脂和提高免疫力等功效而受到大众的关注(Fukushima et al.,2006;Zhu et al.,2016;Biswas and Dwivedi,2019),但总三萜酸类物质在动植物体内含量较少,且存在形态复杂,对植物资源中总三萜酸进行提取分离纯化是使其发挥更好功效的必要前提。采用醇提法对地参总三萜酸初步提取,所得总三萜酸成分为粗提物。由于粗提物中总三萜酸纯度较低,地参中成分复杂,其中含有总三萜酸、多糖、多酚和黄酮等生物活性成分,且提取液中多糖成分较多,不易储存(许泳吉等,2003;Lu et al.,2015),因而纯化地参粗提液尤为重要。【前人研究进展】目前纯化三萜酸最常见的方法是大孔树脂吸附法(姚干等,2007;刘娜,2016),不同极性的树脂对不同种类化合物的选择性有所不同。杜晖和王春雨(2007)研究表明X-5型树脂能有效富集纯化夏枯草中2种五环三萜酸成分,产品中目标组分的纯度和回收率较高,工艺流程简单易行;袁怀波等(2007,2008)采用大孔树脂对山楂和木瓜提取液进行分离纯化,在上样pH为6、洗脱液70%的条件下洗脱出山楂和木瓜总三萜酸纯化物,产品的纯度远高于粗提液;樊君等(2008)利用大孔吸附树脂对枣渣中三萜酸进行分离纯化,其回收率在65%以上,纯度也达80%以上;桑咏梅和丁振铎(2011)通过D101型树脂检测中药复方金匮肾气丸中总三萜类成分,分别对总三萜酸单体及总三萜酸的吸附性能和洗脱参数进行优化,进而证明树脂能有效吸附和解吸总三萜酸单体和总三萜酸;梁卓然(2021)对女贞果实中齐墩果酸进行提取,采用HPD300型树脂纯化后,其齐墩果酸含量可达86.53%,经高效液相色谱(HPLC)检测,分离纯化后齐墩果酸能与杂质有效分离。研究报道,非极性或弱性的树脂可用于分离总三萜酸,AB-8型树脂适用于黄酮、生物碱和多糖类等物质的提取分离和纯化(谌江城等,2014;闵玉涛等,2015)。蒙瑞波等(2012)利用AB-8型树脂对白花蛇舌草中总三萜酸进行提取纯化,其纯化参数为上样流速2 BV/h、洗脱流速2 BV/h、洗脱乙醇体积分数80%,在该条件下,总三萜酸的纯度可提升4倍,说明AB-8型树脂对总三萜酸提取效果极大提高;王苗苗等(2020)采用AB-8型树脂富集罗汉果茎中三萜酸,经大孔树脂富集后三萜酸含量明显增加;柯春山等(2021)筛选出AB-8型树脂为纯化裸花紫珠的最适树脂,纯化后溶液由浑浊变为澄清。【本研究切入点】大孔吸附树脂用于中药材有效成分的筛选也有明显效果(黄燕秋等,2018)。刘娜(2016)对比多种型号树脂对泽兰地上部分分离纯化的效果,其中AB-8型树脂对泽兰地上部分纯化的吸附量、解吸率和吸附率分别为11.82 mg/g、81.82%和55.47%。但目前针对泽兰地下部分中总三萜酸成分纯化的研究报道少有,尤其是利用大孔吸附树脂进行纯化。【拟解决的关键问题】对地参总三萜酸显色条件及纯化工艺进行优化,筛选出最佳显色条件及最优树脂,再以最优大孔树脂对地参总三萜酸粗提物进行纯化,以回收率为考察指标,运用响应面模型优化纯化工艺参数,为研究地参总三萜酸活性提供技术参考。
1 材料与方法
1. 1 试验材料
地参产自重庆市万州区(人工栽培),由重庆三峡学院生物与食品工程学院周浓教授鉴定为地参,在自然条件下烘干,粉碎后过100目筛备用。熊果酸对照品(批号DST180606-019,HPLC≥98%)购自成都德思特生物技术有限公司;无水乙醇(AR)购自重庆川东化工(集团)有限公司;香草醛(香兰素)(AR)、冰乙酸(AR)和高氯酸(AR)购自成都市科隆化学品有限公司;S-8型树脂购自上海吉至生化科技有限公司;AB-8型树脂购自上海麦克林生化科技股份有限公司;D101型、HPD600型和DA201型树脂购自郑州和成新材料科技有限公司。主要仪器设备:高速多功能粉碎机(浙江省永康市金穗机械制造厂)、玻璃砂芯层析柱(三维实验室玻璃仪器公司)、A2004型电子天平(上海津平科学仪器有限公司)、精密天平(METTLER YOLEDO集团)、HSY-26型数显恒温水浴锅(上海跃进医疗器械有限公司)、BUCHI R-300旋轉蒸发仪(北京海富达科技有限公司)和V-1100D型可见分光光度计(上海美谱达仪器有限公司)。
1. 2 试验方法
1. 2. 1 样品溶液制备 称取地参1.000±0.002 g置于锥形瓶中,平行3次,醇提法提取,过滤,浓缩,以乙醇溶液定容至5 mL,移取0.1 mL稀释至50 mL,摇匀后测定吸光值,重复3次取平均值。
1. 2. 2 标准曲线绘制 称取减压干燥至恒重的对照品适量,加乙醇溶解并制成浓度为0.0985 g/mL的对照品溶液。取对照品溶液1.0 mL,用乙醇定容至500 mL,逐级稀释;再分别精密吸取对照品溶液0.1、0.3、0.5、0.7和0.9 mL,测定其吸光值。以对照品溶液浓度为横坐标、吸光值为纵坐标,绘制标准曲线。
1. 3 检测波长测定及显色条件优化
1. 3. 1 检测波长确定 精密移取对照品溶液和供试品溶液,置于试管中挥干水分,加入配制的5%香草醛—冰乙酸0.4 mL和高氯酸0.5 mL,置于水浴锅中恒温加热15 min,冷却后加入冰乙酸3.0 mL,摇匀,待测。以空白及无水乙醇为对照组,采用紫外分光光度计在200~800 nm处全波长扫描,对照品及样品溶液均在545 nm处有最大吸收,因此在检测波长545 nm处测定总三萜酸总量。
1. 3. 2 5%香草醛—冰乙酸用量 移取已配制对照品溶液0.5 mL,平行5份,依次加入5%香草醛—冰乙酸溶液0.2、0.4、0.6、0.8和1.0 mL,加入高氯酸溶液0.4 mL,然后加入3.0 mL冰乙酸,按1.3.1方法测定其吸光值。
1. 3. 3 高氯酸用量 移取已配制对照品溶液0.5 mL,平行5份,加入5%香草醛—冰乙酸溶液0.4 mL,依次加入高氯酸0.2、0.4、0.6、0.8和1.0 mL,然后加入3.0 mL冰乙酸,按1.3.1方法测定其吸光值。
1. 3. 4 显色温度 显色剂:移取5%香草醛—冰乙酸溶液0.2 mL,高氯酸0.4 mL,依次置于40、50、60、70和80 ℃水浴锅中恒温加热15 min,然后加入冰乙酸3.0 mL,按1.3.1方法测定其吸光值。显色剂+对照品:移取已配制对照品溶液0.5 mL,加入5%香草醛—冰乙酸溶液0.2 mL,高氯酸0.4 mL,依次置于40、50、60、70和80 ℃水浴锅中恒温加热15 min,然后加入冰乙酸3.0 mL,按1.3.1方法测定其吸光值。
1. 4 方法学考察
1. 4. 1 精密度试验 取对照品溶液0.5 mL,平行6份,按1.3.1方法測定吸光值,并计算相对标准偏差(RSD)。
1. 4. 2 重复性试验 取样品溶液6份,按1.3.1方法测定吸光值,并计算RSD。
1. 4. 3 稳定性试验 取样品溶液0.5 mL,每隔10 min测定一次吸光值,按1.3.1方法测定吸光值,并计算RSD。
1. 4. 4 加样回收试验 精密移取重复性考察中供试品溶液6份,每份溶液0.2 mL,再加入0.2 mL已知含量的对照品溶液,按1.3.1方法测定吸光值,并计算加样回收率及其RSD。
1. 5 大孔树脂纯化工艺
1. 5. 1 大孔树脂预处理 称量一定质量的树脂,取96%乙醇浸泡24 h,去除树脂的杂质和不完整碎片,使树脂充分溶胀,采用湿法装柱,用96%乙醇反复冲洗至流出液不产生浑浊,再用蒸馏水洗至无醇味以平衡柱子,柱子中树脂排列均匀、无气泡,即预处理完成,备用。
1. 5. 2 大孔树脂筛选 测定吸附率和解吸率,以筛选大孔树脂。静态饱和吸附率测定:分别选择预处理过的AB-8、D101、HPD600、DA201和S-8型树脂适量(相当于干重2 g)置于锥形瓶中,加入精密移取的10.0 mL地参总三萜酸浓缩液(0.7282 mg/mL),在摇床中150 r/min常温振荡24 h,至吸附平衡,过滤,所得滤液测定其吸光值A1,计算可得总三萜酸浓度和树脂饱和吸附率。
解吸率测定:将充分吸附饱和的树脂吸干表面水分,置于锥形瓶中,加入无水乙醇在摇床中150 r/min常温振荡24 h,测定其吸光值A2,计算可得解吸液中总三萜酸浓度和洗脱液解吸率。
吸附量=(C0-C1)V/M
吸附率(%)=(C0-C1)/C0×100
解吸率(%)=C2/(C0-C1)×100
回收率(%)=C2/C0×100
式中,M为树脂质量(mg),V为吸附液体积(mg/L),C0为吸附液中总三萜酸浓度(mg/mL),C1为吸附后溶液总三萜酸浓度(mg/mL),C2为解吸液中总三萜酸浓度(mg/mL)。
1. 6 大孔树脂静态吸附动力学研究
1. 6. 1 静态吸附动力学研究 对大孔树脂的静态吸附能力进行考察,以吸附时间为横坐标、吸附量为纵坐标,绘制静态吸附曲线。在室温条件下,称量预处理的AB-8型大孔树脂适量,置于100 mL锥形瓶中,精密移取地参总三萜酸提取液(0.7282 mg/mL),置于150 r/min摇床中,振荡以测定大孔树脂的静态吸附能力。以接触零时刻开始,每隔60 min取出样液测定1次总三萜酸含量,计算树脂吸附量,绘制静态吸附曲线。采用准一级速率方程和准二级速率方程2个动力学模型模拟吸附过程,进一步分析AB-8型树脂对地参总三萜酸的吸附速率情况。
准一级速率方程:ln(Qe-Qt)=lnQe+K1t
准二级速率方程:t/Qt=1/K2Qe+t/Qe
式中,t为吸附时间(min),Qt为t时刻树脂吸附量(mg/g),Qe为平衡时树脂吸附量(mg/g),K1和K2分别为准一级速率方程速率常数和准二级速率方程速率常数(min-1)。
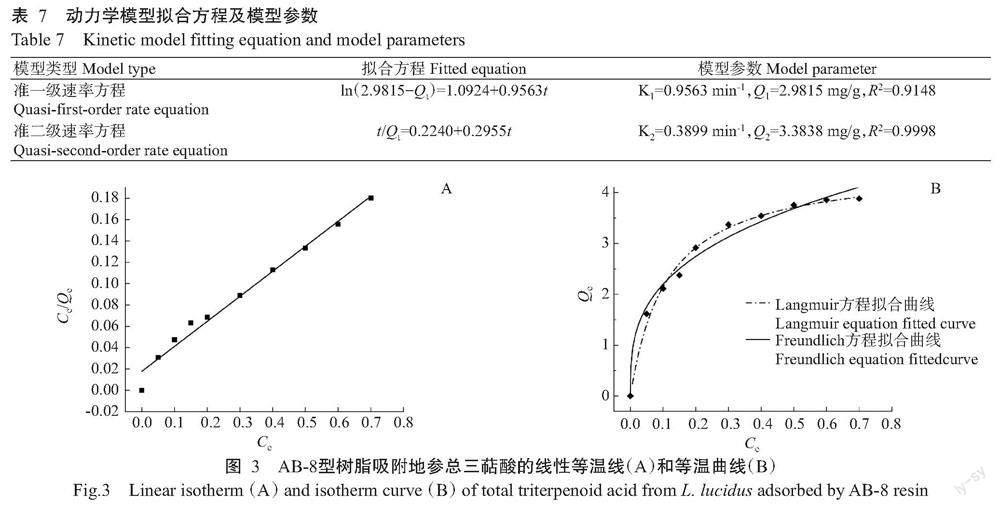
1. 6. 2 吸附等温线测定 配制不同浓度的总三萜酸提取液,在室温条件下,150 r/min摇床振荡24 h后测定样液中总三萜酸浓度,计算不同浓度样液的吸附量。以样液浓度为横坐标、吸附量为纵坐标,绘制树脂吸附地参总三萜酸的等温曲线。等温线的拟合能进一步了解树脂对地参总三萜酸的吸附方式,因而选择Langmuir和Freundlich 2种等温吸附方程线性拟合等温线模型。
Ce/Qe=Ce/Qm+1/KLQm
lnQe=lnKF+1/nlnCe
式中,Ce为溶液平衡时的浓度(mg/mL),Qe为平衡吸附量(mg/g),Qm为饱和吸附量(mg/g),KL为Langmuir方程常数(L/mg),n和KF为Freundlich方程常数,其中KF的单位为L/mg。
1. 7 大孔树脂动态吸附—解吸性能试验
1. 7. 1 大孔树脂上样液泄露曲线 量取预处理的AB-8型树脂适量进行动态吸附,湿法装柱,用已知浓度的地参总三萜酸溶液(0.7282 mg/mL)上柱,流速1 BV/h,分段收集流出液,每份5 mL,收集30份流出液。以收集管吸附液编号为横坐标、总三萜酸含量为纵坐标,绘制总三萜酸上样液泄露曲线。
1. 7. 2 上样浓度选择 取已测浓度的地参总三萜酸溶液,分别加水稀释成0.50、0.55、0.60、0.65和0.70 mg/mL不同浓度梯度进行上柱,静止1 h,依次用80%乙醇進行洗脱,控制流速为1 BV/h,收集洗脱液,测定总三萜酸吸光值,确定最佳上样浓度。
1. 7. 3 上样流速选择 取已测浓度的地参总三萜酸溶液,分别以1、2、3、4和5 BV/h流速上柱,静止1 h,依次用80%乙醇进行洗脱,控制流速为1 BV/h,收集洗脱液,测定总三萜酸含量,确定最佳上样流速。
1. 7. 4 大孔树脂洗脱曲线 量取预处理的AB-8型树脂适量进行动态洗脱,湿法装柱,以已测浓度的地参总三萜酸溶液上柱,流速为1 BV/h进行动态吸附,待树脂吸附平衡后,用80%乙醇进行洗脱,分段收集洗脱液,每份5 mL,收集30份流出液。以收集管洗脱液编号为横坐标、总三萜酸含量为纵坐标,绘制洗脱曲线。
1. 7. 5 洗脱浓度选择 取已测浓度的地参总三萜酸溶液湿法装柱,用蒸馏水洗涤平衡,待树脂吸附至平衡后,用50%、60%、70%、80%和90%乙醇进行洗脱,控制洗脱流速为1 BV/h,测定总三萜酸含量,确定最佳洗脱浓度。
1. 7. 6 洗脱流速选择 取已测浓度的地参总三萜酸溶液上柱,以1 BV/h流速通过后,用80%乙醇以1、2、3、4和5 BV/h进行洗脱,收集洗脱液,测定总三萜酸含量,确定最佳洗脱流速。
1. 8 响应面设计
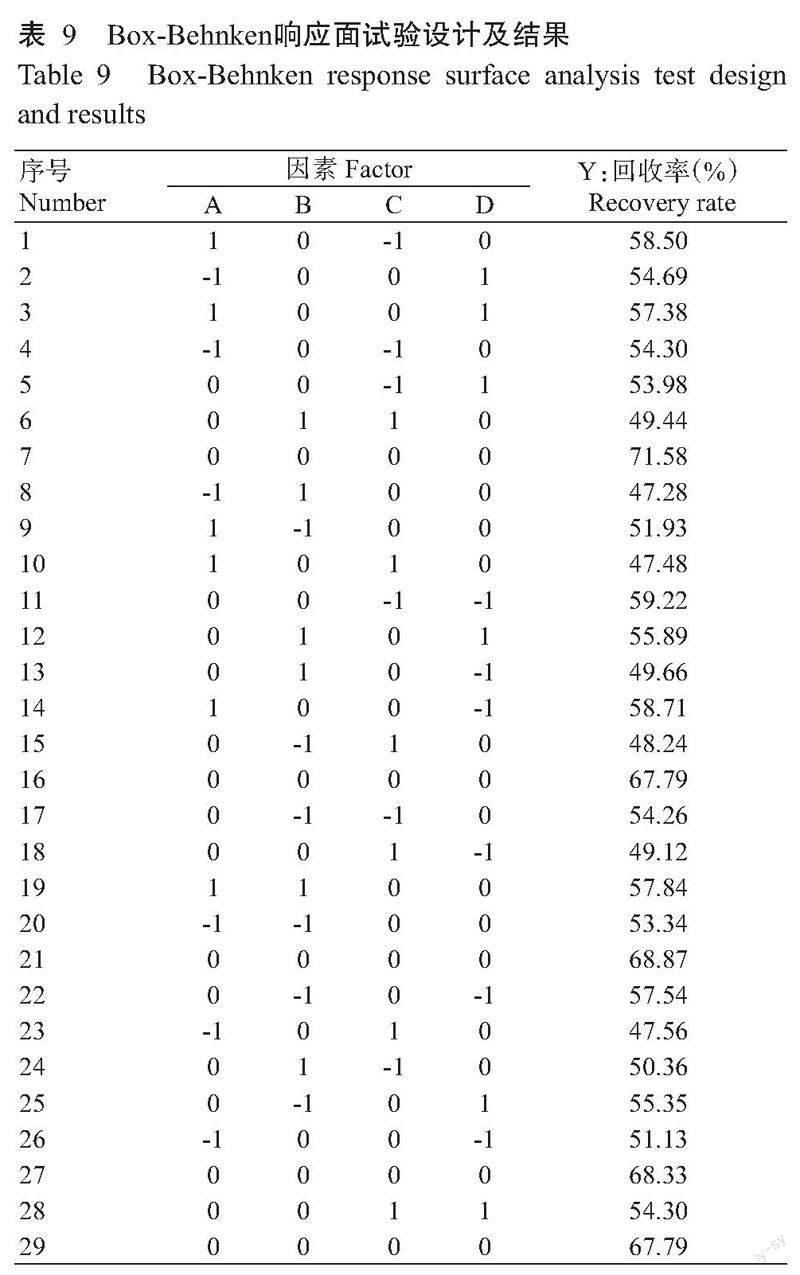
根据单因素试验结果,进一步设计响应面优化试验。选取总三萜酸纯化提取效果最好的因素水平,以上样浓度、上样流速、洗脱浓度和洗脱流速为自变量,总三萜酸纯化回收率为响应值,采用4因素3水平设计Box-Behnken Design试验,响应面因素水平见表1。
1. 9 统计分析
采用Excel 2019、Origin 2018和SPSS 26.0处理数据及绘图,以Design-Expert 12作响应面设计及试验分析。
2 结果与分析
2. 1 标准曲线线性关系考察结果
于545 nm处测定吸光值,以标准品溶液浓度为横坐标(x)、吸光值为纵坐标(y)绘制标准曲线,如图1所示。所得回归方程:y=4.41878x+0.0152(R2=0.9996),绘制的标准曲线在0.00197~0.01773 mg/mL范围内线性关系良好。
2. 2 方法学考察结果
2. 2. 1 精密度试验结果 计算所得总三萜酸平均RSD为1.75%,小于10%,表明仪器精密度良好。
2. 2. 2 重复性试验结果 地参总三萜酸平均RSD为2.19%,小于10%,表明醇提法提取地参总三萜酸的试验方法重复性较好。
2. 2. 3 稳定性试验结果 由表2可知,吸光值在20~40 min内较稳定,40 min稳定性开始下降,RSD为1.12%,表明地参样液适合在20~40 min内测定吸光值。
2. 2. 4 加样回收试验结果 由表3可知,回收率为96.59%~106.65%,在90%~110%范围内,表明醇提法提取地参总三萜酸的方法可靠。
2. 3 显色条件优化结果
由表4可知,5%香草醛—冰乙酸用量越多,吸光值最低,影响样品的显色效果,因而用量在0.2 mL时最合适;高氯酸随着加入量的增加,对样品的显色效果影响相对较小,当高氯酸加至0.4 mL时,显色效果最佳,故选择高氯酸用量为0.4 mL。加入显色剂和显色剂+对照品2组对比(表5)发现,显色剂组吸光值随温度的升高而不断增加,在60 ℃升至70 ℃时,吸光值增加明显,说明显色剂对显色效果的影响较大,综合考虑,选取60 ℃为显色温度。
2. 4 不同树脂的吸附率与解吸率
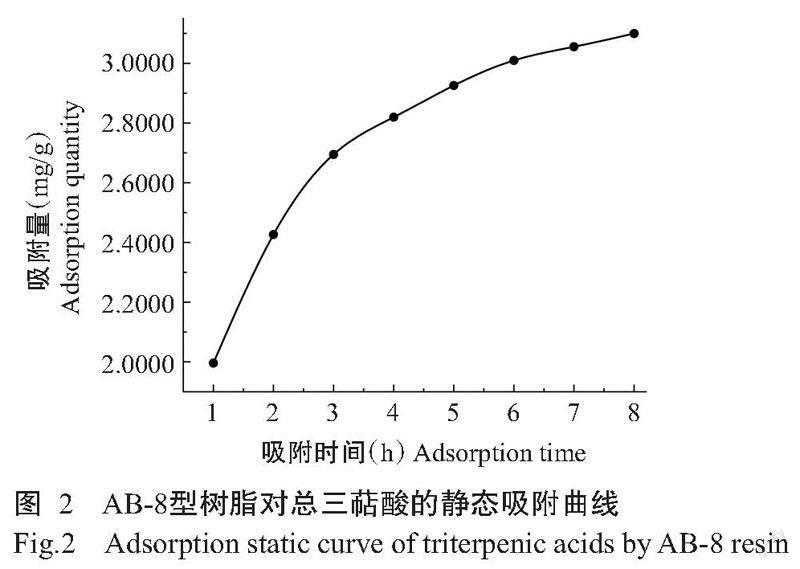
由表6可知,AB-8、D101和HPD600型树脂均为非极性树脂,萜类成分与非极性树脂极性类似,3种型号树脂的解吸率和吸附率均较高,其中AB-8型树脂最高,解吸率和吸附率分别为88.61%和70.54%。综合考虑吸附量、解吸率和吸附率指标,选择AB-8型树脂作下一步研究。
2. 5 大孔树脂静态吸附动力学试验结果
2. 5. 1 静态吸附动力学 由图2可知,随着吸附时间的延长,AB-8型树脂对总三萜酸的吸附量不断增加,在1~3 h吸附量快速增加,在3~6 h吸附量增速有所减缓,6 h之后的吸附量(3.0098 mg/g)增速进一步减缓并接近平衡,表明地参总三萜酸在6 h基本吸附完全。动力学方程(表7)显示,准二级速率方程特征系数更高(R2>0.9900),能描述AB-8型树脂对地参总三萜酸的吸附过程。
2. 5. 2 大孔树脂吸附等温线测定 地参总三萜酸经AB-8型树脂吸附的线性等温线和吸附等温曲线如图3所示,Langmuir和Freundlich方程如表8所示。Langmuir和Freundlich吸附等温曲线模型拟合回归方程的R2均在0.9800以上,2种模型均能描述AB-8型树脂对地参总三萜酸的吸附作用,且Freundlich方程的R2更高。KF和n分别为Freundlich方程的模型参数和特征常数,在方程中,n>1时表明该物质易被吸附(Yildirim et al.,2001),本研究中n=3.1085>1,说明地参总三萜酸易被AB-8型树脂吸附。
2. 6 大孔树脂动态吸附—解吸性能试验结果
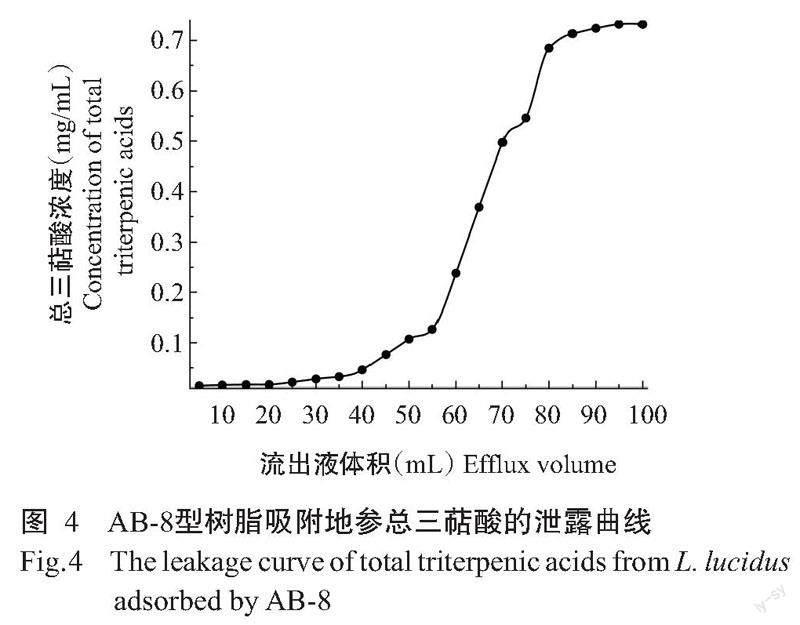
2. 6. 1 大孔树脂泄露曲线 由图4可知,上样液体积越大,流出的总三萜酸浓度逐渐增加,当上样液体积小于55 mL时,总三萜酸浓度增加趋势缓慢,大于55 mL时,总三萜酸浓度增加趋势明显。随着上样体积的继续增加,AB-8型吸附逐渐趋于饱和,上样体积大于85 mL流出的总三萜酸浓度接近于初始样液浓度。当上样体积为45 mL时,流出液中的浓度达初始上样液总三萜酸浓度的10%,为大孔树脂AB-8型的泄漏点,为保证样品液不泄露,避免浪费,上样体积应控制在40 mL最合适。
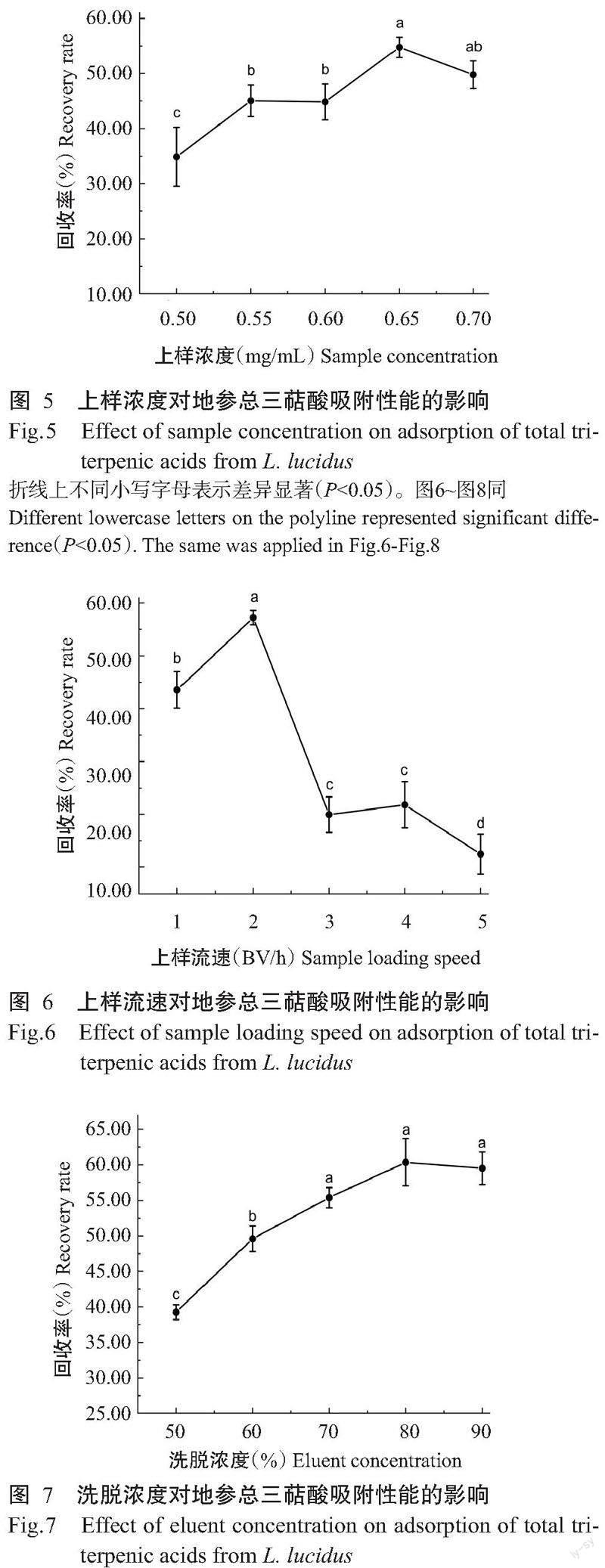
2. 6. 2 上样浓度的选择 由图5可知,当上样浓度小于0.65 mg/mL时,地参总三萜酸纯化回收率呈上升趋势,在上样浓度为0.65 mg/mL时总三萜酸纯化回收率达最大值,上样浓度超0.65 mg/mL后,回收率略有下降,说明浓度过高反而影响地参总三萜酸的纯化工艺。因此,最佳上样浓度为0.65 mg/mL,选取0.60、0.65和0.70 mg/mL进行响应面试验。
2. 6. 3 上样流速的选择 由图6可知,上样流速对地参总三萜酸纯化回收率影响明显,上样流速过慢使得吸附时间长,从而影响总三萜酸纯化,当上样流速增至2 BV/h时吸附时间合适,对总三萜酸的纯化效果最佳,地参总三萜酸纯化回收率达最大值;随着上样流速的继续增加,大孔树脂层吸附萜类化合物时间短,吸附效果差。因此,最佳上样流速为2 BV/h,选取1、2和3 BV/h进行响应面试验。
2. 6. 4 洗脱浓度的选择 由图7可知,随着洗脱浓度的增加,地参总三萜酸纯化回收率逐渐提高,在洗脱浓度为80%时总三萜酸回收率达最大值,显著高于50%和60%的回收率(P<0.05,下同),当洗脱浓度大于80%时,回收率呈下降趋势,说明洗脱浓度越大对地参总三萜酸的纯化效果越好,但达一定浓度后效果下降。因此,选择最佳洗脱浓度为80%,并选取70%、80%和90%进行响应面试验。
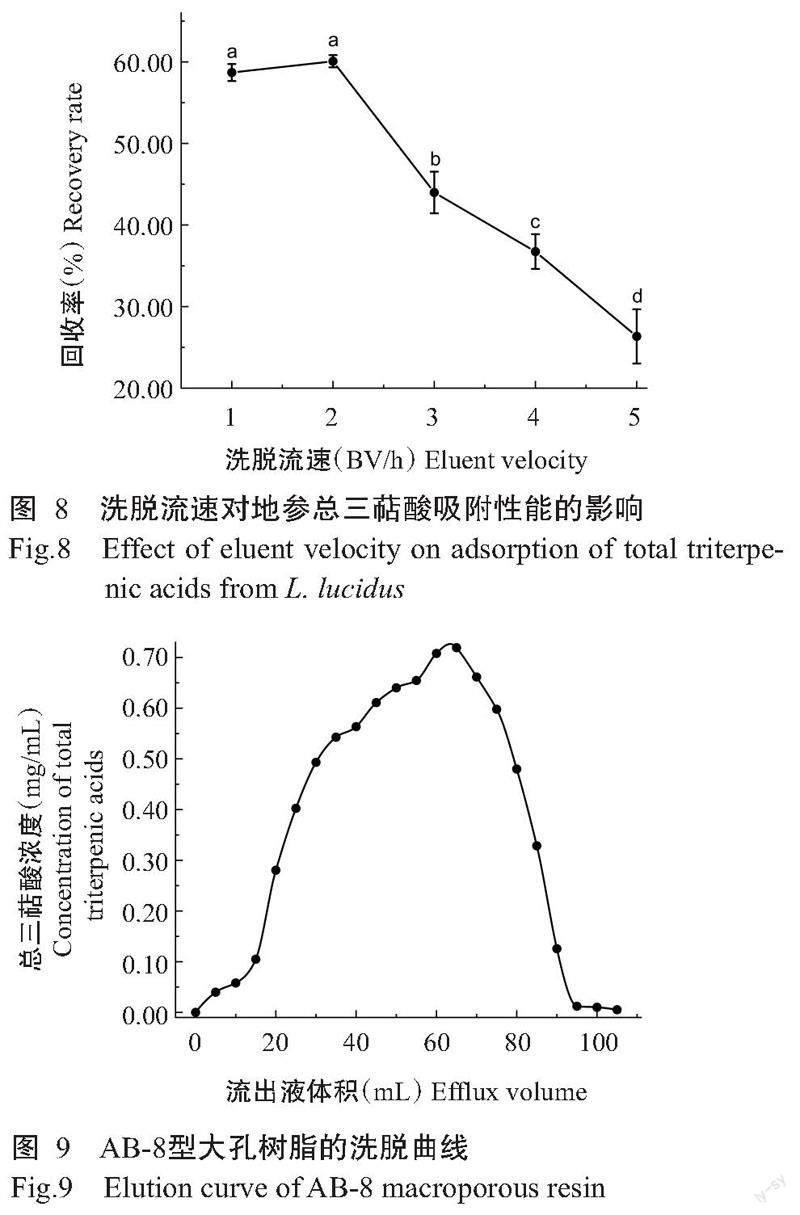
2. 6. 5 洗脱流速的选择 由图8可知,洗脱流速对地参总三萜酸纯化回收率有明显影响,当洗脱流速为2 BV/h时,回收率达最大值;当洗脱流速大于2 BV/h时,总三萜酸回收率显著降低,说明流速过快对总三萜酸的洗脱效果越来越差。因此,最佳洗脱流速为2 BV/h,选取1、2和3 BV/h进行响应面试验。
2. 6. 6 大孔树脂洗脱曲线 由图9可知,随着洗脱液体积增大,地参总三萜酸浓度不断增加,洗脱液体积对总三萜酸的洗脱效果有明显影响;当洗脱液体积在65 mL时,总三萜酸浓度达最大值,当洗脱液体积继续增加,总三萜酸浓度呈下降趋势,直至洗脱液体积在100 mL时,总三萜酸浓度为0.01 mg/mL,说明此时已将总三萜酸成分洗脱完毕。因此,考虑洗脱液体积及总三萜酸洗脱效果,以80%乙醇100 mL可将地参总三萜酸成分洗脱完全。
2. 7 响应面试验结果
2. 7. 1 响应面模型的建立 单因素试验结果显示,上样浓度0.65 mg/mL、上样流速2 BV/h、洗脱浓度80%和洗脱流速2 BV/h为最佳水平条件。在单因素试验的基础上,采用4因素3水平、最佳水平条件为0水平的响应面中心试验(表9),运用Design-Expert 12进行二次多项式拟合。以地参总三萜酸纯化回收率为响应值(Y),由回归模型可得回收率与4个变量(上样浓度、上样流速、洗脱浓度和洗脱流速)之间的线性关系,所得二次回归方程:Y=0.6887+0.0196A-0.0085B-0.0287C+0.0052D+0.0299AB-0.0107AC-0.0122AD+0.0128BC+0.0211BD+0.026A2-0.0765B2-0.0877C2-0.0932D2。
2. 7. 2 显著性检验 由方差分析结果(表10)可知,模型F=33.10,P<0.01,为极显著,失拟项F=1.22,P=0.4587>0.05,为不显著,表明所选用的二次多项模型的拟合程度良好,模型成立。模型相关系数R2=0.9707,表明该回归方程有很好的相关性,校正决定系数[R2Adj]=0.9414,表明有94.14%的响应值变化。在影响地参总三萜酸纯化回收率的因素中,A、C、AB、CD、A2、B2、C2和D2影响极显著(P<0.01,下同),BD影响显著,而B、D、AC、AD和BC影响不显著(P>0.05,下同)。选取的4个因素对地参总三萜酸纯化回收率影响顺序为C>A>B>D,即洗脱浓度对地参总三萜酸纯化回收率的影響最大,洗脱流速的影响最小。
2. 8 两因素间交互作用分析结果
由图10可知,当上样流速不变时,随着上样浓度的增加,地参总三萜酸的回收率逐渐增大,当上样浓度为0.65 mg/mL时,回收率达峰值;上样浓度继续增加,回收率逐渐减小。等高线的椭圆度较大,说明上样流速与上样浓度的交互作用对地参总三萜酸回收率影响极显著,与方差分析结果(表10)一致。
由图11可知,当洗脱浓度不变时,随着上样浓度的增加,地参总三萜酸的回收率逐渐增大,当上样浓度为0.65 mg/mL时,回收率达最大值;之后继续增加上样浓度,回收率则逐渐减小。同时,当上样浓度不变时,随着洗脱浓度的增加,地参总三萜酸的回收率逐渐增大,当洗脱浓度为80%时,回收率达峰值;随着洗脱浓度继续增大,回收率逐渐减小。等高线趋近于圆形,说明洗脱浓度与上样浓度的交互作用对地参总三萜酸回收率的影响不显著,与方差分析结果(表10)一致。
由图12可知,当洗脱流速不变时,随着上样浓度的增加,地参总三萜酸的回收率逐渐增大,当上样浓度为0.65 mg/mL时,回收率达峰值;随着上样浓度的不断增加,回收率则逐渐减小。同时,当上样浓度不变时,随着洗脱流速的增加,地参总三萜酸的回收率逐渐增大,当洗脱流速为2 BV/h时,回收率达峰值;随着洗脱流速的继续增加,回收率逐渐减小。等高线趋近于圆形,说明洗脱流速与上样浓度的交互作用对地参总三萜酸回收率的影响不显著,与方差分析结果(表10)一致。
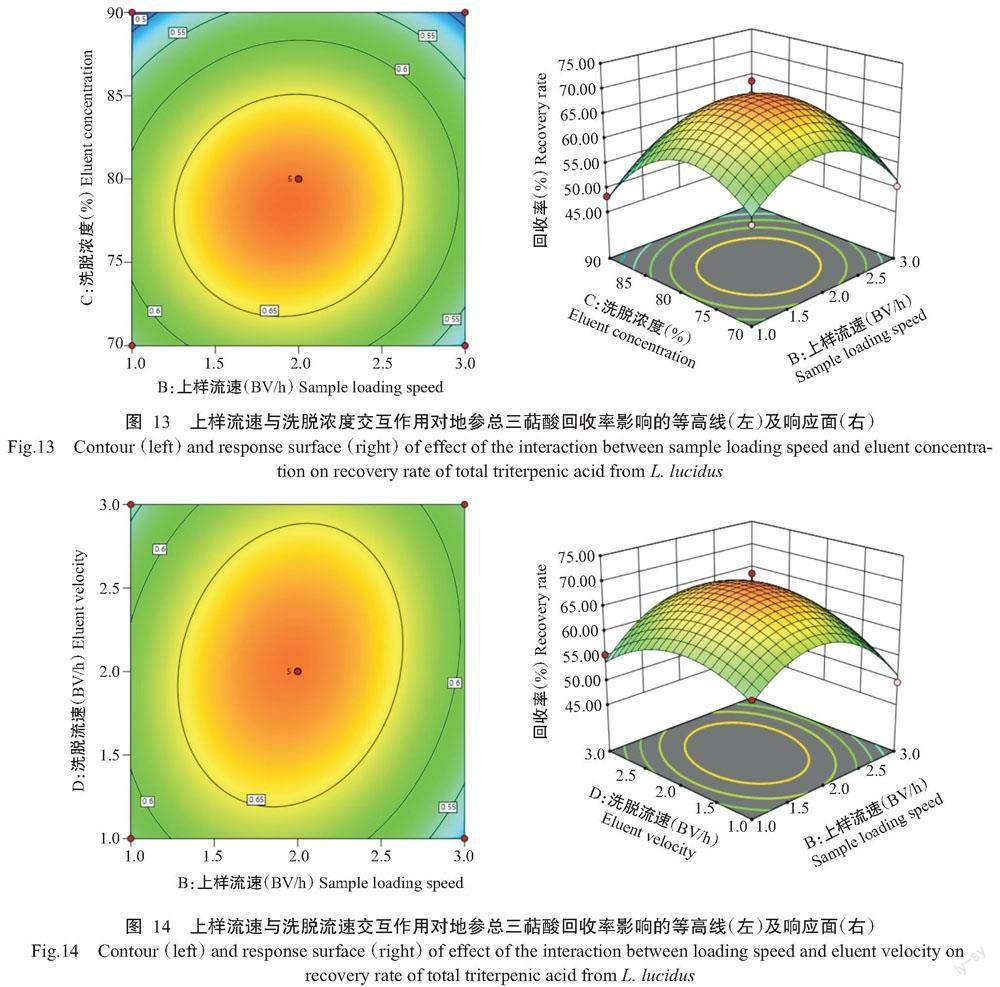
由图13可知,当洗脱浓度不变时,随着上样流速的增加,地参总三萜酸的回收率逐渐增大,当上样流速为2 BV/h时,回收率达峰值;之后随着上样流速的继续增加,回收率则逐渐减小。同时,当上样流速不变时,随着洗脱浓度的增加,地参总三萜酸的回收率逐渐增大,当洗脱浓度为80%时,回收率达峰值;随着洗脱浓度的继续增加,回收率则逐渐减小。等高线趋近于圆形,说明洗脱浓度与上样流速的交互作用对地参总三萜酸回收率的影响不显著,与方差分析结果(表10)一致。
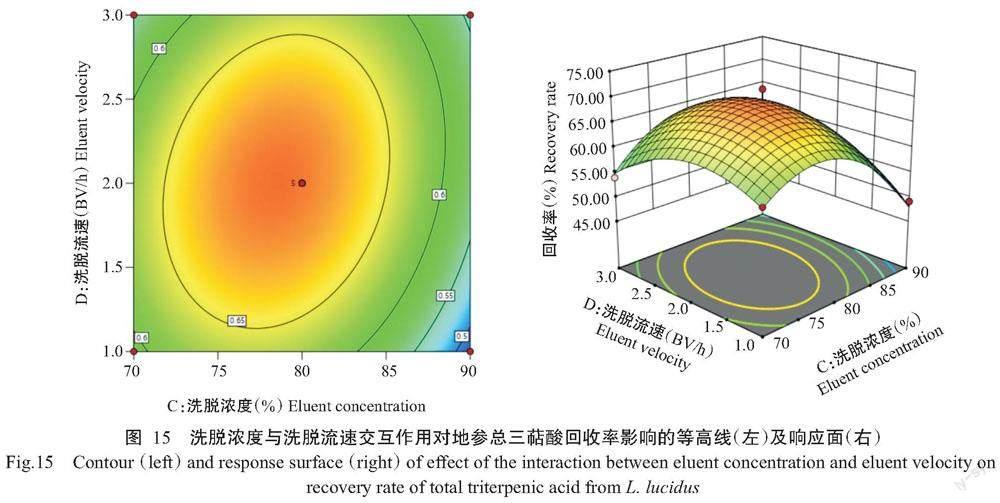
由图14可知,当洗脱流速不变时,随着上样流速的增加,地参总三萜酸的回收率逐渐增大,当上样流速为2 BV/h时,回收率达峰值;之后随着上样流速的不断增加,回收率逐渐减小。同时,当上样流速不变时,随着洗脱流速的增加,地参总三萜酸的回收率逐渐增大,当洗脱流速为2 BV/h时,回收率达峰值;随着洗脱流速的继续增大,回收率则逐渐减小。等高线趋近于椭圆,说明洗脱流速与上样流速的交互作用对地参总三萜酸回收率的影响显著,与方差分析结果(表10)一致。
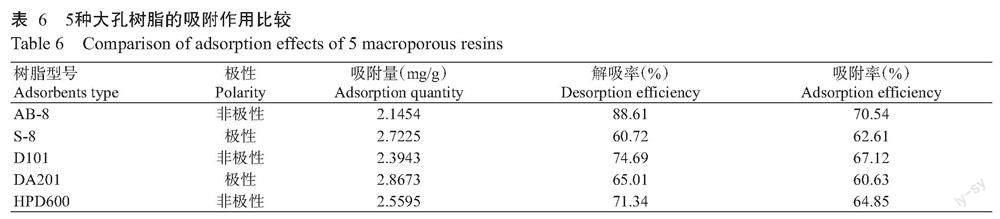
由图15可知,当洗脱流速不变时,随着洗脱浓度的增加,地参总三萜酸的回收率逐渐增大,当洗脱浓度为80%时,回收率达峰值;之后随着洗脱浓度的继续增加,回收率逐渐减小。同时,当洗脱浓度不变时,随着洗脱流速的增加,地参总三萜酸的回收率逐渐增大,当洗脱流速为2 BV/h时,回收率达峰值;之后随着洗脱流速的继续增大,回收率则逐渐减小。等高线的椭圆度较大,说明洗脱流速与洗脱浓度的交互作用对地参总三萜酸回收率的影响极显著,与方差分析结果(表10)一致。
响应面图可直观反映出两因素对地参总三萜酸纯化回收率效果的影响。由图10~图15可知,图10和图15等高线中的椭圆度大,坡度较陡,说明两因素间的交互作用明显,达极显著水平;图14等高线中的椭圆程度较大,两因素间交互作用相对较弱,达显著水平。图11~图13中,固定一个因素,地参总三萜酸回收率均随着另一个因素的增大而减小,等高线趋近于圆形,从而表明两因素间交互作用不明显,与方差分析结果(表10)一致。通过Design-Expert 12的模型模拟,预测选取的4因素最佳组合:上样浓度0.66 mg/mL、上样流速1.97 BV/h、洗脱浓度78.34%、洗脱流速1.99 BV/h,地参总三萜酸的回收率为69.30%。
2. 9 验证试验结果
取地参总三萜酸浓缩液3份各10.0 mL,在模型拟合适宜试验操作的条件(上样浓度0.66 mg/mL、上样流速2 BV/h、洗脱浓度80%、洗脱流速2 BV/h)下,验证响应面法所得最佳纯化工艺可实施性,收集洗脱液,测得地参总三萜酸纯化的回收率分别为66.94%、67.31%和67.85%,平均回收率为67.37%,RSD为0.67%,表明AB-8型树脂纯化地参总三萜酸的优化工艺可行。
3 讨论
3. 1 显色条件分析
紫外分光光度法是分析检测常用的方法,常以香草醛—高氯酸分光光度法对总三萜类含量进行测定(李崇阳,2016),影响该测定方法的因素较多,显色条件的优化能更好地测定不同物种资源的萜类成分含量。在强酸条件下,可将萜类化合物结构成分氧化为羧基,形成共轭体系而显色,进而对萜类含量进行分析测定。本研究中,地参总三萜酸在545 nm处有最大吸收峰,通过不同显色条件的筛选,进而可得5%香草醛—冰乙酸和高氯酸的最佳加入量及显色温度。根据方法学中稳定性检测结果可得比色法对地参总三萜酸的检测在40 min内较稳定,对地参总三萜酸的测定效果较好。由于比色法操作简便,因而作为测定总三萜酸的常用方法,但试剂用量、试验操作时的反应时间及反应温度等因素均对总三萜酸的测定影响较显著,因此在优化显色条件中,分别对5%香草醛—冰乙酸用量、高氯酸用量、显色试剂和显色温度进行优化,得到5%香草醛—冰乙酸用量在0.2 mL时最合适,高氯酸用量为0.4 mL合适,5%香草醛—冰乙酸与高氯酸加入量比例为1∶2,与陶锋等(2011)分离纯化连钱草总三萜酸中显色条件比例相同;60 ℃显色温度下总三萜酸的测定效果好,所得最优显色温度与韩伟和刘曦(2014)在枇杷叶总三萜酸的大孔树脂分离纯化工艺中显色条件相同。由结果可知,地参总三萜酸可采用5%香草醛—高氯酸分光光度法进行测定,该操作可行,可为地参总三萜酸的相关研究提供质量控制技术。
3. 2 大孔树脂选择分析
大孔树脂现已广泛应用于天然植物中活性成分的分离纯化。根据不同树脂极性性质可分为非极性、中性和极性3类,不同树脂型号的极性不同,吸附性能有明显差异,因树脂易再生、吸附富集效果好等优点在萜类化合物的纯化中应用较多,且树脂对生物活性成分纯化可最大限度地提高目标物的回收率(白夺龙和杨开华,2007;李广林,2014;王晓婷等,2022)。树脂吸附原理是靠化合物分子之间的化学作用力,为达到純化、分离等目的可通过合适的溶剂将目标化合物洗脱出来。非极性或弱极性吸附树脂表面的疏水性强,由不带任何功能基团的单体聚合而成,有助于极性溶剂中非极性物质的吸附。本研究选取的AB-8、D101、HPD600、DA201和S-8型树脂具有不同极性,以吸附量、吸附率和解吸率作为评价地参总三萜酸纯化效果的指标,对5种树脂进行筛选。因萜类成分是非极性化合物,非极性或弱极性树脂能很好地将地参总三萜酸成分洗脱下来。AB-8和D101型树脂均为非极性树脂,地参中的总三萜酸所含有的五环三萜类(白桦脂酸、熊果酸和齐墩果酸)分子量较大,AB-8型树脂的孔径在480~520 nm,大于D101型树脂的孔径,能较好地吸附总三萜酸成分,达到纯化效果。本研究结果表明,AB-8型树脂与D101型树脂对地参中的总三萜酸成分吸附效果好,其中AB-8型综合指标更优,与李广林(2014)对桦褐孔菌三萜提取分离试验结果类似。此外,还考察树脂的性能,包括树脂的静态吸附动力学和等温曲线;根据动力学方程得出准二级速率方程能更好地展示树脂的吸附过程,由动力学曲线可知AB-8型树脂在6 h已接近饱和的吸附状态。蔡天娇(2017)筛选所得D101型树脂纯化红枣三萜酸效果优于AB-8型树脂,本研究与之对比,说明不同物种资源中同种生物活性成分的树脂选择及吸附能力均有一定差异;将等温曲线进行Freundlich方程拟合,得到特征常数n>1,说明地参总三萜酸易被AB-8型树脂吸附,吸附效果明显。根据试验结果可得,AB-8型树脂吸附地参总三萜酸的方法可靠,可为树脂大批量纯化地参总三萜酸提供数据支撑。
3. 3 纯化工艺分析
药食同源植物中生物活性成分的研究有助于功能性食品资源的开发利用。地参作为菜药兼备的植物资源,不仅营养丰富,还含有多种药理活性成分,其中总三萜酸是药理活性成分之一。由于地参中成分复杂多样,对目标化合物的提取会受到其他化合物成分的影响,有效成分的分离纯化可为后续该化合物的成分鉴定及体内体外功能研究打下重要基础。本研究利用响应面模型优化上样浓度、上样流速、洗脱浓度和洗脱流速4个因素的工艺条件,采用最佳工艺优化出的因素参数对地参总三萜酸进行纯化,回收率可达66.00%以上。陈建中等(2015)采用响应面法纯化茼蒿中总黄酮,通过D101型树脂测得黄酮回收率为87.36%,其上样浓度达0.86 mg/mL,浓度差异可能会影响目标产物的回收率;纯化工艺优化参数中的洗脱流速与陈建中等(2015)对茼蒿总黄酮分离纯化的洗脱流速类似,均在2 mL/min左右。刘娜(2017)对泽兰地上部分的总三萜酸成分进行分离纯化,得出X-5型树脂的纯化效果最佳,总三萜酸的纯度可达74%;本研究对泽兰地下部分(地参)进行分离纯化,因泽兰地上部分总三萜酸含量约为地下部分的3倍,所得纯化的效果均有一定差异,说明树脂对萜类纯化效果显著,能极大提高目标化合物的纯度。邓思节(2016)对屈曲花种子总黄酮纯化工艺进行优化,并分析其抗氧化活性,发现纯化后的总黄酮抗氧化活性高于粗提总黄酮,说明纯化物的抗氧化活性更强。不同物种资源的不同化合物采用大孔树脂纯化效果不尽相同,因而对地参总三萜酸树脂进行纯化工艺优化很有必要。地参总三萜酸在上样浓度0.66 mg/mL、上样流速2 BV/h、洗脱浓度80%、洗脱流速2 BV/h时纯化效果最佳,与蒙瑞波等(2012)提取纯化白花蛇舌草中总三萜酸的上样流速、洗脱流速及洗脱浓度优化条件结果相同,说明该优化条件稳定可行、重复性好。本研究仅对地参总三萜酸活性成分进行纯化,所得的目标产物为多种萜类成分共存,需进一步分离以测定地参中总三萜酸的单体成分,从而能进一步证明树脂纯化地参总三萜酸的效果。
4 结论
建立的回归模型可用于地参总三萜酸纯化工艺的预测;AB-8型大孔树脂对地参总三萜酸的分离纯化效果较好,适用于总三萜酸物质的纯化。
参考文献:
白夺龙,杨开华. 2007. 大孔吸附树脂分离纯化技术及应用[J]. 海峡药学,19(9):96-99. [Bai D L,Yang K H. 2007. Separation and purification technology of macroporous adsorption resin and its application[J]. Strait Pharmaceutical Journal,19(9):96-99.] doi:10.3969/j.issn. 1006-3765.2007.09.059.
蔡天娇. 2017. 红枣三萜酸提取纯化及其小鼠保肝作用研究[D]. 杨凌:西北农林科技大学. [Cai T J. 2017. Study of purification and hepato protective effect in mice of triterpenic acids in jujube[D]. Yangling:Northwest A & F University.] doi:10.27409/d.cnki.gxbnu.2017. 000215.
陈建中,葛水莲,昝立峰,王更先,邢浩春,付靜. 2015. 响应面优化大孔吸附树脂分离纯化茼蒿总黄酮[J]. 食品与发酵工业,41(11):115-120. [Chen J Z,Ge S L,Zan L F,Wang G X,Xing H C,Fu J. 2015. Purification of total flavonoids from Chrysanthemum coronarium L. with macroporous resins by response surface analysis[J]. Food and Fermentation Industries,41(11):115-120.] doi:10. 13995/j.cnki.11-1802/ts.201511021.
谌江城,尹永芹,何宇愿,杜冠峰,宋国强,沈志滨. 2014. AB-8型大孔树脂纯化东风桔总生物碱的工艺研究[J]. 广东药学院学报,30(6):693-697. [Chen J C,Yin Y Q,He Y Y,Du G F,Song G Q,Shen Z B. 2014. Study on purif-ying the total alkaloids in Atalantia buxifolia with AB-8 macroporous resin[J]. Journal of Guangdong Pharmaceutical University,30(6):693-697.] doi:10.3969/j.issn. 1006-8783.2014.06.006.
邓思节. 2016. 屈曲花种子总黄酮提取、纯化工艺以及抗氧化性能的研究[D]. 重庆:重庆大学. [Deng S J. 2016. Study on the extraction,preliminary purification and antio-xidant activity of total flavonoids of Iberis amara seeds[D]. Chongqing:Chongqing University.]
杜晖,王春雨. 2008. X-5型大孔树脂分离纯化夏枯草中两种五环三萜酸[J]. 时珍国医国药,19(6):1416-1418. [Du H,Wang C Y. 2008. Purification of Prunella vulgaris L. pentacyclic triterpenoids with X-5 macroporous resin[J]. Lishizhen Medicine and Materia Medica Research,19(6):1416-1418.] doi:10.3969/j.issn.1008-0805.2008. 06.062.
樊君,高续春,郭璞,李海瑞,张倩,陈国亮. 2008. 大孔吸附树脂分离纯化枣渣中三萜酸的研究[J]. 离子交换与吸附,24(5):426-433. [Fan J,Gao X C,Guo P,Li H R,Zhang Q,Chen G L. 2008. Study on the separation and purification of triterpene acids from the residue of jujube[J]. Ion Exchange and Adsorption,24(5):426-433.]
韩伟,刘曦. 2014. 枇杷叶三萜酸的大孔树脂分离纯化工艺[J]. 南京工业大学学报(自然科学版),36(6):66-71. [Han W,Liu X. 2014. Separation and purification of triter-penic acid from Eribotrya japonica leaf by macroporous resins[J]. Journal of Nanjing Tech University(Natural Science Edition),36(6):66-71.] doi:10.3969/j.issn.1671-7627.2014.06.012.
黃燕秋,谢志茹,朴胜华,肖雪. 2018. 大孔吸附树脂在中药纯化中的应用进展[J]. 广东化工,45(8):130-132. [Huang Y Q,Xie Z R,Piao S H,Xiao X. 2018. The review on macroporous adsorption resin application in the purification studies of traditional Chinese medicine[J]. Guangdong Chemical Industry,45(8):130-132.] doi:10.3969/j.issn.1007-1865.2018.08.059.
柯春山,吴少福,彭鹏,李麟,李书飞,洪艳平. 2021. 大孔树脂纯化裸花紫珠总三萜工艺研究[J]. 江西农业大学学报,43(5):1178-1187. [Ke C S,Wu S F,Peng P,Li L,Li S F,Hong Y P. 2021. Purification of the total triterpenes extracted from Callicarpa nudiflora Hook. et Arn. by macroporous Resins[J]. Acta Agriculturae Universitatis Jiang-xiensis, 43(5):1178-1187.] doi:10.13836/j.jjau.2021 127.
李崇阳. 2016. 三萜酸的提取工艺及性能研究[D]. 石家庄:河北科技大学. [Li C Y. 2016. Study on the extraction process and properties of triterpenoid acid[D]. Shijiazhuang:Hebei University of Science and Technology.]
李广林. 2014. 桦褐孔菌三萜提取分离、结构鉴定及生物活性研究[D]. 杭州:浙江工业大学. [Li G L. 2014. Study on the isolation,separation,identification and biological activity of teriterpenoids from Inonotus obliquus[D]. Hangzhou:Zhejiang University of Technology.]
梁卓然. 2021. 野生女贞果实中齐墩果酸提取及其抗乳腺癌机制研究[D]. 哈尔滨:东北林业大学. [Liang Z R. 2021. Extraction of oleanolic acid from fruits of wild Fructus Ligustri Lucidi and its mechanism of anti breast cancer[D]. Harbin:Northeast Forestry University.] doi:10.27009/d.cnki.gdblu.2021.000869.
刘娜. 2016. 泽兰中营养成分的测定及其三萜酸的分离纯化的研究[D]. 重庆:西南大学. [Liu N. 2016. Study on determination of nutrient content and separation and purification of triterpenic acid in Lycopus lucidus[D]. Chong-qing:Southwest University.]
罗孟禹,董开居. 2006. 浅析名特珍稀野菜 “地参”种植与开发[J]. 中国野生植物资源,25(5):64-65. [Luo M Y,Dong K J. 2006. Planting and development of Lycopus lucidus,a rare edible wild herb[J]. Chinese Wild Plant Resources,25(5):64-65.] doi:10.3969/j.issn.1006-9690. 2006.05.021.
蒙瑞波,汤庆发,曾永长,郭阳,傅钧庭,范昊宁,罗佳波. 2012. 白花蛇舌草中总三萜酸的提取纯化工艺优选[J]. 中国实验方剂学杂志,18(24):65-68. [Meng R B,Tang Q F,Zeng Y Z,Guo Y,Fu J T,Fan H N,Luo J B. 2012. Optimization of extraction and purification technology for total triterpene acid from Hedyotis diffusa[J]. Chinese Journal of Experimental Traditional Medical Formulae,18(24):65-68.] doi:10.13422/j.cnki.syfjx.2012. 24.001.
闵玉涛,宋彥显,陶敬,马庆一. 2015. AB-8型大孔树脂分离纯化葛根异黄酮的工艺优化[J]. 食品工业,36(7):159-162. [Min Y T,Song Y X,Tao J,Ma Q Y. 2015. Optimized the extraction and partial purification of isoflavone in Pueraria lobata Tubers by AB-8 macroporous resin[J]. The Food Industry,36(7):159-162.]
桑咏梅,丁振铎. 2011. D-101型大孔树脂对三萜类成分的吸附性能研究[J]. 哈尔滨商业大学学报(自然科学版),27(1):12-16. [Sang Y M,Ding Z D. 2011. Study on absorption performance of triterpene in Chinese traditional medicine compound with macroporous resins[J]. Journal of Harbin University of Commerce(Natural Sciences Edition),27(1):12-16.] doi:10.19492/j.cnki.1672-0946. 2011.01.004.
陶锋,周仁义,吴茗希,夏洁,张懿,黄俊俊,张如松. 2011. 大孔吸附树脂分离纯化连钱草总三萜酸[J]. 医药导报,30(11):1490-1492. [Tao F,Zhou R Y,Wu M X,Xia J,Zhang Y,Huang J J,Zhang R S. 2011. Isolation and purification of total triterpenoidic acid from Longtube Ground Ivy Herb with macroporous resin[J]. Herald of Medicine,30(11):1490-1492.] doi:10.3870/yydb.2011. 11.033.
王苗苗,娄华勇,张妮,潘卫东. 2020. 大孔吸附树脂富集罗汉果茎中三萜酸的工艺研究[J]. 贵州师范学院学报,36(12):6-12. [Wang M M,Lou H Y,Zhang N,Pan W D. 2020. Enrichment and purification of triterpenic acid from Siraitia grosvenii by macroporous resin[J]. Journal of Guizhou Education University,36(12):6-12.] doi:10. 13391/j.cnki.issn.1674-7798.2020.12.002.
王晓婷,康明丽,宋丽君,闫家荫. 2022. 大孔吸附树脂法纯化黑玉米花青素工艺[J]. 食品工业,43(5):19-24. [Wang X T,Kang M L,Song L J,Yan J Y. 2022. Purification of anthocyanin from black corn by macroporous adsorption resin[J]. The Food Industry,43(5):19-24.]
许泳吉,钟惠民,杨波,袁瑾. 2003. 野生植物地参中营养成分的测定[J]. 光谱实验室,20(4):528-529. [Xu Y J,Zhong H M,Yang B,Yuan J. 2003. Analysis of nutritional components in wild plant Lycopus lucidus Turcz.[J]. Chinese Journal of Spectroscopy Laboratory,20(4):528-529.] doi:10.3969/j.issn.1004-8138.2003.04.014.
姚干,何宗玉,闫光凡,梁亦龙,谢婷婷,陶建. 2007. 大孔吸附树脂纯化女贞子中齐墩果酸和熊果酸的研究[J]. 中草药,38(10):1498-1501. [Yao G,He Z Y,Yan G F,Liang Y L,Xie T T,Tao J. 2007. Purification of aleanolic acid and ursolic acid from fructus ligustri lucidi by macroporous resins[J]. Chinese Traditional and Herbal Medicines,38(10):1498-1501.] doi:10.3321/j.issn:0253-2670.2007.10.022.
袁怀波,江力,陈宗道. 2007. 大孔树脂分离纯化木瓜总三萜酸的研究[J]. 食品与机械,23(4):80-82. [Yuan H B,Jiang L,Chen Z D. 2007. Purification of Chinese quince triterpenes with macroporous resin[J]. Food & Machi-nery,23(4):80-82.] doi:10.3969/j.issn.1003-5788.2007. 04.022.
袁怀波,凌庆枝,马嫄. 2008. 大孔树脂分离纯化山楂总三萜酸的研究[J]. 食品科学,29(2):155-157. [Yuan H B,Ling Q Z,Ma Y. 2008. Purification of hawthorn triterpenes with macroreticular resin[J]. Food Science,29(2):155-157.] doi:10.3321/j.issn:1002-6630.2008.02.027.
Biswas T,Dwivedi U N. 2019. Plant triterpenoid saponins:Biosynthesis,in vitro production,and pharmacological relevance[J]. Protoplasma,256(5):1463-1468. doi:10. 1007/s00709-019-01411-0.
Fukushima M,Matsuyama F,Ueda N,Egawa K,Takemoto J,Kajimoto Y,Yonaha N,Miura T,Kaneko T,Nishi Y,Mitsui R,Fujita Y,Yamada Y,Seino Y. 2006. Effect of corosolic acid on postchallenge plasma glucose levels[J]. Dia-betes Research & Clinical Practice,73(2):174-177. doi:10.1016/j.diabres.2006.01.010.
Lu Y H,Huang J H,Li Y C,Ma T T,Sang P,Wang W J,Gao C Y. 2015. Variation in nutritional compositions,antioxidant activity and microstructure of Lycopus lucidus Turcz. root at different harvest times[J]. Food Chemistry,183:91-100. doi:10.1016/j.foodchem.2015.03.033.
Yildirim A,Mavi A,Kara A A. 2001. Determination of antioxi-dant and antimicrobial activities of Rumex crispus L. extracts[J]. Journal of Agricultural and Food Chemistry,49(8):4083-4089. doi:10.1021/jf0103572.
Zhu Y S,Li X Q,Chen J Q,Chen T J,Shi Z M,Lei M N,Zhang Y J,Bai P F,Li Y F,Fei X. 2016. The pentacyclic triterpene lupeol switches M1 macrophages to M2 and ameliorates experimental inflammatory bowel disease[J]. International Immunopharmacology,30:74-84. doi:10.1016/ j.intimp.2015.11.031.
(責任编辑 罗 丽)
收稿日期:2022-09-09
基金项目:重庆市自然科学基金项目(cstc2019jcyj-msxmX0770);重庆市教委科学技术研究项目(KJQN202201231,KJQN202002712)
通讯作者:周浓(1978-),https://orcid.org/0000-0003-1236-8585,教授,主要从事中药炮制与资源研究工作,E-mail:erhaizn@126.com
第一作者:李金金(1995-),https://orcid.org/0000-0002-6663-4044,研究方向为药食同源植物资源开发及利用,E-mail:ljjlbh1995 @163.com

