谷氨酸通过T1R1/T1R3-ERK1/2通路调节香猪睾丸间质细胞自噬相关基因表达
王涵 徐永健 蒙利洁 龚婷


DOI:10.3969/j.issn.2095-1191.2023.06.024
摘要:【目的】探究L-谷氨酸刺激對香猪睾丸间质细胞自噬的影响,为进一步研究味觉受体T1R1/T1R3通过雷帕霉素靶蛋白(mTOR)调控下自噬对雄性生殖的影响提供理论依据。【方法】选取30日龄的健康从江香猪分离培养睾丸间质细胞,采用不同浓度L-谷氨酸刺激睾丸间质细胞T1R1/T1R3,探究激活T1R1/T1R3对睾丸间质细胞自噬相关基因(TAS1R1、TAS1R3、ERK1、ERK2、mTOR、Beclin 1和MAP1LC3B)表达的影响。【结果】从江香猪睾丸间质细胞在培养72~96 h增殖最快,于培养96 h时达对数生长期。10 mmol/L是L-谷氨酸刺激睾丸间质细胞味觉受体T1R1/T1R3的有效浓度。经10 mmol/L的L-谷氨酸刺激后,睾丸间质细胞的mTOR、ERK1和ERK2基因相对表达量极显著高于对照组(P<0.01,下同),而Beclin 1基因相对表达量极显著低于对照组,MAP1LC3B基因相对表达量显著低于对照组(P<0.05,下同);ERK1/2和p-S6K1蛋白相对表达量显著高于对照组,而Beclin 1蛋白相对表达量显著低于对照组。单丹磺尸酰胺(MDC)染色结果显示,经10 mmol/L的L-谷氨酸刺激后,睾丸间质细胞内的酸性自噬泡荧光强度明显低于对照组,表明胞内自噬受抑制。【结论】10 mmol/L的L-谷氨酸可激活从江香猪睾丸间质细胞T1R1/T1R3,且自噬相关基因TAS1R1、TAS1R3、ERK1、ERK2和mTOR及相关蛋白T1R1、T1R3、ERK1/2、p-S6K1和p-mTOR表达升高,而Beclin 1和MAP1LC3B基因及Beclin 1蛋白表达降低,故推测谷氨酸可通过激活味觉受体T1R1/T1R3参与雄性生殖自噬的负调控。
关键词:从江香猪;睾丸间质细胞;味觉受体T1R1/T1R3;自噬;谷氨酸
中图分类号:S828.89 文献标志码:A 文章编号:2095-1191(2023)06-1829-08
Glutamate regulating autophagy-related gene expression in
Leydig cells of Xiang pig through T1R1/T1R3-ERK1/2 pathway
WANG Han, XU Yong-jian, MENG Li-jie, GONG Ting*
(College of Animal Science, Guizhou University/Key Laboratory of Plateau Mountain Animal Genetics, Breeding and Reproduction, Ministry of Education/Guizhou Key Laboratory of Animal Genetics, Breeding and Reproduction,
Guiyang, Guizhou 550025,China)
Abstract:【Objective】This paper explored the effect of L-glutamate stimulation on autophagy in Xiang pig Leydig cells, providing a theoretical basis for further research on the effects of taste receptor T1R1/T1R3 on male reproduction under the regulation of rapamycin target protein (mTOR) through autophagy. 【Method】Selecting Leydig cells isolated and cultured from healthy 30 days old Congjiang Xiang pigs, different concentrations of L-glutamate were used to stimulate Leydig cells T1R1/T1R3, to investigate the effect of activating T1R1/T1R3 on expression of autophagy-related genes of Leydig cell (TAS1R1, TAS1R3, ERK1, ERK2, mTOR, Beclin 1 and MAP1LC3B). 【Result】The proliferation of Leydig cells from Congjiang Xiang pig was the fastest during 72-96 h of cultivation, and reached a logarithmic growth phase at 96 h of cultivation. 10 mmol/L was the effective concentration of L-glutamate to stimulate the taste receptor T1R1/T1R3 in Leydig cells. After stimulation with 10 mmol/L L-glutamate, the relative expression levels of mTOR, ERK1, and ERK2 genes in Leydig cells were extremely significantly higher than those in the control group (P<0.01, the same below). The relative expression levels of Beclin 1 gene were extremely significantly lower than those in the control group. And the relative expression levels of MAP1LC3B gene were significantly lower than those in the control group (P<0.05, the same below). The relative expression levels of ERK1/2 and p-S6K1 proteins were significantly higher than those in the control group, while the relative expression levels of Beclin 1 protein were significantly lower than those in the control group. The stai-ning results of dansylcadaverine (MDC) showed that after stimulation with 10 mmol/L L-glutamate, the fluorescence intensity of acidic autophagic vesicles in Leydig cells was significantly lower than that of the control group, indicating that intracellular autophagy was inhibited. 【Conclusion】10 mmol/L of L-glutamate can activate the Leydig cells T1R1/T1R3 of Congjiang Xiang pig, and the expression of autophagy related genes TAS1R1, TAS1R3, ERK1, ERK2 and mTOR, as well as related proteins T1R1, T1R3, ERK1/2, p-S6K1, and p-mTOR increase. However, the expression of Beclin 1 and MAP1LC3B genes and Beclin 1 protein decrease. Therefore, it is speculated that glutamate can participate in the negative regulation of male reproductive autophagy by activating taste receptor T1R1/T1R3.
Key words: Congjiang Xiang pig; Leydig cell; taste receptor T1R1/T1R3; autophagy; glutamate
Foundation items: National Natural Science Foundation of China(31702117); Guizhou Science and Technology Project (QKHJC〔2020〕1Y135, QKHJC〔2018〕1404)
0 引言
【研究意义】在自然界中,哺乳动物可感知酸、甜、鲜、咸、苦等味觉,其中味觉受体第一家族(Taste receptor 1 family,T1Rs)成员T1R1和T1R3形成的异二聚体可感知鲜味(Yarmolinsky et al.,2009)。已有研究表明,味觉受体T1R1/T1R3符合氨基酸跨膜传递要求(Nelson et al.,2002),T1R1或T1R3缺失均会引起机体对氨基酸的不敏感性(Wauson et al.,2012)。不同动物味觉受体T1R1/T1R3可感知不同种类的氨基酸,如小鼠可感知18种L-谷氨酸,猪可感知包括L-谷氨酸在内的6种氨基酸(Toda et al.,2013)。当味觉受体T1R1/T1R3被不同氨基酸激活后,对机体产生的影响也存在明显差异,L-苯丙氨酸和L-亮氨酸可激活小鼠肠道味觉受体T1R1/T1R3而引起胆囊收缩素分泌,L-半胱氨酸可引起肠蠕动和促进降钙素相关基因肽释放(Kendig et al.,2014),L-谷氨酸或精氨酸可引起钙离子释放和胰岛素分泌(Genço[g][̆]lu et al.,2019)。此外,T1R1/T1R3可感知氨基酸激活雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)对下游自噬起负调控作用,而自噬在雄性生殖过程中参与精子的生成及睾酮的合成(魏冬芹等,2021;刘文娇等,2022)。因此,探究氨基酸通过T1R1/T1R3激活mTOR调节下游自噬,可为进一步了解自噬在雄性生殖中的作用机理提供理论依据。【前人研究进展】自噬是一种通过形成双层膜结构对细胞内的蛋白或细胞器进行降解,从而维持细胞稳态的代谢过程,在真核生物体内高度保守(Galluzzi and Green,2019),目前研究较多的有mTOR信号通路、腺苷酸活化蛋白激酶(Adenosine 5'-monophosphate-activated protein kinase,AMPK)信号通路和磷脂酰肌醇-3-磷酸激酶(Phosphoinositide-3-kinase,PI3K)信号通路(Li and Zhang,2019;Wang and Zhang,2019)。mTOR作为一种丝氨酸/苏氨酸蛋白激酶,包括mTOR复合体1(mTORC1)和mTOR复合体2(mTORC2)。其中,mTORC1参与细胞能量代谢、凋亡和自噬等多种生理功能(Hara et al.,1998)。氨基酸作为重要的刺激物质可被T1R1/T1R3感知并调节mTORC1,而不被转运至细胞内。当mTORC1被激活,一方面可磷酸化p70核糖体S6激酶1(p70 ribosomal S6 kinase 1,S6K1)和真核起始因子4E结合蛋白1(4E-binding protein 1,4E-BP1),调节蛋白翻译以促进细胞生长;另一方面,mTORC1可磷酸化unc51样蛋白激酶(unc-51-like kinase 1,ULK1)复合物,抑制自噬的起始(Petherick et al.,2015;Zhou et al.,2016)。Hara等(1998)对酿酒酵母的研究发现,培养基中氨基酸的消耗极大抑制了S6K1活化和4E-BP1磷酸化;Kim等(2002)在人类(Homo sapiens)胚肾细胞中也发现亮氨酸的缺失会抑mTORC1活化,从而快速抑制S6K1和4E-BP1的磷酸化。睾丸间质细胞作为分泌睾酮的重要生殖细胞,其自噬相对活跃,且自噬程度與睾酮合成密切相关,可能是通过自噬来调控胆固醇摄入,进而影响睾酮的合成(Gao et al.,2018;Gong et al.,2021)。【本研究切入点】已有研究表明,味觉受体在睾丸间质细胞中高表达(Gong et al.,2021),且T1Rs被证实在雄性生殖过程(精子发生或生精细胞成熟)中具有调节作用(Meyer et al.,2012),但目前有关氨基酸通过T1R1/T1R3激活mTOR调节下游自噬的研究在雄性生殖上鲜见报道。【拟解决的关键问题】以从江香猪为研究对象,培养其原代睾丸间质细胞并通过L-谷氨酸刺激,利用实时荧光定量PCR和Western blotting检测L-谷氨酸刺激对自噬通路和自噬相关基因的影响,以期为进一步研究T1R1/T1R3通过mTOR调控下自噬对雄性生殖的影响提供理论依据。
1 材料与方法
1. 1 试验材料
选择3头30日龄的健康从江香公猪,由贵州省绿生源畜牧技术开发有限公司提供。通过手术法采集公猪两侧睾丸,置于含3%双抗的PBS中带回实验室,4 h内分离培养睾丸间质细胞。动物试验由贵州大学动物伦理委员会批准,批准号EAE-GZU-2020-P001。Gibco北美胎牛血清、DMEM/F12细胞培养基、I型胶原酶、TRIzol、RIPA蛋白裂解液及PMSF溶液购自西宝生物科技(上海)股份有限公司;DAPI染液、逆转录试剂盒、EBSS细胞缓冲液、0.25%胰酶、细胞自噬MDC染色试剂盒(G0170)及SYBR Green qPCR Master Mix购自贵州卓一生物生物科技有限公司。抗体p-mTOR(1∶1000稀释)、T1R3(1∶1000稀释)、T1R1(1∶1000稀释)和β-actin(1∶5000稀释)购自Affinity Bioscience公司;山羊抗兔IgG(1∶16000稀释)购自Immunoway公司;3β-HSD(1∶100稀释)购自Santa Cruz公司。3β-HSD染色液配制:A液为1.0 mg氯化硝基四氮唑蓝(NBT)和0.5 mg脱氢表雄酮(DHEA)溶于0.5 mL二甲基亚砜;B液为10.0 mg辅酶I(NAD)溶于9.5 mL的PBS;A液和B液混合后为工作液,4 ℃保存备用。主要仪器设备有PCR扩增仪(C1000 TouchTM)、荧光定量PCR仪(CFX96 Real-time System)及荧光显微镜(Nikon ECLIPSE-Ni+DS-Ri2)。
1. 2 试验方法
1. 2. 1 睾丸间质细胞培养与鉴定 睾丸间质细胞培养与鉴定参照王维勇(2020)、刘文娇等(2022)的方法,用75%酒精清洗睾丸1次,再以含双抗的PBS清洗2~3次,在培养皿中用镊子小心剥离睾丸外层的白膜,然后置于4 ℃预冷的75%酒精中消毒2~3 min,PBS清洗2~3次后用剪刀剪成肉泥状,经0.1% I型胶原酶稀释后装入50 mL无菌离心管中,加入2~3倍体积的0.1% I型胶原酶,37 ℃水浴1 h,期间每隔8~10 min晃动1次离心管;然后以含10%胎牛血清的培养基终止胶原酶消化,以200目和400目细胞筛过滤,收集滤液,1000 r/min离心10 min,弃上清液;用不含胎牛血清的DMEM/F12培养液吹散细胞沉淀,800 r/min离心8 min,弃上清液;再用含10%胎牛血清的DMEM/F12完全培养液重悬细胞沉淀,600 r/min离心5 min,弃上清液;离心结束后以含10%胎牛血清的DMEM/F12完全培养液重悬细胞沉淀,制备细胞悬液并接种于细胞瓶进行扩大培养,4 h后更换培养基。
采用间接免疫荧光法鉴定分离培养的睾丸间质细胞纯度,当6孔细胞板中的细胞汇合度达70%~80%时,弃培养液,PBS清洗3次,每次3~5 min;4%多聚甲醛室温固定15~20 min,PBS清洗3次;0.35% TritonX-100通透细胞15 min,PBS清洗3次;37 ℃下5%山羊血清溶液封闭40 min,PBS清洗3次;3β-HSD-mTOR(一抗,1∶100稀释)4 ℃摇床过夜孵育,PBS清洗3次;荧光标记山羊抗兔IgG(二抗,1∶400稀释)37 ℃避光孵育1 h,PBS清洗3次;再用1 μg/mL DAPI溶液染核10 min,PBS清洗3次,置于荧光显微镜下观察拍照。
1. 2. 2 CCK8细胞增殖检测 将细胞培养瓶中汇合度为80%~100%的间质细胞以0.25%胰酶消化后调整细胞浓度。将100.0 mL细胞悬浮液接种至96孔细胞板中,分别在接种后0、24、48、72、96和120 h时加入CCK8检测试剂(每个时间点设4个重复),37 ℃孵育2 h后置于酶标仪中,在450 nm波长处读取OD,并绘制细胞生长曲线。
1. 2. 3 实时荧光定量PCR检测 根据NCBI已公布的ERK1、ERK2、mTOR、Beclin 1和MAP1LC3B基因mRNA序列,利用Primer 5.0設计扩增引物(表1)。TAS1R3和TAS1R1基因的扩增引物设计参照王维勇(2020)的方法。当6孔细胞板中的细胞汇合度达80%~90%时,用EBSS缓冲液处理细胞3 h,排除氨基酸干扰后分别用0(对照)、2.5、5.0和10.0 mmol/L的L-谷氨酸刺激细胞8 h。采用TRIzol法提取细胞总RNA,反转录合成cDNA后利用实时荧光定量PCR检测各组内的TAS1R3、TAS1R1和β-actin基因表达情况。筛选出最佳刺激浓度,再以实时荧光定量PCR检测目的基因在氨基酸处理组和对照组中的表达水平。反应体系10.0 μL:2×SYBR Premix Ex TaqTMⅡ 5.0 μL,cDNA模板1.0 μL,上、下游引物各0.4 μL,ddH2O 3.2 μL。扩增程序:50 ℃酶失活2 min;95 ℃预变性2 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 1 min,进行40个循环。每个样品进行4次平行试验,通过2-△△Ct法计算目的基因相对表达量。
1. 2. 4 Western blotting检测分析 使用蛋白裂解液对处理的细胞进行裂解,提取总蛋白,以BCA试剂盒测定蛋白浓度,调整蛋白浓度并加入5×SDS上样缓冲液,100 ℃变性10 min后进行SDS-PAGE电泳,浓缩胶中80 V电泳30 min,分离胶中110 V电泳70 min。电泳结束后采用湿转法110 V转膜70 min,转印后的PVDF膜在5%脱脂奶粉中37 ℃孵育2 h。用TBST将PVDF膜清洗干净,加入一抗(T1R1、T1R3、mTOR、p-mTOR、ERK1/2、p-S6K1、Beclin 1、β-actin)4 ℃摇床孵育过夜。孵育好的杂交膜以TBST清洗3次,每次5 min,加入山羊抗兔IgG(二抗),室温孵育1.5 h后以TBST清洗3次,每次5 min,采用ECL超敏发光液显示蛋白条带,并以ImageJ 1.8.0对蛋白条带进行灰度分析。
1. 2. 5 单丹磺尸酰胺(MDC)染色 当6孔细胞板中的细胞汇合度达70%~80%时,弃培养基,用PBS清洗3次,按1×Wash Buffer∶MDC染液为9∶1的比例稀释染色工作液,将配好的染液加入6孔细胞板,每孔100.0~200.0 μL,室温下避光孵育20~45 min,弃染液,PBS清洗3次,再加入100.0 μL的Collection Buffer覆盖细胞,在200倍显微镜下选取3~5个视野观察拍照。
1. 3 统计分析
试验数据采用GraphPad Prism 9.0进行单因素方差分析(One-way ANOVA),并以Multiple Comparisons进行多重比较。
2 结果与分析
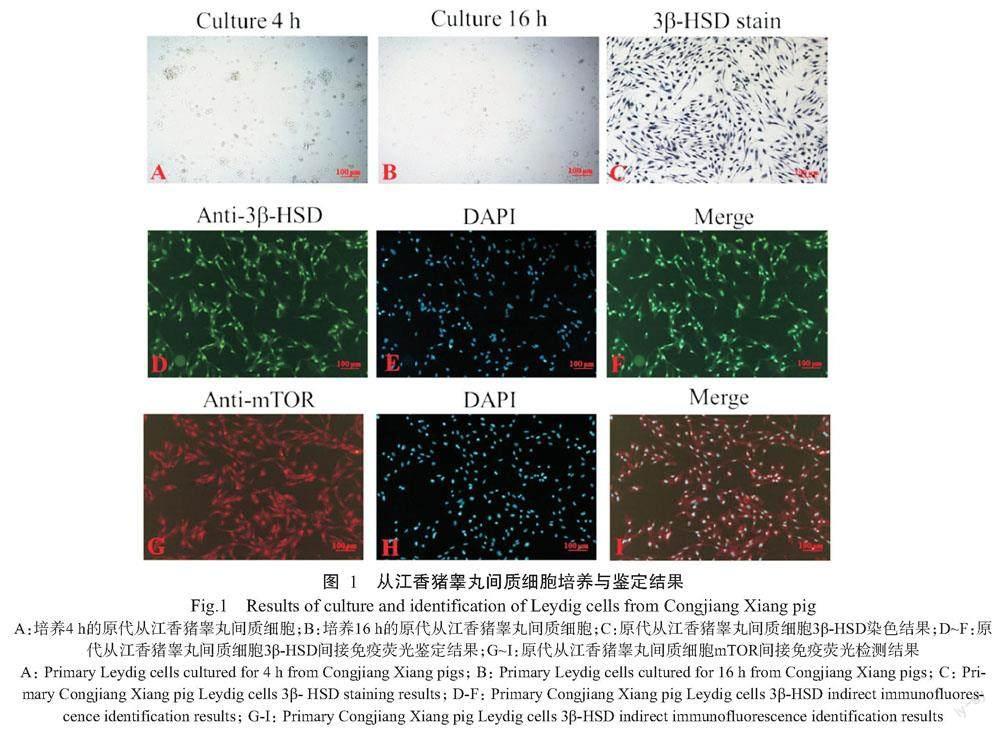
2. 1 从江香猪睾丸间质细胞培养与鉴定结果
分离获得的从江香猪睾丸间质细胞于培养4 h后开始贴壁(图1-A),培养16 h的细胞增殖分化明显(图1-B)。经3β-HSD染色(图1-C)及3β-HSD间接免疫荧光鉴定(图1-D~图1-F)结果均显示,原代从江香猪睾丸间质细胞纯度超过90%。mTOR间接免疫荧光检测结果显示,90%以上的从江香猪睾丸间质细胞能表达mTOR(图1-G~图1-I)。
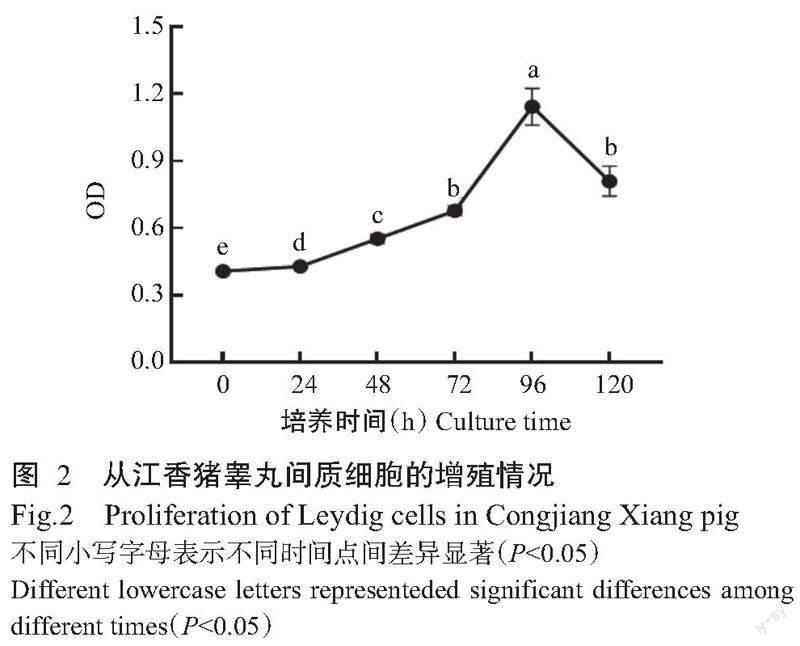
2. 2 CCK8检测从江香猪睾丸间质细胞增殖情况
如图2所示,从江香猪睾丸间质细胞在培养0~72 h阶段生长缓慢,在培养72~96 h阶段的细胞增殖最快,并于培养96 h时达对数生长期,其增殖速度显著高于其他时间点(P<0.05,下同),表明从江香猪睾丸间质细胞增殖效率较高,可用于后续试验。
2. 3 L-谷氨酸对睾丸间质细胞味觉受体TAR1/TAR3 的影响
相对于对照组,以2.5、5.0和10.0 mmol/L的L-谷氨酸刺激睾丸间质细胞后,其TAS1R3基因相对表达量极显著升高(P<0.01,下同)(图3-A);经10 mmol/L的L-谷氨酸刺激后,睾丸间质细胞TAS1R1基因相对表达量也极显著高于对照组,但以2.5和5.0 mmol/L的L-谷氨酸刺激睾丸间质细胞,TAS1R1基因相对表达量与对照组差异不显著(P>0.05,下同)(图3-B)。此外,以10 mmol/L的L-谷氨酸刺激睾丸间质细胞后,T1R3和T1R1蛋白表达量均极显著高于对照组(图3-C和图3-D)。因此,确定10 mmol/L是L-谷氨酸刺激从江香猪睾丸间质细胞味觉受体T1R1/T1R3的有效浓度。
2. 4 L-谷氨酸刺激对自噬相关基因表达的影响
提取经L-谷氨酸刺激的从江香猪睾丸间质细胞总RNA和总蛋白,分别进行实时荧光定量PCR及Western blotting检测分析。实时荧光定量PCR检测结果显示,经10 mmol/L的L-谷氨酸刺激后,从江香猪睾丸间质细胞的mTOR、ERK1和ERK2基因相对表达量极显著高于对照组,而Beclin 1基因相对表达量极显著低于对照组,MAP1LC3B基因相对表达量显著低于对照组(图4-A)。Western blotting检测分析结果如图4-B所示,经10 mmol/L的L-谷氨酸刺激后,从江香猪睾丸间质细胞的mTOR蛋白相对表达量低于对照组,p-mTOR蛋白相对表达量高于对照组,ERK1/2和p-S6K1蛋白相对表达量显著高于对照组,而Beclin 1蛋白相对表达量显著低于对照组(图4-B和图4-C)。MDC染色结果显示,经10 mmol/L的L-谷氨酸刺激后,从江香猪睾丸间质细胞内的酸性自噬泡荧光强度明显低于对照组(图4-D),表明胞内自噬受抑制。
3 讨论
味觉受体T1R1/T1R3在除口腔外的脂肪(Simon et al.,2014)、睾丸(龚婷,2016;Gong et al.,2021)、胰腺(Murovets et al.,2019)、胃肠道(Xie et al.,2020)和脑(Wu et al.,2021)等非味觉组织及器官中均有表达,且参与调控相关生理活动(Wauson et al.,2012;Lee and Owyang,2017)。在雄性生殖中,T1R1/T1R3通过调控小鼠体内的cAMP浓度而控制精子顶体反应,且TAS1R1基因敲除试验发现精子顶体反应频率及细胞坏死/凋亡增加(Luddi et al.,2019)。与此相似,TAS1R3基因敲除试验也发现小鼠生精小管部分生精上皮脱落,精子畸形率增加(Mosinger et al.,2013)。性成熟雄性哺乳动物95%的睾酮由睾丸间质细胞分泌,向小鼠睾丸注射糖精钠后T1R3和下游味导素Gα表达增加,且血清睾酮、雌二醇及cAMP含量上升(龚婷,2016)。大多数细胞需通过氨基酸感测来协调细胞营养需求,而T1R1/T1R3作为鲜味受体可被丙氨酸、谷氨酸及蛋氨酸等多种氨基酸激活(Nelson et al.,2002),将氨基酸可用性信号传递至mTORC1,进而调节mTOR活性。本研究结果表明,10 mmol/L的L-谷氨酸可通过T1R1/T1R3受体激活mTOR而抑制从江香猪睾丸间质细胞自噬,与Zhou等(2016)在小鼠成肌细胞中观察到蛋氨酸可通过T1R1/T1R3激活mTOR,当TAS1R1基因表达受干扰时mTOR受抑制的结论一致。
自噬在维持生精细胞稳态、清除多余生精细胞及调控精子发生的过程中发挥重要作用。睾丸间质细胞作为分泌睾酮的生殖细胞,不仅高表达味觉受体,其自噬程度也相对较活跃。自噬参与小鼠睾酮合成,以尼古丁和氟处理小鼠均发现其血清睾酮水平降低,睾丸间质细胞自噬能力增加(朱宇辰,2016;赵祥龙,2018)。自噬因子LC3包括LC3-I和LC3-II,其中,LC3-I通过与磷脂酰乙醇胺偶联生成脂质化的LC3-II,而LC3-II附着在自噬体膜上,参与自噬体膜的延伸与形成(Sheng and Qin,2019);Beclin 1则主要参与自噬体的起始与成熟(Xu and Qin,2019)。本研究发现,T1R1/T1R3被L-谷氨酸激活后自噬相关基因TAS1R1、TAS1R3、ERK1、ERK2和mTOR及相关蛋白T1R1、T1R3、ERK1/2、p-S6K1和p-mTOR的表达量均呈上升趋势,而Beclin 1和MAP1LC3B基因的相对表达量显著下降,Beclin 1蛋白表达也显著下降,与Wauson等(2012)的研究结果一致。味觉受体T1R1/T1R3可通过促进细胞内钙离子浓度及激活细胞外信号调节蛋白1和2(ERK1/2)而正向调节mTORC1(Wauson et al.,2013)。此外,ERK1/2可直接磷酸化mTORC1的亞基Raptor以促进mTORC1激活(Carriere et al.,2011)。MDC作为酸性染料可对自噬泡进行染色(Sun et al.,2021)。本研究的MDC染色结果显示,经10 mmol/L的L-谷氨酸刺激后,从江香猪睾丸间质细胞内的酸性自噬泡荧光强度明显低于对照组,表明L-谷氨酸刺激可抑制胞内自噬。除谷氨酸外,其他氨基酸也参与自噬调控。Sato等(2013)研究发现,缺乏赖氨酸时会引起骨骼肌蛋白分解加快且合成速率减慢,推测是赖氨酸不足引起骨骼肌细胞发生自噬而导致蛋白被降解;此外,以10 mmol/L的L-赖氨酸处理小鼠成肌细胞时发现mTORC1下游S6K1和4EBP1磷酸化水平上升,而LC3表达下降(Sato et al.,2014)。
目前,有关自噬在雄性生殖上的研究多集中在药物刺激引起的自噬(Chen et al.,2019;Sadeghi et al.,2020),鲜见将自噬与味觉受体联合研究。味觉受体可感知哺乳动物摄取的外界物质,并参与多种组织器官调控。鉴于睾丸间质细胞既表达味觉受体且自噬活跃,本研究以香猪睾丸间质细胞为对象,将味觉受体T1R1/T1R3与自噬相关联,并推测T1R1/T1R3是通过mTOR调控自噬过程,为进一步研究味觉受体T1R1/T1R3在雄性生殖过程中的作用机理提供了借鉴。
4 结论
10 mmol/L的L-谷氨酸可激活从江香猪睾丸间质细胞T1R1/T1R3,且自噬相关基因TAS1R1、TAS1R3、ERK1、ERK2和mTOR及相关蛋白T1R1、T1R3、ERK1/2、p-S6K1和p-mTOR表达升高,而Beclin 1和MAP1LC3B基因及Beclin 1蛋白表达降低,故推测谷氨酸可通过激活味觉受体T1R1/T1R3参与雄性生殖自噬的负调控。
参考文献:
龚婷. 2016. 甜味受体T1R3与Gα-味导素在小鼠睾丸类固醇激素合成中的功能及作用机制研究[D]. 南京:南京农业大学. [Gong T. 2016. Roles of sweet taste receptor T1R3 and alpha-gustducin testicular steroidogenesis of mice[D]. Nanjing:Nanjing Agricultural University.] doi:10.7666/d.Y3290115.
刘文娇,王涵,龚婷. 2022. 从江香猪SP1基因组织表达特征及其超表达对间质细胞自噬和凋亡的影响[J]. 南方农业学报,53(12):3498-3509. [Liu W J,Wang H,Gong T. 2022. Tissue expression characteristics of SP1 gene and effects of its overexpression on autophagy and apoptosis in leydig cells from Congjiang Xiang pigs[J]. Journal of Southern Agriculture,53(12):3498-3509.] doi:10. 3969/j.issn.2095-1191.2022.12.021.
王维勇. 2020. 睾丸T1R3参与从江香猪初情期睾酮合成的机制研究[D]. 贵阳:贵州大学. [Wang W Y. 2020. Study on testicular T1R3 involved in testosterone synthesis of Congjiang Xiang pigs at puberty[D]. Guiyang:Guizhou University.] doi:10.27047/d.cnki.ggudu.2020.001878.
魏冬芹,吴德,林燕. 2021. 细胞自噬在雄性繁殖生理中的研究进展[J]. 中国畜牧杂志,57(11):39-45. [Wei D Q,Wu D,Lin Y. 2021. Advances in autophagy in male reproductive physiology[J]. Chinese Journal of Animal Science,57(11):39-45.] doi:10.19556/j.0258-7033.2020 0917-04.
赵祥龙. 2018. 尼古丁通过睾丸间质细胞自噬降低血清睾酮分泌[D]. 上海:上海交通大学. [Zhao X L. 2018. Nicotine decreases serum testosterone via autophagy in TM3 cells[D]. Shanghai:Shanghai Jiaotong University.] doi:10.27307/d.cnki.gsjtu.2018.000313.
朱宇辰. 2016. 氟對小鼠睾丸组织及间质细胞自噬的体内外观察[D]. 太谷:山西农业大学. [Zhu Y C. 2016. A research of fluoride on autophagy in mice testis and leydig cells:In vivo and vitro[D]. Taigu:Shanxi Agricultural University.]
Carriere A,Romeo Y,Acosta-Jaquez H A,Moreau J,Bonneil E,Thibault P,Fingar D C,Roux P P. 2011. ERK1/2 phosphorylate raptor to promote ras-dependent activation of mTOR complex 1 (mTORC1)[J]. Journal of Biological Chemistry,286(1):567-577. doi:10.1074/jbc.M110.159046.
Chen X W,Li C,Chen Y,Ni C B,Chen X X,Zhang L L,Xu X N,Chen M,Ma X Y,Zhan H L,Xu A Y,Ge R S,Guo X L. 2019. Aflatoxin B1 impairs leydig cells through inhibiting AMPK/mTOR-mediated autophagy flux pathway[J]. Chemosphere,233:261-272. doi:10.1016/j.chemosphere.2019.05.273.
Galluzzi L,Green D R. 2019. Autophagy-independent functions of the autophagy machinery[J]. Cell,177(7):1682-1699. doi:10.1016/j.cell.2019.05.026.
Gao F Y,Li G P,Liu C,Gao H,Wang H,Liu W X,Chen M,Shang Y L,Wang L N,Shi J,Xia W L,Jiao J W,Gao F,Li J,Chen L,Li W. 2018. Autophagy regulates testosterone synthesis by facilitating cholesterol uptake in Leydig cells[J]. Journal of Cell Biology,217(6):2103-2119. doi:10.1083/jcb.201710078.
Genço[g][̆]lu H,Şahin K,Jones P M. 2019. Determining the insulin secretion potential for certain specific G-protein coupled receptors in MIN6 pancreatic beta cells[J]. Turkish Journal of Medical Sciences,49(1):403-411. doi:10.3906/sag-1712-147.
Gong T,Wang W Y,Xu H Q,Yang Y,Chen X,Meng L J,Xu Y J,Li Z Q,Wan S F,Mu Q. 2021. TAS1R3 longitudinal expression of testicular from prepuberty to sexual maturity in Congjiang Xiang pigs[J]. Animals,11(2):437. doi:10.3390/ani11020437.
Hara K,Yonezawa K,Weng Q P,Kozlowski M,Belham C,Avruch J. 1998. Amino acid sufficiency and mTOR regulate p70S6 kinase and eIF-4E BP1 through a common effector mechanism[J]. Journal of Biological Chemistry,273(23):14484-14494. doi:10.1074/jbc.273.23.14484.
Kendig D M,Hurst N R,Bradley Z L,Mahavadi S,Kuemmerle J F,Lyall V,DeSimone J,Murthy K S,Grider J R. 2014. Activation of the umami taste receptor (T1R1/T1R3) initia-tes the peristaltic reflex and pellet propulsion in the distal colon[J]. American Journal of Physiology. Gastrointestinal and Liver Physiology,307(11):G1100-G1107. doi:10.1152/ajpgi.00251.2014.
Kim D H,Sarbassov D D,Ali S M,King J E,Latek R R,Erdjument-Bromage H,Tempst P,Sabatini D. 2002. mTOR interacts with raptor to form a nutrient-sensitive complex that signals to the cell growth machinery[J]. Cell,110(2):163-175. doi:10.1016/s0092-8674(02)00808-5.
Lee A L,Owyang C. 2017. Sugars,sweet taste receptors,and brain responses[J]. Nutrients,9(7):653. doi:10.3390/nu9070653.
Li W,Zhang L N. 2019. Regulation of ATG and autophagy initiation[J]. Advances in Experimental Medicine and Bio-logy,1206:41-65. doi:10.1007/978-981-15-0602-4_2.
Luddi A,Governini L,Wilmskötter D,Gudermann T,Boekhoff I,Piomboni P. 2019. Taste receptors:New players in sperm biology[J]. International Journal of Molecular Scien-ces,20(4):967. doi:10.3390/ijms20040967.
Meyer D,Voigt A,Widmayer P,Borth H,Huebner S,Breit A,Marschall S,de Angelis M H,Boehm U,Meyerhof W,Gudermann T,Boekhoff I. 2012. Expression of tas1 taste receptors in mammalian spermatozoa:Functional role of TAS1R1 in regulating basal Ca2+ and cAMP concentrations in spermatozoa[J]. PLoS One,7(2):e32354. doi:10.1371/journal.pone.0032354.
Mosinger B,Redding K M,Rockwell Parker M,Yevshayeva V,Yee K K,Dyomina K,Li Y,Margolskee R F. 2013. Genetic loss or pharmacological blockade of testes-expressed taste genes causes male sterility[J]. Proceedings of the National Academy of Sciences of the United States of America,110(30):12319-12324. doi:10.1073/pnas.1302827110.
Murovets V O,Sozontov E A,ZachepilO T G. 2019. The effect of the taste receptor protein T1R3 on the development of islet tissue of the murine pancreas[J]. Doklady Biological Sciences,484(1):1-4. doi:10.1134/S00124 96619010010.
Nelson G,Chandrashekar J,Hoon M A,Feng L X,Zhao G,Ryba N J P,Zuker C S. 2002. An amino-acid taste receptor[J]. Nature,416(6877):199-202. doi:10.1038/nature726.
Petherick K J,Conway O J L,Mpamhanga C,Osborne S A,Kamal A,Saxty B,Ganley I G. 2015. Pharmacological inhibition of ULK1 kinase blocks mammalian target of rapamycin (mTOR)-dependent autophagy[J]. Journal of Biological Chemistry,290(48):28726. doi:10.1074/jbc.A114. 627778.
Sadeghi N,Erfani-Majd N,Tavalaee M,Tabandeh M R,Drevet J R,Nasr-Esfahani M H. 2020. Signs of ROS-associa-ted autophagy in testis and sperm in a rat model of varicocele[J]. Oxidative Medicine and Cellular Longevity,2020:5140383. doi:10.1155/2020/5140383.
Sato T,Ito Y,Nagasawa T. 2013. Regulation of skeletal muscle protein degradation and synthesis by oral administration of lysine in rats[J]. Journal of Nutritional Science and Vitaminology,59(5):412-419. doi:10.3177/jnsv.59. 412.
Sato T,Ito Y,Nedachi T,Nagasawa T. 2014. Lysine suppres-ses protein degradation through autophagic-lysosomal system in C2C12 myotubes[J]. Molecular and Cellular Biochemistry,391(1-2):37-46. doi:10.1007/s11010-014-1984-8.
Sheng R,Qin Z H. 2019. History and current status of auto-phagy research[J]. Advances in Experimental Medicine and Biology,1206:3-37. doi:10.1007/978-981-15-0602-4_1.
Simon B R,Learman B S,Parlee S D,Scheller E,Mori H,Cawthorn W P,Ning X M,Krishnan V,Ma Y F,Tyrberg B,MacDougald O A. 2014. Sweet taste receptor deficient mice have decreased adiposity and increased bone mass[J]. PLoS One,9(1):e86454. doi:10.1371/journal.pone. 0086454.
Sun M,Wang C Y,Lv M C,Fan Z,Du J Z. 2021. Mitochondrial-targeting nanoprodrugs to mutually reinforce metabolic inhibition and autophagy for combating resistant cancer[J]. Biological Engineering Society,278:121168. doi:10.1016/j.biomaterials.2021.121168.
Toda Y,Nakagita T,Hayakawa T,Okada S,Narukawa M,Imai H,Ishimaru Y,Misaka T. 2013. Two distinct determinants of ligand specificity in T1R1/T1R3 (the umami taste receptor)[J]. Journal of Biological Chemistry,288(52):36863-36877. doi:10.1074/jbc.M113.494443.
Wang Y,Zhang H B. 2019. Regulation of autophagy by mTOR signaling pathway[J]. Advances in Experimental Medicine and Biology,1206:67-83. doi:10.1007/978-981-15-0602-4_3.
Wauson E M,Lorente-Rodríguez A,Cobb M H. 2013. Minireview:Nutrient sensing by G protein-coupled receptors[J]. Molecular Endocrinology,27(8):1188-1197. doi:10. 1210/me.2013-1100.
Wauson E M,Zaganjor E,Lee A Y,Guerra M L,Ghosh A B,Bookout A L,Chambers C P,Jivan A,McGlynn K,Hutchison M R,Deberardinis R J,Cobb M H. 2012. The G protein-coupled taste receptor T1R1/T1R3 regulates mTORC1 and autophagy[J]. Molecular Cell,47(6):851-862. doi:10.1016/j.molcel.2012.08.001.
Wu B,Eldeghaidy S,Ayed C,Fisk I D,Hewson L,Liu Y. 2021. Mechanisms of umami taste perception:From molecular level to brain imaging[J]. Critical Reviews in Food Science and Nutrition,62(25):7015-7024. doi:10.1080/10408398.2021.1909532.
Xie S Z,Yang G,Jiang X M,Qin D Y,Li Q M,Zha X Q,Pan L H,Jin C S,Luo J P. 2020. Polygonatum cyrtonema hua polysaccharide promotes GLP-1 secretion from enteroendocrine L-cells through sweet taste receptor-mediated cAMP signaling[J]. Journal of Agricultural and Food Chemistry,68(25):6864-6872. doi:10.1021/acs.jafc.0c02058.
Xu H D,Qin Z H. 2019. Beclin 1,bcl-2 and autophagy[J]. Advances in Experimental Medicine and Biology,1206:109-126. doi:10.1007/978-981-15-0602-4_5.
Yarmolinsky D A,Zuker C S,Ryba N J P. 2009. Common sense about taste:From mammals to insects[J]. Cell,139(2):234-244. doi:10.1016/j.cell.2009.10.001.
Zhou Y F,Ren J,Song T X,Peng J,Wei H K. 2016. Methionine regulates mTORC1 via the T1R1/T1R3-PLCβ-Ca2+-ERK1/2 signal transduction process in C2C12 cells[J]. International Journal of Molecular Sciences,7(10):1684. doi:10.3390/ijms17101684.
(責任编辑 兰宗宝)
收稿日期:2022-09-05
基金项目:国家自然科学基金项目(31702117);贵州省科学技术项目(黔科合基础〔2020〕1Y135号,黔科合基础〔2018〕1404号)
通讯作者:龚婷(1990-),https://orcid.org/0000-0003-3624-7972,博士,副教授,主要从事动物遗传育种与繁殖研究工作,E-mail:tgong@gzu.edu.cn
第一作者:王涵(1998-),https://orcid.org/0000-0002-6848-8124,研究方向为动物遗传育种与繁殖,E-mail:3021585823@qq.com

