日本对虾IKKβ基因克隆及其表达分析
范嗣刚 孙珍珠 郭靖 吴昊 邓维德 李翔 黎源 陈燕飞 文菁




DOI:10.3969/j.issn.2095-1191.2023.06.025
摘要:【目的】明確日本对虾NF-κB抑制蛋白激酶β基因(PjIKKβ)生物学特征及其在各组织和哈维弧菌刺激下的表达模式,为揭示IKKβ在日本对虾先天免疫中的作用机制提供理论依据。【方法】克隆PjIKKβ基因cDNA序列,通过ORF Finder、ExPASy ProtParam、SMART、SignalP 5.0、TMHMM、Prot-Comp等在线软件进行生物信息学分析,并以实时荧光定量PCR检测PjIKKβ基因在日本对虾各组织及哈维弧菌悬液刺激后的表达模式。【结果】PjIKKβ基因序列全长2794 bp,其开放阅读框(ORF)长2373 bp,共编码790个氨基酸残基。PjIKKβ蛋白包含1个丝氨酸/苏氨酸蛋白激酶催化结构域(S-TKc)、1个亮氨酸锌指结构域(LZ)和1个螺旋—环—螺旋结构域(HLH),定位于细胞质和细胞核中,无跨膜结构,无信号肽。PjIKKβ与凡纳滨对虾IKKβ氨基酸序列相似性最高(98%),其次是与斑节对虾IKKβ氨基酸序列(97%);多序列比对分析结果显示,各物种IKKβ蛋白序列在S-TKc结构域的保守性较高,而在其他区域的保守性低。基于IKKβ氨基酸序列相似性构建的系统发育进化树显示,在甲壳动物分支中日本对虾先与凡纳滨对虾聚在一起,再与斑节对虾聚为一个分支。PjIKKβ基因在日本对虾肝胰腺、肌肉、鳃、神经节、胃、心脏、血淋巴和眼柄等8个组织中均有表达,以神经节、肌肉、血淋巴和眼柄中的相对表达量较高,显著高于在其他组织中的相对表达量(P<0.05);注射后24、48和72 h,PjIKKβ基因在注射哈维弧菌日本对虾血淋巴中的相对表达量上调,且与注射PBS日本对虾的相对表达量存在极显著差异(P<0.01)。【结论】PjIKKβ蛋白含有1个S-TKc 结构域、1个LZ结构域和1个HLH结构域,在进化过程中非常保守;PjIKKβ基因的组织表达特征及其在哈维弧菌刺激后的表达变化,进一步证实PjIKKβ基因参与了日本对虾的先天免疫应答反应。
关键词:日本对虾;IKKβ基因;哈维弧菌;表达特征;先天免疫
中图分类号:S945.45 文献标志码:A 文章编号:2095-1191(2023)06-1837-10
Cloning and expression analysis of IKKβ gene in Penaeus japonicus
FAN Si-gang1,2, SUN Zhen-zhu3, GUO Jing3, WU Hao3, DENG Wei-de3, LI Xiang3,
LI Yuan3,CHEN Yan-fei3, WEN Jing3*
(1Lingnan Normal University/Western Guangdong Engineering Research Center on Sustainable Utilization of Seafood
Resources,Zhanjiang,Guangdong 524048,China;2South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou,Guangdong 510300,China;3School of Biology and Agriculture,Shaoguan University,
Shaoguan,Guangdong 512005,China)
Abstract:【Objective】To elucidate the biological characteristics of NF-κB inhibitory protein kinase-β gene (named PjIKKβ) in Penaeus japonicus and its expression pattern in various tissues and stimulated by Vibrio harveyi , and to provide theoretical basis for revealing the mechanism of IKKβ in the innate immunity of P. japonicus. 【Method】 The cDNA sequence of PjIKKβ gene was cloned. The bioinformatics of PjIKKβ gene was analyzed by some online softwares, such as ORF Finder, ExPASy ProtParam, SMART, SignalP 5.0, TMHMM and Prot-Comp. The expression of PjIKKβ gene was examinated in various tissues under normal condition and in haemolymph after the treatment with V. harveyi by real-time fluorescence quantitative PCR. 【Result】The full length of PjIKKβ gene sequence was 2794 bp and the open reading frame (ORF) was 2373 bp which encoding 790 amino acid residues. PjIKKβ protein contained a serine/threonine protein kinases catalytic (S-TKc) domain, a leucine zipper (LZ) domain and a helix loop helix (HLH) domain. PjIKKβ protein was localized in cytoplasm and nucleus. No transmembrane structure and signal peptide were detected in PjIKKβ protein. PjKKβ protein shared the highest identity with IKKβ amino acid sequence of P. vannamei (98%) and P. monodon (97%). Multiple sequence alignment analysis showed that S-TKc domain was highly conserved among various species and other domains were low conservation. The result of phylogenetic tree constructed based on IKKβ amino acid sequence showed that P. japonicus were clustered firstly with P. vannamei and then clustered with P. vannamei. PjIKKβ gene was ubiquitously expressed in all tested tissues (hepatopancreas, muscles, gills, ganglia, stomach, heart, hemolymph and eye stalk). The highest expression level was detected in the ganglion, muscle, haemolymph and eye stalk. The expression of PjIKKβ gene in haemolymph was up-regulated at 24, 48 and 72 h after infected of V. harveyi and was extremely significantly different from that infected with PBS(P<0.01). 【Conclusion】PjIKKβ protein contains a S-TKc domain, a LZ domain and a HLH domain, which is conservative in evolution. The expression of PjIKKβ in various tissues and its changes of expression after stimulation by V. harveyi indicate that PjIKKβ is involved in the innate immune response of P. japonicus.
Key words: Penaeus japonicus; IKKβ gene; Vibrio harveyi; expression feature; innate immunity
Foundation items:National Natural Science Foundation of China (31872571); Guangzhou Municipal Science and Technology Plan Project (202206010138); Guangzhou Rural Science and Technology Correspondent Project(2021 2100051)
0 引言
【研究意义】核因子κB(Nuclear factor-κB,NF-κB)能选择性结合到B细胞κ-轻链编码基因的调节区域而调控相关基因表达,参与生物体先天免疫和适应性免疫反应(Xu et al.,2022)。NF-κB抑制蛋白激酶(Inhibitor of NF-κB kinase,IKK)是一种常见的转录因子激活蛋白,被上游调控因子(Toll样受体、白介素及脂多糖等)激活后参与调控NF-κB信号途径,从而抵御病原体的侵袭(Negi and Sharma,2015;Jiang et al.,2018)。IKKβ是IKK家族的重要成员之一,是IKK复合物的主要催化亚基(Rothwarf et al.,1998)。在未受刺激的细胞中,IKKβ与IκBα(κB-α抑制剂)紧密结合,致使NF-κB核转录因子无法在细胞质中定位,而导致NF-κB无法启动下游基因(Kai et al.,2014)。在受刺激的细胞中,IKKβ被一些受体信号通路中的激酶激活后催化IκBα蛋白磷酸化,导致IκBα降解。NF-κB与IκBα蛋白解离后进入细胞核,结合到与其相关的DNA反应元件上,激活目的基因的转录与翻译,参与免疫细胞的发育及分化等生理过程(Oh et al.,2017;Zhao et al.,2018)。因此,研究IKKβ在机体免疫生理过程中的功能作用,对揭示生物体的免疫分子机制具有重要意义。【前人研究进展】至今,脊椎动物IKK介导的信号转导通路及免疫功能已得到系统研究,但在无脊椎动物中针对IKK的研究相对较少。果蝇(Drosophila melanogaster)的IKK家族与脊椎动物的类似,其中IRD5与IKKβ同源,通过IMD信号途径参与免疫反应(Pomerantz and Baltimore,1999;Sun,2011)。Chen等(2011)研究发现传染性脾肾坏死病毒(ISKNV)感染MFF-1细胞后,鳜鱼(Siniperca chuatsi)的IKKβ基因表达明显上调。Huang等(2019)研究表明,太平洋牡蛎(Crassostrea gigas)IKKα和IKKβ-2能誘导哺乳动物细胞中NF-κB、TNFα和 IFNβ的表达,从而启动抵御细菌或病毒入侵的免疫反应。He等(2020)研究表明,石斑鱼(Epinephelus coioides)感染副溶血性弧菌(Vibrio parahaemolyticus)后,其体内的IKKα表达量增加。Li等(2020)研究发现海参(Holothuria leucospilota)的IKKβ转染HEK-293T 细胞后能激活NF-κB活性,并诱导促炎细胞因子TNF-α和IL-1β分泌。Li等(2022)研究证实华贵栉孔扇贝(Chlamys farreri)的IKK1是TLR信号途径的重要转导因子,参与先天免疫调控。此外,在凡纳滨对虾(Penaeus vannamei)、拟穴青蟹(Scylla paramamosain)和斑节对虾(P. monodon)等甲壳类动物中均发现IKKβ能激活NF-κB信号途径(Wang et al.,2013;Jiang et al.,2018;Nhnhkorn et al.,2019),故推测IKKβ参与机体先天免疫反应过程。【本研究切入点】日本对虾(P. japonicus)又名花虾或车虾,个体大、色泽鲜艳、营养丰富、市场价格高,是我国重要的海水虾类养殖品种之一,2020年的产量达4.2万t(农业农村部渔业渔政管理局等,2021)。日本对虾先天免疫的分子机制已有文献报道(Cowley,2020;Ito et al.,2021),但有关IKKβ是否参与日本对虾先天免疫的结论至今尚未明确。【拟解决的关键问题】在线分析日本对虾IKKβ基因cDNA序列及其编码蛋白序列,并通过实时荧光定量PCR检测IKKβ基因在日本对虾各组织及哈维弧菌(V. harveyi)刺激下的表达模式,为揭示IKKβ在日本对虾先天免疫中的作用机制提供理论依据。
1 材料与方法
1. 1 试验材料
从广东省徐闻县对虾养殖场购买500尾日本对虾,平均体重24.3±1.5 g。随机剪取4尾日本对虾的心脏、眼柄、肝胰腺、鳃、神经节、胃和肌肉等组织样品;同时用1 mL注射器加入30.0 μL ACD抗凝剂(柠檬酸钠1.32%,柠檬酸0.48%,葡萄糖1.47%,溶于100 mL的ddH2O)抽取血淋巴,800 r/min离心10 min,弃上清液,即获得血淋巴组织。所有组织样品均以液氮冷冻保存。随机挑选450尾肢体完整且富有活力的日本对虾,置于1000 L塑料桶中养殖(海水盐度34‰,水温23 ℃),每个塑料桶养殖90尾,共5个塑料桶。每天按时按量投喂对虾饲料,及时清除桶内的饲料残留物和粪便,并更换1/2~2/3体积的海水。哈维弧菌由中国水产科学研究院南海水产研究所渔业生物病害防治研究室提供(蒋魁等,2016,2017)。
1. 2 哈维弧菌刺激试验
日本对虾暂养3 d后开始进行菌液注射试验,分为试验组和对照组,每组设3个平行,即每组有3个塑料桶(1000 L),每桶放养50尾日本对虾。哈维弧菌悬液浓度1×106 CFU/mL。试验组每尾日本对虾注射50.0 μL哈维弧菌悬液,对照组日本对虾注射等体积的磷酸盐缓冲液(PBS,pH 7.2)。注射部位为腹部肌肉。注射后0、6、12、24、48和72 h各抽取5尾日本对虾血淋巴组织,液氮冻存运回实验室,-80 ℃冰箱保存备用。
1. 3 RNA提取及cDNA合成
采用TIRzol提取各组织样品RNA,分别以1.2%琼脂糖凝胶电泳和NanoDrop 2000检测RNA完整性及其浓度。以Oligo(dT)18为反转录引物(表1),通过M-MLV反转录试剂盒合成肌肉组织cDNA第一条链,用于IKKβ基因cDNA序列验证。使用PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)反转录合成cDNA,浓度稀释至50 ng/μL,用于实时荧光定量PCR检验。
1. 4 IKKβ基因序列验证
根据日本对虾转录组数据(SRX2030618)获得IKKβ基因片段,用引物IKKβ-S/IKKβ-R(表1)进行PCR扩增。PCR反应体系20.0 μL:10×Ex Taq Buffer(Mg2+ Plus)2.0 μL,dNTP Mixture(2.5 mmol/L)1.6 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA模板0.8 μL,Ex Taq DNA聚合酶(5 U/μL)0.2 μL,ddH2O 13.8 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1min,进行35个循环;72 ℃延伸10 min。使用胶回收试剂盒(TaKaRa)纯化回收PCR扩增产物,并送至生工生物工程(上海)股份有限公司测序。测序结果与转录组数据进行比对,以确定转录组测序结果的正确性。
1. 5 生物信息学分析
使用NCBI中的ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)預测开放阅读框(ORF)及其编码氨基酸序列,运用Global Align分析氨基酸序列相似性;利用ExPASy ProtParam(http://web.expasy.org/protparam/)预测IKKβ蛋白理化特性及亲水性;通过SMART(http://smart.embl-heidelberg.de/)预测蛋白结构域;应用SignalP 5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测蛋白信号肽;使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测蛋白跨膜结构;通过SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsaautomat.pl?page=npsasopma.html)和SWISS-MODEL(http://swissmodel.expasy.org/)分别预测蛋白二、三级结构;运用Prot-Comp(http://linux1.softberry.com/berry.phtml?group=programs&subgroup=proloc&topic=protcomppl)预测蛋白亚细胞定位;利用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)进行多重序列比对;并以MEGA 7.0的邻接法(Neighbor-joining,NJ)构建系统发育进化树(Kumar et al.,2016),Bootstrap设为1000次。
1. 6 IKKβ基因表达模式分析
以qIKKβ-1s/qIKKβ-1a为引物,通过实时荧光定量PCR检测IKKβ基因在日本对虾各组织及哈维弧菌悬液刺激后的表达模式,在LightCycler@480 II(Roche)完成检测分析。实时荧光定量PCR反应体系25.0 μL:2×SYBR Real-time PCR Master Mix(TaKaRa)12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA模板(50 ng/μL)1.0 μL,RNase-free H2O 10.5 μL。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,进行40个循环。每个样品均设3个平行,以β-actin为内参基因,采用2-ΔΔCt法计算IKKβ基因相对表达量(Livak and Schmittgen,2001)。使用SPSS 19.0进行单因素方差分析(One-way ANOVA),以Excel 2020制图。
2 结果与分析
2. 1 PjIKKβ基因序列分析结果
基于转录组测序结果,经PCR扩增及测序验证,获得日本对虾IKKβ基因cDNA序列(命名为PjIKKβ)。PjIKKβ基因序列全长2794 bp,其中,ORF长2373 bp,5'端非翻译区(5'-UTR)长66 bp,3'端非翻译区(3'-UTR)长355 bp,共编码790个氨基酸残基。PjIKKβ蛋白理论分子量为89327.78 Da,理论等电点(pI)为7.56,总亲水性平均系数为-0.373,即该蛋白属于疏水性蛋白。PjIKKβ蛋白含有1个丝氨酸/苏氨酸蛋白激酶催化结构域(Serine/threonine protein kinases,catalytic domain,S-TKc)(位于第13~307位氨基酸处)、1个亮氨酸锌指结构域(Leucine zipper domain,LZ)(位于第438~492位氨基酸处)和1个螺旋—环—螺旋结构域(Helix loop helix domain,HLH)(位于第528~615位氨基酸处)(图1)。Prot-Comp预测结果表明,PjIKKβ蛋白定位于细胞质和细胞核中。PjIKKβ蛋白无跨膜结构,亦无信号肽。
SOPMA预测结果显示,PjIKKβ蛋白二级结构中α-螺旋占52.28%、β-折叠占4.18%、无规则卷曲占32.66%、延伸链占10.88%(图2)。以SWISS-MODEL对PjIKKβ蛋白三级结构进行预测,结果发现该蛋白三级结构与人类IKKβ蛋白的三级结构高度相似(图3),说明IKKβ在进化过程中非常保守。
2. 2 PjIKKβ与其他物种IKKβ的比对分析结果
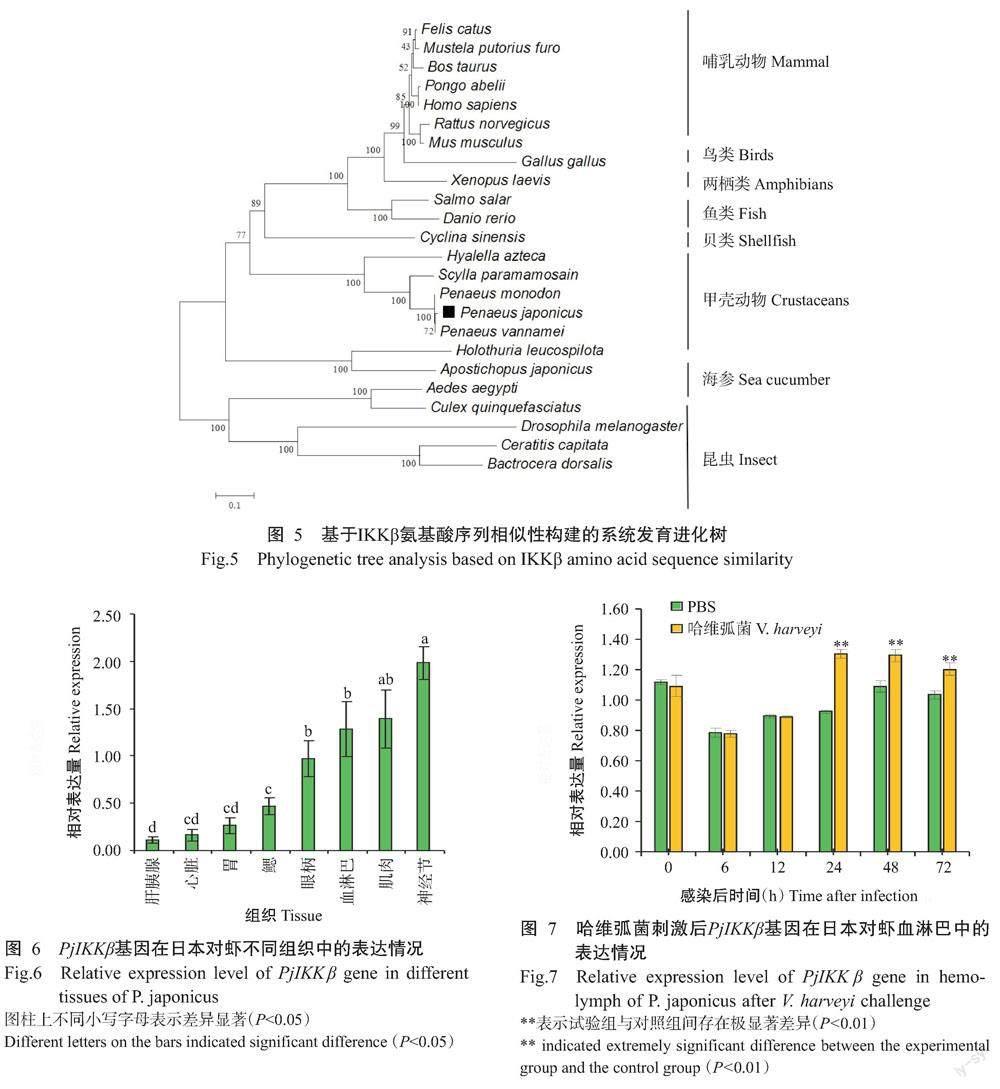
PjIKKβ氨基酸序列与其他物种IKKβ氨基酸序列进行比对,结果如表2所示。PjIKKβ与凡纳滨对虾IKKβ氨基酸序列相似性最高(98%),其次是与斑节对虾IKKβ氨基酸序列(97%),与斑马鱼、小鼠和黑腹果蝇等模式动物的IKKβ氨基酸序列相似性分别为34%、35%和22%。多序列比對分析结果显示,各物种IKKβ蛋白序列在S-TKc结构域的保守性较高,而在其他区域的保守性较低(图4)。基于IKKβ氨基酸序列相似性构建的系统发育进化树显示,同类物种聚为一支,如甲壳动物聚为一支,昆虫聚为一支,哺乳动物聚为一支;在甲壳动物分支中日本对虾先与凡纳滨对虾聚在一起,再与斑节对虾聚为一个分支(图5)。
2. 3 PjIKKβ基因在日本对虾不同组织中的表达情况
实时荧光定量PCR检测结果显示,PjIKKβ基因在日本对虾肝胰腺、肌肉、鳃、神经节、胃、心脏、血淋巴、眼柄等8个组织中均有表达(图6),以神经节、肌肉和血淋巴和眼柄中的相对表达量较高,显著高于在其他组织中的相对表达量(P<0.05,下同),而在胃、心脏和肝胰腺中的相对表达量较低。
2. 4 PjIKKβ基因在哈维弧菌刺激后的表达变化
采用实时荧光定量PCR检测不同注射时段(0、6、12、24、48和72 h)日本对虾血淋巴中的PjIKKβ基因表达变化,结果(图7)显示:与注射前(0 h)的PjIKKβ基因相对表达量相比,至注射后6和12 h试验组和对照组日本对虾血淋巴中的PjIKKβ基因相对表达量均呈下调趋势;但注射后24、48和72 h,PjIKKβ基因在试验组日本对虾血淋巴中的相对表达量上调,与对照组日本对虾血淋巴中的相对表达量存在极显著差异(P<0.01)。注射72 h后,PjIKKβ基因在试验组日本对虾血淋巴中的相对表达量略有降低。
3 讨论
本研究获得的日本对虾PjIKKβ基因序列全长2794 bp,其ORF长2373 bp,共编码790个氨基酸残基,较凡纳滨对虾和斑节对虾的IKKβ基因少编码1个氨基酸残基(Wang et al.,2013;Nhnhkorn et al.,2019)。PjIKKβ蛋白含有1个S-TKc 结构域、1个LZ结构域和1个HLH结构域,与其他甲壳动物、海参等无脊椎动物的IKKβ蛋白结构相同(Wang et al.,2013;Jiang et al.,2018;Nhnhkorn et al.,2019;Li et al.,2020),说明无脊椎动物IKKβ蛋白结构非常保守。这些结构域是组成IKK复合物及产生催化功能的主要结构(Hinz and Scheidereit,2014)。此外,PjIKKβ氨基酸序列与其他对虾的IKKβ氨基酸序列相似性高达97%~98%,与人类的IKKβ氨基酸序列相似性为34%,与黑腹果蝇的IKKβ氨基酸序列相似性最低(22%)。
为了解PjIKKβ基因在日本对虾机体中的生物学功能,本研究采用实时荧光定量PCR检测PjIKKβ基因在不同组织中的表达情况,结果表明,PjIKKβ基因在日本对虾肝胰腺、肌肉、鳃、神经节、胃、心脏、血淋巴和眼柄等8个组织中均有表达,与IKKβ基因在其他动物中的组织表达特性(Chen et al.,2011;Wang et al.,2013;Jiang et al.,2018;Nhnhkorn et al.,2019)一致,说明IKKβ基因在生物体内的功能具有多样性。IKKβ基因在凡纳滨对虾肌肉中的表达量远高于其他组织,其次为神经节(Wang et al.,2013);IKKβ基因在拟穴青蟹血淋巴、胃和心脏中的表达量较高(Jiang et al.,2018);IKKβ基因在斑节对虾血淋巴中的相对表达量最高(Nhnhkorn et al.,2019)。本研究结果表明,PjIKKβ基因在日本对虾的神经节、肌肉、血淋巴和眼柄中的相对表达量较高,显著高于在其他组织中的相对表达量,但至今鲜见有关IKK在水产动物肌肉和神经节方面的研究报道。在哺乳动物中,IKK通过NF-κB信号途径调控肌肉生长(Bakkar et al.,2008);在小鼠中依赖于IKK/NF-κB的神经胶质活化能诱导脊髓小胶质细胞活化及神经损伤后的神经性疼痛(Lim et al.,2017)。血淋巴是甲壳动物的重要免疫组织,通过机体的开放式循环系统流动于各组织间,参与机体的细胞免疫和体液免疫等先天免疫(Tassanakajon et al.,2013)。PjIKKβ基因在日本对虾血淋巴中高表达,说明其可能参与日本对虾的先天免疫。
本研究还分析哈维弧菌侵染日本对虾机体后PjIKKβ基因在血淋巴中的表达变化,结果显示,注射哈维弧菌后6和12 h,PjIKKβ基因在血淋巴中的相对表达量下调;至注射后24、48和72 h,注射哈维弧菌日本对虾血淋巴的PjIKKβ基因相对表达量极显著高于注射PBS日本对虾的相对表达量。在凡纳滨对虾中,注射溶藻弧菌后IKKβ基因在血淋巴中的相对表达量呈先下降后上升的波动变化趋势,但在各时间段的相对表达量均低于注射PBS的凡纳滨对虾(Wang et al.,2013)。在斑节对虾中,注射哈维弧菌后PjIKKβ基因在血淋巴中的相对表达量先呈下降趋势,注射24 h后开始上升,注射48 h的相对表达量明显高于注射前(0 h),但与注射PBS的斑节对虾相比无显著差异(Nhnhkorn et al.,2019)。可见,IKKβ基因参与了甲壳动物的先天免疫应答反应。
4 结论
PjIKKβ蛋白含有1个S-TKc 结构域、1个LZ结构域和1个HLH结构域,在进化过程中非常保守;PjIKKβ基因的组织表达特征及其在哈维弧菌刺激后的表达变化,进一步证实PjIKKβ基因参与了日本对虾的先天免疫应答反应。
參考文献:
蒋魁,徐力文,苏友禄,马红玲,刘广锋,郭志勋,高芳,冯娟. 2017. 两株珍珠龙趸病原性哈维弧菌(Vibrio harveyi)的分离与鉴定[J]. 生态科学,36(6):16-24. [Jiang K,Xu L W,Su Y L,Ma H L,Liu G F,Guo Z X,Gao F,Feng J. 2017. Isolation and identification of two pathogenetic Vibrio harveyi strains from pearl gentian[J]. Ecological Science,36(6):16-24.] doi:10.14108/j.cnki.1008-8873. 2017.06.003.
蒋魁,徐力文,苏友禄,王雨,郭志勋,许海东,高芳,冯娟. 2016. 2012年~2014年南海海水养殖鱼类病原菌哈维弧菌分离株的耐药性分析[J]. 南方水产科学,12(6):99-107. [Jiang K,Xu L W,Su Y L,Wang Y,Guo Z X,Xu H D,Gao F,Feng J. 2016. Analysis of antibiotic resistance spectrum of Vibrio harveyi strains isolated from maricultured fish in the South China Sea during 2012-2014[J]. South China Fisheries Science,12(6):99-107.] doi:10.3969/j.issn.2095-0780.2016.06.013.
农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会. 2021. 2020中国渔业统计年鉴[M]. 北京:中国农业出版社. [Fishery and Fishery Administration Bureau of the Ministry of Agriculture and Rural Affairs,National Fishery Technology Extension Station,China Aquatic Society. 2021. China fishery statistics yearbook 2020[M]. Beijing:China Agricultural Press.] doi:10.43455/y.cnki.yzytn.2021.000001.
Bakkar N,Wang J X,Ladner K J,Wang H T,Dahlman J M,Carathers M,Acharyya S,Rudnicki M A,Hollenbach A D,Guttridge D C. 2008. IKK/NF-kappaB regulates skeletal myogenesis via a signaling switch to inhibit differentiation and promote mitochondrial biogenesis[J]. Journal of Cell Biology,180(4):787-802. doi:10.1083/jcb.2007 07179.
Chen W J,Guo C J,Zhou Z C,Yuan L Q,Xiang Z M,Weng S P,Zhang Y F,Yu X Q,He J G. 2011. Molecular cloning of IKKβ from the mandarin fish Siniperca chuatsi and its up-regulation in cells by ISKNV infection[J]. Veterinary Immunology and Immunopathology,139(1):61-66. doi:10.1016/j.vetimm.2010.07.025.
Cowley J A. 2020. Mourilyan virus pathogenicity in kuruma shrimp (Penaeus japonicus)[J]. Journal of Fish Diseases,43(11):1401-1407. doi:10.1111/jfd.13244.
He L G,Zhao Y L,Tang L,Yu X,Ye Z F,Lin H R,Zhang Y,Li S S,Lu D Q. 2020. Molecular characterization and functional analysis of IKKα in orange-spotted grouper (Epinephelus coioides)[J]. Fish & Shellfish Immunology,101:159-167. doi:10.1016/j.fsi.2020.03.029.
Hinz M,Scheidereit C. 2014. The IκB kinase complex in NF-κB regulation and beyond[J]. EMBO Reports,15:46-61. doi:10.1002/embr.201337983.
Huang B Y,Zhang L L,Xu F,Tang X Y,Li L,Wang W,Liu M K,Zhang G F. 2019. Oyster versatile IKKα/βs are involved in toll-like receptor and RIG-I-like receptor signa-ling for innate immune response[J]. Frontiers in Immunology,10:1826. doi:10.3389/fimmu.2019.01826.
Ito M,Satoh J,Hano T,Mekata T,Ito K. 2021. Immune toxicity of phenanthrene and its combined effects of white spot syndrome virus on the survival of kuruma shrimp (Penaeus Japonicus)[J]. Ecotoxicology and Environmental Safety,208:111640. doi:10.1016/j.ecoenv.2020.111640.
Jiang M,Tu D D,Gu W B,Zhou Y L,Zhu Q H,Guo X L,Shu M A. 2018. Identification and functional analysis of inhibitor of NF-κB kinase (IKK) from Scylla paramamosain:The first evidence of three IKKs in crab species and their expression profiles under biotic and abiotic stresses[J]. Developmental & Comparative Immunology,84:199-212. doi:10.1016/j.dci.2018.02.014.
Kai X,Chellappa V,Donado C,Reyon D,Sekigami Y,Ataca D,Louissaint A,Mattoo H,Joung J K,Pillai S. 2014. IκB kinase β (IKBKB) mutations in lymphomas that constitutively activate canonical nuclear factor κB (NFκB) signaling[J]. Journal of Biological Chemistry,289(39):26960-26972. doi:10.1074/jbc.M114.598763.
Kumar S,Stecher G,Tamura K. 2016. MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,33(7):1870-1874. doi:10.1093/molbev/msw054.
Li H P,Wu X F,Chen T,Jiang X,Ren C H. 2020. Molecular characterization,inducible expression and functional ana-lysis of an IKKβ from the tropical sea cucumber Holothuria leucospilota[J]. Fish & Shellfish Immunology,104:622-632. doi:10.1016/j.fsi.2020.06.024.
Li L L,Liu W J,Fan N N,Li F S,Huang B Y,Liu Q,Wang X M,Zheng Y X,Sang X X,Dong J,Wang X N,Wei L,Liu Y Q,Zhang M W,Ma J L,Chen J W,Qi Y T,Wang X T. 2022. Scallop IKK1 responds to bacterial and virus-related pathogen stimulation and interacts with MyD88 adaptor of toll-like receptor pathway signaling[J]. Frontiers in Immunology,13:869845. doi:10.3389/fimmu.2022. 869845.
Lim H,Lee H,Noh K,Lee S J. 2017. IKK/NF-κB-dependent satellite glia activation induces spinal cord microglia activation and neuropathic pain after nerve injury[J]. Pain,158(9):1666-1677. doi:10.1097/j.pain.0000000000000959.
Livak K J,Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,25(4):402-408. doi:10.1006/meth.2001.1262.
Negi G,Sharma S S. 2015. Inhibition of IκB kinase (IKK) protects against peripheral nerve dysfunction of experimental diabetes[J]. Molecular Neurobiology,51(2):591-598. doi:10.1007/s12035-014-8784-8.
Nhnhkorn Z,Amparyup P,Kawai T,Tassanakajon A. 2019. Penaeus monodon IKKs participate in regulation of cytokine-like system and antiviral responses of innate immune system[J]. Frontiers in Immunology,10:1430. doi:10.3389/fimmu.2019.01430.
Oh H,Grinberg-Bleyer Y,Liao W,Maloney D,Wang P Z,Wu Z K,Wang J G,Bhatt D M,Heise N,Schmid R M,Hayden M S,Klein U,Rabadan R,Ghosh S. 2017. An NF-κB transcription-factor-dependent lineage-specific transcriptional program promotes regulatory T cell identity and function[J]. Immunity,47(3):450-465. doi:10.1016/j.immuni.2017.08.010.
Pomerantz J L,Baltimore D. 1999. NF-κB activation by a signaling complex containing TRAF2,TANK and TBK1,a novel IKK-related kinase[J]. The EMBO Journal,18(23):6694-6704. doi:10.1093/emboj/18.23.6694.
Rothwarf D M,Zandi E,Natoli G,Karin M. 1998. IKK-γ is an essential regulatory subunit of the IκB kinase complex[J]. Nature,395:297-300. doi:10.1038/26261.
Sun S C. 2011. Non-canonical NF-κB signaling pathway[J]. Cell Research,21:71-85. doi:10.1038/cr.2010.177.
Tassanakajon A,Somboonwiwat K,Supungul P,Tang S. 2013. Discovery of immune molecules and their crucial functions in shrimp immunity[J]. Fish & Shellfish Immunology,34(4):954-967. doi:10.1016/j.fsi.2012.09.021.
Wang P H,Gu Z H,Wan D H,Liu B D,Huang X D,Weng S P,Yu X Q,He J G. 2013. The shrimp IKK-NF-κB signa-ling pathway regulates antimicrobial peptide expression and may be subverted by white spot syndrome virus to facilitate viral gene expression[J]. Cellular & Molecular Immunology,10(5):423-436. doi:10.1038/cmi.2013.30.
Xu C,Li L C,Wang C Y,Jiang J Z,Li L,Zhu L H,Jin S,Jin Z H,Lee J J,Li G H,Yan G H. 2022. Effects of G-Rh2 on mast cell-mediated anaphylaxis via AKT-Nrf2/NF-κB and MAPK-Nrf2/NF-κB pathways[J]. Journal of Ginseng Research,46(4):550-560. doi:10.1016/j.jgr.2021. 10.001.
Zhao M M,Joy J,Zhou W Q,De S,Wood W H,Becker K G,Ji H K,Sen R J. 2018. Transcriptional outcomes and kinetic patterning of gene expression in response to NF-κB activation[J]. PLoS Biology,16(9):e2006347. doi:10. 1371/journal.pbio.2006347.
(责任编辑 兰宗宝)
收稿日期:2022-08-03
基金项目:国家自然科学基金项目(31872571);广州市科技计划项目(202206010138);广州市农村科技特派员项目(20212100051)
通讯作者:文菁(1982-),https://orcid.org/0000-0001-8169-7740,博士,教授,主要从事海洋生物学研究工作,E-mail:jw82123@126.com
第一作者:范嗣刚(1982-),https://orcid.org/0000-0002-4265-4964,博士,副研究員,主要从事海洋生物学研究工作,E-mail:fansigang @cscfri.ac.cn

