水体叶绿素a和硅藻群落时空分布及影响因子的对比分析
——以云贵高原异龙湖为例*
周 起,陈光杰,李 蕊,陈小林,张 涛,韩桥花,王 露
(云南师范大学地理学部,云南省高原地理过程与环境变化重点实验室,昆明 650500)
藻类是湖泊重要的初级生产者,具有种属多样性高和功能性状差异明显等特征,浮游植物生物量(常用叶绿素a指代)、群落结构变化成为评价内陆水体环境参数的主要参数指标[1-2]。硅藻是藻类的一个重要门类[3]且生长周期短[4],其物种组成对水体环境(如营养水平、水温、水深)的变化十分敏感[5],因此硅藻群落指标被广泛用于指示湖泊水体的环境特征及其变化模式。在影响藻类分布的环境梯度中,水体温度直接影响了藻类细胞的生长速率、新陈代谢等关键过程[6],硅藻在相对低温(12~16℃)的环境条件下比其他浮游植物更具竞争优势[7]。在营养盐和光照充足的条件下,温度成为浮游植物生物量变化的主要环境因子[8]。营养水平也是驱动藻类时空分布的重要因子,营养盐浓度的变化会影响浮游植物群落组成[9],并促进藻类生物量明显上升[10]。在湖泊的营养水平较低时硅藻和绿藻等藻类通常占优,而营养水平的持续增加会引起蓝藻水华[11]。类似地,在硅藻生物量较高时湖泊叶绿素a一般处于较低水平,而蓝藻生物量较高时叶绿素a水平会出现明显上升[12]。同时,营养盐浓度对硅藻群落构成至关重要,且不同属种对营养水平最适浓度具有差异性[13-14]。
在浅水湖泊中,水位和水动力条件的波动会显著影响藻类的生长与分布。浮游植物生物量的最大值通常在表层水下10 m[15],随着水深的增加,湖泊水温和水下光照条件的改变影响浮游植物的生长,水深大于10 m后浮游植物生物量逐渐降低[16]。水位的变化改变了硅藻群落生境,导致硅藻浮游种和底栖种之间的快速演替和群落组成变化[17]。水动力条件会直接改变水体的混合强度,从而影响藻类生物量和硅藻群落结构。对太湖和鄱阳湖研究发现,相对较为封闭、水体扰动较弱的太湖蓝藻暴发较为严重,而同处长江流域的鄱阳湖水动力较强,藻类以硅藻为主,不易形成水华[18-19]。如壳体硅质含量高的直链藻属(Aulacoseira),在较强的水动力条件和较多的溶解性硅酸盐环境中具有竞争优势,在水体混合作用强烈时(如浅水湖泊中)有利于直链藻的生长[20]。
云南地区开展了大量湖泊藻类的研究工作,呈现了藻类分布受营养盐和水文气候梯度差异性影响的时空特征。已有研究表明,营养盐梯度是驱动高原湖泊浮游植物群落现代分布的重要环境因子[21-22]。空间调查发现,云南地区的湖泊浮游植物生物量和群落结构在区域空间上差异显著,营养盐和温度的梯度变化是主要驱动因子[23],而逐月调查显示水温和营养盐梯度均是导致浮游植物季节和空间差异的重要因子[24]。同时,典型高原湖泊中硅藻群落结构也存在较强的空间差异和季节波动[25]。区域尺度上,受人类活动影响较弱的高山湖泊中硅藻群落以贫营养的底栖种为主且物种多样性较高,水温和营养盐是影响物种组成的主要因子[26];在受人类活动直接影响的高原湖泊中,硅藻群落以耐中富营养的物种为主且生物多样性较低,水体营养水平已成为硅藻群落构建的关键因子[27]。目前高原浅水湖泊的富营养化问题日益突出,藻类演替呈现加速变化的趋势。与抚仙湖等深水型湖泊相比,滇池等湖泊较高的营养水平导致了硅藻群落结构和优势物种出现了显著变化[28]。异龙湖长期监测数据和沉积物记录的对比分析表明[29],近几十年来水体富营养化是影响藻类生物量长期变化的重要因子,而硅藻群落演替的主要驱动因子从营养水平驱动转变为水文气候驱动为主。因此,开展藻类分布现代调查与生态环境评价需要充分考虑高原浅水湖泊生态过程的空间差异与季节波动特征。
异龙湖作为西南地区典型富营养化浅水湖泊,由于人类活动的强烈影响,自20世纪末以来,异龙湖水质逐渐恶化[30-31]。根据云南省生态环境厅发布的《云南省2021年环境状况公报》,异龙湖是云南九大高原湖泊中水质唯一处于劣Ⅴ类的湖泊,在此背景下,对异龙湖富营养化和水质治理研究尤为重要。对异龙湖现代调查研究多集中在湖泊富营养化、水生植物和浮游植物群落结构的变化等领域,对藻类生物量和硅藻群落的时空变化及驱动因子的研究较少[31-33]。本研究以异龙湖为调查对象,拟对比分析藻类生产力与群落结构分布的时空特征及其影响因子,诊断浅水湖泊中不同藻类指标指示环境梯度的相似性水平(如生物量和群落结构指标)和调查尺度的依赖性程度(如季节和空间尺度上的一致性)。本研究于2020-2021年对异龙湖开展了四个季节的湖沼学空间调查和藻类指标对比分析,在识别水体Chl.a浓度与硅藻群落组成的空间特征、演替模式及其驱动因子基础上,甄别了初级生产力和硅藻群落分布均指示相似的环境梯度但时空尺度上的差异性特征显著。异龙湖作为典型的高原断陷溶蚀湖泊,本研究可为应用藻类不同指标开展此类型湖泊的生态环境评价提供指标基础与科学依据。
1 材料与方法
1.1 研究区概况
异龙湖位于云南省东南部,是云南省九大高原湖泊之一且为断陷溶蚀湖泊。流域面积为411.52 km2(图1),主要的入湖河流有3条(分别为城河、城北河和城南河),均分布在西岸且流经石屏县城,由湖盆东侧新街海河流出。湖盆分布呈西北-东南向轴线的形态,东西距离长、南北距离较短。近几十年来湖泊面积总体缩小且波动显著,如从1987年的43.21 km2缩减至2017年的15.92 km2(湖面高程为1414 m)。气象监测资料显示,1981-2010年的月平均降雨和温度分别为(76.95±56.51) mm和(18.13±4.16)℃;旱雨季分明,每年5-10月为雨季,月平均降水量达到(122.45±42.03) mm,而旱季降水量仅为(31.45±17.06) mm。基于Landsat TM/OLI遥感影像的流域土地利用二级分类结果显示(图1),2020年异龙湖流域的土地利用类型以林地(32.88%)、耕地(28.2%)和建设用地(13.09%)为主[34]。

图1 异龙湖流域土地利用覆被、入湖河流、湖泊水深及采样点分布Fig.1 Catchment land use, inflow rivers water depth and sampling sites of Lake Yilong
1.2 湖泊采样与样品处理

水体硅藻定性样品采用22 μm浮游生物网获取,加3 mL无水乙醇试剂后带回实验室进行样品处理。将硅藻样品摇匀倒入烧杯,缓慢加入10% HCl,置于60℃水浴锅中直至不再产生气泡以去除碳酸盐,其次将水浴锅调至80℃水浴4 h,期间多次适量加入30%双氧水(H2O2)以去除硅藻细胞壁上的有机质,直至不再有气泡产生。样品水浴结束后,用离心机1200 r/min的转速离心样品4 min,每次离心完用一次性滴管将上清液吸出后加入蒸馏水,重复4次[35]。将处理后的样品滴至盖玻片上,使之自然干燥后用Naphrax树胶制片。 硅藻属种的鉴定主要参照欧洲硅藻分类系统等[36-37],在Leica(DM2500)显微镜(1000倍,油镜)下进行硅藻属种鉴定。每个壳体记作一个,每个样品至少400个壳体,用硅藻每个种的个数除以总数计算相对丰度(%)用于数据分析。
1.3 数据分析与统计方法

2 结果与分析
2.1 异龙湖主要水环境因子的季节变化
异龙湖采样点平均水深为(2.31±1.1) m,4个季节的水深波动显著但均<5 m。水体环境因子的季节变化显示(图2),水温((22.95±3.97)℃)呈现明显的旱、雨季差异,雨季((26.62±0.71)℃)显著高于旱季((19.28±1.95)℃)。水体透明度较低((18.78±8.54)cm),季节差异显著,旱季((25.99±5.79)cm)高于雨季((11.58±2.77)cm)。
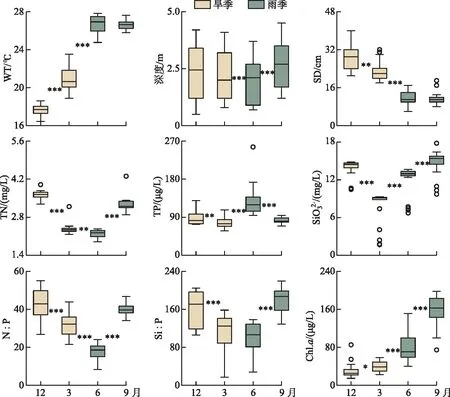
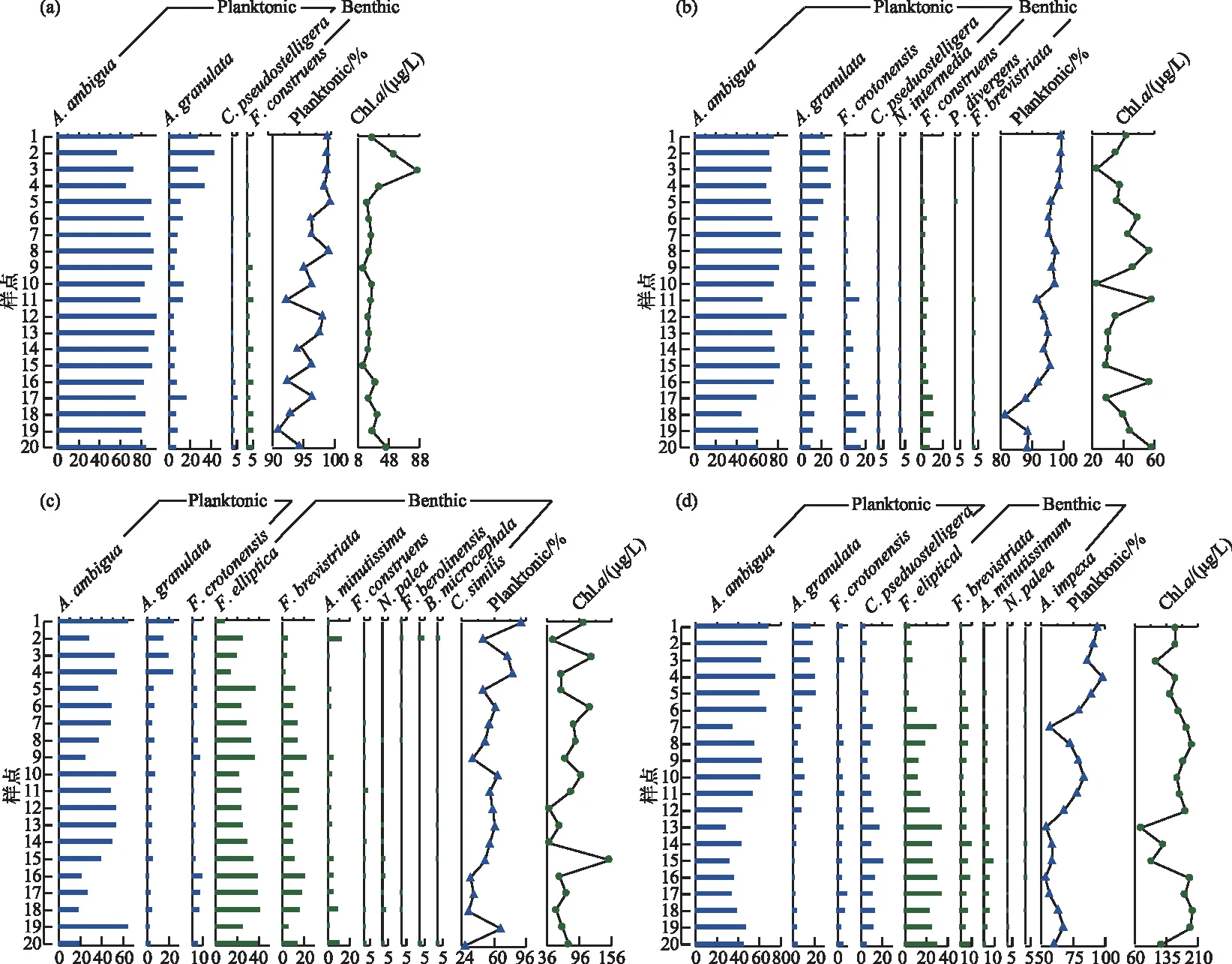
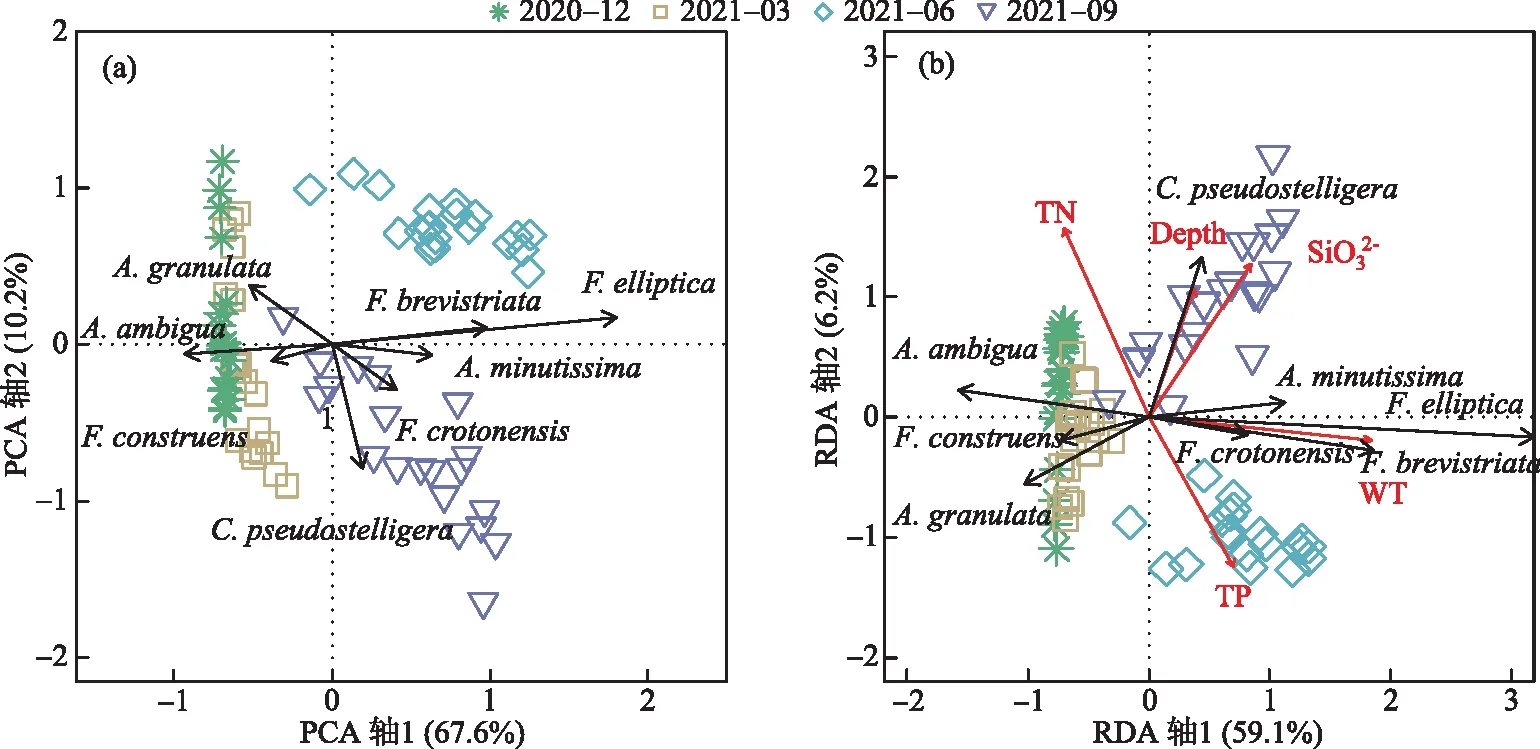
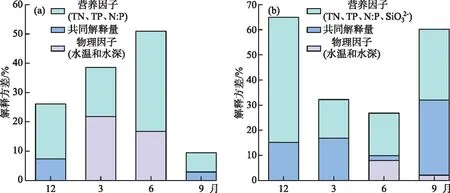
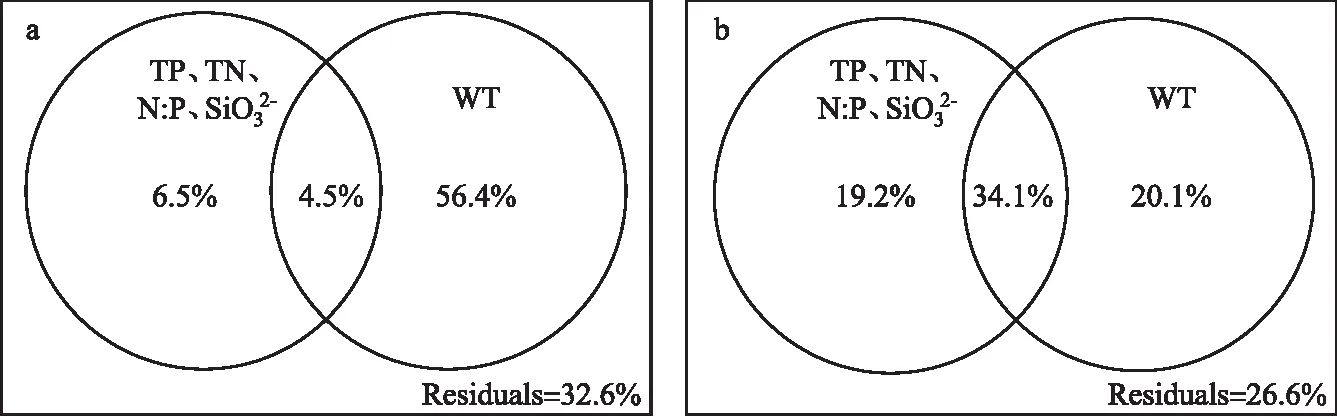
图2 异龙湖20个样点湖沼学特征的季节变化(*0.01 水体Chl.a浓度((76.15±55.68) μg/L)呈现规律性的旱雨季变化,且季节间差异显著(图2)。其中,水体Chl.a浓度在雨季((117.28±50.93) μg/L)显著高于旱季((35.03±14.72) μg/L);水体Chl.a浓度在2020年12月-2021年9月期间呈上升趋势,2020年12月浓度最低(为14.82 μg/L),2021年9月浓度最高(为197.92 μg/L),Chl.a浓度空间差异显著(图2~3),雨季空间差异(标准差=50.93 μg/L)显著高于旱季(标准差=14.72 μg/L)。 本研究采集的80个样品共鉴定出硅藻21属68种,硅藻群落主要以浮游硅藻(79.33%±20.69%)为主(图3)。膜糊直链藻(61.62%±20.26%)为主要优势种,颗粒直链藻(10.83%±8.46%)为次优势种,而在2021年6月和9月底栖硅藻种显著增加并成为次优势属种(36.77%±17.88%)。 图3 异龙湖20个样点水体硅藻常见物种(相对丰度>1%)组成和Chl.a浓度的季节变化特征(a:2020年12月,b:2021年3月,c:2021年6月,d:2021年9月。硅藻物种简称及属种名(按代码字母顺序排列):A. impexa-Achnanthes impexa, 极细微曲壳藻A. minutissima-Achnanthes minutissima, 膜糊直链藻A. ambigua-Aulacoseira ambigua, 颗粒直链藻A. granulata-Aulacoseira granulata, B. microcephala-Brachysira microcephala, 假具星小环藻C. pseudostelligera-Cyclotella pseudostelligera, 相似桥弯藻C. similis-Cymbella similis, F. berolinensis-Fragilaria berolinensis, 短纹脆杆藻F. brevistriata-Fragilaria brevistriata, 克罗脆杆藻F. crotonensis-Fragilaria crotonensis, 连结脆杆藻F. construens-Fragilaria construens, 椭圆脆杆藻F. elliptica-Fragilaria elliptica, N. intermedia-Nitzschia intermedia, 谷皮菱形藻N. palea-Nitzschia palea, 分歧羽纹藻P. divergens-Pinnularia divergens)Fig.3 Seasonal variations of common diatom species (relative abundance >1%) and Chl.a concentration in 20 sites of Lake Yilong 为了进一步探讨异龙湖硅藻群落结构的空间差异,对西部湖区和中东部湖区每月的硅藻群落结构数据进行ANOSIM差异性分析。2020年12月(r=0.97,P=0.001)、2021年3月(r=0.3,P=0.048)、6月(r=0.57,P=0.001)、9月(r=0.51,P=0.002)的P值均小于0.05,表明异龙湖西部湖区与中东部湖区的硅藻群落结构在这4个月呈现显著相异性(P<0.05)。 2020年12月(图3),硅藻群落结构中大于1%的硅藻种只有4个(为4个月份的最低值),主要以膜糊直链藻(81.8%±9.69%)和颗粒直链藻(13.37%±10.87%)为优势种;两个物种在西部湖区(66.34%±7.17%和32.84%±7.37%)与中东部湖区(85.67%±5.38%和8.5%±3.55%)存在显著差异。2021年3月,大于1%硅藻种数量增加,膜糊直链藻(72.29%±10.1%)和颗粒直链藻(14.19%±7%)仍为优势种,两个物种的相对丰度西部湖区(72.44%±2.95%和25.6%±2.75%)与中东部湖区(72.25%±11.29%和11.34%±4.16%)同样存在显著差异。2021年6月,底栖椭圆脆杆藻(27.76%±9.1%)与短纹脆杆藻(11.39%±5.87%)相对丰度总体增加,膜糊直链藻(41.87%±14.92%)和颗粒直链藻(7.74%±7.13%)相对丰度下降,4个优势种空间差异依旧显著,呈现西部湖区浮游种相对丰度较高(浮游百分比73.35%±18.35%)、中东部湖区底栖种相对丰度较高(底栖百分比50.45%±12.64%)的差异模式。2021年9月,膜糊直链藻(50.53%±14.1%)相对丰度有所增加,浮游种在西部湖区(浮游百分比92.13%±5.05%)与中东部湖区(浮游百分比67.16%±11.53%)之间的空间异质性进一步增强。 应用主成分分析(PCA),识别了水体硅藻群落结构的主要变化方向和时空特征(图4a)。零模型检验结果显示显著的PCA主轴有1个,其中主轴1和主轴2分别解释了硅藻群落结构变化的67.6%和10.2%。异龙湖硅藻群落组合的季节变化主要沿着主轴1方向演替,反映了硅藻群落变化的季节特征明显。季节尺度上,异龙湖硅藻群落变化还表现为浮游种和底栖种之间的演替;主要表现为浮游种(膜糊直链藻和颗粒直链藻)向底栖种(椭圆脆杆藻、短纹脆杆藻和极细微曲壳藻)的演替特征。基于线性响应模式的冗余分析(RDA),进一步识别了影响硅藻群落组合变化的主要环境因子(图4b)。RDA主轴1解释了硅藻群落结构变化的59.1%,主轴1的正半轴与WT的梯度变化相关;主轴2解释了6.2%,主要反映了营养盐浓度的波动对硅藻群落构建的影响。 图4 异龙湖20个样点的水体硅藻群落时空变化PCA三序图(a)及其与显著环境变量关系的RDA分析三序图(b)Fig.4 PCA (a) and RDA (b) triplots showing the spatio-temporal distribution of diatom assemblages and key environmental variables in 20 sites of Lake Yilong 图5 水体Chl.a、硅藻群落PCA主轴1和浮游硅藻百分比分别与主要环境因子的相关性分析Fig.5 Pearson correlation analysis showing the relationship of lake-water Chl.a, diatom PCA axis 1 and percentage of planktonic diatoms with significant environmental factors 图6 影响异龙湖4个季节中藻类生物量(a)和硅藻群落(b)空间变化的环境因子方差分解分析Fig.6 Summary of variance partitioning showing the impact of key environmental factors affecting the spatial variation of algae biomass (a) and diatom community (b) in Lake Yilong across four seasons 表1 异龙湖时空尺度上水体叶绿素a、硅藻群落PCA主轴1和浮游硅藻占比的环境因子多元回归模型Tab.1 Multiple regression models showing key environmental drivers for algae biomass, diatom community PCA axis 1 and percentage of planktonic diatoms, respectively 对异龙湖Chl.a浓度和硅藻群落全年变化开展相同环境梯度下的方差分解分析,以识别水温和营养盐对Chl.a浓度和硅藻群落时空变化的驱动强度(图7)。结果表明,异龙湖水环境因子对Chl.a和硅藻群落的季节波动影响显著,解释量均超过65%。其中水温对Chl.a和硅藻群落均有显著影响,水温对Chl.a季节变化的独立解释量(56.4%)显著高于营养盐(6.5%),而水温对硅藻群落季节变化的独立解释量(20.1%)与营养盐(19.2%)接近。 图7 影响异龙湖藻类生物量(a)和硅藻群落(b)时空变化的环境因子方差分解分析Fig.7 Summary of variance partitioning showing the impact of key environmental factors affecting the season variation of algae biomass (a) and diatom community (b) in Lake Yilong 对异龙湖水体Chl.a浓度和硅藻群落指标的时空模式与驱动因子分析发现,藻类生产力和群落结构存在明显的空间差异和季节波动,其影响因子及其驱动强度在空间尺度上具有较高的一致性但存在显著的季节差异。在空间分布上,营养水平是影响Chl.a(19.08%±11.4%)和硅藻群落(27.55%±15.83%)变化的重要环境因子。不同季节的对比分析表明,营养水平在12月和9月期间对硅藻群落空间分布的独立解释能力显著上升,而对Chl.a的独立驱动作用则在6月最强(均大于25%)。在季节波动上,水温是影响Chl.a(56.4%)和硅藻群落(20.1%)变化的重要驱动力;同时,营养水平对硅藻群落(19.2%)的独立解释量更高。在藻类分布的时空模式上,水温是独立影响初级生产力水平的主要因子,而硅藻群落的构建则受到营养水平、水温及其相互作用的共同影响。 人类活动的持续增强导致了大量水体营养水平的迅速上升,营养盐已成为影响湖泊浮游植物群落结构和生物量的重要驱动因子。外源营养盐的持续富集可以导致浅水湖泊生物群落和生态系统结构的变化[39],甚至出现以水生植物为主的清水态向以藻类为主的浊水态的突变[40]。自20世纪50年代以来异龙湖外源输入的营养盐持续富集,已成为驱动水体Chl.a浓度和硅藻群落变化的长期影响因子[29]。现代调查结果显示,近30年来异龙湖的水生植物覆盖度持续降低,于2009年由草型湖泊转变为藻型湖泊[33,41]。同时,异龙湖浮游植物群落结构出现了显著变化,1957-1997年期间藻类组成由以硅藻占优转变为以蓝藻为主[1]。本次调查显示,异龙湖水环境特征表现为高营养水平且呈现显著的季节变化,4个季节综合营养指数TSI[38]均高于70,表明该浅水湖泊全年处于重富营养水平且以藻类为主的浊水状态。 氮磷营养元素是控制浮游植物生长的重要环境因子。长江中游湖泊调查结果发现,氮磷营养元素的升高显著促进了洪湖、斧头湖、梁子湖等湖泊Chl.a浓度的升高[42]。云南高原湖泊的研究中,氮磷营养元素的变化显著影响了湖泊浮游植物的空间分布和生物量变化[2,43]。其中异龙湖、滇池、星云湖、大屯海和长桥海等以蓝藻为主的湖泊中,浮游植物分布显著受TN浓度的影响[2]。异龙湖的逐月调查表明,水体营养元素呈东高西低的分布模式,是导致浮游植物密度空间差异的重要因素[32],与本研究中氮磷营养元素(19.08%±11.4%)影响水体Chl.a浓度空间差异的驱动模式类似。 水温的季节变化是驱动湖泊浮游植物群落和生物量季节演替的重要因子。在营养水平较高的水体中,水温成为驱动浮游植物生物量季节变化的主要环境因子,部分富营养浅水湖泊中(太湖、大屯海等)浮游植物生物量的变化显著受水温的影响[21,44]。研究表明,随着温度的上升,浮游植物的代谢活动增强、生物量迅速增加[45-46]。与已有研究结果相似,本次季节调查结果表明水温是影响异龙湖Chl.a浓度季节变化的主要环境因子(56.4%)。 异龙湖的结果表明,水体水温和水动力条件也是影响硅藻群落空间分布和季节演替的重要因素。多元回归结果显示,水温和水深的变化对异龙湖硅藻群落的季节波动产生了显著影响,且与浮游硅藻变化呈显著负相关(图5,表1)。水温的变化会导致湖泊水体稳定性的增强,影响硅藻对光照以及营养盐等资源的可获得性,进而影响硅藻群落结构的时空变化[56-57]。小型的小环藻(Cyclotella)在水动力稳定时期更具有生长优势(如较高的生长速率),温度升高导致藻类生长期延长和水体热力分层的增强,直链藻等硅藻优势种属逐渐被小环藻等小型硅藻所替代[20]。浮游硅藻在敞水区占比较高[58],异龙湖作为浅水湖泊(<5 m),硅藻群落以重硅质浮游种直链藻(72.5%±23.99%)占优,水深增加会导致湖泊受到水流扰动的强度减弱[59],不利于重硅质浮游硅藻的生长。 水温对异龙湖Chl.a浓度和硅藻群落的季节变化均有显著影响,但对两者的独立作用上存在较大差异。云南地区已有研究表明,水温与浮游植物生物量的变化显著相关[1,21],且对硅藻群落结构的季节演替产生显著影响[25,65]。在富营养化的浅水湖泊中,水温的增加可以明显促进内源污染物的释放从而影响藻类的生成及其分布模式[66-67]。浅水湖泊的水温波动对硅藻群落季节演替的驱动强度较深水湖泊更为显著的特征[58]。浅水湖泊太湖的研究表明,水温是导致浮游植物生物量季节变化的主要因子,硅藻群落结构的季节变化受到水温等物理因子和营养盐的共同驱动[44,54]。本研究结果显示,水温的季节波动显著影响了异龙湖Chl.a浓度和硅藻群落的季节变化,并且对Chl.a浓度的季节变化驱动作用更强(图7),出现了与太湖等富营养浅水湖泊相似的驱动模式[44,54]。由此可见,大型浅水富营养化湖泊水环境因子具有空间和季节异质性,需要结合藻类的多指标调查对湖泊的水环境质量与生态健康开展科学评价。 对异龙湖水体藻类指标的空间和季节调查显示,藻类生物量和硅藻群落结构存在显著空间差异和季节波动。影响异龙湖水体藻类生物量和硅藻群落结构时空变化的环境因素主要包括物理因子(水温、水深)和营养盐,其中营养盐是驱动水体藻类生物量和硅藻群落结构空间变化的主要环境因子;水温对藻类的季节演替具有重要驱动作用。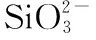
2.2 水体叶绿素a和硅藻群落结构的空间变化
2.3 水体叶绿素a和硅藻群落时空变化的影响因子识别


2.4 水体叶绿素a和硅藻群落时空变化的驱动强度识别
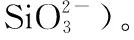
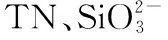

3 讨论
3.1 叶绿素a时空变化特征驱动因子识别
3.2 硅藻群落结构变化的时空模式驱动因子识别
3.3 叶绿素a和硅藻群落结构指示湖泊环境变化的对比分析
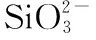
4 结论

