青藏高原水体碳源汇过程的重新认知与挑战*
高 扬,罗 飚,沈 迪,贾珺杰,陆 瑶,2,王朔月,2
(1:中国科学院地理科学与资源研究所,生态系统网络观测与模拟重点实验室,北京 100101)(2:中国科学院大学资源与环境学院,北京 100049)(3:中国石油天然气集团有限公司大港油田分公司第三采油厂,沧州 061023)(4:兰州大学资源与环境学院,兰州 730000)
二氧化碳(CO2)在陆-水界面、水-气界面和水-底泥界面通过无机碳(IC)库转化过程、有机碳(OC)库转化过程、无机与有机碳库之间的转化过程进行碳的固定和释放[1]。CO2从内陆水体转化到大气中,即所谓的“碳逃逸”,是全球碳循环的一部分[2],全球每年CO2逃逸量约为2.3 Pg C[3],其中15%来自于内陆湖泊和水库,85%来自河流。因此,内陆水体在全球碳收支和碳循环中都发挥着关键作用[4-5]。内陆水体的浮游植物和水生植物、异养生物以及微生物等固碳潜力巨大[6],它们主要通过IC与OC库转化、有机质的降解和碳的吸收或埋藏进行固碳[6-7]。此外,岩石矿物的化学风化长期以来一直被认为是去除大气中CO2的关键机制,在岩石化学风化过程中,流域通过水岩反应吸收大气CO2,产生流域碳汇作用,从而降低大气中CO2[8-9],但目前对定量理解化学风化如何响应侵蚀过程及其对全球碳循环的影响仍然有限。
近年来,随着全球变化的加剧,各环境要素通过影响水体的生物-物理-化学过程不断影响着内陆水体的碳交换过程[6]。例如,光照、温度、养分和金属改变水体生物的光合和呼吸过程[10-12],进而影响水-气之间的CO2交换以及水体碳源汇特征。降水量会通过对土壤的淋溶作用影响湖泊有机碳积累,进而影响湖泊沉积物对碳的固定。pH[13]和氧化还原电位[14]能够改变水体的物理化学环境进而调节水体碳酸盐体系,从而决定CO2的产生释放[15]。风速[16]和温度[17]也会通过控制气体传递速率和水中气体溶解度的变化驱动着水-气界面的CO2溶解和扩散过程。因此,准确定量水体碳收支是深入理解陆地生态系统碳循环和实现碳中和的重要前提。
青藏高原湖泊总面积达到42521 km2,占到全国湖泊总面积的57%,湖泊不仅在时间和空间上存在着剧烈的变化,而且自然地理环境也差异巨大;青藏高原湖泊跨越1000~6000 m海拔高度,其中4000~5000和5000~6000 m海拔高度范围内的湖泊数量分别为840和158个,合计占比达到88.5%[18]。青藏高原由于其独特的高寒气候,形成了以淡水、咸水和盐湖为主的较为原始和多样化的湖泊,不同类型的水体导致内陆水体碳交换量估算存在很大的不确定性[19-20]。例如,全球盐湖二氧化碳年排放量为0.11~0.15 Pg C/a,约占全球湖泊的39%~47%[21]。然而,青藏高原的盐湖作为碳汇,每年吸收了(10.28±1.65) Tg C的CO2[22]。此外,由于水生生物的代谢作用而产生的CO2,以及水体中有机碳经过分解与矿化形成无机碳脱气致使淡水湖成为已知的CO2逃逸到大气中的主要管道[21]。因此,本文旨在厘清全球变化下内陆水体的碳源汇过程及其驱动机制,重新认知青藏高原碳源汇功能与未来研究的挑战,为如何应对全球变化下青藏高原水体在碳中和过程中的作用提供重要科学依据。
1 青藏高原水体碳侵蚀与碳沉积特征
1.1 风化、侵蚀与CO2消耗
侵蚀过程中的化学作用主要表现为岩石的化学风化,而化学风化作用主要包括溶解、水解、水化、碳酸盐化、氧化和生物化学风化作用。根据风化和侵蚀作用的强度和性质,物理风化和化学风化所起的作用不同,化学风化的基本反应也有差别,使得形成地表物质的组成也不相同。侵蚀过程通过硅酸盐风化从土壤中调动陆地植被的OC,将其转移到河流和沉积物中,从而降低大气CO2;同时通过氧化含有机碳或硫化物的岩矿物也可释放CO2(图1)。侵蚀、风化和碳循环之间耦合的前提是硅酸盐矿物和碳酸的反应,了解风化作用对碳中和的影响需要区分硅酸盐风化作用和碳酸盐风化作用(图1)。硅酸盐矿物风化过程中吸收的大气-水体中的CO2,通过河流进入海洋后部分以碳酸盐的形式沉积(生物或化学沉积),被称为永久性无机碳汇(substantial inorganic carbon sink);碳酸盐风化吸收的CO2,通过河流进入水体后全部释放,被称为非永久性碳汇(insubstantial inorganic carbon sink)[23]。
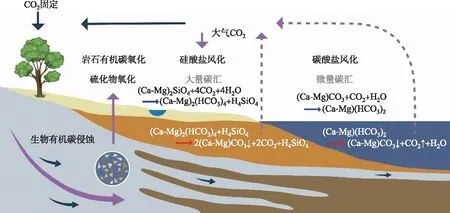
图1 风化侵蚀的碳源汇过程(紫色实心箭头代表风化和侵蚀碳过程,紫色虚线箭头代表风化作用产生的CO2流向)Fig.1 Carbon source and sink processes of weathering erosion (The solid purple arrows represent weathering and erosion carbon processes, and the dashed purple arrows represent the flow of CO2 from weathering)
在岩石风化过程中,如温度、降水和生物生产力等都会影响CO2通量[24-25]。适宜的温度是岩石风化的重要因素,温度过低不利于岩石风化,过高的温度使CO2更容易从水中析出。温度变化还会改变生物光合作用及活性,水生光合生物利用水体溶解无机碳形成有机碳的稳定碳汇,并在地表水和地下水中实现碳循环交换,即形成了生物光合作用和碳酸盐风化耦合的岩溶动力系统,进而影响岩溶碳汇[26]。径流量也是影响流域碳汇量的直接因素,径流量越大,岩石风化速率越大,从而形成的岩溶碳汇量越大[27]。此外,近年来由于大气沉降(酸雨),硫化物氧化而形成的硫酸会对碳酸盐进行溶解,进而也会形成一部分的碳,因此外源酸在岩石风化溶解中也发挥了极大的作用[28]。
在全球尺度上,相比于通过硅酸盐风化的固碳速率,物理侵蚀速率更能剧烈影响生物圈POC在水域沉积物中的埋藏速率[29]。成岩OC通过河流输出与沉积物输出紧密相连,通过快速沉积并转移到河流系统中得以有效保存[30]。目前,大多数与侵蚀相关的净CO2收支模型中,没有考虑OC埋藏和氧化风化作用,这限制了定量预测由气候和构造运动导致的POC通量变化[9]。物理剥蚀速率和硅酸盐风化通量取决于侵蚀物质供应和化学反应速度,而碳酸盐风化与硅酸盐风化形成的溶质比例通常随侵蚀率而增加[31]。在低侵蚀率下,风化产物积聚在土壤中,保护下伏岩石免受与地表流体的相互作用,导致“供应有限”的风化[32-33]。在供应有限的条件下,随着侵蚀率的增加,风化和侵蚀呈线性扩展,暴露出更多的地表物质参与反应[34]。相反,在较高的侵蚀率下,矿物的供应速度与它们的反应速度不同,通量被“风化限制”(也被称为“动力学限制”)并由其他因素控制,如CO2浓度、流体流速和温度[35]。尽管侵蚀率与总风化通量之间存在明显的线性关系,但这种关系可能并不反映对长期CO2下降的侵蚀控制[36]。
青藏高原是世界上独一无二的地域生态单元,在全球地球化学循环中发挥着重要的作用。其地质历史年轻,新构造运动活跃。新生代以来印度板块与亚洲板块碰撞造成青藏高原不断隆升[37],地势的不断隆升使高原地貌遭受强烈的内、外营利作用,地表处于不断的侵蚀、搬运和堆积过程中,大量岩石裸露加速了岩石化学风化过程与对大气CO2的消耗[38]。在岩石化学风化过程中,流域通过水岩反应吸收大气CO2,产生流域碳汇作用。在青藏高原地区,主要以硅酸盐与碳酸盐为主参与了流域的岩石风化作用。有研究显示青藏高原拉萨河流域碳酸盐风化速率为21.6~33.6 t/(km2·a),硅酸盐风化速率为3.61~6.62 t/(km2·a),对应的CO2净消耗通量分别为88.9×103和118×103mol/(km2·a)[39]。尼洋河硅酸盐与碳酸盐的岩石风华速率分别为4.46和41.50 t/(km2·a),CO2净消耗通量分别为92×103和350×103mol/(km2·a)[40]。此外,还有研究结果表明青藏高原南部的雅鲁藏布江流域全年岩石风化速率为42.03 t/(km2·a),流域岩石风化CO2消耗速率平均为407.13×103mol/(km2·a)[41],而在全世界范围内,非喀斯特流域的平均CO2吸收通量约为158.89×103mol/(km2·a)[42],因此,青藏高原的CO2消耗速率是高于世界河流的平均水平,青藏高原强烈的侵蚀作用对地球系统吸收和平衡CO2浓度起着重要的调控作用,进而影响着全球气候以及生态系统的变化。
1.2 沉积储碳
水体中的碳通过溶解泵和生物泵等过程导致的有机碳由水体表层向深层乃至水底的转移,将一部分碳封存在水底沉积物中长期不参与大气CO2循环, 起到“沉积物储碳”的作用[43-44]。对于许多水坝河流系统来说,持续的富营养化正在驱使水库趋向于自养,因为营养物质浓度的增加使得浮游生物群落的光合作用超过了呼吸作用,这种生产力变化的结果是增加了埋藏在沉积物中的碳[45]。内陆水体的沉积碳由无机碳和有机碳两部分组成,既有内源如湖泊内的浮游生物和大型水生植物等,也有外源如径流携带的陆源碎屑和土壤有机碳,一般可分为藻类、草本类、木质类和木炭4种类型[46];无机碳则来源于湖泊自生碳酸盐和外源碳酸盐[47]。外源碳酸盐是由湖盆流域母岩风化产生,由地表径流搬运至湖泊水体的碳酸盐,而湖泊自生碳酸盐包括湖水中无机化学沉淀产生的碳酸盐和生物壳体碳酸盐,以及少量沉积物埋藏后早期成岩作用产生的碳酸盐[48-49]。水生植物通过光合作用从大气中吸收CO2,以及水生生物死亡后降解沉降到底泥[50-51];自然界中的碳还会通过径流、土壤以及生物等陆地环境要素的传送作用进入湖泊,水体中POC会沉降到底部[52]。当大气中的pCO2与pCH4大于水体中的pCO2与pCH4时,CO2与CH4就会进入并溶解于水体,同时与沉积物进行碳交换[53]。因此,内陆水体的碳埋藏量是被忽视的一部分,存在巨大的不确定性(图2)。

图2 内陆水体碳源汇过程Fig.2 Process of carbon source and sink in inland water
内陆水体沉积碳受多种因素的影响。在一些水热条件变化大的区域,温度[54]以及降水[55]对湖泊碳埋藏速率会产生较为显著的调控作用。温度的高低会影响水体中细菌对沉积物的分解以及影响湖泊初级生产力,而降水的多少不仅会影响湖泊水量,同时还通过对土壤的淋溶作用影响湖泊有机碳积累,进而影响湖泊沉积物的碳埋藏速率。一些湖泊的理化性质[56],例如湖泊的营养状况,湖泊水体类型以及湖泊中的溶解氧气等同样会影响沉积物碳积累。底层水氧气越少,越有利于有机碳储存,有机碳的埋藏效率也越高。此外,一些生物因素[57](如湖泊生物量、湖泊中生物类型)以及人类活动[58](土地利用类型的变换)也会加快或者减缓有机碳的埋藏速率。有研究表明在农田施肥后,部分化肥会随着地表径流进入湖泊,由此对湖泊中的营养多寡造成影响,进而影响湖泊有机碳储量。
青藏高原由于其复杂的地貌特征与气候条件,形成了世界上海拔最高、范围最广、数量最多,以盐湖与咸水湖集中为特色的高原湖泊群,而且青藏高原受人类活动等外界的扰动较小,在静水条件下,水体中的碳更容易沉降到湖泊底部,因此,青藏高原湖泊可以更大限度的将碳埋藏在沉积物中。目前,一些研究对青藏高原湖泊沉积物中的碳埋藏速率以及碳储量进行了估算。研究结果显示哈拉湖沉积物的碳埋藏速率为4.71 g C/(m2·a),尕海沉积物的碳埋藏速率为14.02 g C/(m2·a),兹格塘错沉积物的碳埋藏速率为6.80 g C/(m2·a)[59],青海湖沉积物的碳埋藏速率约为7.23 g C/(m2·a)[60],而欧洲一些湖泊沉积物碳埋藏速率大概为5.6 g C/(m2·a)[61],格陵兰岛湖泊沉积物碳埋藏速率为6 g C/(m2·a)[62],而美国一些地区的湖泊沉积物碳埋藏速率大概为5.63 g C/(m2·a)[63],可见,青藏高原湖泊沉积物的碳埋藏速率与全世界上其他地区的许多湖泊记录是可相提并论的。此外,还有研究结果表明青藏高原12 ka 以来的湖泊碳储量约为73(16~274)kg C/m2[64]。因此,青藏高原湖泊沉积物中储存着大量有机碳,是内陆生态系统的重要碳库,在区域碳循环过程中扮演着重要角色。
2 青藏高原水体碳固定与碳逃逸特征
2.1 水体初级生产固碳
浮游植物是水体中最主要的初级生产者,虽然只占地球生物圈初级生产者生物量的0.2%[65-66],但浮游植物固碳对生物圈净初级生产(NPP)的贡献率约50%,是OC和IC储库间循环的最重要的环节[67-68]。同时,水生植物通过光合作用吸收大气CO2合成有机质,积累大量的OC和IC的过程也不容忽视[69-70]。这些浮游植物和水生植物的初级生产对营养时间和碳动力学产生了强烈的连锁效应,它将直接影响内陆水体碳沉积,控制水柱中O2的可用性(通过从主要生产者直接释放或通过漂浮的大型植物限制通入大气和通向大气的通量),从而间接影响水柱中的好氧矿化速率和磷浓度,因此在小型和浅水水生系统的碳沉积在全球碳循环中起着至关重要的作用[71]。
2002-2020 年间青藏高原湖泊初级生产力(GPP)分布格局如图3所示[72]。2000年以来,青藏高原湖泊年均初级生产力在477~622 mg C/(m2·d)范围内不断波动,其平均值达到 (553 ± 36) mg C/(m2·d)。大多数湖泊系统(72%)的GPP随时间呈显著下降趋势,尤其是位于高原内部和南部地区。大多数GPP显著增加的湖泊系统主要位于青藏高原东南部和东北部。在空间分布上,青藏高原湖泊初级生产力呈现出西高东低、北高南低的地理格局(图3a)。位于高原西部海拔在4291 m的咸水湖曼冬错具有最高的年均 GPP(5598 mg C/(m2·d)),而位于高原南部海拔4685 m的姆错丙尼具有最低GPP(106 mg C/(m2·d))。 大多数GPP较高的湖泊系统位于青藏高原南部, 只有少数GPP高于平均值的湖泊系统位于青藏高原西部。此外,海拔较低或盐度较低的湖泊系统具有较高初级生产力。
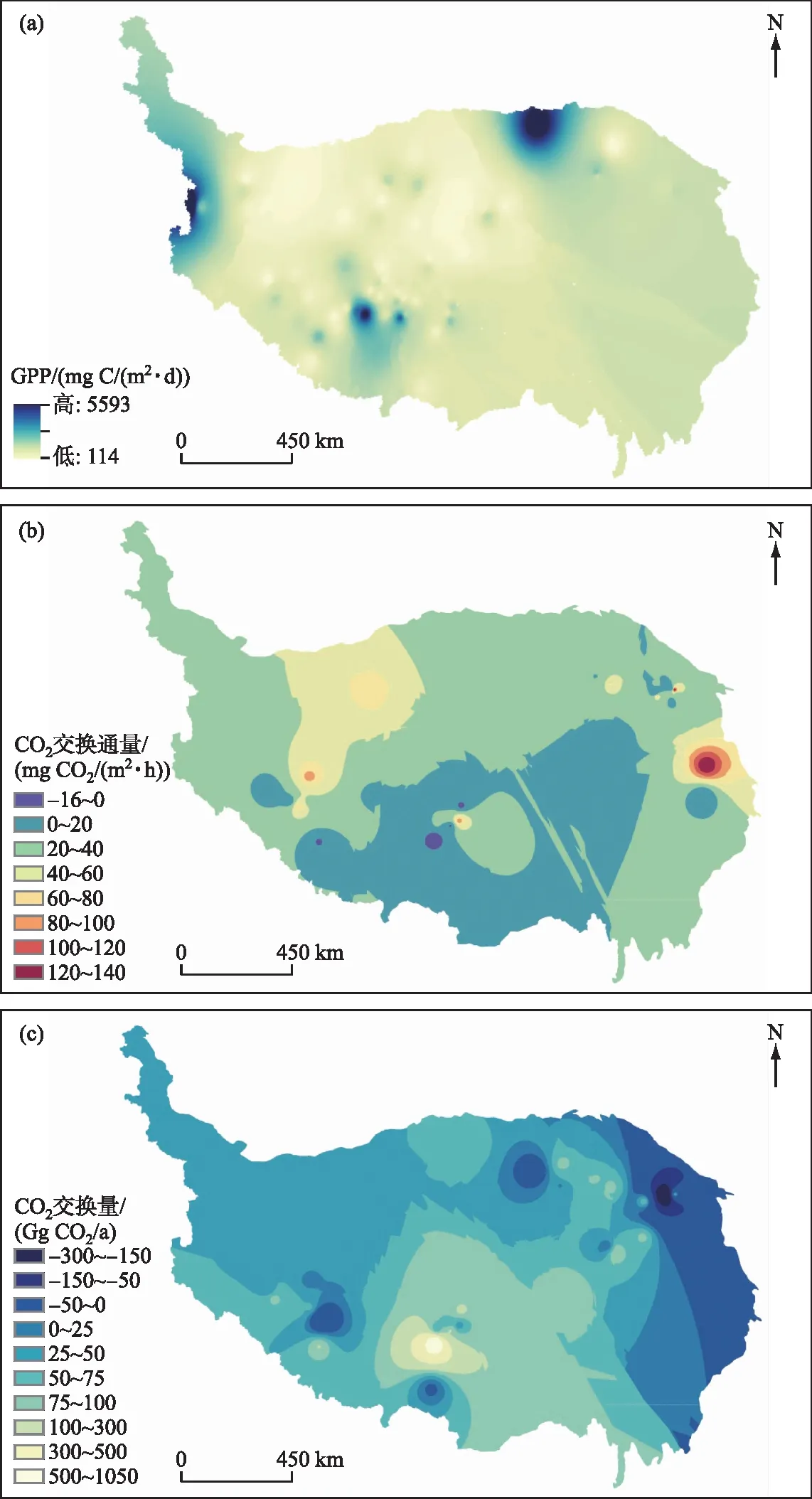
图3 青藏高原湖泊(a)总初级生产力、(b)CO2交换通量以及(c)CO2交换量空间分布格局Fig.3 Spatial distribution pattern of (a) total primary productivity, (b)CO2 flux rates and (c) CO2 exchange flux in lakes on the Qinghai-Tibet Plateau
2.2 水体C逃逸
内陆水体与大气之间进行了数量巨大的CO2交换,但目前缺乏对全球尺度上内陆水体与大气之间基于CO2交换量空间分布的系统性研究[2]。在全球范围内CO2逃逸总量评估主要取决于3个参数:水体中CO2量[73]、全球内陆水体(河流、湖泊、水库等)的总面积[74]以及气体交换速率(k,决定气体交换速率的物理学常数)[75-76]。内陆水体通常CO2过饱和,这反映了大气水量平衡,通过水体碱度和pH值计算得到的内陆水体中CO2含量显著高于大气中CO2含量。Butman 等研究表明,在美国境内北纬25°至50°的温带地区河流每年排放的CO2数量大约为5亿吨[77],而对于内陆大型河流以及北极水体也被证明为CO2过饱和状态[78]。
湿润热带地区的单位面积CO2排放量最高,咸水湖的CO2排放量也不低,仅里海就贡献了20%左右的全球湖泊碳排放,所有咸水湖则贡献了不到50%[21]。内陆水体中CO2逃逸是陆地呼吸的一部分,虽然从陆地到内陆水体的净初级生产力NPP输送仅占陆地NPP的4%,但每年异养呼吸和火灾与NPP的差值大约是15亿吨碳[79]。通过在英国流域的长期研究发现:约1.2%~2.2%的陆地NPP从湖泊逃逸[80]。因此,忽略内陆水体碳排放可能造成区域尺度碳平衡的较大误差,而这部分在全球碳收支中十分重要[4]。
青藏高原地区湖泊CO2交换通量形成了强差异化格局,从-16~140 mg CO2/(m2·h)不等(图3b)。大部分湖泊CO2交换通量处在0~60 mg CO2/(m2·h)范围内。个别湖泊也具有固碳潜力,即CO2交换通量小于0。进一步统计了淡水湖和咸水湖的CO2平均交换通量(图4),发现咸水湖CO2排放通量((38±34) mg CO2/(m2·h))高于淡水湖((33±28) mg CO2/(m2·h)),咸水湖的CO2吸收通量((-9±10) mg CO2/(m2·h))也高于淡水湖的吸收通量((-5±4) mg CO2/(m2·h))(绝对值相比)。 因此,青藏高原咸水湖的平均净CO2排放通量((34±35) mg CO2/(m2·h))高于淡水湖((17±28) mg CO2/(m2·h))。原因可能是咸水湖盐度高,高盐毒害水生植物和浮游植物,导致较低的生物量和较弱的光合作用,但是较强的呼吸作用致使水中CO2分压高,CO2交换通量高,而淡水湖水生植物和浮游植物生长旺盛,较强的光合作用导致水中CO2分压低,CO2交换通量低[81]。
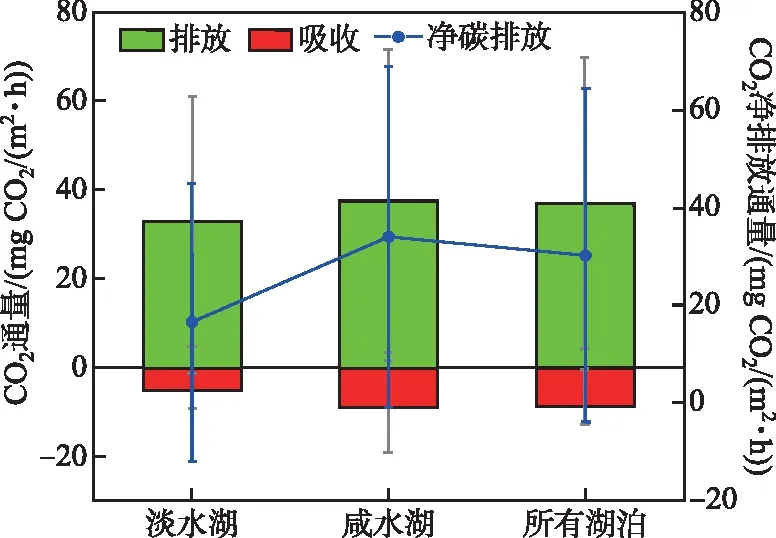
图4 青藏高原淡水湖与咸水湖CO2交换通量Fig.4 CO2 flux rates between freshwater and saltwater lakes on the Qinghai-Tibet Plateau
青藏高原湖泊CO2交换量形成南低北高的格局,每年在-30万吨CO2到105万吨 CO2范围内(图3c)。整体上看,青藏高原湖泊是个巨大的碳源,每年平均净二氧化碳排放量达到(7±18)万吨,尤其是咸水湖高达(8±22)万吨,淡水湖低于咸水湖,但是每年平均净二氧化碳排放量也达到(3±4)万吨。咸水湖平均面积大于淡水湖,因此相比淡水湖来说,咸水湖既可能是一个巨大的碳汇,也可能是一个巨大的CO2排放源[81]。
不同青藏高原湖泊的水温、盐度、碱度、pH等水环境要素的异质性制约了湖泊CO2交换通量,导致在利用有限采样数据升尺度评估青藏高原湖泊总体碳排放量时的高度不确定性。对青藏高原地区湖泊而言,本研究基于2003-2020年采样观测数据的评估结果为2.27 Tg C/a。Li等基于1998-2012年采样数据的估算结果为4.6 Tg C/a,置信区间范围为2.4~6.7 Tg C/a[18],而基于2014-2015年数据估算的CO2排放量达到10.1 Tg C/a[82];Ran等利用不同时期观测数据的估算结果为2.1 Tg C/a (1980s)和3.8 Tg C/a (2010s)[20](图5)。以上研究也表明,青藏高原湖泊总体表现为碳源,每年CO2排放量范围在2~10 Tg C/a之间,而且其碳排放量随时间呈现显著上升趋势。除了各研究自身估算的不确定性,不同研究对青藏高原湖泊碳排放的估算结果也存在显著差异。造成显著差异的原因包括:1)不同研究所用数据的采样点位置不同;2)不同研究所用数据的采样时间不一致;3)受限于青藏高原高寒环境,采样观测数据量总体偏少。总体而言,当前研究结果表明青藏高原湖泊整体依然处于碳排放状态,但碳排放量估算仍然存在高度不确定性。
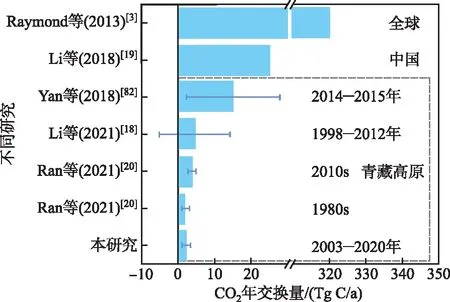
图5 青藏高原湖泊CO2排放量不同研究估算结果对比Fig.5 Comparison of CO2 emission estimates from different studies in lakes of the Qinghai-Tibet Plateau
2.3 水体温室气体排放
目前关于青藏高原河流CO2总体排放的研究当前还十分缺乏,1980s青藏高原河流在干季和湿季的总面积分别为(8902±4691)和(11091±5616) km2,2010s分别为(9662±5481)和(11368±5934) km2;平均CO2交换通量在1980s为(6656.4±7160.4) mg/(m2·d),到2010s为(5721.6±9362.4) mg/(m2·d);CO2总体排放量在1980s为(15.8±7.4) Tg C/a,到2010s上升至(18.6±7.9) Tg C/a[20]。据此推断,青藏高原河流CO2排放量是湖泊CO2排放量的4.9~7.5倍,占到青藏高原水体CO2排放量的83%~88%,是青藏高原水体排放的主要来源。相对于湖泊和河流,青藏高原水库的面积与数量较少。2010s统计结果共有水库239个,水库总面积(695.7±56) km2。青藏高原水库CO2排放量在1980s和2010s分别为(0.03±0.01)和(0.07±0.02) Tg C/a,仅占湖泊CO2排放量不到2%[20]。
除了CO2以外,CH4也是水体碳交换的一个重要来源。青藏高原湖泊CH4的平均交换通量为5.2(0.0008~45.9) mmol/(m2·d)[82],淡水湖CH4净排放通量(4 mg CH4/(m2·h))普遍高于咸水湖(0.50 mg CH4/(m2·h))。青藏高原湖泊CH4总体排放量估算为1.6(0.45~2.7) Tg C/a,约为青藏高原湖泊CO2排放量的35%[18]。青藏高原河流CH4的平均交换通量为11.9 mmol/(m2·d),约为湖泊CH4平均交换通量的2倍。Zhang等的长期观测分析结果指出,青藏高原东部主要河流的CH4排放量在0.37~1.23 Tg CH4/a[51]。因此,CH4也是青藏高原湖泊碳排放的重要组成部分。然而,由于缺乏足够的采样观测数据,青藏高原CH4排放量评估和CO2一样,还存在较大的不确定性,需要进一步开展相关研究。另一个主要的温室气体排放源是N2O。青藏高原湖泊N2O排放通量达到(2.16±1.77) mg N/(m2·d),年N2O总排放通量为(32.37±26.52) Gg N/a,占中国所有湖泊的88% ,贡献了最多的中国 N2O 排放[18]。由于青藏高原海拔较高,湖泊缺氧加剧了湖泊沉积物中的硝酸盐反硝化过程形成 N2O 汇[83-84]。与CO2(73.9%) 和 CH4(25.7%)相比,湖泊 N2O 排放水平 (0.4%) 极低[82]。 总体而言,青藏高原湖泊的温室气体占中国湖泊总排放量的44%。
CO2和CH4净排放量从2000s的2.06和0.50 Tg C/a增加到2020s的4.58和0.61 Tg C/a,然而多数研究将夏季观测数据作为全年碳收支进行评估,这并未考虑冬季结冰期的碳收支情况。Li 等的研究表明青藏高原所有盐湖吸收的 CO2总量为 (-10.28±1.65) Tg C/a,相当于青藏高原陆地生态系统净碳汇的1/3[20]。 若考虑冬季季节性水化学过程和盐湖中湖冰对CO2的吸收效应,目前青藏高原CO2净排放量应低于此估值(4.58 Tg C/a),然而碳交换通量估算依然存在高度不确定性。自20世纪80年代初以来,青藏高原全面的气候变化如地表空气变暖和增湿、太阳变暗和风力减弱[85],显著影响了水体碳源汇效应。温度升高会导致水体生物物理作用加快以及碳排放增加[86],同时也会引起无冰期延长、冰川雪水融化[87-88]、湖泊数量面积增加,进而造成湖泊盐度降低和冰期变短,促进浮游植物生长,最终导致湖泊CO2吸收增强[22]。太阳变暗会引起水体自养生物的光合作用减弱进而减少对CO2的吸收[11]。风速减慢使气体扩散速率变慢以及气体交换通量变低[15]。未来青藏高原水体碳源汇向何方演变,仍需进一步加强结冰期的源汇观测评估。
3 青藏高原碳源汇过程研究挑战
水-土界面输入、水-气界面释放、光合作用、沉积作用等过程之间密切关联,河流碳输出通量是这些过程综合作用的结果,目前大多数研究主要针对单一过程独立开展,碳释放、累积、运输等过程的综合研究有待进一步加强[89]。随河流运移碳通量的估算方法主要有3类:通过碳含量与流量的乘积计算,利用水体中的碳浓度或通量观测数据与影响因素构建经验方程,以及生态水文与生物地球化学过程耦合模型[90-91]。直接利用碳含量与流量乘积的方法,受到观测数据时间序列或空间变化较少的限制,较难全面反应不同时间、空间尺度的碳通量[73]。生态水文与生物地球化学过程耦合模型通过链接陆-水-气界面的碳过程,综合观测数据与理论模型,可对不同气候、土地利用、土壤类型等条件下的水体碳传输通量进行实时动态、长时间序列、多空间位置的定量估算,如NICE-BGC模型[88-90]。
解析陆-水、水-气、水-底泥等界面之间淋溶及侵蚀、光合/呼吸、溶解/沉淀、底泥释放/沉积等过程的碳通量是准确预测环境变化对水体碳通量与碳循环的影响,以及理解其控制机制的基础[53,89]。区域尺度水土过程的碳流失通量较难直接观测估算得到,而生物地球化学过程模型综合考虑了不同条件下的物质循环过程,为定量估算水土过程的碳流失提供了有效工具[90]。水-气界面CO2通量直接准确测定较为困难,其定量计算方法有示踪法、箱式法、扩散模型法等[92-93]。当前内陆水体初级生产评估主要在特定区域利用实地采样数据来进行分析[6],而基于遥感观测与模型模拟的水体初级生产研究受制于地面采样与遥感反演技术,主要在局部区域开展[94],缺乏大范围、长时期、高精度的评估结果[82]。水体中碳沉积量估算主要是根据其沉积速率,并且水体中碳同位素组成的变化可以反应水体化学特征、水气界面CO2的交换程度、流域C3和C4植被变化情况、浮游植物光合/呼吸作用强弱等重要信息,同时可以结合C/N解析水体碳的不同来源[95]。此外,卫星遥感快捷、大范围和周期性的特点为陆地-河流-近海等生态系统碳循环研究提供了更好的研究手段,特别是随着拥有适合内陆水体水色波段的卫星发展,均可为开展基于卫星遥感的陆地-河流-近海的碳循环研究,提供了重要的技术支撑。
目前对于大多数水体碳源汇的研究,不论是基于实地采样或是通过遥感的方式来进行监测,基本都集中在开放水域的季节。而冰封期的水体由于在传统上被认为相对于开放水域季节的水体,在碳循环中并不那么重要,因此常常被排除在碳收支预算之外。但有研究发现,冰本身就可以从大气中吸收CO2。此外,随着冬季生态系统研究的深入,发现冰下栖息地并不像曾经假设的处于休眠状态,冰下生命活动仍然存在,碳交换在冰下持续进行着。因此,结冰期水体的碳交换量可能会对青藏高原内陆水体碳循环过程产生重要影响。
4 展望
未来如何加强青藏高原水体碳中和研究,首先需确定青藏高原水体碳汇(定义为CO2收支的剩余部分),对于青藏高原碳收支的闭合具有很重要的作用。青藏高原淡水湖、盐湖和咸湖随海拔梯度变化的巨大空间异质性,导致当前缺乏测量方法和足够数据来完全对青藏高原陆-水-气系统的异质性进行分类,以致不能将区域尺度的碳动态向全球尺度外推,而水-气CO2通量的不确定性将会对全球陆地生物圈与大气的碳交换及碳汇功能造成较大误差。在过去的几十年里,碳同位素方法提供了关于碳埋藏和风化速率的重要间接证据,未来研究需要运用新的技术与方法解决陆-水-气关键带碳收支中的有机和无机碳的去向问题,包括最新先进的碳来源、年龄和现代不稳定有机碳(如从浮游植物和现代维管植物)监测,以及新的CO2、pH和DOC的传感装置运用。同时提高耦合水动力的生物地球化学模型的参数敏感性分析,降低模型预测的不确定性,发展新一代耦合水动力的生物地球化学模型,从力学上考虑控制碳动力学的因素,如元素化学计量学和生物碳周转率等。

