蔗糖和咖啡因的持续摄入对不同饮食小鼠生理代谢的影响
蒋如梦, 黄佳薇, 王永红
(华东理工大学生物反应器工程国家重点实验室, 上海 200237)
众所周知,不良的饮食习惯是一系列可预防的全球性疾病的主要诱因,尤其是一些糖和脂肪摄入量高,而纤维、水果和蔬菜摄入量低的饮食习惯[1-2]。饮食中的糖在代谢和肾脏类疾病中的作用越来越被人们所注意,常见的食品中的添加糖 (如蔗糖和高果糖玉米糖浆)都是由葡萄糖和果糖组成的,会使饮食能量密集但营养素缺乏,人长期大量摄入会促使更高的总能量摄入,容易造成脂肪堆积,进而影响生理代谢[3-5]。研究表明,饮食中过量的糖是代谢紊乱、肥胖、糖尿病和心血管病等代谢类疾病的主要诱因[6-7]。除糖以外,咖啡因也是现代人饮食中的一种常见物质。咖啡因是一种植物次生代谢物,主要用于咖啡、茶、巧克力和软饮料中,是人类已知的最广泛使用的精神活性物质,它在人体中枢神经系统中起到甲基黄嘌呤类兴奋剂的作用[8-9]。咖啡因在摄入后通过胃肠道迅速被吸收到血液中,可以自由穿过所有生物膜,包括血脑屏障,它一般通过与广泛分布于胃肠道、心血管、肾脏和大脑中枢神经系统中的腺苷受体拮抗,从而发挥生物学效应[10-11]。通过抑制腺苷受体,咖啡因增加脑能量代谢、皮质活动和神经递质的释放,进而产生外周血管收缩、血压升高和产热等生理效应[12-13]。
奶茶是一种深受年轻人喜爱的新型含糖饮品,很多年轻人每天饮用大量的奶茶。奶茶中含有大量糖和咖啡因,长期饮用可能会影响生理代谢,并引发一系列代谢类疾病,但其对人体生理代谢的具体影响尚不明确。本文通过对小鼠持续灌胃蔗糖和咖啡因来模拟人长期摄入蔗糖和咖啡因,以体重、血糖、血脂、炎症因子和组织学检查为评价指标来探讨其对小鼠生理代谢的影响,以期为人们饮食行为提供参考,同时为预防和治疗因蔗糖和咖啡因持续摄入所导致的代谢紊乱等疾病提供科学依据。
1 材料与方法
1.1 材料与仪器
蔗糖:分析纯,生工生物工程有限公司;氢氧化钠:分析纯,上海泰坦科技股份有限公司;盐酸:分析纯,凌峰化学试剂有限公司;3、5-二硝基水杨酸(DNS)试剂:实验室配制;三氯乙酸:分析纯,国药集团化学试剂有限公司;甲醇:色谱纯,国药集团化学试剂有限公司;咖啡因:分析纯,Sigma-Aldrich 公司;咖啡和奶茶:购自超市;小鼠总胆固醇 (TC)、总甘油三酯 (TG)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)试剂盒:生化试剂,南京建成生物工程研究所;固定液、油红染液、苏木素染液、分化液、返蓝液、甘油明胶封片剂和苏木精-伊红 (HE)染色套装:生化试剂,Servicebio 公司;OCT 包埋剂和中性树胶:生化试剂,国药集团化学试剂有限公司;SPF 级C57 BL/6J 雄性小鼠:购买于上海杰思捷实验动物有限公司。常规饲料 (蛋白质、碳水化合物和脂肪的热量分数分别为19.7%、72.3%和10%):上海杰思捷实验动物有限公司;高糖高脂饲料 (蛋白质、碳水化合物和脂肪的热量分数分别为19.8%、31.7%和48.5%):北京博泰宏达生物技术有限公司。
酶标仪 (美国赛默飞世尔科技公司,Varioskan lux 型);分析天平 (上海 舜宇横平科学仪器有限公司,FA1004 型);岛津高效液相色谱 (日本岛津,DGU-20A 型);旋涡混合器 (上海琪特分析仪器有限公司,XW-80A 型);离心机 (上海亭科学仪器厂,TGL-16B型);罗氏血糖仪 (德国 Roche);冰冻切片机 (美国赛默飞世尔科技公司);病理切片机 (上海徕卡仪器有限公司)。
1.2 实验方法
1.2.1 奶茶中总糖和咖啡因含量的测定
(1)总糖含量的测定。采用DNS 法对奶茶中总糖含量进行测定,向各比色管中加入0.5 mL 稀释200 倍的样品,然后加入0.375 mL、6 mol/L 的盐酸,混匀后于100 ℃沸水浴中水解5 min,冷却至室温后先加入0.5 mL、6 mol/L 的NaOH 溶液,再加入0.75 mL的DNS 试剂,摇匀后于100 ℃沸水浴中进行5 min显色反应,待冷却至室温后定容至5 mL,用漩涡振荡仪混匀,分别吸取200 μL 上述溶液至酶标板中,用酶标仪测定各样品在550 nm 处的吸光度。将吸光度代入标准曲线方程中,再乘以稀释倍数即可得到原样品的总糖含量。每个样品重复测定3 次。
(2)咖啡因含量的测定。采用高效液相色谱法对奶茶中咖啡因含量进行测定。色谱条件:Unitary C18色谱柱 (4.6 mm×250 mm),柱温为25 ℃,流动相为甲醇和水 (甲醇与水体积比为24∶76),流速为1.0 mL/min,检测波长为272 nm,进样量为10 μL。将样品和质量浓度为10 g/L 的三氯乙酸溶液按体积比1∶10 进行混合,摇匀经滤膜过滤后上机检测,将测得的峰面积代入标准曲线方程,再乘以稀释倍数即可得原样品的咖啡因浓度。每个样品重复测定3 次。
1.2.2 动物实验灌胃剂量换算与确定 选取样品中总糖和咖啡因测定结果的中值(分别约为70 g/L和550 mg/L)。按照每人每天饮用一杯700 mL 奶茶计算,相当于摄入49 g 的糖和385 mg 的咖啡因。结合中国居民营养与慢性病状况报告[14],以成人体重65 kg 为标准,实验小鼠为C57 BL/6J 雄性小鼠,进行灌胃剂量的换算,换算式如下:
式中:A为小鼠的剂量 (mL/kg),B为人的剂量 (mL/kg),Km1=37,Km2=3[15]。
设定体重为65 kg 的人每天喝700 mL 的奶茶,可计算出对应小鼠的奶茶摄入标准为132.82 mL/kg,此时小鼠摄入对应的蔗糖剂量为9.30 g/kg,咖啡因剂量为73.05 mg/kg;20 g 小鼠摄入0.4 mL 蔗糖与咖啡因混合溶液所需的蔗糖质量浓度为464.75 g/L、咖啡因质量浓度为3.653 g/L,所含能量约为3.11 kJ。
1.2.3 实验动物分组设计与饲养 对36 只6 周龄C57 BL/6J 雄性小鼠用常规饲料适应性饲养,一周后采用随机分组的方式分为6 组,分别为常规饲料组(ND)、常规饲料加蔗糖组 (ND+S)、常规饲料加蔗糖和咖啡因组 (ND+SC)、高糖高脂饲料组 (HSD)、高糖高脂饲料加蔗糖组 (HSD+S)、高糖高脂饲料加蔗糖和咖啡因组 (HSD+SC)。其中ND 组喂食常规饲料并灌胃生理盐水,ND+S 组喂食常规饲料并灌胃蔗糖溶液,ND+SC 组喂食常规饲料并灌胃蔗糖和咖啡因的混合溶液,HSD 组喂食高糖高脂饲料并灌胃生理盐水,HSD+S 组喂食高糖高脂饲料并灌胃蔗糖溶液,HSD+SC 组喂食高糖高脂饲料并灌胃蔗糖和咖啡因的混合溶液。实验过程中每天12 h 光照和黑暗循环,保持实验房室温(22±2)℃,湿度50%~60%,定期更换垫料,每笼小鼠让其自由进食与饮水,本文中所有实验操作均符合实验动物福利伦理审查指南。
1.2.4 动物实验样品采集和测定方法
(1)小鼠血液样品的收集处理。实验周期内定期测量小鼠进食量、饮水量和体重并记录,每两周使用罗氏血糖仪测定小鼠空腹血糖并尾静脉采血,采集的血样离心后取上层血清置于-80 ℃冰箱保存待测。每次测空腹血糖和取血时提前12 h 对小鼠禁食,但不禁水。
(2)口服葡萄糖耐量实验。小鼠解剖前一周进行糖耐量实验,按照2 g/kg (葡萄糖用量/体重)的标准给小鼠灌胃200 g/L 的葡萄糖标准溶液,并在灌胃后第0、15、30、60、90 min 和120 min 时测定小鼠的血糖值并记录。糖耐量实验前12 h 对小鼠禁食,但不禁水。
(3)小鼠组织样本的收集。糖耐量实验完成一周后对小鼠实行安乐死,并进行解剖,取出小鼠下腹部两侧附睾丸脂肪、肾周脂肪和肝脏称重,并置于40 g/L 的多聚甲醛溶液中进行固定,留待之后做切片观察。解剖前12 h 对小鼠禁食,但不禁水。
(4)血清样品的测定。使用TC、TG、TNF-α和IL-6 试剂盒对上述保存的血清样品进行测定,具体步骤按试剂盒说明书进行。
(5)小鼠组织固定与观察。将上述置于40 g/L多聚甲醛溶液中的新鲜组织固定24 h 后,对脂肪和肝脏组织进行石蜡切片的制作和HE 染色,同时对肝脏组织进行冷冻切片的制作和油红O 染色。
1.2.5 数据处理 实验中所有数据均采用均值±平均标准差表示,使用SPSS 21.0 软件进行统计分析,组间差异比较采用Duncant 单因素方差分析,以P<0.05 为差异有统计学意义,用GraphPad 8.0 软件进行绘图。本文所有图中数值与ND 组的差异性比较用#表示 (#表示P<0.05,##表示P<0.01,###表示P<0.001),与HSD 组的差异性比较用*表示 (*表示P<0.05,**表示P<0.01,***表示P<0.001)。
2 结果与讨论
2.1 市售奶茶样品中总糖和咖啡因含量
本研究选取了市面上几种品牌的热销奶茶对其中的总糖和咖啡因含量进行了测定,测定结果如表1所示。所测样品中的总糖质量浓度范围为25~135 g/L,其中无糖奶茶实际上也含有一定量的糖;咖啡因质量浓度范围为190 ~853 mg/L。研究结果表明,鲜奶茶和拿铁中的咖啡因含量比普通奶茶高,港式奶茶中的咖啡因含量要高于其他奶茶。综合考虑总糖和咖啡因含量,所测样品中一点点的五分糖拿铁和厝内小眷村的总糖和咖啡因质量浓度相近,总糖质量浓度约为70 g/L,咖啡因质量浓度约为550 mg/L,接近整个选取样品中总糖和咖啡因质量浓度的中值。按照一杯奶茶700 mL 体积计算,若每人每天饮用一杯奶茶,相当于每天摄入49 g 的糖和385 mg 的咖啡因,均接近世界卫生组织建议每日食用量上限,因此以上述两种奶茶中的总糖和咖啡因含量为基准进行下一步动物实验。
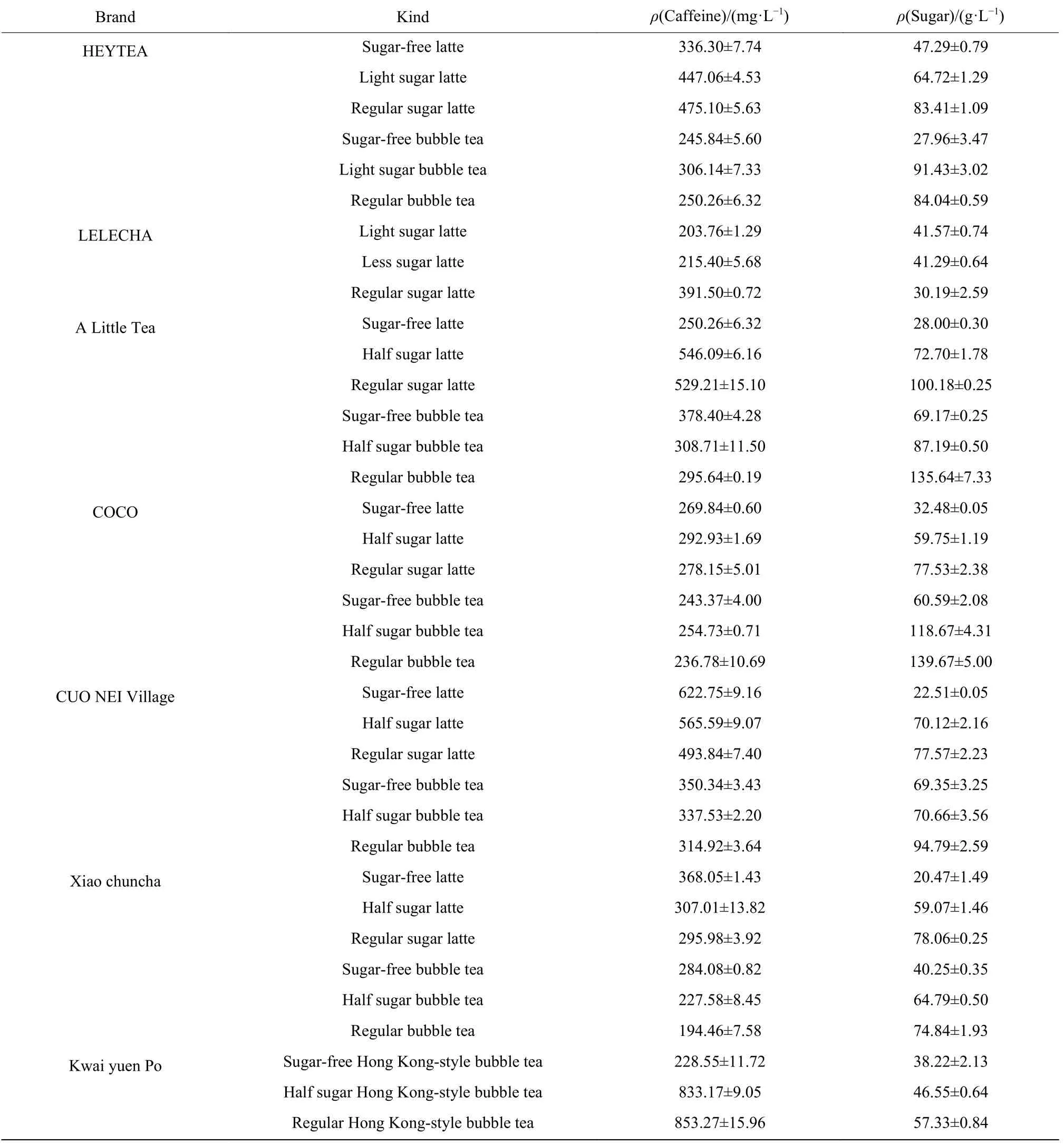
表1 奶茶中的总糖和咖啡因含量Table 1 Sugar and caffeine content in bubble tea
2.2 蔗糖和咖啡因的持续摄入对小鼠生理代谢的影响
2.2.1 蔗糖和咖啡因的持续摄入对小鼠能量摄入的影响 对各实验组小鼠进行16 周的差异化饲养和灌胃,每天记录各组小鼠摄入饲料量。16 周内小鼠平均日总能量摄入结果如图1 所示,其中灌胃蔗糖和灌胃蔗糖加咖啡因的小鼠摄入的总能量是指消耗的饲料与蔗糖能量的总和。与ND 组相比,ND+S、ND+SC、HSD+S 和HSD+SC 组小鼠能量摄入无统计学差异,HSD 组小鼠能量摄入增加,且有统计学差异 (P<0.05);与HSD 组相比,HSD+S 组小鼠能量摄入减少但无统计学差异,HSD+SC 组小鼠能量摄入减少且有差异(P<0.05)。有研究表明,大鼠摄入咖啡因后食欲被抑制从而降低能量的摄入[16],本研究中单独的高糖高脂饮食会导致能量摄入显著增高,高糖高脂饮食下补充蔗糖和咖啡因会使小鼠摄入能量降低。
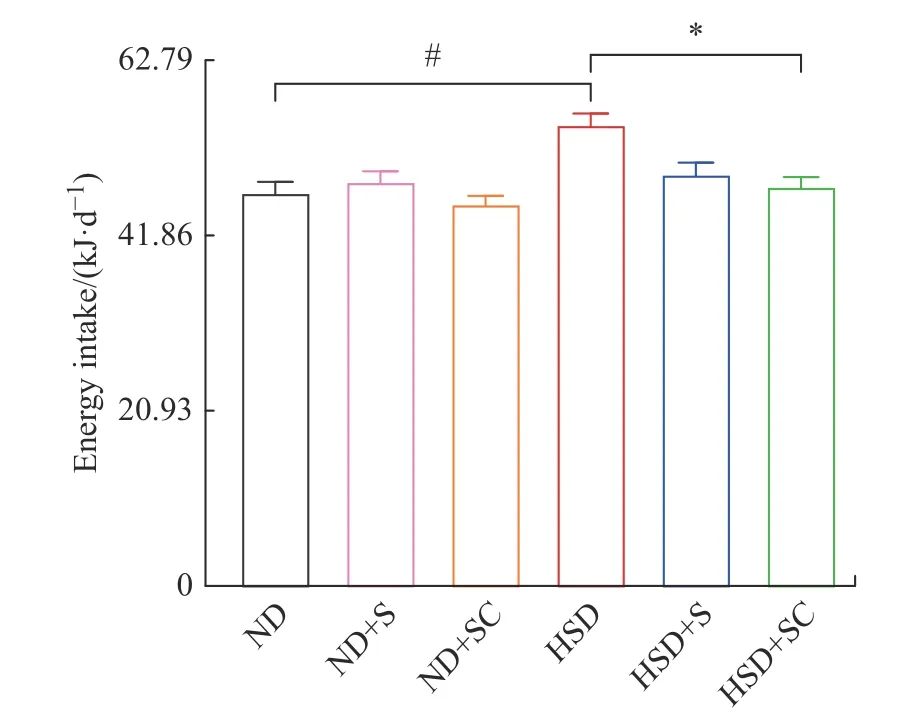
图1 各组小鼠日总能量摄入Fig.1 Daily total energy intake of mice in each group
2.2.2 蔗糖和咖啡因的持续摄入对小鼠体重的影响 对各实验组小鼠进行16 周的差异化饲养和灌胃,各组小鼠每周的体重变化和16 周的总体重增量分别如图2 (a)和2(b)所示。与ND 组相比,ND+S组小鼠体重持续上升但实验结束时体重增长量无统计学差异;ND+SC 组小鼠体重增长平缓,增长量低于ND 组但无统计学差异;HSD 和HSD+S 组小鼠体重持续上升且体重增长量有极显著差异 (P<0.001);HSD+SC组小鼠体重增长平缓且增长量无统计学差异。与HSD 组相比,HSD+S 组小鼠体重增长量比HSD 组少但无统计学差异,HSD+SC 组的小鼠体重增长量比HSD 组少且有显著差异 (P<0.01)。以上结果表明单纯摄取高热量的高糖高脂饲料能够使小鼠体重明显上升;在常规饲料基础上摄取一定量的蔗糖能够使小鼠体重上升,而在高糖高脂饲料基础上摄取一定量蔗糖的小鼠,其体重增长量比单纯饲喂高糖高脂饲料还要低,这可能是由于对小鼠灌胃蔗糖减少了小鼠对高糖高脂饲料的摄入量,而灌胃蔗糖所含能量低于减少摄取的高糖高脂饲料所含能量;但在摄入蔗糖的基础上摄入一定量的咖啡因能够使体重增加速度下降,尤其是在摄取高糖高脂饲料和蔗糖的基础上摄取咖啡因甚至能够使小鼠体重下降到常规饲料组水平,这与杨哲[16]所报道的摄入咖啡因能够使大鼠体重增速明显放缓的结果相一致。

图2 16 周内不同饲喂条件下小鼠体重的变化Fig.2 Changes of body weight in mice under different feeding conditions during 16 weeks
2.2.3 蔗糖和咖啡因的持续摄入对小鼠空腹血糖的影响 对各实验组小鼠进行16 周的差异化饲养和灌胃,每周测定各组小鼠的空腹血糖 (Fasting blood glucose, FBG)浓度,其每两周的FBG 浓度和第16 周的FBG 浓度分别如图3 (a)和3(b)所示。在整个实验周期内,ND 组FBG 浓度没有明显变化,在4.5 mmol/L上下波动。与ND 组相比,ND+S 组小鼠的FBG 浓度在整个周期内有上升趋势但无统计学差异,ND+SC 组小鼠的FBG 浓度有上升趋势且有显著差异 (P<0.01); HSD、 HSD+S 和HSD+SC 组小鼠的FBG 浓度从第4 周开始升高,到第10 周时稳定在较高水平,且实验结束时这3 组小鼠的FBG 浓度与ND 组有极显著差异 (P<0.001)。与HSD 组相比,HSD+S 组小鼠的FBG 浓度偏低但在整个实验周期内也呈上升趋势,HSD+SC 组小鼠的FBG 浓度上升,但无统计学差异。以上结果表明在常规饲料喂养基础上长期持续灌胃蔗糖加咖啡因能够促使小鼠的FBG 浓度上升,但长期喂食高糖高脂饲料能够使小鼠的FBG浓度更早且更显著上升。
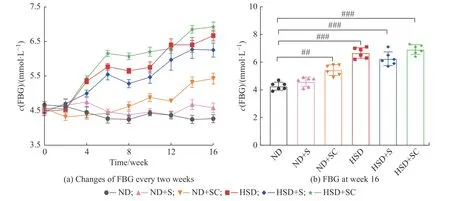
图3 16 周内不同饲喂条件下小鼠FBG 的变化Fig.3 Changes of FBG in mice under different feeding conditions during 16 weeks
2.2.4 蔗糖和咖啡因的持续摄入对小鼠葡萄糖耐量的影响 在16 周的差异化饲养和灌胃后,对各实验组小鼠进行口服葡萄糖耐量实验 (Oral glucose tolerance test, OGTT),结果如图4 所示。与ND 组相比,ND+S 和ND+SC 组小鼠在灌胃葡萄糖后曲线下面积 (Area under curve, AUC)无统计学差异,HSD、HSD+S 和HSD+SC 组的AUC 比ND 组大,且有极显著差异 (P<0.001);与HSD 组相比,HSD+S 和HSD+SC组小鼠的AUC 无统计学差异。以上结果表明饲喂常规饲料基础上持续摄入蔗糖及蔗糖加咖啡因的混合液对小鼠血糖调节能力无明显影响,但饲喂高糖高脂饲料能够使小鼠的血糖调节能力明显变差,对葡萄糖的耐受性降低,这与高伟华[17]的研究中脂肪含量为40%左右的高脂饲料能够使小鼠血糖的调节和耐受能力下降这一结果具有一致性,结合2.2.3 节中高糖高脂饲料喂养下小鼠FBG 浓度上升这一结果,表明本研究中高糖高脂饲料喂养的小鼠有Ⅱ型糖尿病发病前期迹象。

图4 16 周后不同饲喂条件下小鼠口服葡萄糖耐量实验结果Fig.4 Results of OGTT in mice under different feeding conditions after 16 weeks
2.2.5 蔗糖和咖啡因的持续摄入对小鼠脂质代谢的影响 总胆固醇(TC)和总甘油三酯(TG)是反映脂质代谢水平的重要指标。胆固醇是哺乳动物细胞膜的主要成分,TC 浓度过高容易导致其沉积在血管上,引起动脉粥样硬化;甘油三脂是由长链脂肪酸和甘油形成的脂肪分子,TG 浓度过高时提示体内会有脂肪堆积,易于引起血液黏稠度上升进而增加患心血管相关疾病的风险。
在16 周的差异化饲养和灌胃后,对各实验组小鼠血清中TC 和TG 浓度进行测定。血清中TC 浓度的测定结果如图5 (a)所示。与ND 组相比,ND+S和ND+SC 组TC 浓度无明显变化,HSD、HSD+S 和HSD+SC 组的TC 浓度上升,且有极显著差异 (P<0.001);与HSD 组相比,HSD+S 和HSD+SC 组小鼠的TC 浓度无统计学差异。以上结果表明长期单纯的蔗糖和咖啡因摄入不会使小鼠TC 水平发生显著性改变,而含高胆固醇的高糖高脂饲料能够使小鼠TC 水平显著上升。有研究表明,长期摄入脂肪能量为40%左右的高脂饲料能够使小鼠血清中的TC 水平显著上升[18-19],本研究与上述研究结果一致。各实验组小鼠血清中TG 浓度测定结果如图5 (b)所示。与ND 组相比,ND+S、HSD 和HSD+S 组的TG 浓度无统计学差异,ND+SC 和HSD+SC 组的TG 浓度有差异性降低 (P<0.05);与HSD 组相比,HSD+S 组的TG 浓度无统计学差异,HSD+SC 组的TG 浓度有差异性降低(P<0.05)。以上结果表明,无论饲喂何种饲料,持续每天摄入咖啡因能够降低小鼠血清中TG 浓度,而在目前实验条件下持续摄入蔗糖溶液和高糖高脂饲料喂养对小鼠血清里的TG 浓度无显著影响。

图5 16 周后不同饲喂条件下小鼠血清中TC 和TG 浓度Fig.5 Concentration of serum TC and TG in mice under different feeding conditions after 16 weeks
2.2.6 蔗糖和咖啡因的持续摄入对小鼠血清中炎症因子的影响 炎症反应是一种级联反应,是机体对不同病理刺激和组织损伤做出的回应。TNF-α是脂肪组织产生的促炎因子,其浓度升高可以抑制胰岛素信号,使胰岛素抵抗能力增强。IL-6 是激活的巨噬细胞、淋巴细胞及上皮细胞分泌的促炎因子,能被白细胞介素-1β和TNF-α诱导,可以调节免疫应答并参与炎症反应。
在16 周的差异化饲养和灌胃后,对各实验组小鼠血清中的TNF-α和IL-6 质量浓度进行测定,结果分别如图6(a)和6(b)所示。与ND 组相比,ND+S、ND+SC、 HSD、 HSD+S 和HSD+SC 组的TNF-α和IL-6 质量浓度均上升,且有显著差异 (P<0.01);与HSD 组相比,HSD+S和HSD+SC 组的TNF-α和IL-6 质量浓度无统计学差异。以上结果表明持续摄入蔗糖、蔗糖和咖啡因混合溶液以及高糖高脂饲料均能够使小鼠机体发生炎症反应。

图6 16 周后不同饲喂条件下小鼠血清中TNF-α 和IL-6 的质量浓度Fig.6 Mass concentration of serum TNF-α and IL-6 in mice under different feeding conditions after 16 weeks
2.2.7 蔗糖和咖啡因的持续摄入对小鼠组织的影响
在16 周的差异化饲养和灌胃后,对各实验组小鼠脂肪和肝脏组织进行观察比较。实验结束时小鼠组织质量如图7 所示。与ND 组相比,ND+S 组的各组织质量无统计学差异,ND+SC 组的肝脏质量无统计学差异、附睾丸脂肪减少且有极显著差异 (P<0.001)、肾周脂肪减少但无统计学差异,HSD 组的肝脏、附睾丸脂肪和肾周脂肪的质量都增加,且有极显著差异(P<0.001)。与HSD 组相比,HSD+S 组的附睾丸脂肪质量增加且有极显著差异 (P<0.001)。肝脏和肾周脂肪质量增加但无统计学差异;HSD+SC 组的肝脏、附睾丸脂肪和肾周脂肪质量均减少,且有极显著差异(P<0.001)。以上实验结果表明,饲喂高糖高脂饲料能极显著地增加肝脏和脂肪组织质量,小鼠无论在常规饲料还是高糖高脂饲料喂养基础上,补充蔗糖的摄入都能在一定程度上造成附睾丸脂肪的增加和肝脏脂肪的堆积,在蔗糖摄入基础上再补充咖啡因的摄入能有效缓解因蔗糖摄入所造成的附睾丸脂肪增加和肝脏脂肪堆积现象,尤其是在高糖高脂饲料加蔗糖摄入的基础上补充咖啡因对于缓解这一现象有非常显著的效果。
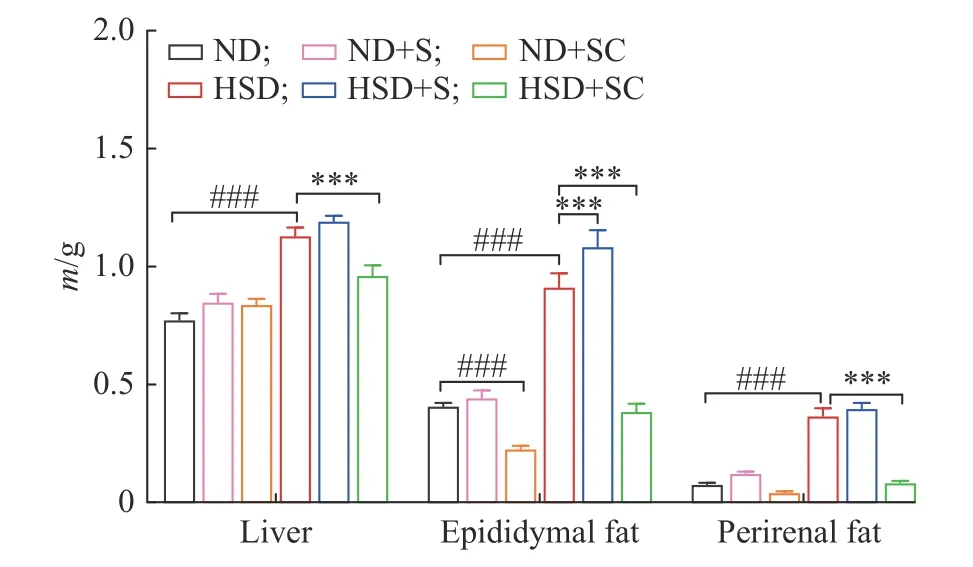
图7 16 周后不同饲喂条件下小鼠组织 (肝脏和附睾丸脂肪、肾周脂肪)质量Fig.7 Mass of tissue (liver, epididymal fat and perirenal fat) in mice under different feeding conditions after 16 weeks
实验结束时各实验组小鼠肝脏组织HE 染色结果如图8 所示。正常组 (ND)细胞排列整齐,肝索清晰,无明显的炎性细胞浸润和炎症灶。与ND 组相比,ND+S 和ND+SC 组细胞排列不整齐,肝索不清晰,有轻微的炎症灶;HSD 组细胞核挤向一边,肝细胞气泡样变大,细胞排列不整齐,肝索不清晰,胞浆内有较多的空泡 (脂肪滴)。与HSD 组相比,HSD+S组胞浆内空泡数量增加,HSD+SC 组空泡数量减少但有炎症灶,提示炎症较强。实验结束时各实验组小鼠肝脏组织油红O 染色结果如图9 所示。与ND 组相比,ND+S 组的红色面积有轻微增加,ND+SC 组的红色面积减少,HSD 组的红色面积明显增加。与HSD 组相比,HSD+S 组的红色面积增加,HSD+SC 组红色面积明显减少。小鼠肝脏组织油红O 染色结果中染上红色的面积与肝脏脂肪堆积程度呈正相关。以上结果表明,蔗糖和高糖高脂饲料的摄入会增加肝脏组织的脂肪堆积,而在此基础上补充咖啡因的摄入能够减弱上述脂肪堆积现象;此外切片染色结果显示无论是在常规饲料还是高糖饲料的基础上补充蔗糖和咖啡因的摄入都会使肝脏组织发生炎症。
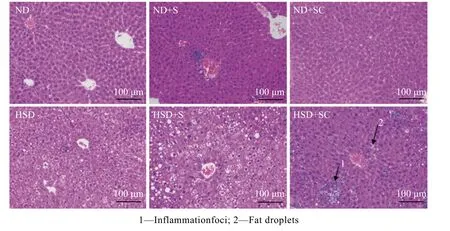
图8 各组小鼠肝脏组织HE 染色结果 (200×)Fig.8 HE staining of liver tissues of mice in each group (200×)

图9 各组小鼠肝脏组织油红O 染色结果 (200×)Fig.9 Oil red O staining of liver tissues of mice in each group (200×)
实验结束时各实验组小鼠附睾丸脂肪HE 染色结果如图10 所示。与ND 组相比,ND+S 和HSD 组的脂肪细胞发生气球样变,面积变大,其中HSD 组的气球样变化更明显,面积更大,ND+SC 组的脂肪细胞发生气球样变,但面积变小;与HSD 组相比,HSD+S组的脂肪细胞面积轻微增大,HSD+SC 的脂肪细胞发生气球样变,但面积变小。小鼠的附睾丸脂肪HE染色结果中脂肪细胞变大表示脂肪的积累增多,且脂肪细胞的大小与附睾丸脂肪质量呈正相关。以上结果表明,蔗糖和高糖高脂饲料的摄入会使小鼠的附睾丸脂肪组织细胞面积变大,提示小鼠附睾丸脂肪积累增多;在持续摄入蔗糖的基础上增加咖啡因的摄入能使小鼠的附睾丸脂肪组织细胞面积减小,减少小鼠附睾丸脂肪的积累。
3 讨 论
奶茶因其良好的饮用口感而越来越流行,导致部分人群长期饮用大量的奶茶。有研究显示,在一个363 人的问卷调查中,高达35.7%的人每周饮用两杯以上的奶茶[20],但市售奶茶中含有大量的糖和咖啡因,长期饮用可能会对人体造成一定的伤害,并引发代谢类疾病。本研究首先广泛调研并测定了市面上流行品牌奶茶中的总糖和咖啡因含量,结果表明所调研奶茶中总糖质量浓度范围为25~135 g/L,咖啡因质量浓度范围为190~853 mg/L,本研究选取的样品中总糖和咖啡因质量浓度的中值分别为70 g/L 和550 mg/L。世界卫生组织建议,健康成人每日糖摄入量最好在25 g以下,不超过50 g;咖啡因单次摄入量200 mg 以下,全天摄入量不超过400 mg,若每人每天饮用一杯700 mL上述奶茶,相当于摄入49 g 的糖和385 mg 的咖啡因,接近于世界卫生组织所建议的每日糖和咖啡因食用量的上限。
本研究对C57 BL/6J 小鼠饲喂不同饲料同时灌胃蔗糖和咖啡因溶液,模拟不同饮食方式的人每天喝1 杯700 mL 奶茶所摄入的蔗糖与咖啡因,并研究其对小鼠生理代谢的影响。结果表明,在常规饲料喂养情况下,蔗糖的持续摄入能使小鼠的体重和空腹血糖上升,附睾丸脂肪细胞发生一定的气球样变,肝脏有少量的脂肪堆积,肝脏组织发生炎症,血清中促炎因子TNF-α和IL-6 质量浓度增加,但对TC、TG和血糖调节能力无显著影响;在高糖高脂饲料喂养情况下,增加蔗糖的持续摄入对小鼠体重、FBG、TC、TG、附睾丸脂肪细胞的气球样变和肝脏脂肪的堆积均无明显进一步影响。无论是在常规饲料还是在高糖高脂饲料喂养情况下,在蔗糖持续摄入的基础上补充咖啡因的摄入都能够使小鼠的体重和TG 浓度下降,减少附睾丸脂肪积累,清除肝脏的脂肪堆积;但会使小鼠FBG 浓度上升,血清中促炎因子TNF-α和IL-6 质量浓度增加。有报道[21]显示小鼠长期食用富含58%脂肪和25%碳水的高糖高脂饲料能够使小鼠的体重增加,同时肝脏组织发生一定程度的脂肪堆积,本研究结果中高糖高脂饲料喂养和蔗糖灌胃下小鼠体重的上升和脂肪的堆积与上述报道一致。食物中一定量的糖质进入机体后通过一系列消化酶的作用被水解为单糖后吸收,这些单糖在胰岛素的作用下,进入肌肉和脂肪组织转化为能量被利用,该过程中通过抑制糖消化酶可以防止血糖上升,有研究表明,咖啡中的咖啡因对α-葡萄糖苷酶的活性无抑制作用[22]。本研究结果显示灌胃蔗糖加咖啡因能使小鼠FBG 浓度上升,可能是由于咖啡因对α-葡萄糖苷酶的活性无抑制作用,但其具体原因还有待进一步研究。有报道显示,机体营养过剩会导致脂肪细胞分泌趋化因子,提供趋化梯度,吸引单核细胞进入脂肪组织成为巨噬细胞并分泌促炎因子如TNF-α和IL-6,进而导致胰岛素靶细胞的胰岛素敏感性降低[23-24]。本研究结果表明,长期蔗糖和高糖高脂饲料的摄入能够使小鼠体内脂肪积累增多,从而增加促炎因子的释放,使机体产生炎症反应,在此基础上持续摄入一定量的咖啡因虽然能清除脂肪细胞的积累但不能逆转炎症反应的发生。
综上所述,长期持续摄入一定量的蔗糖能够使机体的体重、空腹血糖和促炎因子增加,在此基础上持续摄入一定量的咖啡因能够使体重下降但会促进血糖浓度进一步上升。随着奶茶等含大量糖和咖啡因饮料的流行,本研究对人们选择该类饮品有一定的参考价值和指导意义。

