人胚胎滋养细胞独立合成并分泌孕酮时间的探讨
李洁 莫似恩 王书佳 莫馥华 乃东红
孕激素主要由卵巢黄体和妊娠滋养叶细胞合成。生理状态下,排卵后卵泡液流出,卵泡壁的卵泡颗粒细胞和卵泡内膜细胞塌陷并共同形成黄体,在黄体生成素(LH)峰的作用下,两种细胞进一步黄素化并分泌孕激素[1]。孕激素促进子宫内膜充分转化,为胚胎着床提供条件,同时抑制子宫收缩,维持妊娠[1-3]。有研究表明,在没有妊娠黄体支持的情况下,妊娠可能是不稳定的,直到胎盘形成并开始分泌孕酮[1-2]。
1972年,Csapo等[2]研究证实在胎盘形成前切除黄体会导致流产。体外受精-胚胎移植(IVF-ET)过程中因促排卵用药及手术操作等影响,存在着明显的黄体功能不足[3-5]。因此,对IVF助孕后的患者进行充分的黄体支持显得非常重要[6-7]。多数学者认为妊娠8~10周后,胎盘合体滋养细胞是产生孕激素的主要来源,并在此基础上建议IVF助孕后黄体支持需进行至妊娠10~12周[8-10]。然而,由于卵巢黄体及胚胎滋养细胞交叉分泌孕激素的影响,目前关于胚胎滋养细胞开始独立合成并分泌孕激素的相关研究甚少。
地屈孕酮作为IVF助孕中黄体支持的药物之一,是一种强有力的口服孕激素受体激动剂[11-13]。地屈孕酮由天然孕激素逆转结构后形成。这种逆转结构的变化使得地屈孕酮与孕激素受体的结合力超过天然孕酮,且不与雌激素、雄激素受体结合,即口服后不产生雌激素、雄激素活性[14-18]。令人感兴趣的是,在临床应用中,由于地屈孕酮口服后按常规的孕激素试剂并不能检测出其在血中的浓度[5],利用这一特性,本研究探讨在冻融胚胎移植(frozen-thawed embryo transfer,FET)周期中胚胎滋养细胞独立分泌的孕激素在人血液中的动态变化,并为胚胎移植后进行黄体支持的时间及剂量提供可靠的依据。
对象与方法
一、研究对象
选取2019年3月1日至9月15日在本中心行冻融胚胎移植的患者进行前瞻性队列研究,患者年龄20~40岁,月经周期规律,随机纳入符合以上条件且用自然周期(natural cycle,NC)、人工周期(hormone replacement cycle,HRT)进行内膜准备的患者。排除孕前或孕期接受过放射性治疗、既往自然流产史、有疱疹病毒、巨细胞病毒、风疹病毒、弓形虫病毒感染的患者;甲状腺功能异常、高泌乳素血症患者也需排除。除地屈孕酮外,额外使用其他孕激素剂型进行黄体支持的患者也需要排除。对纳入患者的一般资料进行描述,包括平均年龄、体重指数(BMI)、不孕原因及移植胚胎情况。所有的研究对象均知情同意。
二、方法
1.内膜的准备及分组:依据内膜准备的方案不同,分为NC组和HRT组。NC组于月经周期第11天开始,定期用阴道B超监测子宫内膜增长情况以及卵泡大小,并结合血清黄体生成素( luteinizing hormone,LH) 、雌二醇(estradiol,E2 ) 和孕激素(progestin,Prog) 水平来确定排卵,排卵后立即给予地屈孕酮( 荷兰苏威制药公司,10 毫克 /片) 20 mg每日三次口服进行黄体支持,内膜转化5 d后在 B 超引导下进行囊胚移植。HRT组于月经来潮或孕激素撤药性出血第3天 起每日口服戊酸雌二醇片(补佳乐,拜耳中国有限公司,1毫克 /片) 3 mg,用药7 d后用阴道超声监测子宫内膜生长情况,若子宫内膜厚度≥7 mm,则继续按原剂量口服补佳乐5 d;若子宫内膜厚度<7 mm,则加量至口服补佳乐6毫克/天,总计口服补佳乐12~15 d,当子宫内膜厚度≥8 mm 时加用地屈孕酮20 mg每日三次口服进行内膜转化,5 d后进行囊胚移植,移植后继续按原剂量雌孕激素替代治疗。若妊娠,则继续原量黄体支持至孕8~10周后逐渐减量(图1)。
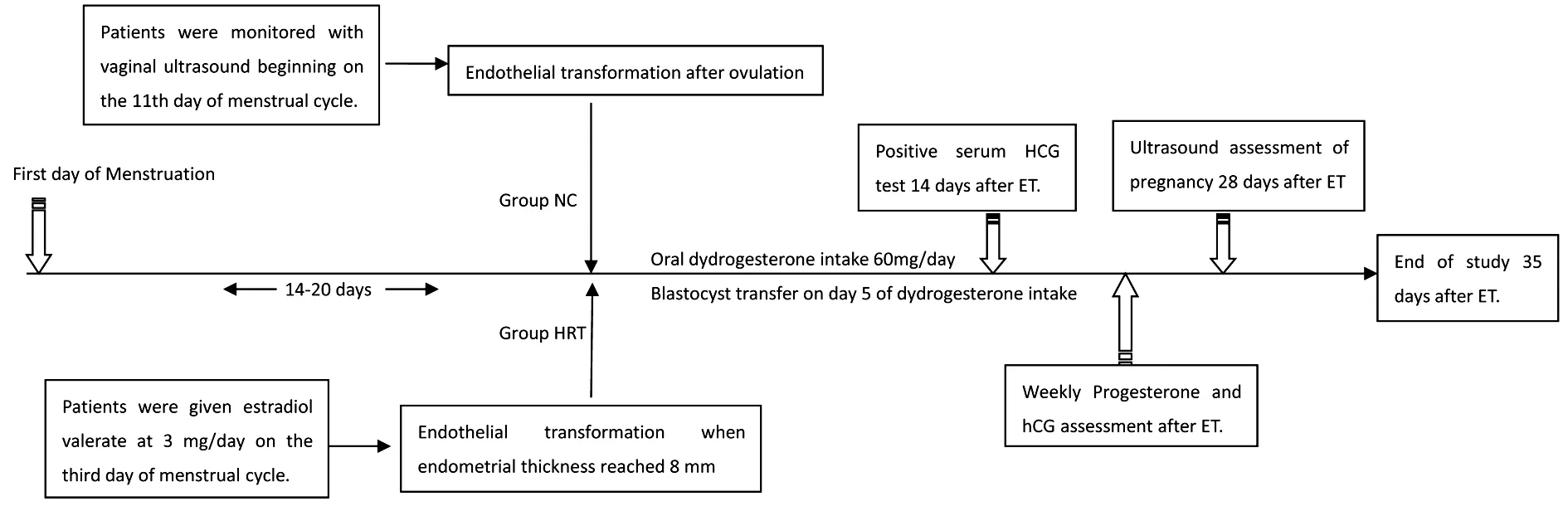
图1 解冻周期血清采样和超声检查时间Figure 1 The time of serum sampling and sonography for frozen-thaw embryo transfer cycle regimen
2.干预及检验指标:所有研究对象在移植后7 d、14 d、21 d、28 d、35 d分别抽取静脉血3~5 mL,以3 000 r/min离心5 min后取上层血清,置于2~8℃冰箱待检,用罗氏电化学发光免疫分析法(Elecsys ECLIA)检测血清孕激素及β-hCG水平,仪器与试剂为美国贝克曼公司生产的ACCESS2全自动免疫发光分析仪及其配套试剂。对于移植后14 d血β-hCG≥25 IU/L定义为生化妊娠,并于移植后7 d、14 d、21 d、28 d、35 d继续动态监测血清孕酮及β-hCG水平,并进行地屈孕酮黄体支持(图1)。对移植后未妊娠的患者,则终止血清孕酮及β-hCG水平的监测。
3.统计学处理:采用SPSS19.0进行数据处理及统计分析,计量资料以均数±标准差表示,组间比较采用t检验及方差分析;当数据不满足方差齐性检验时,采用Welch′s Anova和Kruskal-Wallis检验。对计数资料采用卡方检验或Fisher精确检验。P<0.05表示差异有统计学意义。
结 果
一、一般资料及妊娠随访情况
初步纳入患者共400例,其中HRT组218人,NC组182人,两组胚胎移植后14 d血hCG阳性的患者共258例(HRT组144人,NC组114人)。患者的年龄、不孕年限、基础泌乳素水平、原发/继发不孕症、体重指数(BMI)及平均移植胚胎数组间一般资料比较差异均无统计学意义,见表1。

表1 纳入的妊娠患者基本信息比较Table 1 Comparison of basic information of included pregnant patients
两组共有258例患者血清hCG阳性。其中HRT组的临床妊娠率为62.4%(136/218),其中26名患者因有先兆流产症状,予黄体酮注射液进行保胎治疗,2名患者因恐慌孕激素过低,但并无先兆流产症状,在当地医院自行使用黄体酮注射液治疗,6名患者拒绝每周孕激素监测。NC组中临床妊娠率为60.4%(110/182),8名患者随访中有先兆流产症状,予黄体酮注射液保胎治疗,2名患者因就诊路途遥远及个人因素拒绝每周的孕激素监测。最终对202名妊娠患者(HRT组102例,NC组100例)进行每周孕激素的监测,监测结果见表1、表2和图2。与NC组相比,HRT组的先兆流产发生率较高(19.1% vs.7.3%),差异有统计学意义。

表2 两组血清孕酮和 β-hCG水平比较Table 2 Comparison of serum progesterone and β-hCG levels between two groups
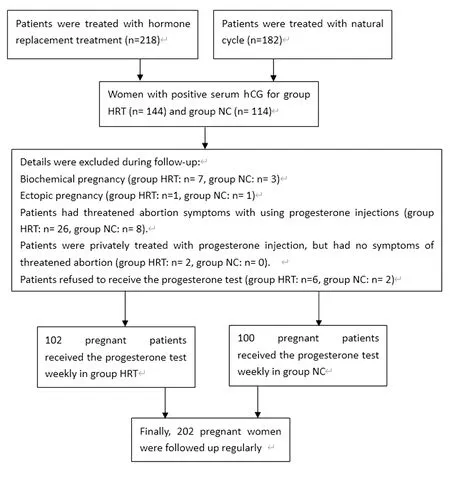
图2 解冻周期胚胎移植后妊娠结局随访情况Figure 2 Follow-up of pregnancy outcomes after the frozen-thaw embryo transfer cycle
二、两组血清孕激素和hCG水平的监测及比较
NC组在移植后7 d、14 d、21 d、28 d和35 d检测的血清孕激素平均水平为22.84 ng/mL,25.98 ng/mL,26.45ng/mL,28.04 ng/mL和28.75 ng/mL,无明显变化趋势(见图3)。HRT组在移植后7 d、14 d、21 d、28 d和35 d中的血孕激素检测的平均水平为0.77 ng/mL, 0.90 ng/mL, 2.22 ng/mL, 5.49 ng/mL和10.05 ng/mL,呈缓慢增长的趋势(见图4)(P<0.05)。HRT组中,孕激素从胚胎移植后14 d开始逐渐分泌,移植后21 d孕酮平均水平达到2.22 ng/mL。移植后28 d,有一定数量的孕激素分泌,孕激素平均水平达到5.49 ng/mL。移植后7 d、14 d、21 d、28 d、35 d,两组血中hCG水平均显著升高(P<0.05)。NC组移植后7 d、14 d、21 d、28 d、35 d孕激素水平明显高于HRT组(P<0.05)。两组hCG水平差异无统计学意义。
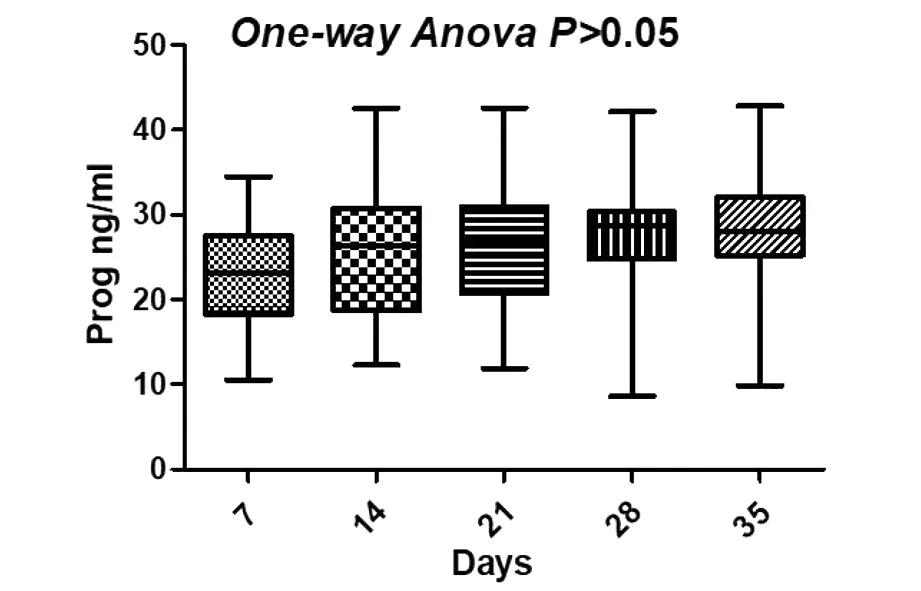
Annotation:The horizontal coordinate is the number of days(days) after FET, and the vertical coordinate is the concentration of progesterone level(ng/mL)图3 自然周期组孕酮水平监测情况Figure 3 Monitoring progesterone concentration in group NC
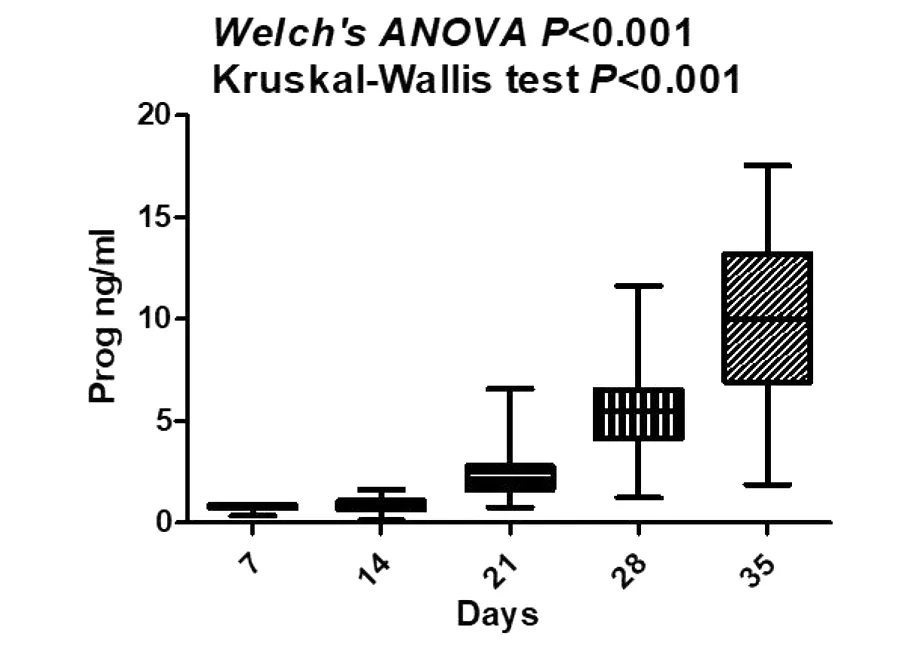
Annotation:The horizontal coordinate is the number of days(days) after FET, and the vertical coordinate is the concentration of progesterone level(ng/mL) 图4 人工周期组孕酮水平监测情况Figure 4 Monitoring progesterone in group HRT
讨 论
孕激素是雌激素的前体,妊娠8周前由滋养叶细胞及卵巢黄体分泌产生,妊娠8~10周后,胎盘合体滋养细胞是产生孕激素的主要来源[8,19]。在自然妊娠8周前,由于妊娠黄体产生孕激素的干预,目前关于胚胎滋养叶细胞独立开始分泌孕激素的时间及其动态变化的研究甚少。本研究通过冻融胚胎移植的人工周期的去黄体功能,使用地屈孕酮口服进行黄体支持。地屈孕酮由于其逆转结构,不能用常规孕酮测定试剂在血液中检测,结合地屈孕酮的逆转结构变化,用常规孕酮测定试剂来监测胚胎滋养叶细胞独立开始分泌孕激素的时间,为黄体支持持续的时间提供依据[5]。
在本次研究过程中,一共收集了NC和HRT两组妊娠数据,分别对其血清hCG及孕激素进行动态监测,并进行对比分析。本研究结果显示,在HRT组中,胚胎滋养细胞在移植后14~21 d开始有少量的孕激素分泌,移植后28 d分泌较多量的孕激素。目前,多数学者认为妊娠8~10周后,胎盘合体滋养细胞是产生孕激素的主要来源,并在此基础上建议IVF助孕后的患者调整外源性黄体支持用药剂量的时间是孕8~10周[8-10]。然而,这些学者虽然考虑到胎盘合体滋养细胞是产生孕激素的主要来源,却忽略了胚胎滋养细胞本身在妊娠早期也能同样分泌较多的孕激素。因此,依据本次研究的结果,建议在胚胎移植后28 d(即孕6周),可考虑调整外源性黄体支持的用量,甚至开始逐渐减量,以减轻患者经济负担以及大剂量黄体支持药物带来的相关副作用。本研究NC组中由于妊娠黄体的孕激素分泌,其孕激素的浓度一直处于较高的水平,并明显高于HRT组,但两组之间的血hCG水平并无差异。而血hCG作为人体妊娠的特异性激素,主要是增加孕激素及雌激素的分泌,从而促进子宫蜕膜形成,进而加快胎盘生长成熟,是促进胚胎生长发育的重要指标之一[20]。地屈孕酮作为黄体支持的药物之一,虽然常规的孕激素试剂并不能检测出其在血中的浓度,但患者在服用地屈孕酮后,药物仍具有较高的生物活性[8,21]。据估计,地屈孕酮的半衰期为5~7 h,而20a-羟基地屈孕酮的半衰期为14~17 h[21]。其作用前的受体调节主要是通过氧化还原酶1C1将地屈孕酮转化为具有生物活性的20a-羟基代谢物,继续发挥孕激素的效应[21]。地屈孕酮是天然孕激素经紫外线照射后产生的逆转异构体,与内源性孕激素具有相似的分子结构,仅在碳原子C6和C7之间多了一个双键,9、10位碳原子上的氢原子和甲基与天然孕激素反向[22-24]。这种“逆转”结构使得地屈孕酮对孕激素受体具有高度的亲和力,且结合力超过天然孕酮,没有雌激素和雄激素的特性,生物利用度高[17-18, 25]。在动物实验中,口服地屈孕酮与注射黄体酮作用相当[26]。此外,地屈孕酮的孕酮受体及其保留逆转录结构的代谢物的选择性较高[27]。
在本次研究的两组患者中,有部分患者出现先兆流产的症状,且HRT组较NC组先兆流产的发生率较高(19.1% vs.7.3%,P<0.05)。在地屈孕酮临床应用中,患者在检测血清孕激素浓度时无法看到地屈孕酮的效应,仅看到自身偏低的孕激素水平,可能会引起患者的过度恐慌,诱发先兆流产的症状,但也不排除地屈孕激素本身在HRT组进行黄体支持时药效相对缺乏[28-30]。有先兆流产症状的患者,均予黄体酮注射液进行保胎治疗,且结局良好。但随访中由于使用黄体酮注射液的干预,终止了血清孕酮及β-hCG水平的监测。由于随访过程中部分患者先兆流产症状的出现,需进行药物干预,以及部分妊娠患者拒绝监测孕激素的动态变化,导致较多的患者未能进入队列随访。尽管最终纳入此次队列研究的样本量较少,但仍能观测到胚胎滋养细胞开始分泌孕激素的时间及其动态变化的趋势。除此之外,此次研究还有一些不足的地方。本研究需妊娠患者每周复诊进行孕激素的检测,由于考虑到患者复诊的次数较多且多为外地就诊患者,就诊不便,此次研究仅检测到移植后35 d(即孕7周),并没有监测到孕激素达到稳定状态的时间。后续本中心将进行更全面、更长时间监测以及更大样本量的统计分析,来指导IVF助孕后进行黄体支持的有效时间。
本研究结果表明,胚胎滋养细胞分泌的孕激素在胚胎移植后14~21 d血液中可被检测到,在移植后28 d分泌的孕激素量明显增多。因此,建议胚胎移植后28 d(即孕6周),可考虑外源性黄体支持的调整用量,甚至开始逐渐减量,以减轻患者经济负担和可能产生的副作用。但地屈孕酮在HRT中黄体支持的药效及剂量仍需要后续更大样本量的研究。

