异鼠李素对6-羟基多巴胺诱导的神经元细胞毒性的影响及氧化损伤的保护作用
郑雨微 于浪潮 夏士杰 何雨曦 吕红明
(黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319)
氧化应激(Oxidative stress)是由于动物机体活性氧(Reactive oxygen species,ROS)的产生与抗氧化剂的防御之间的失衡,而致使组织器官损害的过程[1]。近年来,多项研究指出氧化应激严重影响鸡的繁殖性能,破坏仔猪肠道健康并参与奶牛多种营养代谢性疾病(如酮病、脂肪肝、低钙血症及乳房炎等)的进程[2-4]。另外,氧化应激还能引起动物下丘脑神经元损伤,抑制动物采食,降低其生产性能[5]。研究表明,5-羟色胺(5-HT)注射于脑室可激活细胞内的NADPH氧化酶,引起下丘脑ROS含量增加,进而促使动物采食量下降[6]。由此提示,探究增强动物机体的抗氧化能力、清除体内氧自由基及改善脑组织氧化损伤,可能是提高畜禽采食量及生产性能的一种有效策略。
核因子红细胞2相关因子2(Nuclear factor erythroid 2 related factor 2,Nrf2)是一种由7个结构域组成的重要核转录因子,其主要功能参与调节机体氧化还原。研究表明,Nrf2激活后可抑制过多的ROS聚集以平衡细胞的氧化应激,减轻机体组织氧化损害,改善神经毒素导致的神经细胞元损伤[7-8]。在正常情况下,Nrf2和Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)作为复合体存在于细胞质中,Keap1是Nrf2的天然抑制剂。然而,氧化刺激或小分子化合物能导致其构象变化使Keap1的降解,进而使Nrf2积累并转移到细胞核,激活Nrf2调控的下游抗氧化基因的表达,如血红素氧合酶-1(HO-1)[9]。大量研究表明,天然植物化合物可通过激活Nrf2信号通路缓解多种刺激物导致的神经元细胞损伤[10]。Wei等[11]表明鞣花酸可通过激活Nrf2信号保护多巴胺神经元免受鱼藤酮诱导的神经毒性。Wruck等[12]发现木犀草素通过依赖ERK介导的Keap1/Nrf2-ARE途径保护大鼠PC12和C6细胞免受1-甲基-4-苯基吡啶(1-methyl-4-phenyl-pyridinium,MPP+)诱导的神经损伤。
异鼠李素(Isorhamnetin,ISO)是一种存在于沙棘果实中的天然黄酮类化合物,具有良好的抗炎、抗氧化及神经保护作用[13]。有研究表明,异鼠李素通过增强细胞的抗氧化能力可有效缓解过氧化氢(H2O2)诱导的人永生化角质形成细胞(HaCaT)氧化损伤[14]。谭会洁等[15]揭示异鼠李素通过PI3K/Akt/GSK-3β/CREB信号通路可显著减轻鱼藤酮诱导的PC12细胞损伤。6-羟基多巴胺(6-hydroxydopamine,6-OHDA)是一种神经毒性化合物,经常用于体外诱导脑组织氧化损伤的模型[16]。异鼠李素能否通过上调Keap1/Nrf2抗氧化信号通路保护6-OHDA导致的神经元细胞损伤,尚未有相关研究。因而本研究利用6-OHDA诱导人神经元细胞系(SH-SY5Y)的神经毒性,探究异鼠李素对神经细胞元氧化损伤的保护作用,为氧化应激引发的动物脑组织损伤的防治提供有效策略。
1 材料与方法
1.1 试剂和试验材料
人神经母细胞瘤细胞(SH-SY5Y)购于北京北纳创联生物技术研究院;GSH检测试剂盒购自南京建成生物工程研究所;异鼠李素(ISO),纯度>98%,由成都普菲德生物技术有限公司提供(成都,中国);6-羟基多巴胺(6-OHDA)和二甲亚砜(DMSO)均由Sigma-Aldrich公司提供。试验所涉及的抗体主要购自Abcam(Cambridge MA USA)公司。DMEM培养基、胰蛋白酶由赛默飞世尔生物化学制品(美国)有限公司生产。除非有特别地说明,其他试剂均由Sigma-Aldrich(St.Louis,MO,USA)提供。
1.2 SH-SY5Y神经元细胞培养
SH-SY5Y培养于DMEM高糖培养基(其中含1%谷氨酰胺、3 mmol/L谷氨酰胺、10%胎牛血清、0.1%β-巯基乙醇、100 U/mL链霉素以及100 U/mL青霉素),并放置在湿度适宜含5% CO2的37 ℃恒温培养箱中培养。
1.3 SH-SY5Y神经元细胞活力检测
CCK-8试剂盒用于测定ISO对6-OHDA诱导SH-SY5Y神经元细胞活力的影响。首先,用胰酶消化并在对数期生长的SH-SY5Y细胞离心后,铺于96孔的培养板中,细胞计数每孔为5×103cells/孔,培养时间为24 h。然后,利用不同剂量的6-OHDA(50、75、150、300和600 μmol/L)刺激细胞24 h,以筛选最适合的6-OHDA刺激剂量。其次,在用6-OHDA(300 μmol/L)处理之前1 h,加入5、10和20 μmol/L的ISO,再共同处理24 h。然后,在每个小孔中添加10 μL CCK-8,放置于培养皿中2 h,最后用酶标仪检测450 nm下的吸光值,检测细胞活性。
1.4 SH-SY5Y神经元细胞的细胞凋亡检测
Hoechst 33342对细胞核进行染色,用于评估ISO对6-OHDA诱导SH-SY5Y神经元细胞活力的影响。首先,用胰酶消化并在对数期生长的SH-SY5Y细胞离心后,铺于12孔的培养板中,细胞计数每孔为2.5×105cells/孔,培养时间为24 h。其次,在用6-OHDA(300 μmol/L)处理之前1 h,加入5、10和20 μmol/L的ISO;再共同处理18 h后,在培养基中加入Hoechst 33342(2 μL/孔)作用15 min后,使用5 mL的固定液,固定10 min。最后,采用无菌的PBS液冲洗3遍后,用不同倍数的荧光显微镜观察细胞凋亡程度。
1.5 SH-SY5Y神经元细胞的氧化损伤检测
活性氧(ROS)探针检测ISO对6-OHDA诱导SH-SY5Y神经元细胞的氧化损伤的影响。首先,将SH-SY5Y细胞接种在96孔板(2×103cells/孔)中24 h。然后,将细胞置于不同浓度的ISO(5、10和20 μmol/L)中18 h,以及6-OHDA(300 μmol/L)中3 h,将细胞与50 mmol/L DCFH-DA孵育30 min,用检测器分别在激发和发射波长485和535 nm处评估DCF荧光强度,并使用荧光显微镜拍照。
1.6 SH-SY5Y神经元细胞的GSH含量检测
为检测细胞内还原谷胱甘肽(GSH)水平,评估ISO的抗氧化活性。首先,将SH-SY5Y神经元细胞在75 mm3培养皿中培养24 h,然后将细胞在不同浓度的ISO处理18 h,随后接受6-OHDA(300 μmol/L)3 h的刺激。根据试剂盒说明,利用GSH检测试剂盒对细胞内GSH水平进行量化,使用酶标仪测定405 nm处吸光度。
1.7 SH-SY5Y神经元细胞中Keap1的过表达
用于扩增Keap1全编码区序列的引物如下:5′-GCT CTA GAG CAT GCA GCC AGA TCC CAG GC-3′(Forword)和5′-CGC GGA TCC GCG TCA ACA GGT ACA GTT CTG CTG G-3′(Reverse)。然后,PCR产物经XbaI和BamHI酶切后克隆到表达载体VR1012中。用Viafect转染试剂(Promega)将重组载体VR1012-Keap1转染到SH-SY5Y神经元细胞系,以实现Keap1的过量表达[17]。
1.8 JC-1染色法检测SH-SY5Y神经元细胞的线粒体损伤
线粒体膜电位(ΔΨ)由JC-1染色测定。首先,SH-SY5Y细胞在12孔板中培养(2.5×105cells/孔);接着用ISO(20 μmol/L)处理细胞18 h后,再用6-OHDA(300 μmol/L)处理3 h。最后,利用JC-1(10 μg/mL)染料在37 ℃,避光,孵育20 min,再使用荧光显微镜拍照、保存。
1.9 Western blot分析SH-SY5Y神经元细胞的氧化应激相关蛋白、凋亡蛋白水平
收集处理好的细胞,加入混合蛋白酶抑制剂(10 μmol/L)和蛋白裂解液(RIPA),充分震荡后置于4 ℃冰箱中,裂解30 min。然后4 ℃ 12 000 r/min离心10 min,取上清。用BCA试剂测定样品中蛋白质的浓度,根据上样量加样相同数量的蛋白质。随后,经电泳、转膜、封闭、一抗(Nrf2抗体:A16737、Keap1抗体:ab66620、NQO1抗体:ab80588、HO-1抗体:ab68477、GCLC抗体:ab207777、GCLM抗体:ab126704、Caspase-3抗体:300968、Bax抗体:ab32503、Bcl-2抗体:ab59348、β-actin抗体:60008-1-Ig及Lamin B抗体:SGA1910)和二抗(辣根过氧化物酶标记的山羊抗兔二抗)孵育后。化学发光剂ECL,在显影仪器上显影,并使用Image Lab 4.0.1软件分析。
1.10 数据分析
所有试验都进行独立3次重复。所有数据利用SPSS 19.0(IBM)软件进行分析与统计,结果用Mean±SD表示。组间比较采用“One-way ANOVA”检验,多重比较实用LSD方法。并以P<0.05代表差异性显著,P<0.01代表差异性极显著。
2 结果与分析
2.1 ISO改善6-OHDA诱导的SH-SY5Y神经元细胞活性
本研究结果显示:不同浓度的6-OHDA(50、75、150、300和600 μmol/L)刺激SH-SY5Y细胞24 h均能显著降低细胞的存活率,其中300 μmol/L细胞活性接近50%(图1(a))。因此,300 μmol/L被选为后续试验的最佳刺激剂量。同时,研究结果表明了ISO(5、10和20 μmol/L)处理细胞可有效增加300 μmol/L 6-OHDA降低的细胞存活率且呈剂量依赖性,其中ISO(20 μmol/L)治疗组细胞存活率高达70%,而单独使用ISO(20 μmol/L)处理组细胞活性无明显下降(图1(b))。此外,通过细胞形态学观察,6-OHDA可诱发明显的形态学变化,导致细胞损伤和萎缩、促进细胞死亡,进而显著减少细胞的数量,而经ISO(5、10和20 μmol/L)处理能不同程度地改善细胞损伤和增多细胞数量(图1(c))。
2.2 ISO抑制6-OHDA诱导的SH-SY5Y神经元细胞凋亡
如图2(a)~(b)所示:与空白组(Control)相比,300 μmol/L的6-OHDA能显著诱导细胞凋亡(凋亡细胞的细胞核呈致密浓染),细胞凋亡率为40%左右,而经ISO(5、10和20 μmol/L)处理后SH-SY5Y凋亡细胞呈剂量依赖性减少,其中高剂量的凋亡细胞降低至15%左右。同时,凋亡蛋白的检测结果显示:6-OHDA(300 μmol/L)可显著促进Bax和Caspase-3的激活,并抑制Bcl-2的表达,而ISO(20 μmol/L)可有效降低Bax和剪切型Caspase-3的表达,并上调Bcl-2和前体型Caspase-3的蛋白水平(图2(c)~(g))。
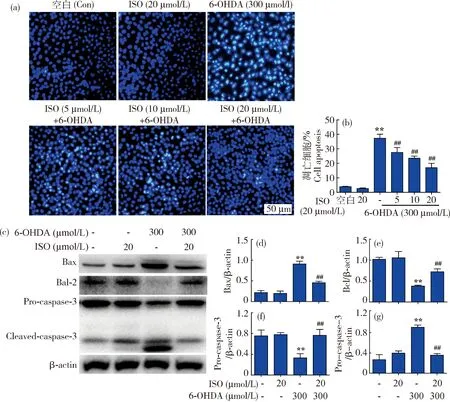
(a)~(b)Hoechst染色及分析(200×);(c)Western blot分析凋亡相关蛋白Bax、Bcl-2及Caspase-3;(d)~(g)相应蛋白的灰度分析。
2.3 ISO减轻6-OHDA诱导的SH-SY5Y神经元细胞的氧化应激
胞内活性氧(ROS)聚集是导致神经毒性的重要原因之一。本试验结果表明,与空白组(Control)相比,300 μmol/L的6-OHDA可显著诱导ROS过多产生(P<0.01),而ISO(20 μmol/L)处理后可显著减少6-OHDA诱导的ROS过度积累(图3(a)~(b))。此外,结果还显示300 μmol/L的6-OHDA能明显消耗细胞中GSH的含量(P<0.05),而ISO(20 μmol/L)处理后可显著减少GSH的消耗(P<0.05)(图3(c))。
2.4 ISO改善6-OHDA诱导的SH-SY5Y神经元细胞的线粒体损伤
线粒体膜电位(MMP,ΔΨm)的下降是细胞凋亡和线粒体功能障碍的早期阶段的一个标志性事件。当线粒体膜电位低时,JC-1产生绿色荧光,代表MMP崩溃;反之,JC-1产生红色荧光。6-OHDA(300 μmol/L)可诱导绿色荧光点的数量显著增加,而ISO(20 μmol/L)能明显减少绿色荧光点的数量,而增加红色荧光。这些结果提示,ISO可有效改善6-OHDA诱发的线粒体功能紊乱(图4)。
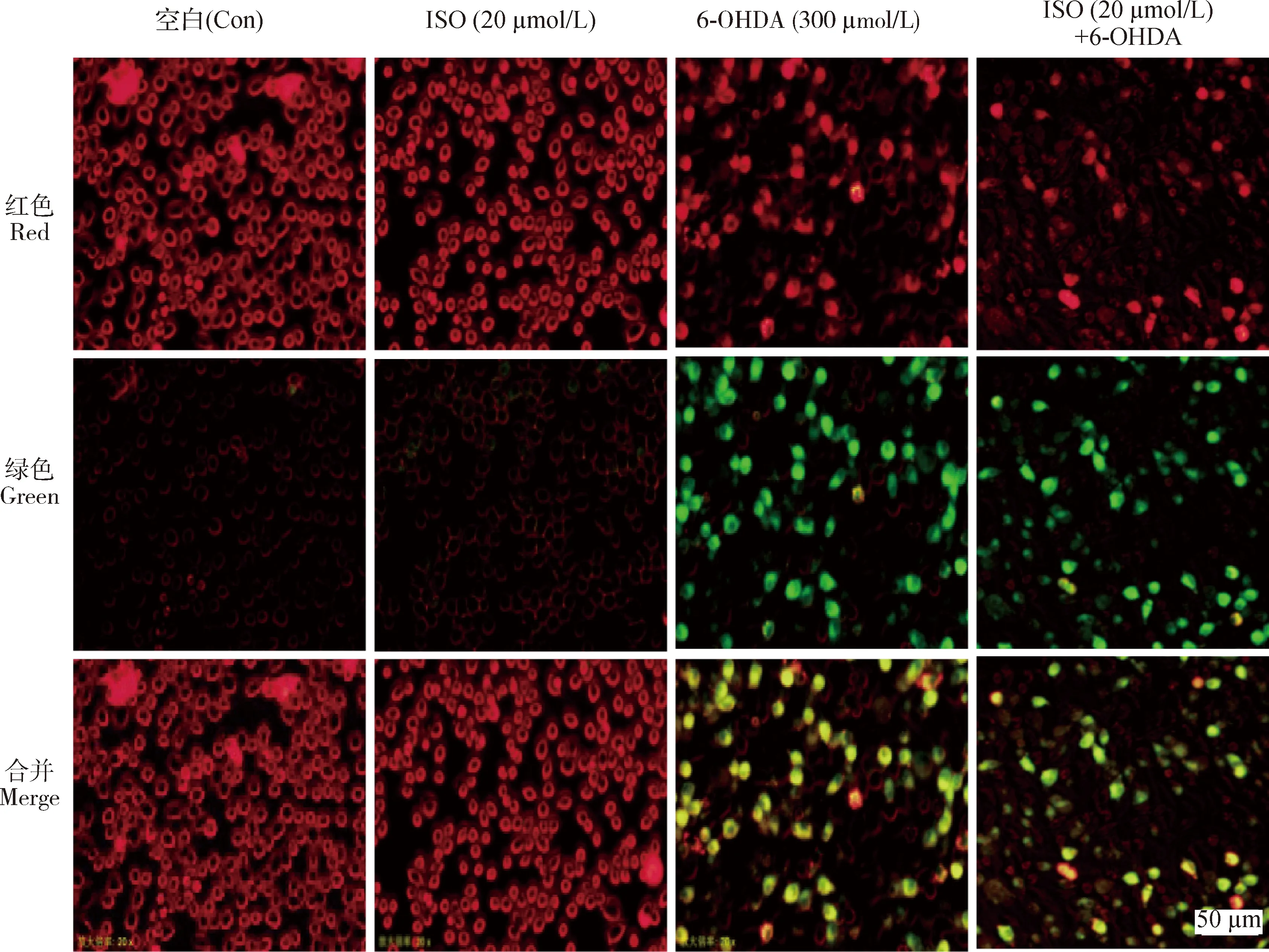
红色代表正常细胞;绿色代表线粒体膜电位损伤细胞,200×。
2.5 ISO增强SH-SY5Y神经元细胞中抗氧化蛋白的表达
鉴于GCLC、GCLM、HO-1和NQO1是细胞中重要的抗氧化蛋白,因而本试验进一步检测ISO对GCLC、GCLM、HO-1与NQO1表达水平的影响。首先,不同浓度ISO(2.5、5、10和20 μmol/L)处理SH-SY5Y细胞18 h。结果显示,ISO能显著促进抗氧化蛋白GCLC、GCLM、HO-1和NQO1表达(P<0.05),其中20 μmol/L的ISO效果最佳(图5)。
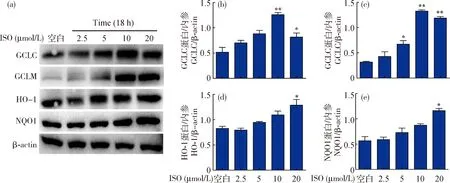
(a)Western blot分析抗氧化蛋白GCLC、GCLM、HO-1和NQO1表达情况;(b)~(e)相应蛋白的灰度分析。
2.6 ISO上调SH-SY5Y神经元细胞中Keap1/Nrf2信号通路
核转录因子Nrf2对多种抗氧化酶(如GCLC、GCLM、HO-1和NQO1等)具有关键的调控作用,而Keap1可负向调节Nrf2。本研究结果表明,ISO可有效增加Nrf2的核转位,并降低其细胞质水平(图6(a)~(b))。为明确ISO激活的Nrf2信号是否直接被Keap1抑制所调节,进行过表达SH-SY5Y细胞Keap1。结果显示,Keap1的过表达能显著降低ISO增强的Nrf2、GCLC、GCLM、HO-1和NQO1蛋白的表达,这表明ISO介导的抗氧化蛋白的表达与Keap1/Nrf2信号通路密切相关(图6(c)~(g))。

(a)Western blot分析Nrf2浆核蛋白表达情况;(c)Western blot分析过表达Keap1(OE-Keap1)后对Keap1、Nrf2、NQO1及HO-1蛋白表达影响;(b),(d)~(e)相应蛋白的灰度分析。
2.7 ISO逆转6-OHDA降低的Nrf2抗氧化信号通路
基于上述结果,本试验进一步检测了ISO对6-OHDA诱导的SH-SY5Y细胞抗氧化蛋白表达的影响。结果显示,300 μmol/L的6-OHDA能显著降低抗氧化蛋白Nrf2、GCLC、HO-1与NQO1的表达,而ISO(20 μmol/L)处理后可有效恢复这些蛋白的表达(图7)。
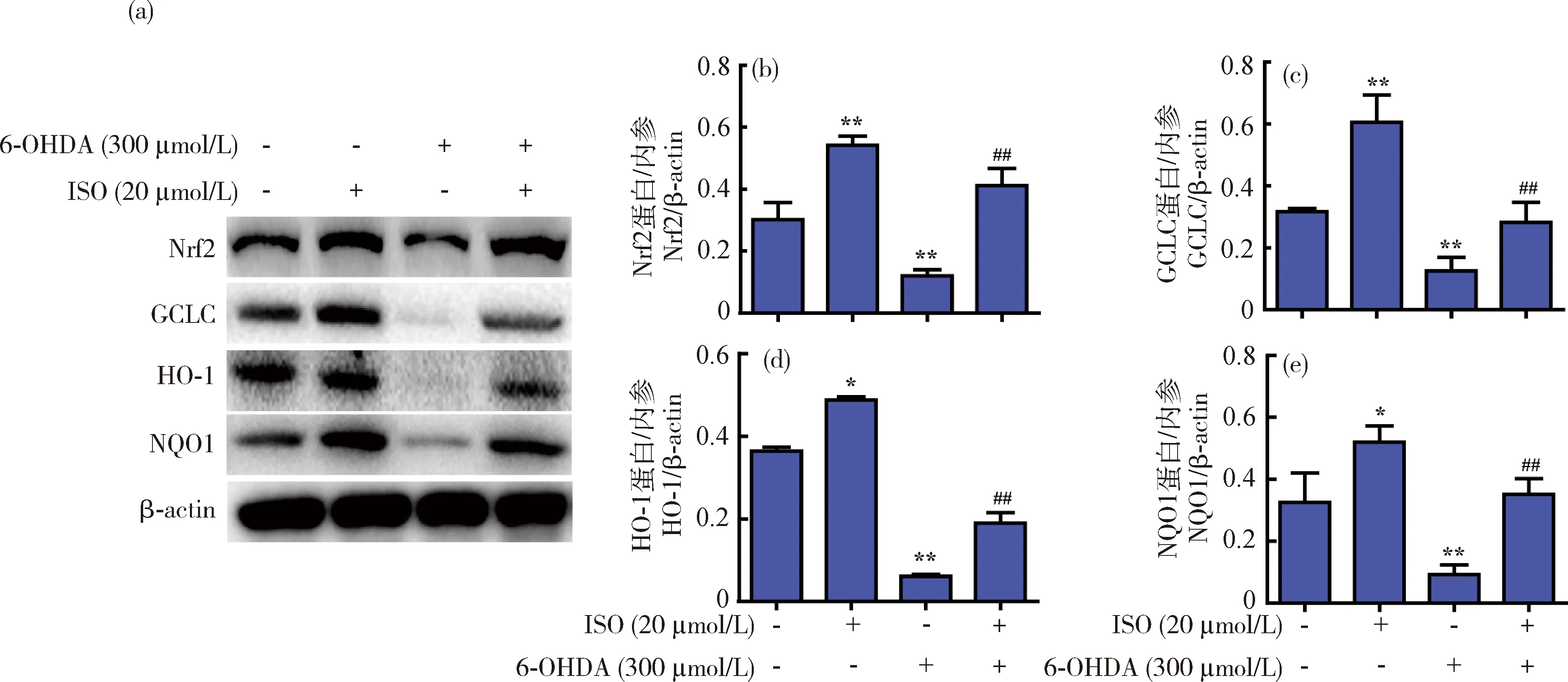
(a)Western blot分析Nrf2、GCLC、NQO1及HO-1蛋白表达影响;(b)~(e)相应蛋白的灰度分析。
3 讨 论
饲料是畜禽获取营养的主要来源,但由于储存与生产过程中易受空气氧化,引起氧化变性、蛋白质破坏,而产生有毒有害的物质,进而导致动物机体氧化损伤及采食量降低,严重影响畜牧业的经济效益[18-19]。在饲料中添加适量的抗氧化剂可有效改善在储存过程中饲料的氧化等问题,并能有效防止饲料氧化造成的畜禽机体氧化损伤。近年来,研究发现抗氧化剂还能通过减少下丘脑ROS含量,增加其下丘脑促采食神经元的NPY/AgRP蛋白表达,提高动物的采食量,继而增强其生产性能[20]。天然植物化合物因具有来源广泛、毒副作用小及药理活性多样,在神经损伤保护作用的应用中备受研究者关注[21]。ISO作为一种果实食用性黄酮类小分子化合物,具有良好的抗氧化、抗炎和抗凋亡活性[22]。本研究表明,ISO可通过上调Nrf2抗氧化通路有效缓解6-OHDA诱导的细胞氧化应激、细胞凋亡及线粒体损伤,进而改善神经元细胞的损伤。
有研究表明,6-羟基多巴胺(6-OHDA)是一种选择性的儿茶酚胺能神经毒素,常用于神经元细胞氧化损伤的模型[23]。6-OHDA可以被多巴胺转运器接受,通过抑制线粒体电子转运链复合物I和IV,而导致过多的ROS产生[24]。在长寿的非有丝分裂细胞(如神经元)中,氧化应激是由线粒体ROS的过度产生或抗氧化防御系统的损害所引起,继而导致线粒体功能障碍和细胞死亡级联的启动[25]。此外,腹腔注射脂肪乳剂可导致下丘脑ROS含量增加,促使动物采食量下降,而清除ROS含量,则能提高其采食量[26]。本研究表明,6-OHDA可以显著增加神经元细胞的神经毒性、细胞凋亡和死亡,引起过多的ROS聚集,而经ISO处理后可有效地缓解神经元细胞这些损伤。此外,有研究指出,Bcl-2家族和caspase家族在调控细胞凋亡的途径中起着极其重要的作用,尤其是线粒体途径[24]。Bcl-2是细胞凋亡信号转导途径的关键调控者,通过线粒体途径调控细胞色素c的释放。Caspase-3是级联反应下游的凋亡最关键的执行者,其激活主要取决于细胞色素c的释放[25]。本研究发现ISO通过抑制Caspase-3的激活和Bax的表达及上调Bcl-2蛋白水平,逆转了6-OHDA诱导的细胞凋亡。考虑到ROS的积累会导致线粒体功能紊乱并引发细胞凋亡,本研究进一步探究了ISO对ROS的产生和6-OHDA诱导的SH-SY5Y细胞中的线粒体功能障碍的影响。本研究结果表明,6-OHDA显著促进了ROS的产生并加剧了线粒体的损伤,而ISO处理可有效改善ROS产生和线粒体损伤。综上所述,这些研究表明ISO通过抑制6-OHDA诱导的氧化应激,进而改善其导致神经毒性、线粒体损伤、细胞凋亡和细胞凋亡相关蛋白表达。
目前,核转录因子(Nrf2)是一种与应激反应有关的转录因子,在体内和体外都能减轻多种氧化剂如MPP+/MPTP、鱼藤酮、6-OHDA和过氧化氢的导致的机体组织细胞的氧化损伤[26-27]。Keap1-Nrf2/ARE信号通路在保护细胞对抗内源性和外源性应激方面起至关重要的作用,而Keap1与Nrf2结合存在胞浆中,Nrf2不能表现出生物活性[28]。事实上,包括天然化合物在内的许多生物活性分子都依赖于Nrf2的活化来调控各种抗氧化酶的表达,调节G-谷氨酰半胱氨酸连接酶催化(GCLC)/调节(GCLM)亚单位、NAD(P)H:醌氧化还原酶(NQO1)和Ⅱ期解毒酶(血红素氧合酶,HO-1)的表达等,以防止氧化应激、线粒体功能紊乱和神经炎症[29-30]。在本研究结果中发现,不同剂量的ISO(尤其是20 μmol/L)处理SH-SY5Y神经元细胞18 h能显著增加抗氧化基因HO-1、GCLM、GCLC和NQO1的表达。此外,ISO处理能显著促进Nrf2的核转位,降低细胞质中Nrf2的比率。然而,过表达Keap1后能显著逆转ISO提高的Nrf2、HO-1和NQO1的蛋白表达水平,这表明ISO可能通过促进Keap1的降解而导致Nrf2入核被激活。此外,据报道6-OHDA可通过抑制Nrf2抗氧化信号通路,以破坏神经元细胞氧化-抗氧化平衡,进而导致细胞氧化损伤[31]。的确,在研究结果中也发现6-OHDA能显著引起Nrf2、GCLC、HO-1和NQO1的蛋白表达下降,而经20 μmol/L的ISO处理后能显著恢复这些抗氧化蛋白的表达。
4 结 论
ISO可上调Keap1/Nrf2及其下游抗氧化相关蛋白GCLC、GCLM、HO-1和NQO1的表达,进而保护神经元细胞免受6-OHDA诱导的神经毒性、氧化应激和线粒体损伤。本研究将有助于对氧化应激造成的神经元损伤的防治提供新策略及新饲料抗氧化添加剂的研发奠定理论基础,具有重要的科学意义和应用价值。

