不同品种羔羊胃肠道微生物发育规律的比较研究
刘 洁 李 伟 李 鑫 任二军 刘进军 王朋然 韩学良 张英杰
(1.石家庄市农林科学研究院,石家庄 050041;2.河北农业大学动物科技学院,保定 071000)
动物的胃肠道定植着复杂和多样的微生物菌群,共生微生物对宿主健康在平衡免疫反应、消化营养物质和调节宿主生理等方面有着至关重要的作用。遗传背景对胃肠道微生物的结构和组成具有较大影响,每个动物机体胃肠道都含有属于自己的微生物组。胃肠道微生物对于植物纤维的消化、动物生产性能和健康都具有重要作用,但是微生物特征的遗传性、宿主遗传成分与瘤胃微生物的关联,以及这些遗传成分与宿主生产性能的关联目前还是未知。研究表明,动物胃肠道微生物菌群差异的原因主要包括宿主基因型、宿主年龄、宿主饲粮等[1-8]。宿主基因型的多样性可引起胃肠道菌群不同,每个动物机体胃肠道都含有属于自己的微生物组,遗传背景对胃肠道微生物的结构和组成的具有非常大的影响[9-10]。不同物种间胃肠道菌群多样性差异显著[11-12]。在同一饮食和管理条件下的同一物种,不同品种的动物胃肠道微生物菌群结构和组成也存在一定差异[13-17]。
道赛特羊属肉用型绵羊引入品种,原产于澳大利亚和新西兰,具有生长发育快、体型大、肉用性能好、常年发情、适应性强等特点[18]。湖羊原产于太湖流域的浙江和江苏一带,具有性成熟早、繁殖力高、四季发情、前期生长速度较快、耐湿热、耐粗饲、宜舍饲、适应性强等优良性状[19]。小尾寒羊原产于黄河流域的山东、河北及河南一带,具有性成熟早、繁殖率高、生长发育快、屠宰率高、肉质细嫩、裘用价值高、适应性强、耐粗饲等优良特点[20]。湖羊和小尾寒羊均是我国著名的绵羊品种,优点是繁殖性能高、产羔多,但生长速度相对国外引进专门化肉羊品种较慢。从开食到断奶前后是羔羊生长和消化系统发育的关键阶段,虽然羔羊抗病力差,易发生腹泻等疾病,但不同品种羔羊在补料和断奶等关键环节表现出的生长潜力和抗逆性不同。微生物参与动物的生长、发育、消化、吸收、营养、免疫、生物拮抗等方面的过程。研究表明,不同品种的动物胃肠道微生物的种类虽然有可能具有一定的相似性,但其胃肠道内的菌群的分布及数量仍然有一定的差异性,可能是导致不同品种具有不同生产特性的原因[21-28]。因此,本研究以道赛特羊、湖羊和小尾寒羊为研究对象,在相同饲养管理条件下,通过高通量测序技术分析比较不同品种绵羊羔羊瘤胃和直肠菌群结构的差异性,揭示不同品种羔羊胃肠道微生物发育规律,为研究羔羊胃肠道菌群和宿主关系及健康养殖提供理论基础。
1 材料与方法
1.1 试验设计和饲粮
试验于2020年10月至2021年1月在河北省衡水市志豪牧业有限公司进行。试验羔羊均来自同一批次开展同期发情和人工授精的纯种繁育母羊,选取同一产房、胎次和性别相同的1日龄不同品种羔羊各10窝,均为单羔,其中道赛特羊、湖羊和小尾寒羊公羔各10只。15日龄从产房转入母子圈,并开始补饲相同商品羔羊料(购自联英饲料有限公司,主要由玉米、豆粕、玉米胚芽粕、石粉、氯化钠等组成;营养水平为总能16.72 MJ/kg,粗蛋白质18.03%,中性洗涤纤维23.16%,酸性洗涤纤维11.99%)。75日龄一次性断奶,母羊转移,羔羊留在母子圈,饲喂全混合日粮(total mixed ration,TMR),直至120日龄试验结束。TMR组成及营养水平见表1。试验期内,所有试验羊均由固定人员进行专门饲养,每日分别在07: 00和16: 00各饲喂1次,自由采食和饮水。
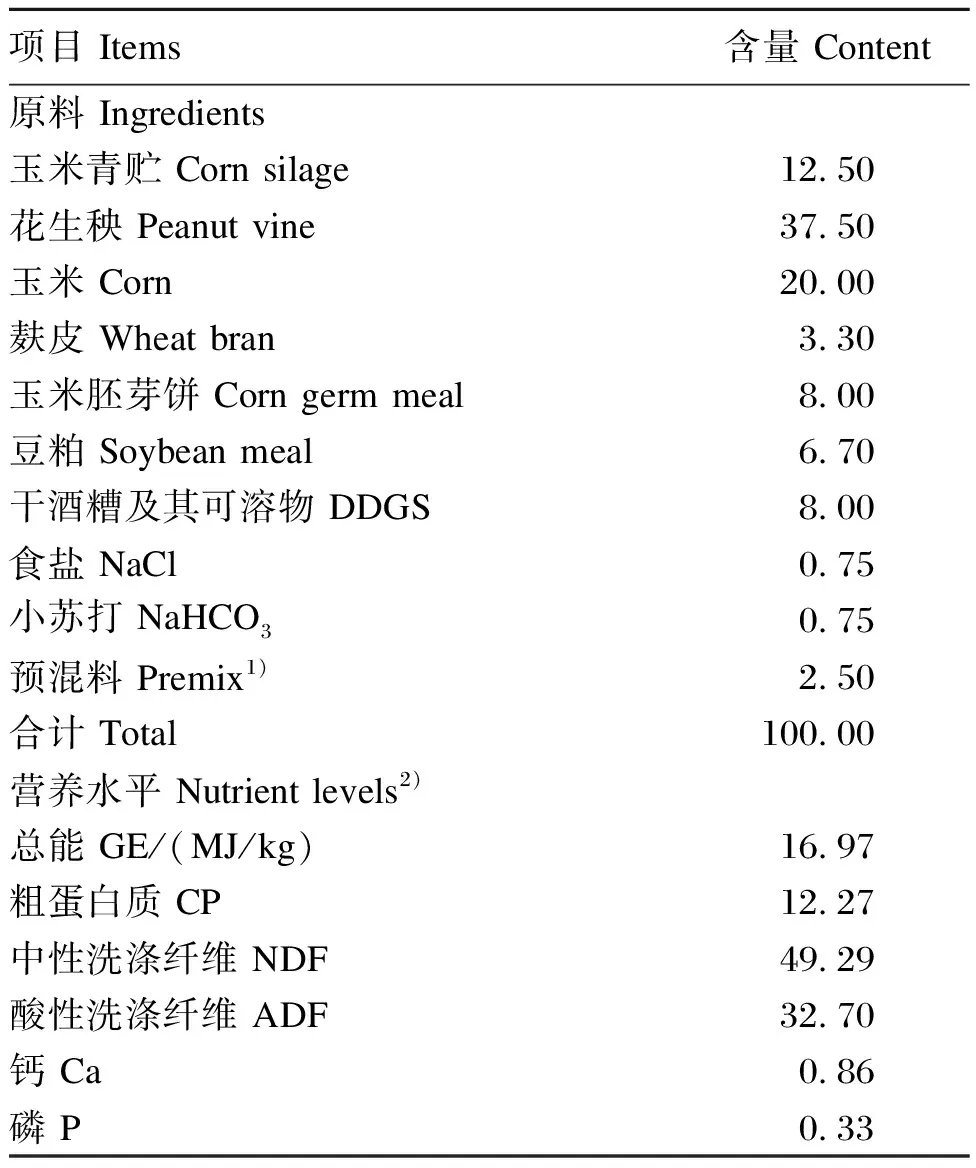
表1 全混合日粮组成及营养水平(干物质基础)
1.2 样品采集及测序分析
在羔羊出生后20(转圈补料后)、70(断奶前)、90(断奶后)和120日龄(4月龄),晨饲前每组采集5只体重相近羔羊的瘤胃液和粪便样品,瘤胃液采用瘤胃导管从口腔采集,粪便样品通过佩戴一次性手套从直肠采集,迅速装入2 mL无菌离心管中,置于液氮速冻,存放于-80 ℃冰箱保存待测。
瘤胃和直肠微生物区系分析采用高通量测序Illumina MiSeq PE300平台(北京奥维森基因科技有限公司)。细菌16S rRNA基因V3~V4区选用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)扩增。真菌内转录间隔区(ITS)选用引物ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-TGCGTTCTTCATCGATGC-3′)扩增。绘制韦恩图分析共有操作分类单元(OTU)和特有OTU数量。采用Chao1指数、覆盖度、观测到的物种数、PD whole tree指数、香农指数和辛普森指数分析Alpha多样性。采用主坐标分析(PCoA)方法评价Beta多样性,并用相似性分析(ANOSIM)方法进行OTU数量的组间差异检验。比较相对丰度>1.0%的菌群在门水平和属水平的组间差异。
1.3 数据统计分析
试验数据采用Excel 2019初步整理,采用SPSS 22.0统计软件进行双因素方差分析(two-way ANOVA),差异显著者采用Duncan氏法分析进行多重比较检验。结果用平均值和均值标准误(SEM)表示,P<0.05为差异显著,P>0.05为差异不显著,0.05≤P<0.10为有显著趋势。
2 结果与分析
2.1 不同品种羔羊的瘤胃细菌区系
2.1.1 不同品种羔羊的瘤胃细菌特异性分析
由图1可知,20日龄时,3个品种羔羊瘤胃细菌共计2 938个OTU,共有OTU为928个,占总OTU的31.59%;道赛特羊、湖羊和小尾寒羊OTU分别为1 873、1 705和2 151个,特有OTU分别为213、291和571个;小尾寒羊OTU和特有OTU数量最多(图1-A)。70日龄时,3个品种羔羊瘤胃细菌共计2 058个OTU,共有OTU为976个,占总OTU的47.42%;道赛特羊、湖羊和小尾寒羊OTU分别为1 681、1 378和1 537个,特有OTU分别为215、112和169个;道赛特羊OTU和特有OTU数量最多(图1-B)。90日龄时,3个品种羔羊瘤胃细菌共计2 631个OTU,共有OTU为1 440个,占总OTU的54.73%;道赛特羊、湖羊和小尾寒羊OTU分别为2 044、2 090和2 111个,特有OTU分别为163、125和169个;小尾寒羊OTU和特有OTU数量最多(图1-C)。120日龄时,3个品种羔羊瘤胃细菌共计2 380个OTU,共有OTU为1 360个,占总OTU的57.14%;道赛特羊、湖羊和小尾寒羊OTU分别为1 953、1 801和1 949个,特有OTU分别为136、95和186个;道赛特羊OTU数量最多,小尾寒羊特有OTU数量最多(图1-D)。
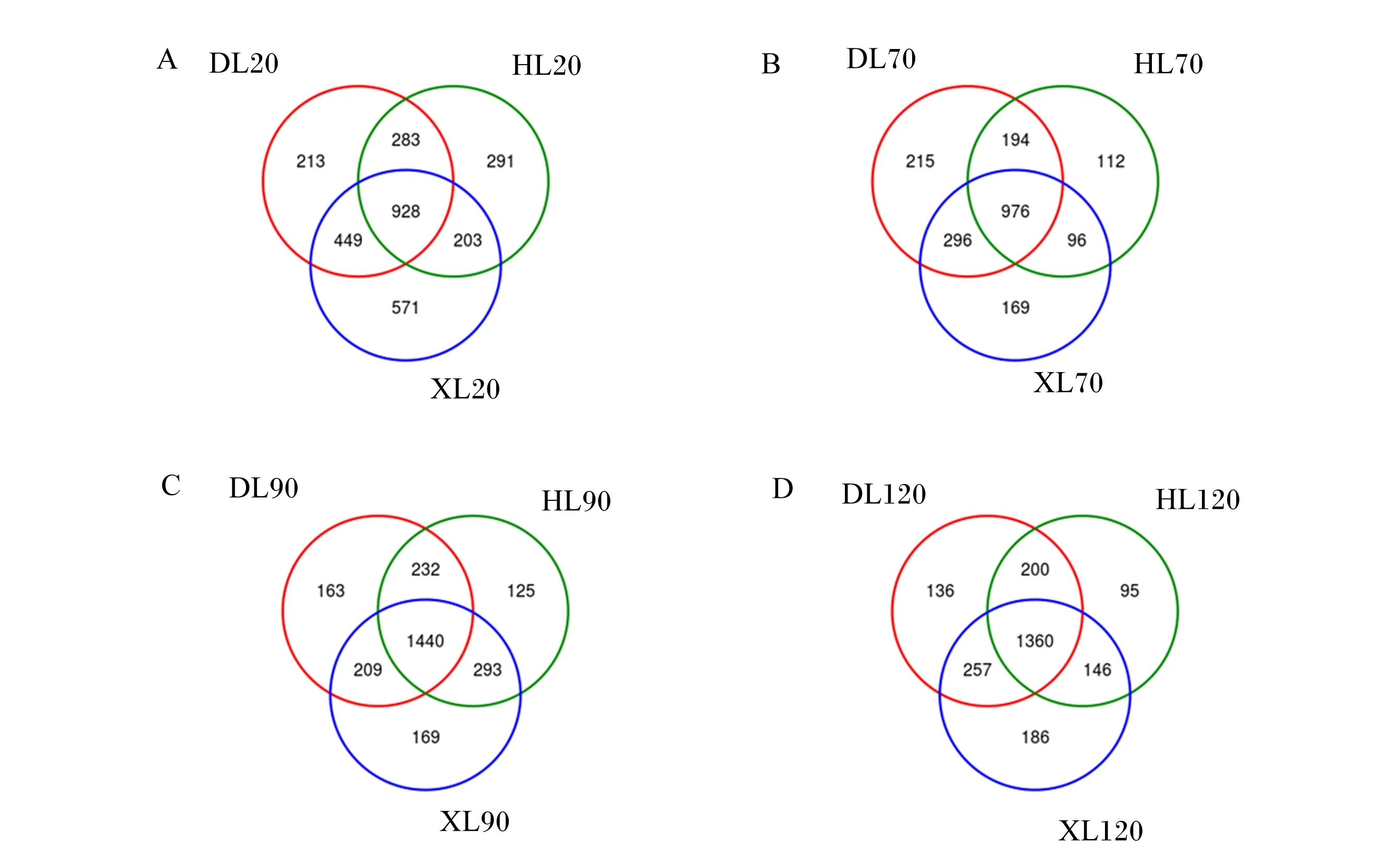
DL20:20日龄道赛特羊;HL20:20日龄湖羊;XL20:20日龄小尾寒羊;DL70:70日龄道赛特羊;HL70:70日龄湖羊;XL70:70日龄小尾寒羊;DL90:90日龄道赛特羊;HL90:90日龄湖羊;XL90:90日龄小尾寒羊;DL120:120日龄道赛特羊;HL120:120日龄湖羊;XL120:120日龄小尾寒羊。下图同。
2.1.2 不同品种羔羊的瘤胃细菌Alpha多样性分析
由表2可知,小尾寒羊瘤胃细菌PD whole tree指数显著高于湖羊(P<0.05),与道赛特羊之间差异不显著(P>0.05)。日龄对瘤胃细菌Alpha多样性指数无显著影响(P>0.05)。
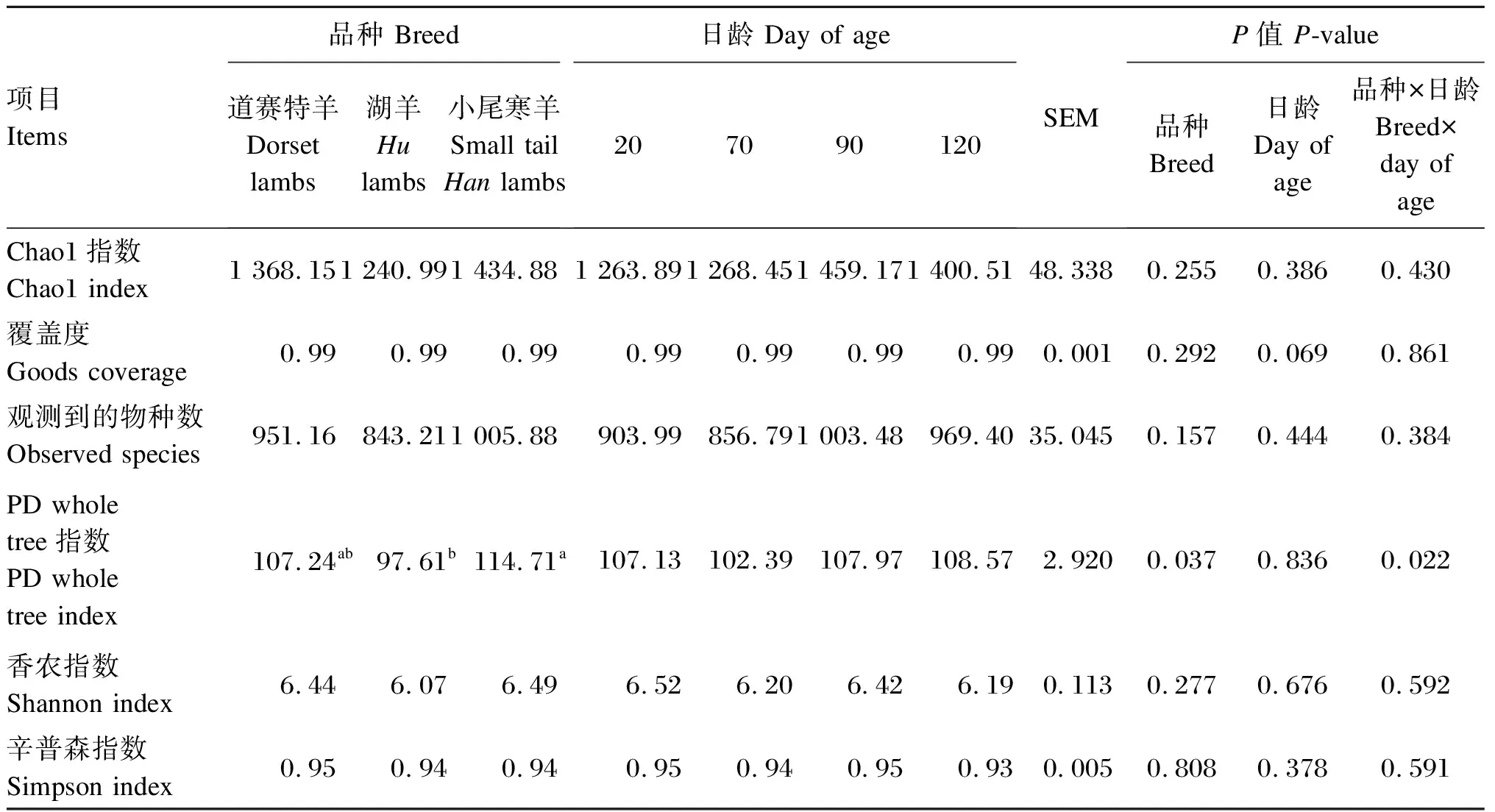
表2 不同品种羔羊的瘤胃细菌Alpha多样性分析
2.1.3 不同品种羔羊的瘤胃细菌Beta多样性分析
由图2可知,基于Bray-Curtis的主坐标分析联合相似性分析结果表明,20和90日龄时,不同品种之间瘤胃细菌群落差异显著(P<0.05);其他日龄时,不同品种之间瘤胃细菌群落差异不显著(P>0.05)。
2.1.4 不同品种羔羊的瘤胃细菌结构分析
由表3可知,在瘤胃细菌门水平上(相对丰度>1.0%),道赛特羊和湖羊的互养菌门相对丰度显著高于小尾寒羊(P<0.05),道赛特羊和湖羊之间差异不显著(P>0.05)。日龄显著影响羔羊的拟杆菌门、厚壁菌门、放线菌门和互养菌门相对丰度(P<0.05),对变形菌门相对丰度无显著影响(P>0.05)。
由表4可知,在瘤胃细菌属水平上(相对丰度>1.0%),小尾寒羊理研菌科RC-9肠道群和克里斯滕森菌科R-7群相对丰度显著高于道赛特羊和湖羊(P<0.05),道赛特羊和湖羊之间差异不显著(P>0.05);小尾寒羊瘤胃球菌科NK4A214群和厌氧弧菌属相对丰度显著高于湖羊(P<0.05),与道赛特羊之间差异不显著(P>0.05);不同品种之间其他菌属相对丰度均差异不显著(P>0.05),小尾寒羊普雷沃氏菌属相对丰度表现出降低的趋势(P=0.063)。日龄显著影响羔羊的普雷沃氏菌属、解琥珀酸菌属、瘤胃球菌属、普雷沃氏菌科NK3B31群、克里斯滕森菌科R-7群、毛螺菌科NK3A20群相对丰度(P<0.05),对其他菌属相对丰度无显著影响(P>0.05)。
2.2 不同品种羔羊瘤胃真菌区系
2.2.1 瘤胃真菌特异性分析
由图3可知,20日龄时,3个品种羔羊瘤胃真菌共计1 408个OTU,共有OTU为456个,占总OTU的32.39%;道赛特羊、湖羊和小尾寒羊OTU分别为870、861和964个,特有OTU分别为130、137和310个;小尾寒羊OTU和特有OTU数量最多(图3-A)。70日龄时,3个品种羔羊瘤胃真菌共计1 001个OTU,共有OTU为483个,占总OTU的48.25%;道赛特羊、湖羊和小尾寒羊OTU分别为738、716和773个,特有OTU分别为77、90和91个;小尾寒羊OTU和特有OTU数量最多(图3-B)。90日龄时,3个品种羔羊瘤胃真菌共计1 149个OTU,共有OTU为367个,占总OTU的31.94%;道赛特羊、湖羊和小尾寒羊OTU分别为635、693和804个,特有OTU分别为169、132和232个;小尾寒羊OTU和特有OTU数量最多(图3-C)。120日龄时,3个品种羔羊瘤胃真菌共计1 609个OTU,共有OTU为455个,占总OTU的28.28%;道赛特羊、湖羊和小尾寒羊OTU分别为1 081、1 037和749个,特有OTU分别为366、312和128个;道赛特羊OTU和特有OTU数量最多(图3-D)。
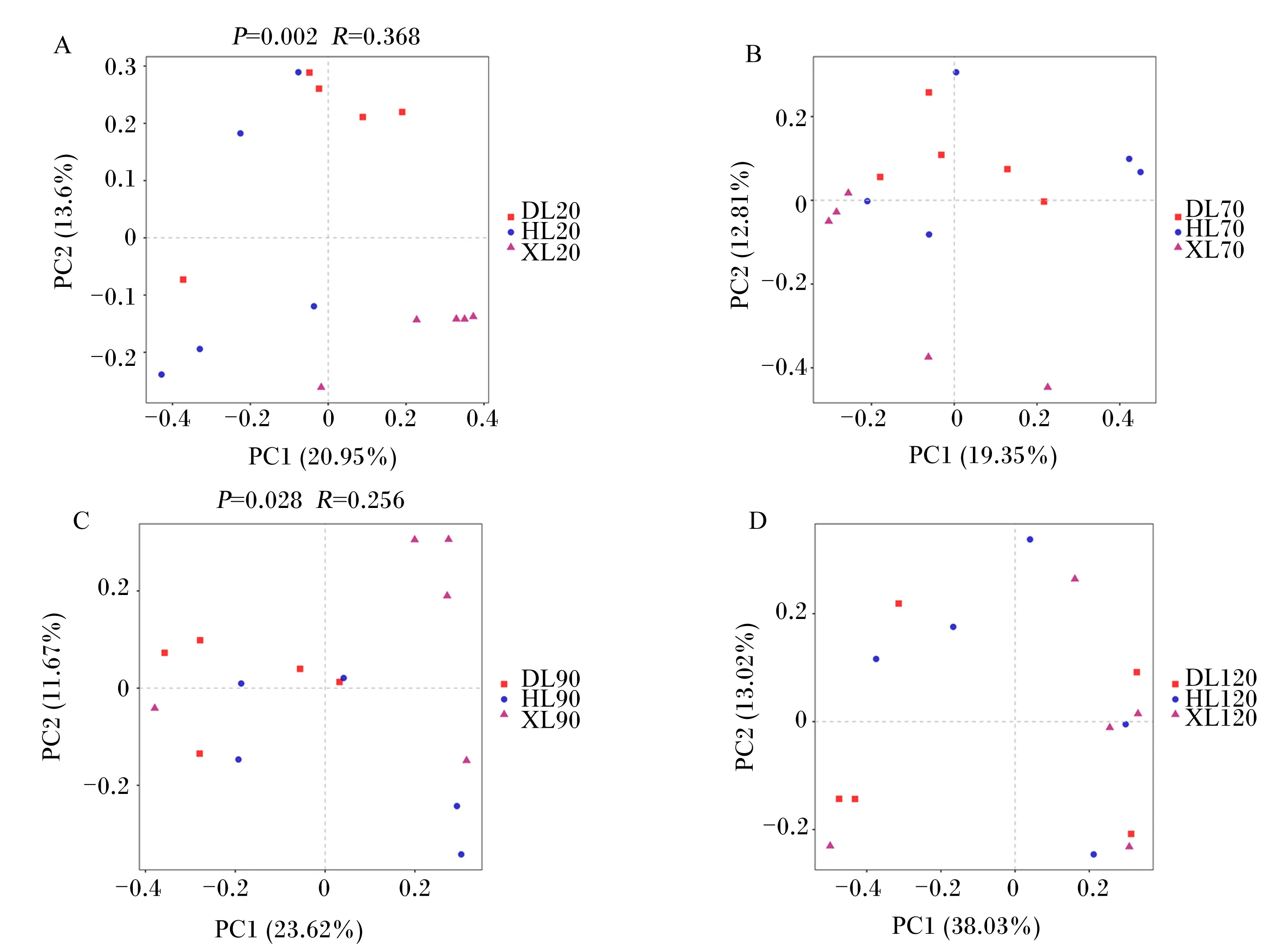
PC1:主坐标1;PC2:主坐标2。图4、图6和图8同。
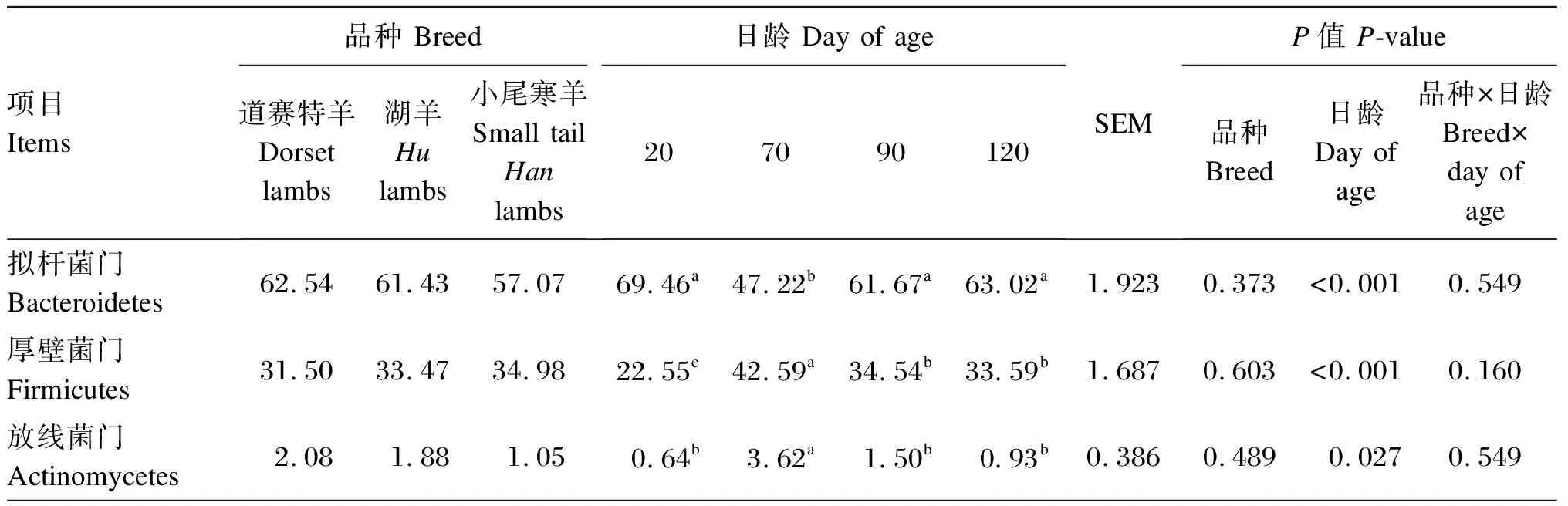
表3 不同品种羔羊的瘤胃细菌门水平的相对丰度(相对丰度>1.0%)
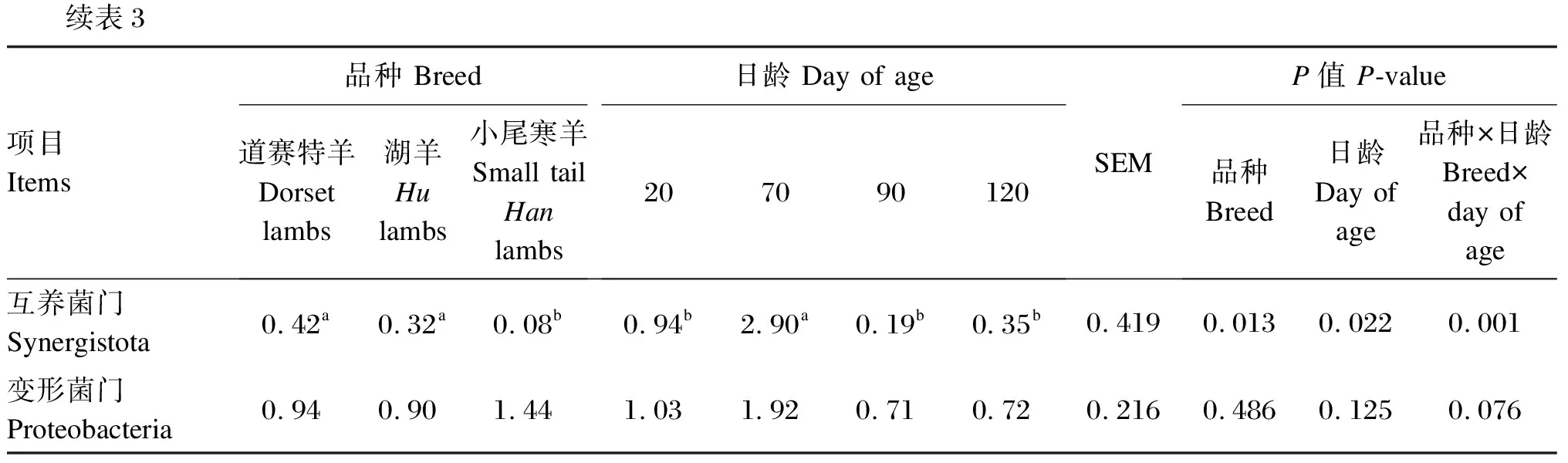
续表3项目Items品种 Breed道赛特羊Dorset lambs湖羊Hulambs小尾寒羊Small tail Hanlambs日龄 Day of age207090120SEMP值 P-value品种Breed日龄Day of age品种×日龄Breed×day of age互养菌门Synergistota0.42a0.32a0.08b0.94b2.90a0.19b0.35b0.4190.0130.0220.001变形菌门Proteobacteria0.940.901.441.031.920.710.720.2160.4860.1250.076
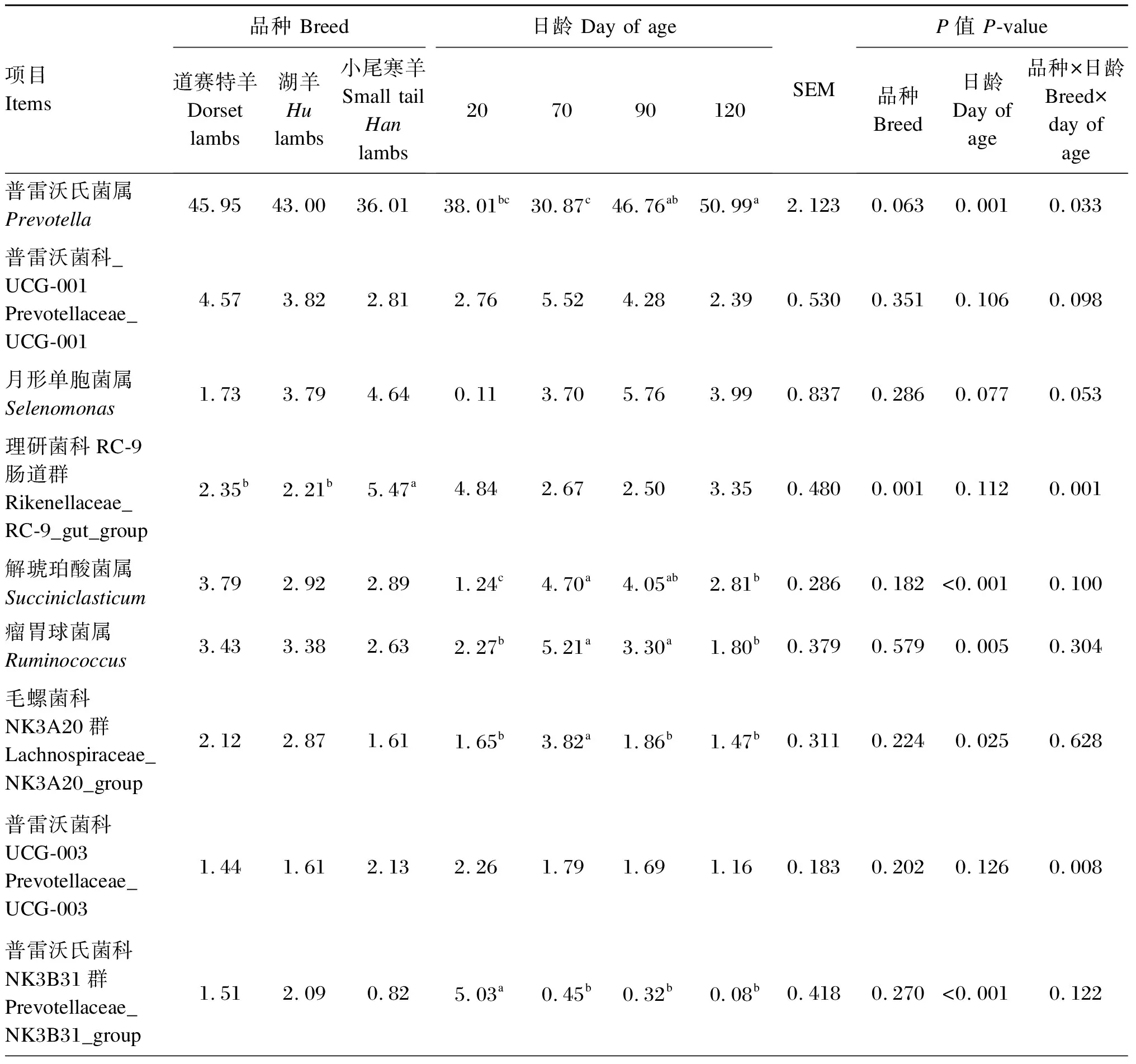
表4 不同品种羔羊的瘤胃细菌属水平的相对丰度(相对丰度>1.0%)
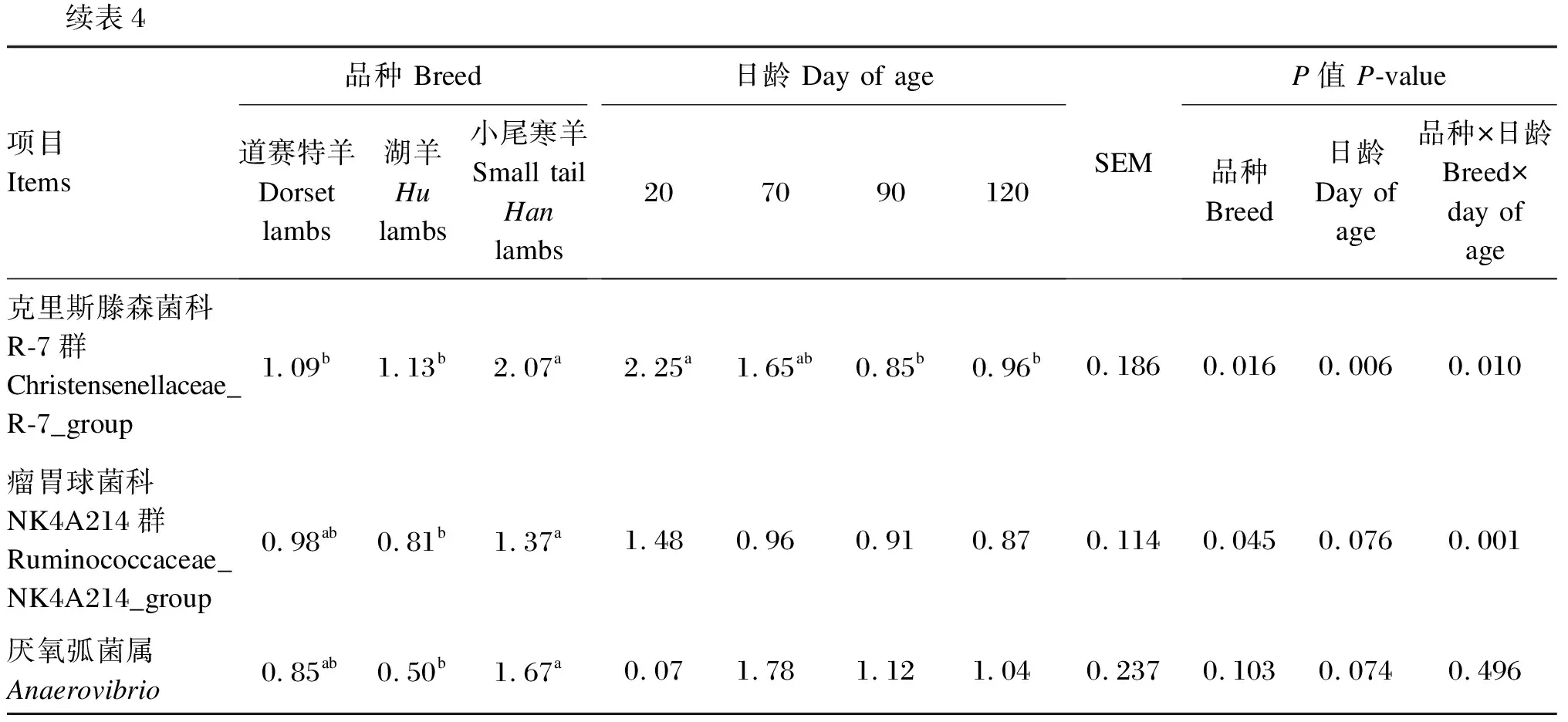
续表4项目Items品种 Breed道赛特羊Dorset lambs湖羊Hulambs小尾寒羊Small tail Hanlambs日龄 Day of age207090120SEMP值 P-value品种Breed日龄Day of age品种×日龄Breed×day of age克里斯滕森菌科R-7群Christensenellaceae_R-7_group1.09b1.13b2.07a2.25a1.65ab0.85b0.96b0.1860.0160.0060.010瘤胃球菌科NK4A214群Ruminococcaceae_NK4A214_group0.98ab0.81b1.37a1.480.960.910.870.1140.0450.0760.001厌氧弧菌属Anaerovibrio0.85ab0.50b1.67a0.071.781.121.040.2370.1030.0740.496
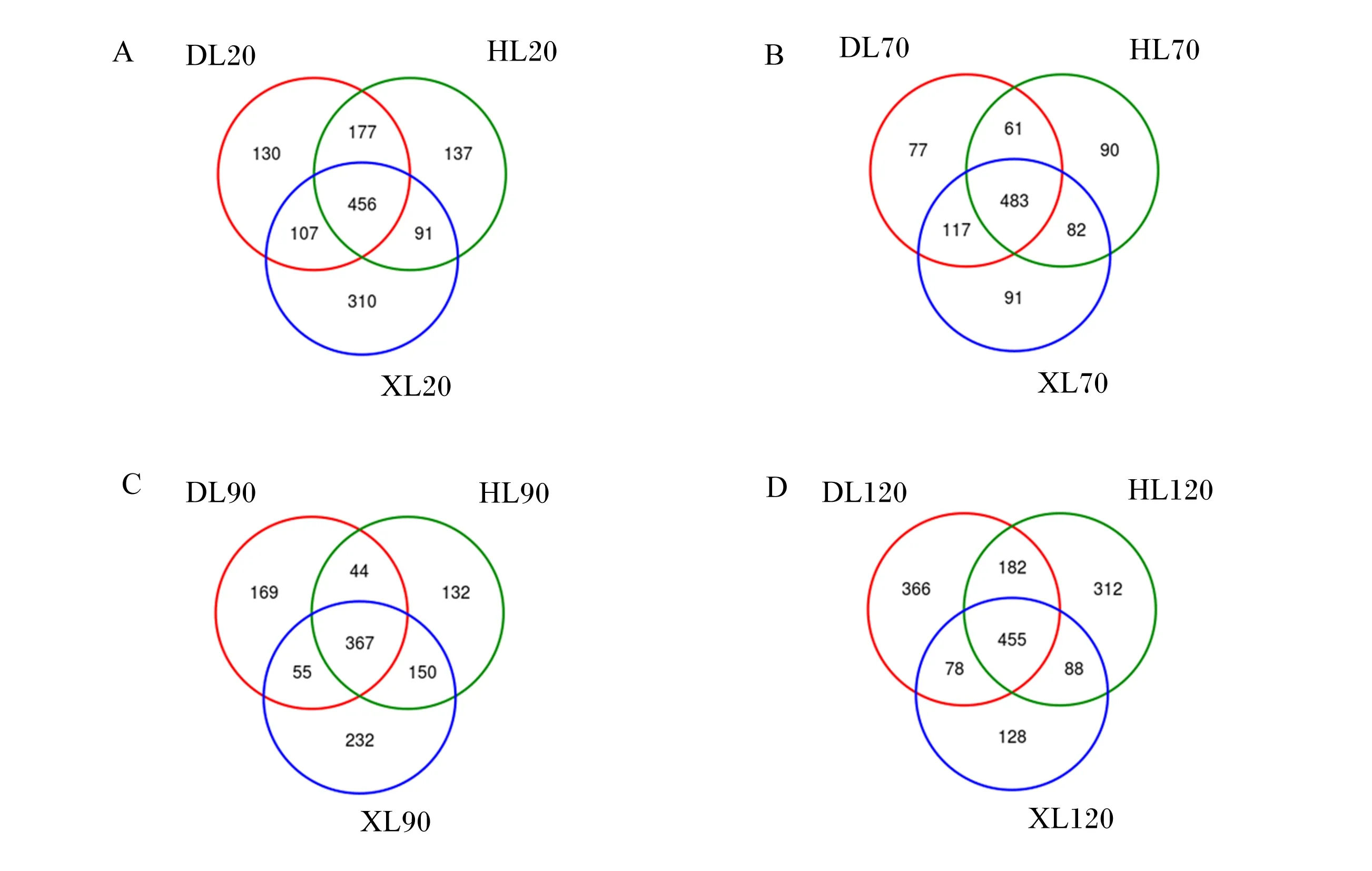
图3 不同品种羔羊瘤胃真菌韦恩图
2.2.2 瘤胃真菌Alpha多样性分析
由表5可知,不同品种羔羊瘤胃真菌Alpha多样性指数均差异不显著(P<0.05)。日龄显著影响Chao1指数、观测到的物种数、PD whole tree指数、香农指数和辛普森指数(P<0.05),对覆盖度无显著影响(P>0.05)。
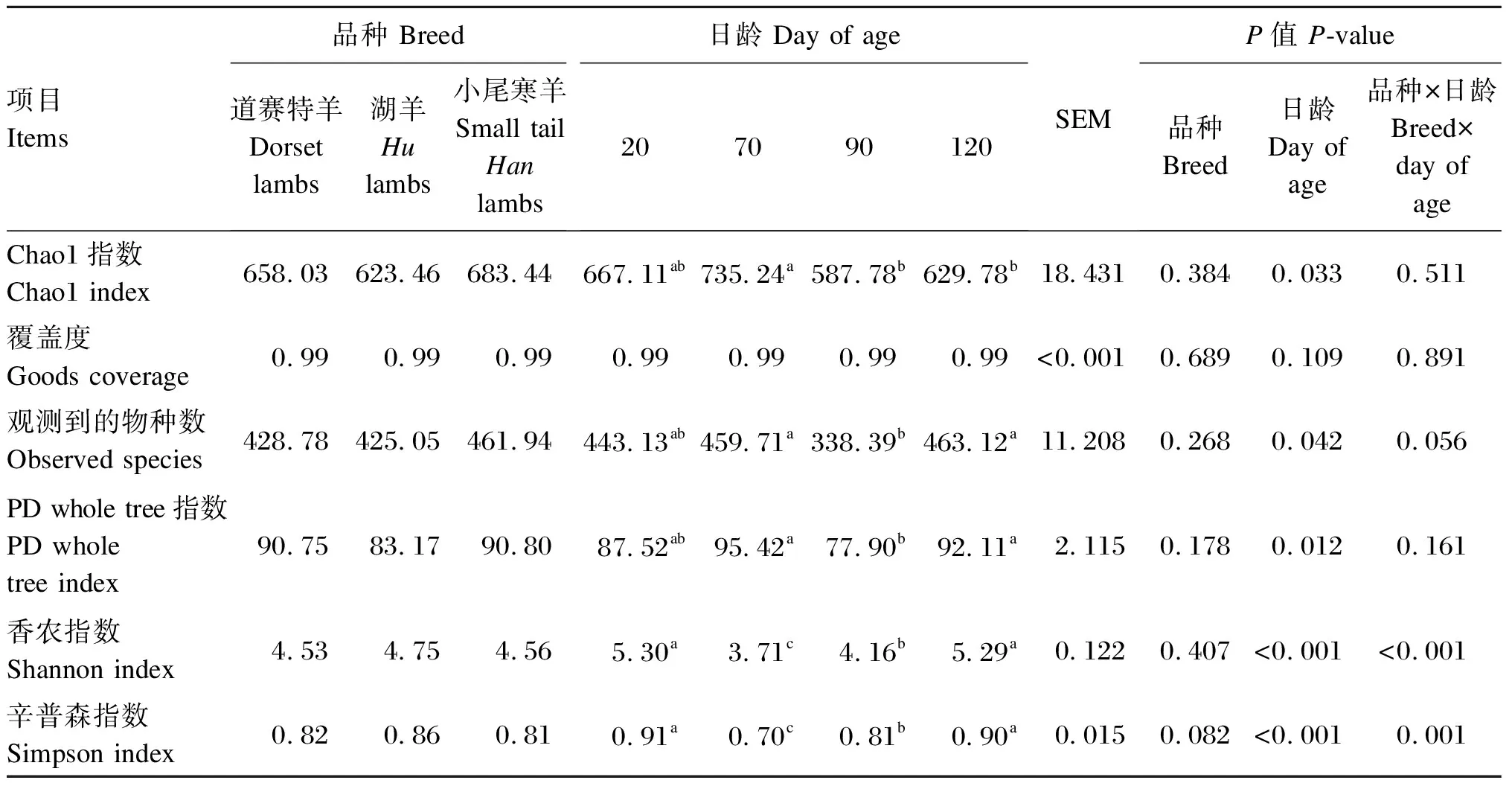
表5 不同品种羔羊的瘤胃真菌Alpha多样性指数分析
2.2.3 瘤胃真菌Beta多样性分析
由图4可知,基于Bray-Curtis的主坐标分析联合相似性分析结果表明,20、70和90日龄时,不同品种之间瘤胃真菌群落差异显著(P<0.05);120日龄时,不同品种之间瘤胃真菌群落差异不显著(P>0.05)。
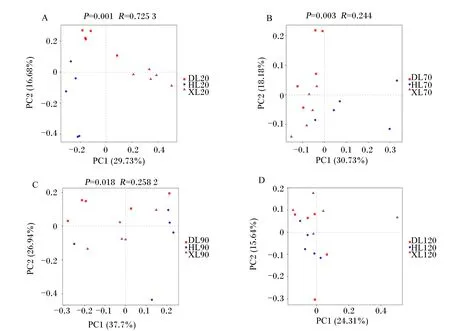
图4 不同品种羔羊瘤胃真菌基于Bray-Curtis的主坐标分析
2.2.4 瘤胃真菌结构分析
由表6可知,在瘤胃真菌门水平上(相对丰度>1%),道赛特羊和湖羊子囊菌门相对丰度显著高于小尾寒羊(P<0.05),道赛特羊和湖羊之间差异不显著(P>0.05);小尾寒羊新美鞭菌门相对丰度显著高于道赛特羊和湖羊(P<0.05),道赛特羊和湖羊之间差异不显著(P>0.05);湖羊担子菌门相对丰度表现出降低的趋势(P=0.088)。日龄显著影响羔羊的子囊菌门、担子菌门和新美鞭菌门相对丰度(P<0.05)。
由表7可知,在瘤胃真菌属水平上(相对丰度>1.0%),道赛特羊和小尾寒羊酵母菌属和Symmetrospora相对丰度显著高于湖羊(P<0.05),曲霉菌属和念珠菌属相对丰度显著低于湖羊(P<0.05),道赛特羊和小尾寒羊之间差异不显著(P>0.05);小尾寒羊盲肠菌属和瘤胃壶菌属相对丰度显著高于道赛特羊和湖羊(P<0.05),道赛特羊和湖羊之间差异不显著(P>0.05)。日龄显著影响羔羊的酵母菌属、青霉菌属、Pseudoascochyta、曲霉菌属、盲肠菌属、镰刀菌属、篮状菌属、瘤胃壶菌属、小囊菌属、Symmetrospora、节丹菌属和念珠菌属相对丰度(P<0.05)。

表7 不同品种羔羊的瘤胃真菌属水平的相对丰度(相对丰度>1.0%)
2.3 不同品种羔羊直肠细菌区系
2.3.1 直肠细菌特异性分析
由图5可知,20日龄时,3个品种羔羊直肠细菌共计1 122个OTU,共有OTU为419个,占总OTU的37.34%;道赛特羊、湖羊和小尾寒羊OTU分别为844、725和689个,特有OTU分别为231、102和72个;道赛特羊OTU和特有OTU数量最多(图5-A)。70日龄时,3个品种羔羊直肠细菌共计1 981个OTU,共有OTU为1 156个,占总OTU的58.35%;道赛特羊、湖羊和小尾寒羊OTU分别为1 666、1 579和1 546个,特有OTU分别为131、105和91个;道赛特羊OTU和特有OTU数量最多(图5-B)。90日龄时,3个品种羔羊直肠细菌共计2 144个OTU,共有OTU为1 185个,占总OTU的55.27%;道赛特羊、湖羊和小尾寒羊OTU分别为1 769、1 557和1 704个,特有OTU分别为188、116和139个;道赛特羊OTU和特有OTU数量最多(图5-C)。120日龄时,3个品种羔羊直肠细菌共计2 364个OTU,共有OTU为1 424个,占总OTU的60.24%;道赛特羊、湖羊和小尾寒羊OTU分别为1 889、1 871和1 978个,特有OTU分别为131、75和208个;小尾寒羊OTU和特有OTU数量最多(图5-D)。
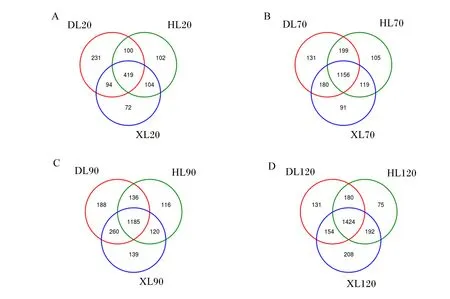
图5 不同品种羔羊直肠细菌韦恩图
2.3.2 直肠细菌Alpha多样性指数分析
由表8可知,不同品种羔羊间直肠细菌Alpha多样性指数均差异不显著(P>0.05)。日龄显著影响Chao1指数、观测到的物种数、PD whole tree指数、香农指数和辛普森指数(P<0.05),对覆盖度无显著影响(P>0.05)。
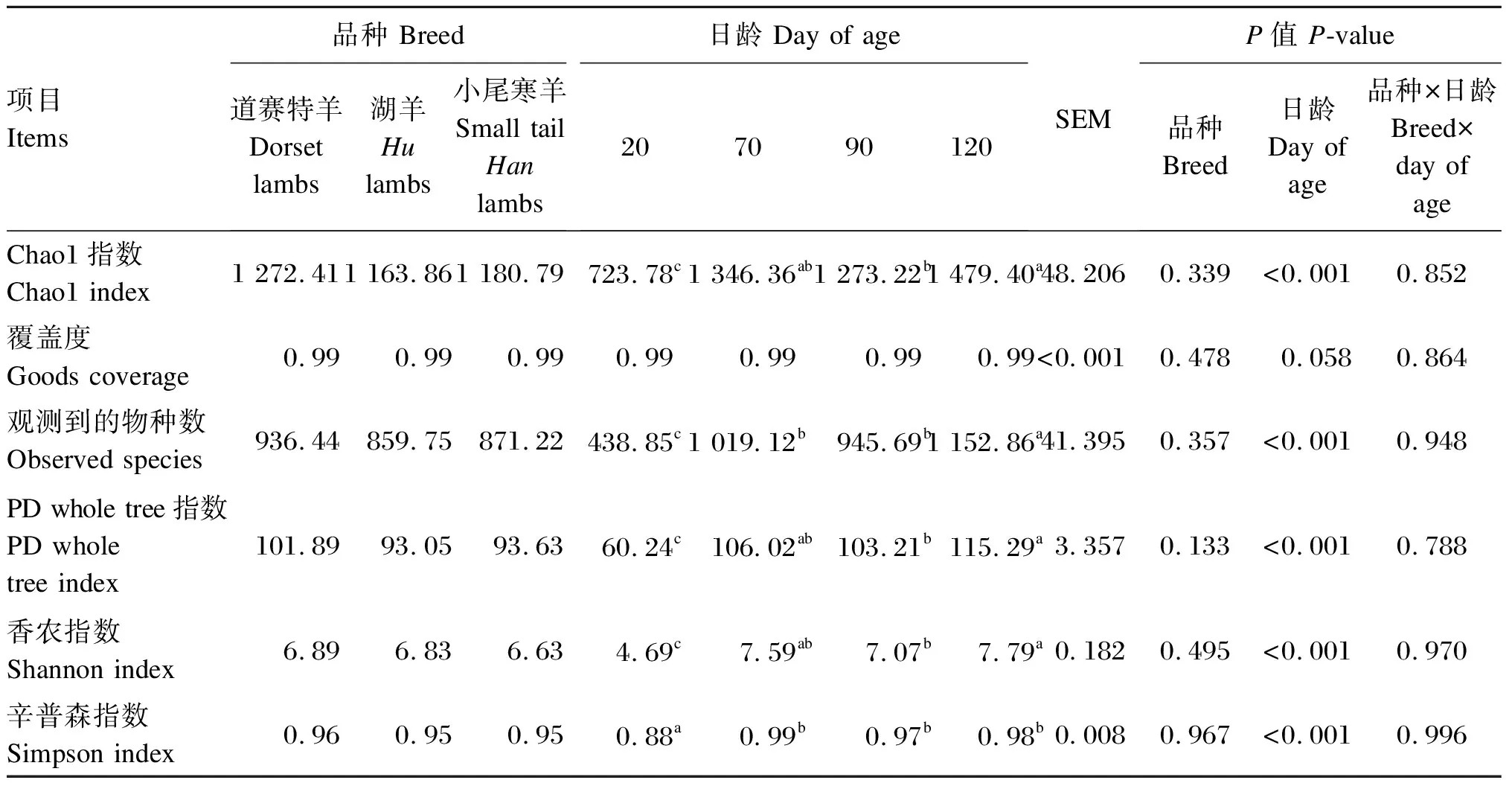
表8 不同品种羔羊的直肠细菌Alpha多样性指数分析
2.3.3 直肠细菌Beta多样性分析
由图6可知,基于Bray-Curtis的主坐标分析联合相似性分析表明,70日龄时,不同品种之间直肠细菌群落差异显著(P<0.05);其他日龄时,不同品种之间直肠细菌群落差异不显著(P>0.05)。
2.3.4 直肠细菌结构分析
由表6可知,在直肠细菌门水平上(相对丰度>1.0%),不同品种羔羊之间各菌门相对丰度均差异不显著(P>0.05),道赛特羊螺旋体门相对丰度表现出升高的趋势(P=0.086)。日龄显著影响羔羊的变形菌门、螺旋体门相对丰度(P<0.05),对厚壁菌门、拟杆菌门、放线菌门和弯曲杆菌门相对丰度无显著影响(P>0.05)。
由表10可知,在直肠细菌属水平上(相对丰度>1.0%),不同品种羔羊之间各菌属相对丰度均差异不显著(P>0.05);道赛特羊密螺旋体属相对丰度表现出升高的趋势(P=0.086)。日龄显著影响羔羊的UCG-005菌属、拟杆菌属、大肠杆菌-志贺菌属、布劳特氏菌属、克里斯滕森菌科R-7群、理研菌科RC-9肠道群、瘤胃球菌属、普雷沃菌科UCG-003、普雷沃氏菌属、泰勒菌属、Monoglobus、密螺旋体属和毛螺菌科NK4A136群相对丰度(P<0.05),对其他菌属相对丰度无显著影响(P>0.05)。
2.4 不同品种羔羊直肠真菌区系
2.4.1 直肠真菌特异性分析
由图7可知,20日龄时,3个品种羔羊直肠真菌共计914个OTU,共有OTU为262个,占总OTU的28.67%;道赛特羊、湖羊和小尾寒羊OTU分别为597、480和626个,特有OTU分别为140、81和166个;小尾寒羊OTU和特有OTU数量最多(图7-A)。70日龄时,3个品种羔羊直肠真菌共计883个OTU,共有OTU为240个,占总OTU的27.18%;道赛特羊、湖羊和小尾寒羊OTU分别为573、463和552个,特有OTU分别为177、80和161个;道赛特羊OTU和特有OTU数量最多(图7-B)。90日龄时,3个品种羔羊直肠真菌共计1 233个OTU,共有OTU为305个,占总OTU的24.74%;道赛特羊、湖羊和小尾寒羊OTU分别为673、805和788个,特有OTU分别为146、127和232个;小尾寒羊OTU和特有OTU数量最多(图7-C)。120日龄时3个品种羔羊直肠真菌共计1 209个OTU,共有OTU为474个,占总OTU的39.21%;道赛特羊、湖羊和小尾寒羊OTU分别为828、871和774个,特有OTU分别为118、177和124个;湖羊OTU和特有OTU数量最多(图7-D)。
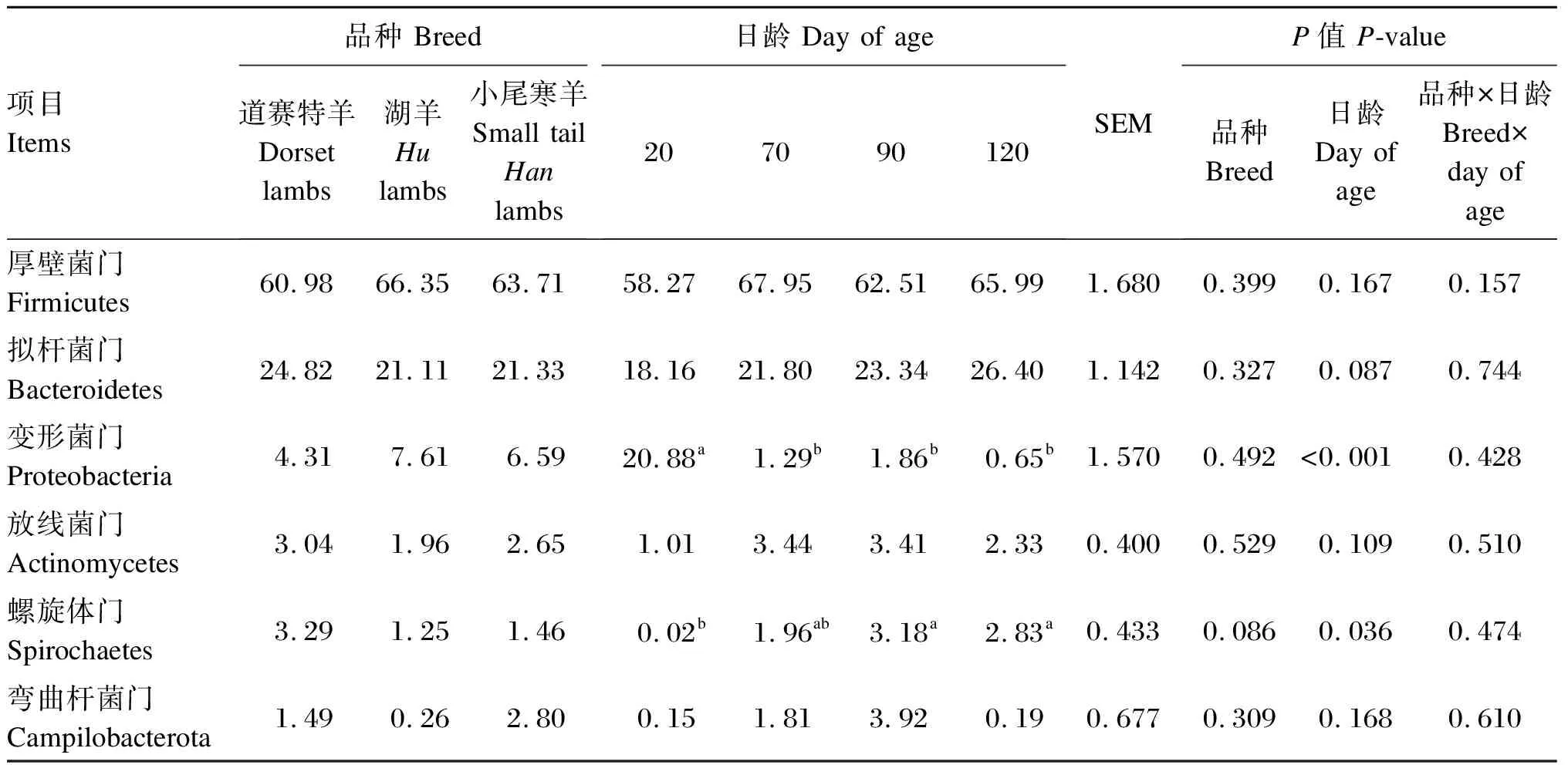
表9 不同品种羔羊的直肠细菌门水平的相对丰度(相对丰度>1.0%)
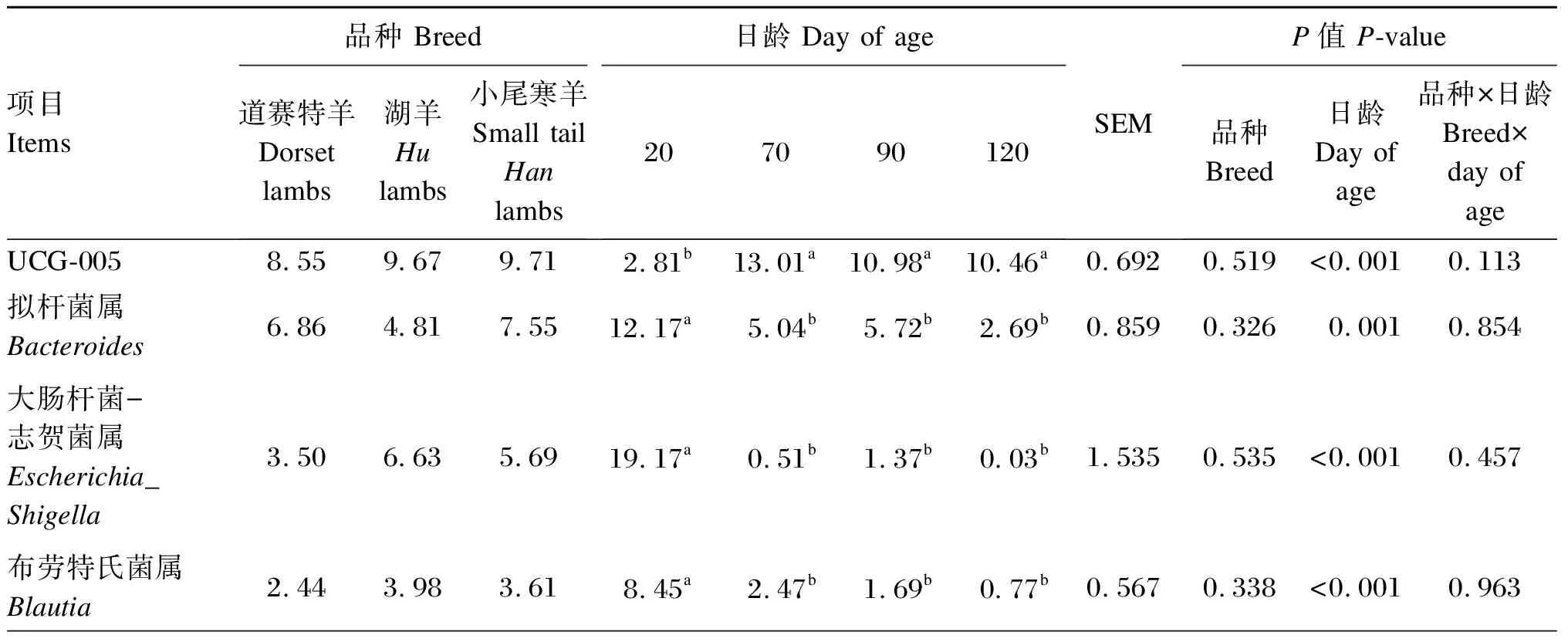
表10 不同品种羔羊的直肠细菌属水平的相对丰度(相对丰度>1.0%)

续表10项目Items品种 Breed道赛特羊Dorset lambs湖羊Hulambs小尾寒羊Small tail Hanlambs日龄 Day of age207090120SEMP值 P-value品种Breed日龄Day of age品种×日龄Breed×day of age克里斯滕森菌科R-7群Christensenellaceae_R-7_group3.21 2.72 3.36 0.79b3.69a3.80a4.11a0.3140.613 <0.0010.709 理研菌科RC-9肠道群Rikenellaceae_RC-9_gut_group2.22 2.48 2.57 0.06b3.45a2.80a3.38a0.2870.827 <0.0010.813 瘤胃球菌属Ruminococcus2.45 2.81 1.90 0.38c2.92ab2.31b3.92a0.2520.163 <0.0010.696 密螺旋体属Treponema3.28 1.24 1.46 0.02b1.95ab3.17a2.83a0.4320.086 0.036 0.477 普雷沃菌科UCG-003Prevotellaceae_UCG-0030.90 2.06 2.37 0.03b0.34b2.05ab4.69a0.5140.411 0.003 0.476 普雷沃氏菌属Prevotella2.28 1.48 1.34 0.51b1.21b1.62b3.46a0.3120.321 0.003 0.126 毛螺菌科NK4A136群Lachnospiraceae_NK4A136_group1.42 2.18 1.27 0.91b1.73ab1.45ab2.41a0.1870.075 0.028 0.365 泰勒菌属Yzzerella1.41 0.91 2.51 5.66a0.24b0.34b0.20b0.5430.344 <0.0010.258 另枝菌属Alistipes1.60 1.61 1.35 0.99 1.86 1.76 1.46 0.1720.786 0.276 0.172 乳杆菌属Lactobacillus2.79 0.59 1.00 4.79 1.04 0.01 0.00 0.7630.434 0.080 0.368 弯曲杆菌属Campylobacter1.02 0.25 2.80 0.15 1.80 3.29 0.18 0.6130.224 0.219 0.628 考拉杆菌属Phascolarctobacte-rium1.46 1.10 1.36 1.54 1.43 1.07 1.19 0.1510.648 0.722 0.948 Monoglobus1.19 1.47 1.20 0.03c1.34b1.11b2.67a0.1650.463 <0.0010.008 普雷沃氏菌科NK3B31群Prevotellaceae_NK3B31_group0.75 1.91 0.64 0.04 0.88 1.41 2.07 0.3980.357 0.324 0.366 毛螺菌科NK3A20群Lachnospiraceae_NK3A20_group1.01 1.23 0.97 0.73 1.58 1.35 0.60 0.178 0.788 0.123 0.070
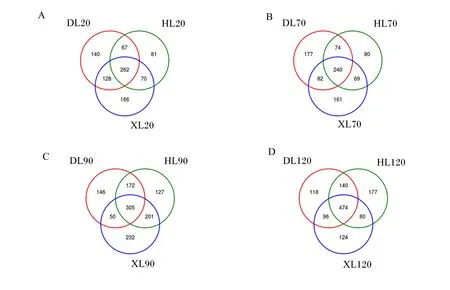
图7 不同品种羔羊直肠真菌韦恩图
2.4.2 直肠真菌Alpha多样性指数分析
由表11可知,湖羊直肠真菌的辛普森指数显著高于道赛特羊(P<0.05),与小尾寒羊之间差异不显著(P>0.05);不同品种羔羊之间其他Alpha多样性指数均差异不显著(P>0.05)。日龄显著影响Chao1指数、观测到的物种数、覆盖度、香农指数和辛普森指数(P<0.05),对PD whole tree指数影响不显著(P>0.05)。
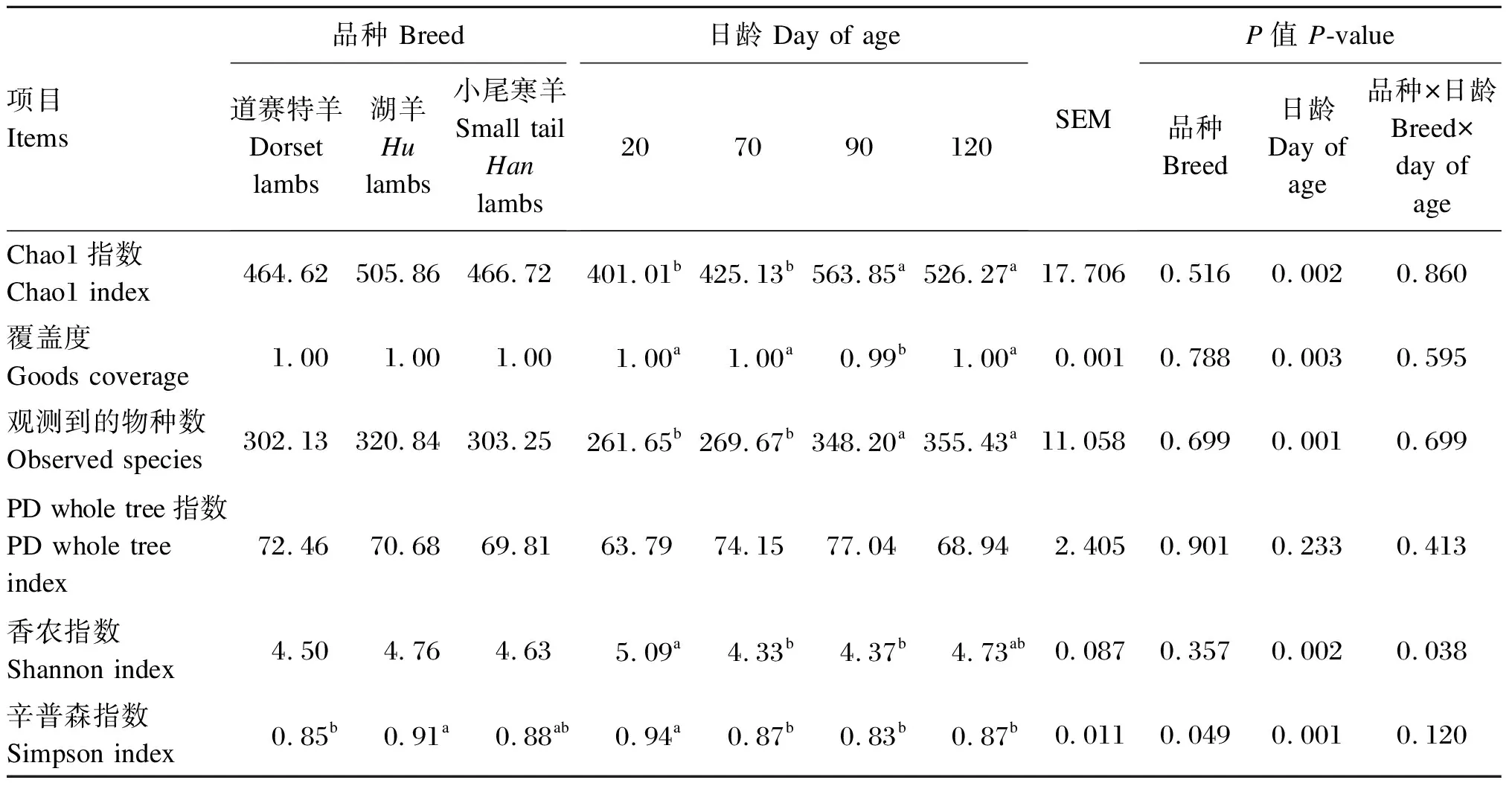
表11 不同品种羔羊的直肠真菌Alpha多样性指数分析
2.4.3 直肠真菌Beta多样性分析
由图8可知,基于Bray-Curtis的主坐标分析联合相似性分析结果表明,90和120日龄时,不同品种之间直肠真菌群落差异显著(P<0.05);其他日龄差异不显著(P>0.05)。
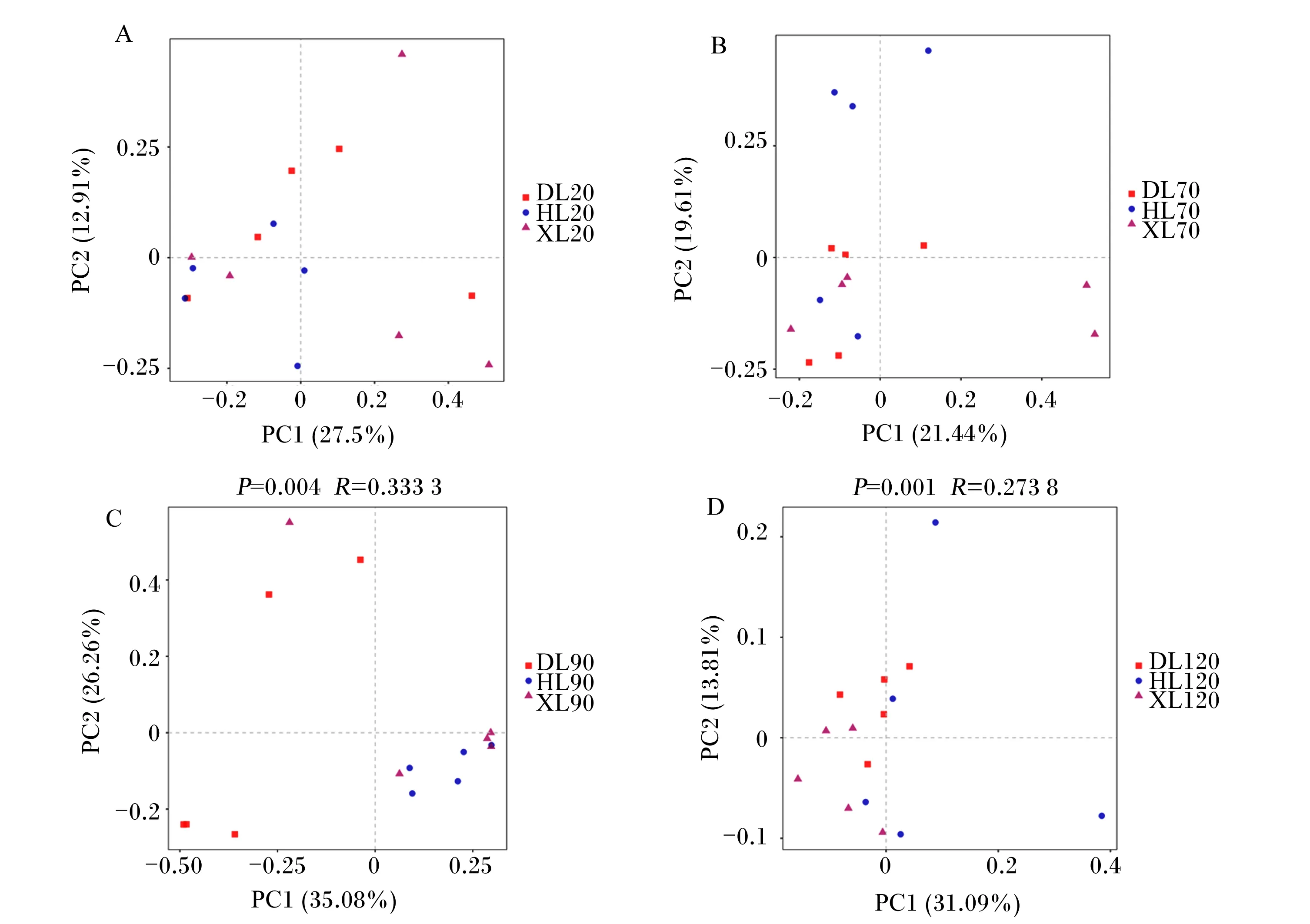
图8 不同品种羔羊直肠真菌基于Bray-Curtis的主坐标分析
2.4.4 直肠真菌结构分析
由表12可知,在直肠真菌门水平上(相对丰度>1.0%),不同品种羔羊之间子囊菌门和担子菌门相对丰度均差异不显著(P>0.05)。日龄显著影响羔羊的子囊菌门相对丰度(P<0.05),对担子菌门相对丰度无显著影响(P>0.05)。

表12 不同品种羔羊的直肠真菌门水平的相对丰度(相对丰度>1.0%)
由表13可知,在直肠真菌属水平上(相对丰度>1.0%),小尾寒羊青霉菌属相对丰度显著高于道赛特羊和湖羊(P<0.05),道赛特羊和湖羊之间差异不显著(P>0.05);湖羊曲霉菌属显著高于道赛特羊和小尾寒羊(P<0.05),道赛特羊和小尾寒羊之间差异不显著(P>0.05);不同品种羔羊之间其他菌属均差异不显著(P>0.05)。日龄显著影响羔羊的青霉菌属、曲霉菌属、酵母菌属、篮状菌属、红曲霉属、Tausonia、小囊菌属、枝孢属和假壳二孢属相对丰度(P<0.05),对节丹菌属和木霉菌属相对丰度均无显著影响(P>0.05)。

表13 不同品种羔羊的直肠真菌属水平的相对丰度(相对丰度>1.0%)
3 讨 论
3.1 不同品种羔羊胃肠道微生物多样性
胃肠道微生物主要由细菌、古生菌和真核生物(真菌和原虫)构成,随着宿主的成长而不断变化,在此过程中,微生物会受到如饲粮、日龄、宿主生活环境、抗生素以及亲缘关系等多种因素的影响。宿主基因型是影响胃肠道微生物多样性的因素之一。微生物多样性对于维持稳定的微生物群落起着至关重要的作用。崔浩然等[29]比较了35 kg体重的湖羊与卡拉库尔羊瘤胃菌群结构的差异性,发现2个品种瘤胃细菌的特有OTU数量及占比不同,卡拉库尔羊瘤胃菌群多样性和丰富度极显著高于湖羊。这与本试验结果相似,道赛特羊、湖羊和小尾寒羊3个品种羔羊瘤胃细菌特有OTU数量及占比不同,小尾寒羊具有较高的瘤胃细菌多样性。研究表明,瘤胃细菌的Alpha多样性指数与饲料效率有关,低饲料效率的个体拥有更复杂和多样化的微生物群落[30-34]。Li等[35]对安格斯牛、夏洛莱牛和Kinsella牛3个品种肉牛瘤胃微生物组的影响及其与饲料效率的关系的研究表明,更多样化的瘤胃微生物群落能够发酵更广泛的底物,但饲料转化率较低,而“简单瘤胃”可能会产生更多有效被宿主吸收和利用的产物。Shabat等[36]对奶牛饲料效率研究也得出了类似的结果,表明微生物组基因含量和类群丰富度越低,饲料效率越高。微生物多样性可能成为一种新的生物标志物或健康指标,虽然不同类型的微生物多样性在宿主健康中的作用仍有待确定,但微生物多样性可能与羔羊的生产性能有关[37]。在本试验中,小尾寒羊具有较高的瘤胃细菌多样性,可能是在相同饲养管理条件下,小尾寒羊羔羊在3个品种中表现出较低生长速度、消化能和代谢能的原因。
Chang等[38]对1岁道赛特羊、小尾寒羊、西藏羊和杜泊羊4个不同品种绵羊的肠道细菌群落进行研究,表明4个品种绵羊的OTU数量存在差异,西藏羊具有较低的OTU数量,而且细菌群落丰度和多样性显著低于其他3个品种绵羊。在本试验中,不同品种肠道菌群Alpha多样性差异不显著,70日龄时主坐标分析差异显著,这可能与羊只年龄有关,本试验中羔羊均为4月龄内羔羊,且肠道细菌多样性受日龄显著影响,可能是造成直肠细菌未表现出明显的品种差异的原因。研究表明,胃肠道微生物多样性指数随动物年龄的增长而升高[39]。微生物多样性对维持稳定的微生物群落起着至关重要的作用,较高的微生物多样性与对环境较强适应性和抵抗力密切相关[37]。Yin等[40]对0~4月龄湖羊羔羊粪便中细菌群落演替及其与血清免疫指标相关性进行研究,表明日龄显著影响羔羊的生产性能、血清参数、粪便细菌群落和功能。本试验对胃肠道微生物多样性的研究也得出相似结果,瘤胃和直肠细菌和真菌多样性总体上随日龄增长而增加,并且通过主坐标分析和相似性分析表明不同品种羔羊瘤胃细菌和真菌群落在20、90日龄均存在显著差异,这可能是造成不同品种羔羊在20(补料后)、90日龄(断奶后)2个饲养关键阶段免疫指标和腹泻率存在差异的原因。研究表明,幼龄反刍动物瘤胃微生物群落具有很强可塑性[41],提示在补料和断奶应激状态下,可以通过外部干预进行调控,引导瘤胃微生物菌群有序定植和健康发酵,以降低羔羊发病率和提高健康水平及后续生产性能。
3.2 不同品种羔羊胃肠道微生物群落组成
瘤胃微生物对植物纤维消化、动物生产性能和健康都具有重要作用,肠道微生态系统与宿主的营养、代谢和免疫等方面密切相关,反刍动物胃肠道微生物能够将饲粮中营养物质转化为可供反刍动物吸收利用的营养物质,同时对动物代谢和健康也发挥着重要作用。研究表明,胃肠道中菌群的建立除受到饲粮、环境和疫病等因素影响外,宿主肠道微生物菌群结构与动物的遗传背景密切相关,具有个体特异性,会因为动物品种遗传学差异引起微生物群落相对丰度的差异[42-45]。张瑜等[46]比较了3~4岁都安山羊和努比亚山羊母羊的瘤胃微生物区系特征及品种之间的差异,结果表明都安山羊和努比亚山羊的瘤胃微生物优势菌群相似,但努比亚山羊隶属于厚壁菌门的菌群相对丰度更高。Langda等[47]比较相同高原牧场的藏山羊和藏绵羊瘤胃微生物多样性和组成的差异,发现2个物种的瘤胃细菌、真菌和原生动物中厚壁菌门、拟杆菌门、新美鞭菌门和纤毛菌门相对丰度最高,但在多个分类水平上存在显著差异,绵羊中新丽鞭菌科(Neocallimastigaceae)和后毛属(Metadinium)相对丰度较高,山羊中则Saccharofermentans和毛螺菌科XPB1014(Lachnospiraceae_XPB1014)相对丰度较高。本试验与以上研究结果类似,3个品种羔羊的胃肠道菌群结构具有相似性,瘤胃细菌和直肠细菌优势菌门均为拟杆菌门和厚壁菌门,瘤胃真菌优势菌门为子囊菌门、担子菌门和新美鞭菌门,直肠真菌优势菌门为子囊菌门和担子菌门,但在一些特异性门属的相对丰度上存在差异,道赛特羊的直肠细菌螺旋体门和密螺旋体属相对丰度较高,螺旋体门属于有益菌,可以有效降解纤维素、果胶和磷酸酯,发酵形成挥发性脂肪酸,为动物机体提供能量[48-49],这可能是道赛特羊表现出较好生产性能的原因。
本试验中,小尾寒羊瘤胃细菌中普雷沃氏菌属相对丰度较低,理研菌科RC-9肠道群和克里斯滕森菌科R-7群相对丰度较高。普雷沃氏菌属作为反刍动物的核心菌群,主要承担发酵功能,不仅可以消化利用淀粉,还能降解非结构性的碳水化合物和蛋白质[50],理研菌科RC-9肠道群相对丰度与挥发性脂肪酸中丙酸含量和挥发性脂肪酸转运基因表达量呈负相关[51-52]。丙酸作为反刍动物碳水化合物代谢中一种重要的挥发性脂肪酸,通过糖异生作用生成葡萄糖或者进入三羧酸循环氧化供能。克里斯滕森菌科R-7群与宿主体重指数呈负相关[53],本试验中,小尾寒羊瘤胃细菌中普雷沃氏菌属相对丰度较低,理研菌科RC-9肠道群和克里斯滕森菌科R-7群相对丰度较高,以及瘤胃真菌中具有分解纤维功能的子囊菌门相对丰度较低,意味着小尾寒羊对营养物质的利用率较低,提示可能是小尾寒羊在生产中表现出相对较低生产性能的原因。研究表明,日龄是影响反刍动物胃肠道微生物菌群结构的重要因素,随日龄增长,拟杆菌门、厚壁菌门、普雷沃氏菌属、瘤胃球菌属、密螺旋体菌属等相对丰度逐渐升高,变形菌门、埃希氏菌属、乳酸杆菌属等相对丰度逐渐降低[54-56]。本试验对不同品种羔羊胃肠道微生物发育规律研究结果与以上研究相似,表明微生物群落组成受日龄显著影响,部分菌群表现出随日龄增长的规律变化,其中螺旋体门、子囊菌门、普雷沃氏菌属、密螺旋体属和青霉菌属相对丰度随日龄增长显著增加,变形菌门、新美鞭菌门、大肠杆菌-志贺菌属、克里斯滕森菌科R-7群、曲霉菌属、盲肠菌属相对丰度随日龄增长显著降低。胃肠道微生物相对丰度会随着日龄增长而发生变化,其主要原因是幼龄动物胃肠道处于逐渐发育的过程。本试验中,小尾寒羊胃肠道中普雷沃氏菌属和子囊菌门相对丰度较低,新美鞭菌门和克里斯滕森菌科R-7群相对丰度较高,意味着小尾寒羊胃肠道发育相对较慢,提示这也可能是影响小尾寒羊生长和消化性能的因素。
4 结 论
小尾寒羊、湖羊和道赛特羔羊的胃肠道菌群多样性和结构具有相似性,也存在一定差异。小尾寒羊具有较高的瘤胃细菌多样性,湖羊具有较高的直肠真菌多样性,道赛特羊直肠细菌中螺旋体门和密螺旋体属相对丰度较高,小尾寒羊瘤胃细菌中普雷沃氏菌属相对丰度较低以及理研菌科RC-9肠道群和克里斯滕森菌科R-7群相对丰度较高。胃肠道微生物区系差异可能是导致不同品种羔羊生产性能差异的原因之一。

