单宁和裂壶藻粉对滩羊生长性能及瘤胃菌群多样性的影响
温红瑞 高昌鹏 杨万彪 刘文茂 周玉香*
(1.宁夏大学农学院,银川 750021;2.宁夏中宁文茂生态饲料有限公司,中宁 755100)
绿色发展背景下,饲料行业迈入“无抗”时代。但在畜牧生产过程中,细菌性和病毒性等疾病频发、动物机体生长缓慢、发病率高等问题成为制约我国畜牧业发展的瓶颈。因而寻找替抗饲料添加剂迫在眉睫。
单宁作为一种天然植物多酚,具有较强的收敛性和生物学活性,如抗氧化[1]、抗菌[2]、抗炎[3]、抗病毒[4]等。研究表明,添加适量的单宁可以调节瘤胃微生物区系[5]、增加“瘤胃逃逸蛋白”的数量[6]、提高蛋白质利用率,并且单宁也是潜在的生物加氢调节剂,它可以通过调控多不饱和脂肪酸(PUFAs)的合成来改善肉品质[7],对反刍动物生长有着积极影响。但添加过量的单宁也会对动物产生副作用[8]。
裂壶藻,又称裂殖壶藻,是从海水中分离筛选到的单细胞微藻,其增殖速度快、发酵周期短。在生长过程中积累了大量的营养物质和对动物有益的活性成分,如n-3PUFAs、蛋白质、虾青素和类胡萝卜素等,可作为一种功能性添加剂或代替部分蛋白质源和油脂使用。添加适量的裂壶藻粉可以增加PUFAs的含量,从而促进脂质代谢[9],改善肉品质[10],提高免疫性能[11]。
本课题组前期研究表明,单独添加0.4%单宁或2.0%裂壶藻粉均对滩羊有促生长、提高免疫力、改善肉品质的作用[12-13]。但两者组合添加对滩羊瘤胃菌群结构的影响鲜见报道。且单宁和PUFAs在反刍动物上的研究,也只是集中于缩合单宁和亚油酸(LA)或亚麻酸(LNA)对其生产性能表型指标的影响[14-15]。因此,本试验在课题组前期试验的基础上,研究饲粮中添加0.4%单宁+2.0%裂壶藻粉对滩羊生长性能及其瘤胃菌群结构的影响,以期为单宁和裂壶藻粉在滩羊生产实践中的应用提供理论依据。
1 材料与方法
1.1 试验设计
试验于2022年7月至2022年11月在中宁县文茂草源生态饲料有限公司进行。试验采用单因素随机试验设计,选取体重[(25.53±3.18) kg]相近的5月龄健康滩羊公羔48只,随机均分为4组,每组12个重复。对照组饲喂基础饲粮,试验Ⅰ组饲喂基础饲粮+0.4%单宁(水解单宁含量为76%),试验Ⅱ组饲喂基础饲粮+2.0%裂壶藻粉(干物质含量96%,粗蛋白质含量26%,粗脂肪含量40%,二十二碳六烯酸含量15%)、试验Ⅲ组饲喂基础饲粮+0.4%单宁+2.0%裂壶藻粉。试验期共105 d,其中预试期15 d,正试期90 d。
1.2 试验饲粮
试验饲粮按照《肉羊饲养标准》(NY/T 816—2021)并结合实际生产进行配制,由于裂壶藻粉中含有大量的营养物质,而单宁中营养物质较少,因而选择用裂壶藻粉代替玉米,单宁代替小苏打。各组饲粮营养水平相近,精粗比为45∶55。试验饲粮组成及营养水平见表1。

表1 试验饲粮组成及营养水平(干物质基础)
1.3 饲养管理
在试验开始前,对羊圈进行打扫、消毒处理,并对试验羊进行统一编号、布病检测和驱虫防疫。所有试验羊每天分2次(07:00和17:00)饲喂全混合日粮,期间保障试验羊自由采食和自由饮水,每天定时清理料槽,记录投料量和剩料量,用于计算干物质采食量(DMI)。试验羊在正试期开始和结束时空腹称重、记录,并计算总增重(TG)、平均日增重(ADG)和料重比(F/G)。

续表1项目 Items对照组Control group试验Ⅰ组Trial group Ⅰ试验Ⅱ组Trial group Ⅱ试验Ⅲ组Trial group Ⅲ营养水平 Nutrient levels2)代谢能 ME/(MJ/kg)10.8810.8810.6110.61粗蛋白质 CP15.3915.3915.7515.75钙 Ca0.880.880.880.88磷 P0.340.340.330.33中性洗涤纤维 NDF37.0437.0436.8536.85酸性洗涤纤维 ADF22.5622.5622.5022.50
1.4 瘤胃液的采集和处理
在正试期第90天,晨饲前每组随机选择6只羊,用口腔瘤胃液采集器采集瘤胃液50 mL,分装于2 mL冻存管中,置于-80 ℃保存,用于后续瘤胃微生物多样性分析。
1.5 测序及生物信息学分析
提取样品总DNA、构建文库及测序由上海美吉生物医药科技有限公司完成,采用Illumina Miseq平台测序。测序得到的原始数据经质控优化得到有效数据,然后进行物种注释分析、物种差异比较分析。
1.6 数据处理与分析
生长性能数据通过Excel 2010初步整理后,采用SPSS 27.0统计软件进行单因素方差分析,LSD多重比较法进行组间比较。微生物数据通过美吉生物云平台进行分析,使用非参数Kruskal-Wallis秩和检验分析瘤胃液菌群多样性指数组间差异和微生物门、属水平相对丰度的变化,运用PICRUSt2预测菌群基因组功能与KEGG数据库对比,进行菌群代谢功能的预测。利用R语言工具(version 3.3.1)作图。结果均以图或表的形式列出,表中数据用平均值±均值标准误表示。P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。
2 结果与分析
2.1 单宁和裂壶藻粉对滩羊生长性能的影响
由表2可知,各组羊只的初始体重和终末体重均无显著差异(P>0.05)。与对照组相比,各试验组羊只的总增重和平均日增重都有所提高,其中试验Ⅰ组羊只的总增重显著增加(P<0.05)。与对照组相比,试验Ⅰ组羊只的总增重和平均日增重分别增加了22.64%和16.15%;试验Ⅱ组羊只的总增重和平均日增重分别增加了14.54%和8.76%;试验Ⅲ组羊只的总增重和平均日增重分别增加了15.43%和9.58%。各试验组羊只的干物质采食量和料重比均低于对照组,但差异不显著(P>0.05)。

表2 单宁和裂壶藻粉对滩羊生长性能的影响
2.2 单宁和裂壶藻粉对滩羊瘤胃菌群结构的影响
2.2.1 操作分类单元(OTUs)聚类分析
经Illumina Miseq测序结束后,除去低质量序列,通过序列拼接,应用Mouthur,根据相似度97%的原则,进行OTUs划分。根据OTUs聚类分析结果,分析24个样品中OTUs的分布,并绘制韦恩图(图1)。由图1可知,对照组中发现1 153个OTUs,试验Ⅰ组中发现1 144个OTUs,试验Ⅱ组中发现1 080个OTUs,试验Ⅲ组中发现1 050个OTUs,共享了940个OTUs,表明添加单宁、裂壶藻粉会降低滩羊瘤胃液中OTUs数目,即降低细菌菌群的种类。
2.2.2 Alpha多样性分析
由图2可知,所有样品的Sobs指数稀释曲线均为先陡然升高,后趋于平缓,表明测序数据量渐近合理,更深入的测序对滩羊瘤胃液中检测出新的OTUs贡献很小。由图3可知,各样品Shannon指数稀释曲线均为先直线上升,后骤然到达平台期,表明测序趋向饱和,即测序深度已覆盖样品中绝大多数微生物生物种类,能够进行细菌多样性分析。
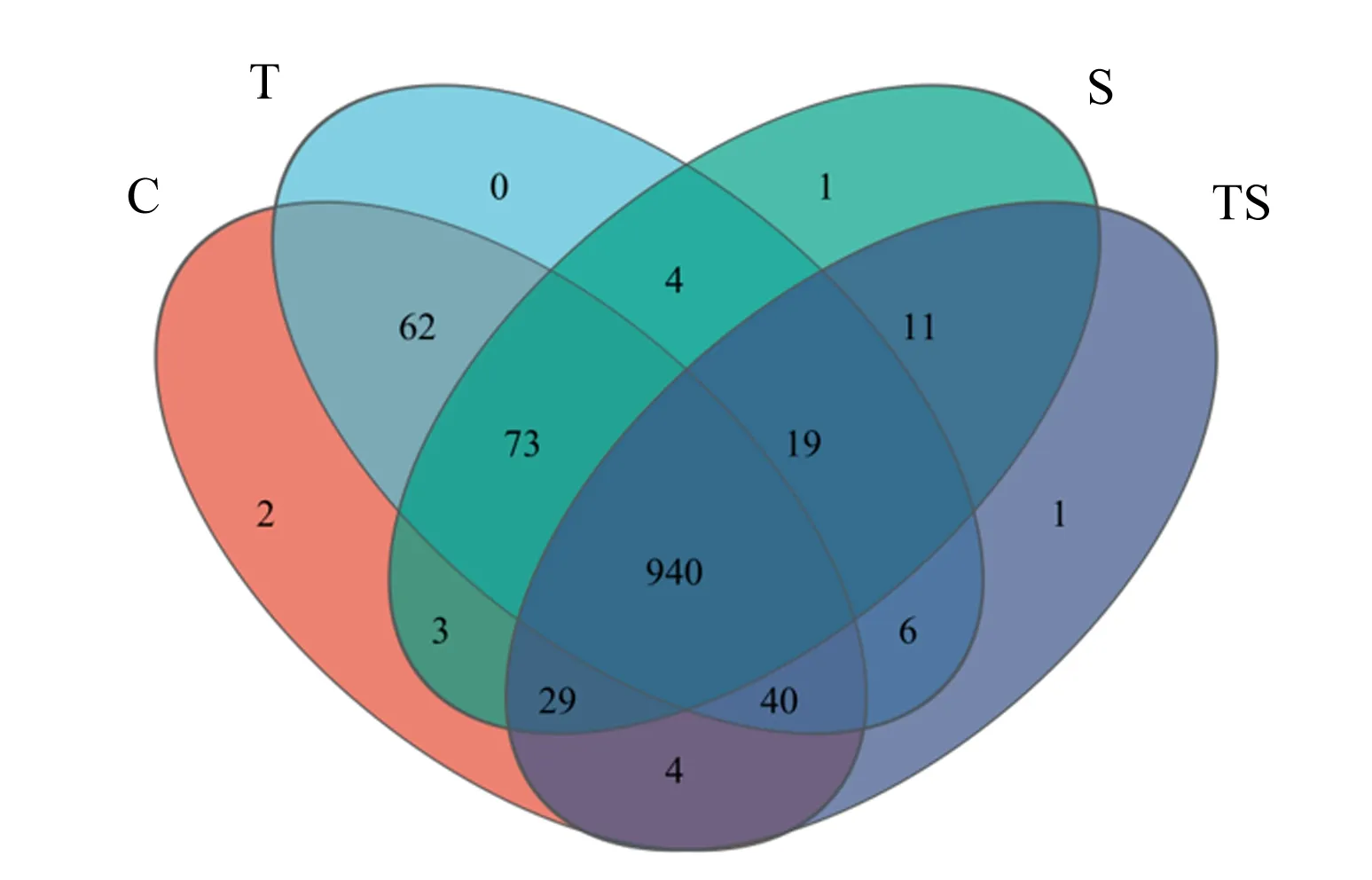
C:对照组;T:试验Ⅰ组;S:试验Ⅱ组;TS:试验Ⅲ组。下图同。
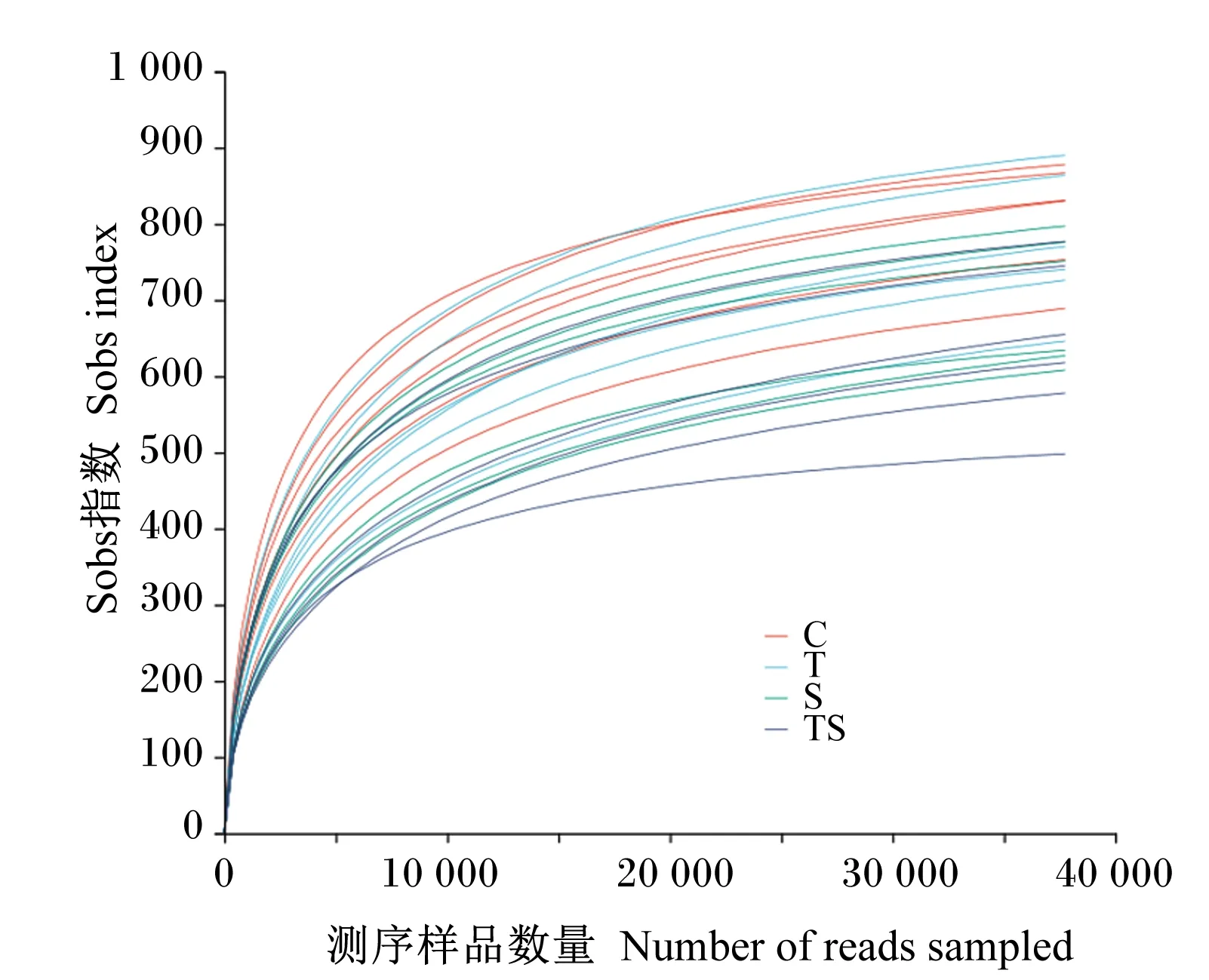
图2 样品的Sobs指数稀释曲线
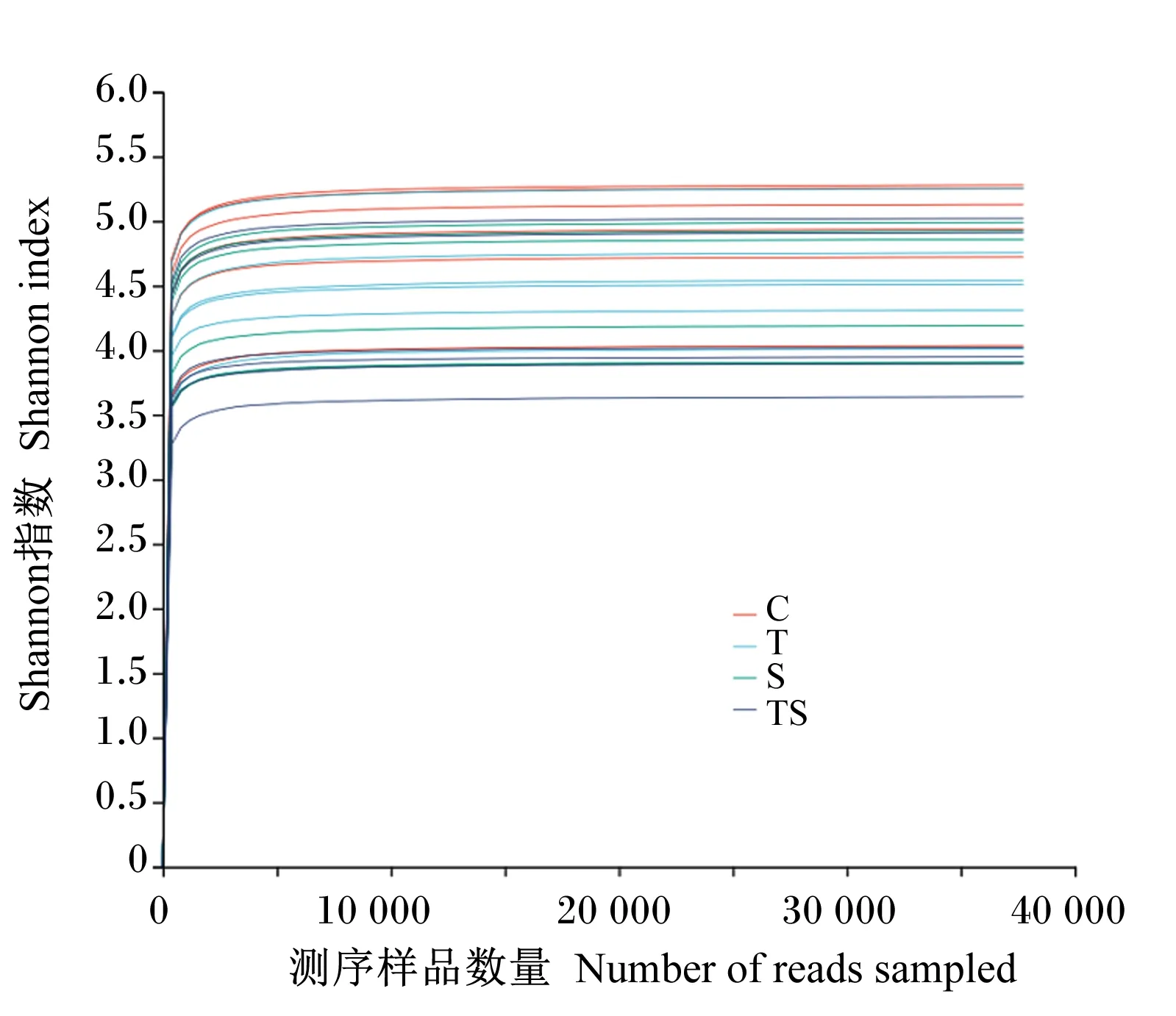
图3 样品的Shannon指数曲线
2.2.3 微生物群落Alpha多样性分析
由表3可知,各组间Shannon指数和Simpson指数均差异不显著(P>0.05),表明无论是单独添加单宁或裂壶藻粉还是同时添加,均不会对滩羊瘤胃菌群多样性产生影响。但与对照组相比,试验Ⅲ组Sobs指数、Ace指数和Chao1指数均出现显著下降(P<0.05),表明在饲粮中同时添加单宁和裂壶藻粉会降低滩羊瘤胃细菌菌群的种类。与试验Ⅰ组相比,试验Ⅲ组Ace指数和Chao1指数也出现了显著下降(P<0.05),表明在饲粮中同时添加单宁和裂壶藻粉会降低滩羊瘤胃细菌菌群的种类的结果中裂壶藻粉起到了重要的作用。在本试验中,各组覆盖率均大于0.99,说明样品采集足以反映滩羊瘤胃菌群情况。

表3 Alpha多样性
2.2.4 瘤胃菌群主坐标分析(PCoA)
由图4可知,对照组与试验Ⅰ组之间的距离比较相近,试验Ⅱ组与试验Ⅲ组的距离较近,而对照组、试验Ⅰ组和试验Ⅱ组、试验Ⅲ组之间的距离比较远,说明对照组与试验Ⅰ组的瘤胃菌群结构相似,试验Ⅱ组与试验Ⅲ组的瘤胃菌群结构相似,而对照组与试验Ⅰ组和试验Ⅱ组、试验Ⅲ组的瘤胃菌群结构存在着差异(P<0.05),也进一步可以说明裂壶藻粉的添加在改变滩羊瘤胃菌群结构中起着重要的作用。

图4 主坐标分析
2.2.5 细菌组成与菌群结构分析
2.2.5.1 门水平结构分析
根据物种注释结果,滩羊瘤胃液细菌在门水平上的菌落组成和相对丰度见表4和图5,共检测到了16个菌门,包括拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、脱硫菌门(Desulfobacterota)、放线菌门(Actinobacteriota)、互养菌门(Synergistota)、Patescibacteria、疣微菌门(Verrucomicrobiota)、螺旋菌门(Spirochaetota)、未分类菌门(unclassified_k_norank_d_bacteria)、蓝藻门(Cyanobacteria)、浮霉菌门(Planctomycetota)、绿屈挠菌门(Chloroflexi)、丝状杆菌门(Fibrobacterota)、WPS-2、Elusimicrobiota。对照组、试验Ⅰ组和试验Ⅱ组滩羊瘤胃液中的优势菌门均为拟杆菌门和厚壁菌门,占到总细菌数的91.19%以上。试验Ⅲ组的优势菌门为拟杆菌门、厚壁菌门和变形菌门,其中拟杆菌门和厚壁菌门占总细菌数的79.75%,变形菌门占总细菌数的13.21%。与对照组相比,试验Ⅰ组脱硫菌门的相对丰度极显著降低(P<0.01);试验Ⅲ组脱硫菌门的相对丰度显著升高(P<0.05),Patescibacteria的相对丰度显著降低(P<0.05)。与试验Ⅰ组相比,试验Ⅱ组浮霉菌门的相对丰度极显著升高(P<0.01);试验Ⅲ组脱硫菌门的相对丰度显著升高(P<0.05)。
2.2.5.2 属水平结构分析
根据物种注释结果,滩羊瘤胃液细菌在属水平上的菌落组成和相对丰度见表5和图6。共检测到了175个菌属,其中有29个菌属相对丰度比例在1%以上,分别为普雷沃氏菌属(Prevotella)、理研菌科_RC9_肠道群(Rikenellaceae_RC9_gut_group)、解琥珀酸菌属(Succiniclasticum)、普雷沃氏菌科UCG-003(Prevotellaceae_UCG-003)、琥珀酸弧菌属(Succinivibrio)、未分类硒藻科(unclassified_Selenomonadaceae)、韦荣氏球菌科_UCG-001(Veillonellaceae_UCG-001)、norank_Muribaculaceae、奎因氏菌属(Quinella)、norank_F082、脱硫弧菌属(Desulfovibrio)、普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)、毛螺菌科_NK3A20_群(Lachnospiraceae_NK3A20_group)、月形单胞菌属(Selenomonas)、克里斯滕森菌科R-7群Christensenellaceae_R-7_group)、瘤胃球菌属(Ruminococcus)等。与对照组相比,试验Ⅰ组脱硫弧菌属的相对丰度极显著降低(P<0.01),未排位拟杆菌目_BS11_肠道群(norank_Bacteroidales_BS11_gut_group)的相对丰度显著降低(P<0.05);试验Ⅱ组理研菌科_RC9_肠道群、未排位拟杆菌目_BS11_肠道群的相对丰度极显著降低(P<0.01);试验Ⅲ组理研菌科_RC9_肠道群、未排位拟杆菌目_BS11_肠道群和未排位拟杆菌目_RF16_群(norank_Bacteroidales_RF16_group)的相对丰度极显著降低(P<0.01)。与试验Ⅰ组相比,试验Ⅱ组norank_Muribaculaceae的相对丰度显著升高(P<0.05);试验Ⅲ组理研菌科_RC9_肠道群和未排位拟杆菌目_RF16_群的相对丰度极显著降低(P<0.01),韦荣氏球菌科_UCG-001的相对丰度显著升高(P<0.05),脱硫弧菌属的相对丰度极显著升高(P<0.01)。
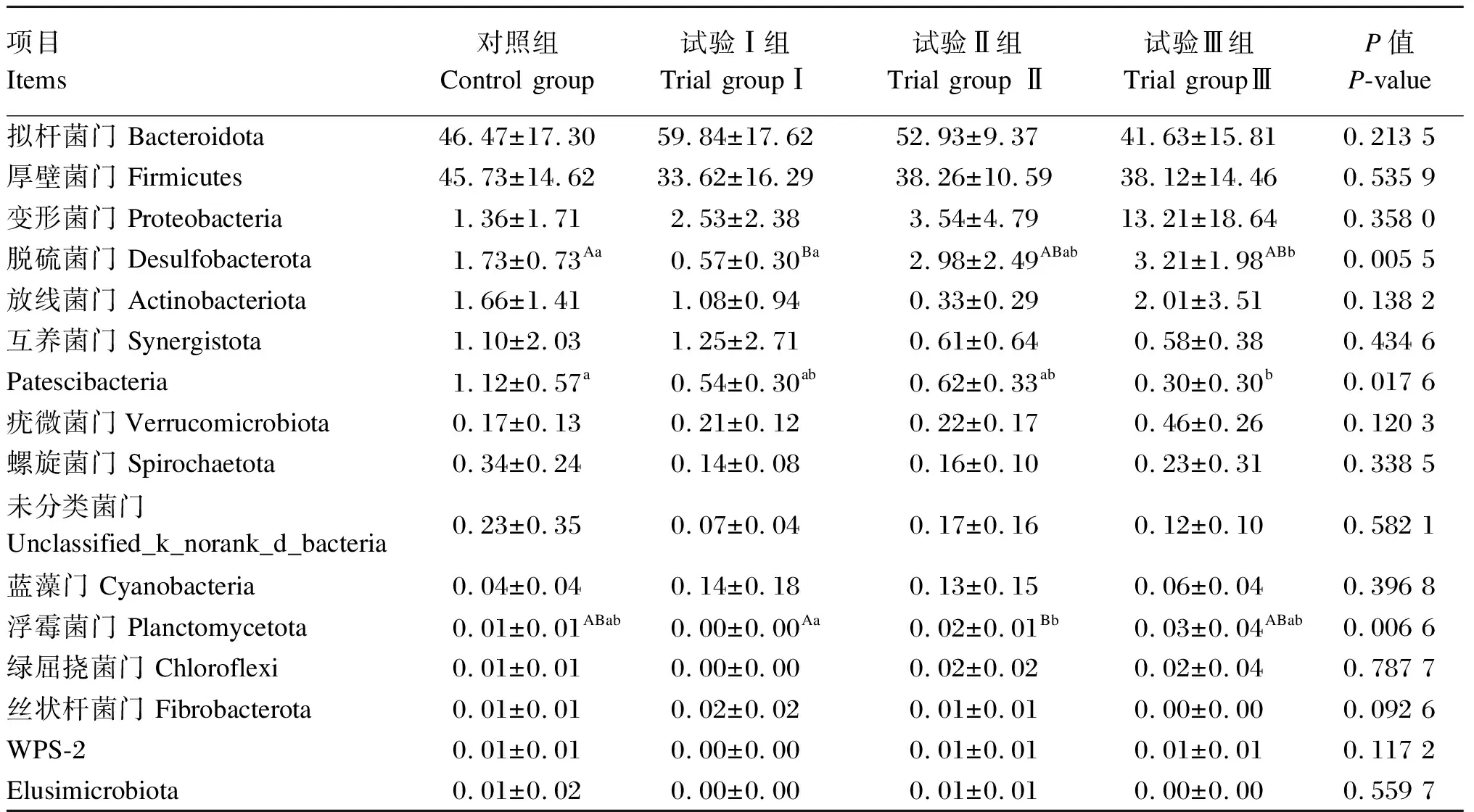
表4 单宁和裂壶藻粉对滩羊瘤胃菌群在门水平上相对丰度的影响
2.3 瘤胃菌群功能预测分析(PICRUSt)
由表6可知,在KEGG生物代谢一级通路水平上,各组滩羊的功能基因主要富集在新陈代谢(metabolism)、遗传信息处理(genetic information processing)和环境信息处理(environmental information processing)。每种功能基因在各组滩羊中相对丰度基本一致。在KEGG生物代谢二级通路水平上,各组滩羊瘤胃菌群功能丰度富集在前10条的二级通路依次为全局和概述图谱(global and overview maps)、碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、辅助因子和维生素的代谢(metabolism of cofactors and vitamins)、能量代谢(energy metabolism)、翻译(translation)、复制和修复(replication and repair)、信号转导(nucleotide metabolism)、膜运输(membrane transport)和聚糖的生物合成和代谢(glycan biosynthesis and metabolism)。其中,试验Ⅰ组的滩羊瘤胃菌群的氨基酸代谢功能通路相对丰度显著高于试验Ⅱ组(P<0.05)。
3 讨 论
生长性能是衡量动物生长速率最重要的指标,也是动物对饲粮中营养物质消化吸收情况的最终显现。刘绘汇等[16]研究发现,在羔羊的代乳粉中添加0.2%的单宁酸能够显著提高羔羊的采食量和平均日增重,与本试验研究结果一致。这是因为单宁对瘤胃蛋白有过瘤胃保护作用,其降低了蛋白质在瘤胃中的降解度,增加了肠道对蛋白质和氨基酸的吸收,提高氮素的利用率。同时由于过瘤胃蛋白含量增加,瘤胃菌群所需的营养物质减少,抑制了菌群的正常繁殖,改变了瘤胃菌群结构,降低了营养物质在瘤胃中的代谢效率,从而使得营养物质进入小肠被小肠消化吸收的含量增多,使得吸收更加充分,从长期来看,与滩羊总增重和平均日增重提高的结果相对应。此外,也有研究表明,单宁会增加空肠和回肠中的绒毛高度、促进肠道细胞的增殖、提高血清中总蛋白和球蛋白的含量、改善肠道完整性、增强机体蛋白质代谢和免疫力、改善了生长性能[17]。在本试验中,试验Ⅰ组瘤胃内脱硫菌门相对丰度的下降再次验证了这一结果。徐晨晨等[18]在柴达木福牛的饲粮中添加100 g/d DHA微藻粉,结果显示该牛的平均日增重增加,这与本试验的结果一致。这可能与DHA会激活蛋白激酶/哺乳动物雷帕霉素靶蛋白(Akt/mTOR)信号通路,增强肌肉蛋白质合成[19],降低瘤胃中氨基酸代谢有关。在本试验中,试验Ⅰ组瘤胃内碳水化合物代谢通路、能量代谢通路和聚糖的生物合成和代谢水平要高于试验Ⅲ组,继而导致了试验Ⅰ组对生长性能提升的效果要优于试验Ⅲ组。
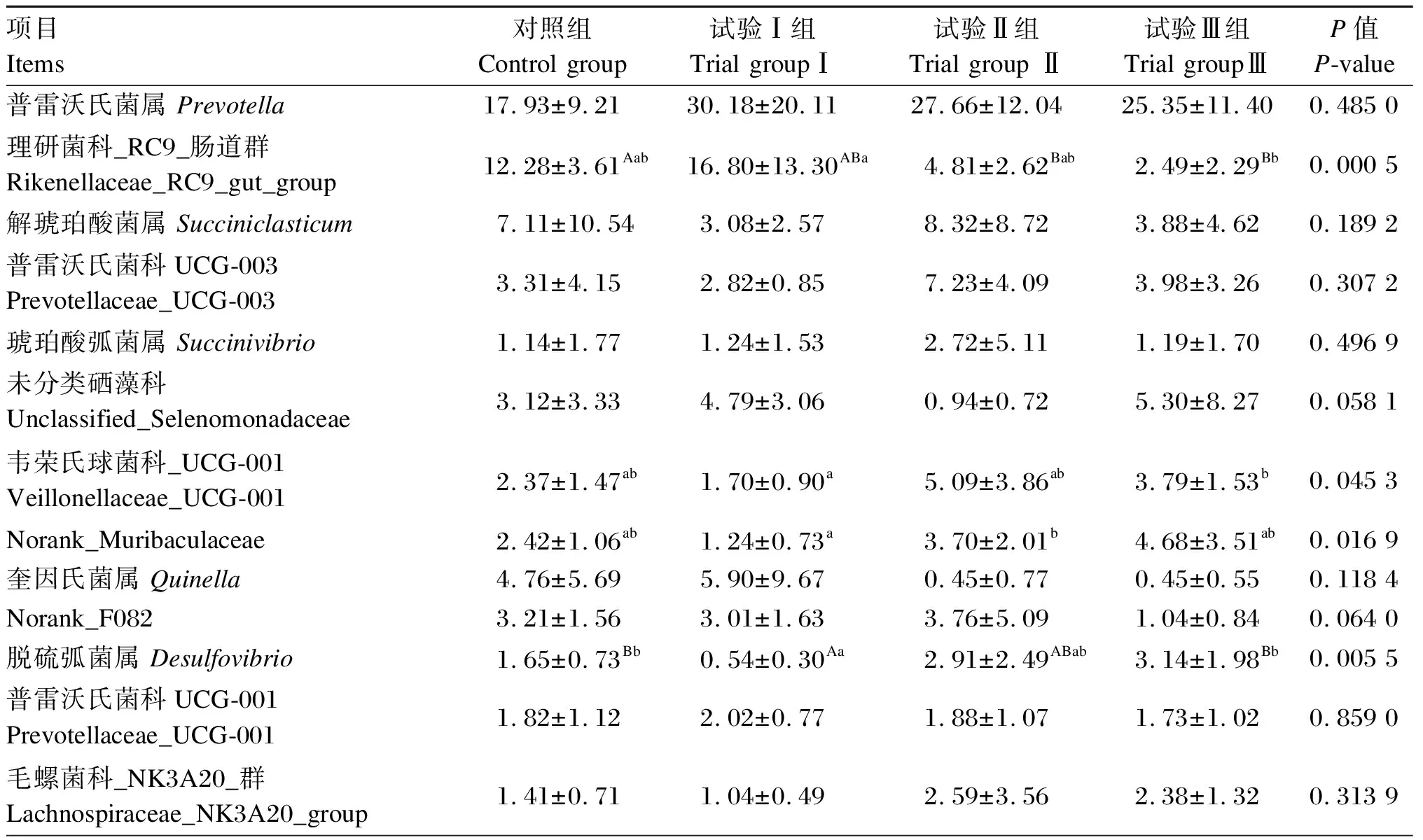
表5 单宁和裂壶藻粉对滩羊瘤胃菌群在属水平上相对丰度的影响
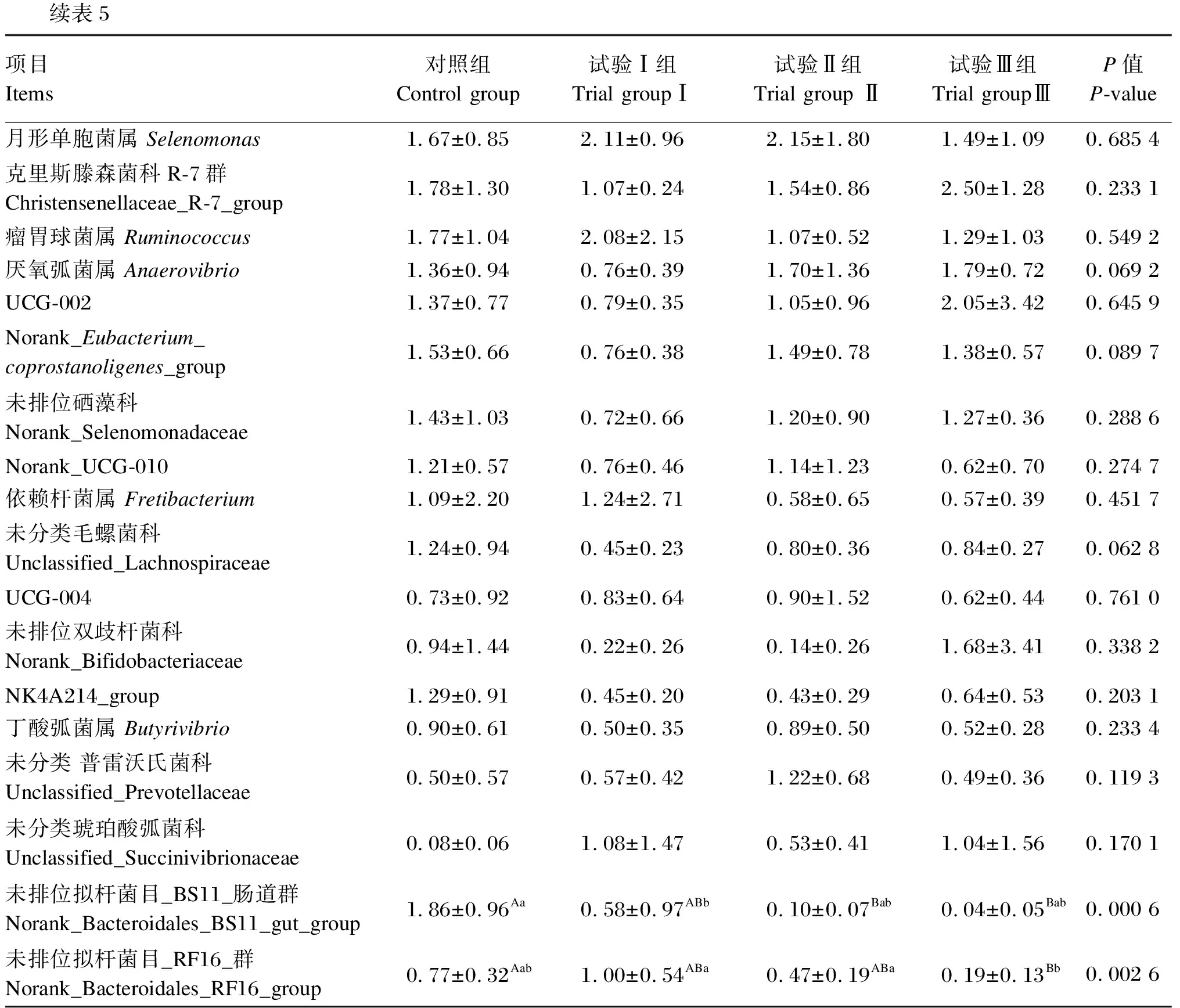
续表5项目Items对照组Control group试验Ⅰ组Trial groupⅠ试验Ⅱ组Trial group Ⅱ试验Ⅲ组Trial groupⅢP值P-value月形单胞菌属 Selenomonas1.67±0.852.11±0.962.15±1.801.49±1.090.685 4克里斯滕森菌科R-7群Christensenellaceae_R-7_group1.78±1.301.07±0.241.54±0.862.50±1.280.233 1瘤胃球菌属 Ruminococcus1.77±1.042.08±2.151.07±0.521.29±1.030.549 2厌氧弧菌属 Anaerovibrio1.36±0.940.76±0.391.70±1.361.79±0.720.069 2UCG-0021.37±0.770.79±0.351.05±0.962.05±3.420.645 9Norank_Eubacterium_coprostanoligenes_group1.53±0.660.76±0.381.49±0.781.38±0.570.089 7未排位硒藻科Norank_Selenomonadaceae1.43±1.030.72±0.661.20±0.901.27±0.360.288 6Norank_UCG-0101.21±0.570.76±0.461.14±1.230.62±0.700.274 7依赖杆菌属 Fretibacterium1.09±2.201.24±2.710.58±0.650.57±0.390.451 7未分类毛螺菌科Unclassified_Lachnospiraceae1.24±0.940.45±0.230.80±0.360.84±0.270.062 8UCG-0040.73±0.920.83±0.640.90±1.520.62±0.440.761 0未排位双歧杆菌科Norank_Bifidobacteriaceae0.94±1.440.22±0.260.14±0.261.68±3.410.338 2NK4A214_group1.29±0.910.45±0.200.43±0.290.64±0.530.203 1丁酸弧菌属 Butyrivibrio0.90±0.610.50±0.350.89±0.500.52±0.280.233 4未分类 普雷沃氏菌科Unclassified_Prevotellaceae0.50±0.570.57±0.421.22±0.680.49±0.360.119 3未分类琥珀酸弧菌科Unclassified_Succinivibrionaceae0.08±0.061.08±1.470.53±0.411.04±1.560.170 1未排位拟杆菌目_BS11_肠道群Norank_Bacteroidales_BS11_gut_group1.86±0.96Aa0.58±0.97ABb0.10±0.07Bab0.04±0.05Bab0.000 6未排位拟杆菌目_RF16_群Norank_Bacteroidales_RF16_group0.77±0.32Aab1.00±0.54ABa0.47±0.19ABa0.19±0.13Bb0.002 6
瘤胃是反刍动物主要的消化器官,就像是一个密闭的厌氧发酵罐,其内栖息着庞大的微生物群落,包括细菌、真菌、原虫等。微生物菌群能将不能被反刍动物直接消化吸收的纤维素和非蛋白氮等,转变为可吸收的短链脂肪酸和含氮物质等代谢产物,为反刍动物的生长发育提供必须的物质和能量。大量研究证实,反刍动物瘤胃中的优势菌群为拟杆菌门和厚壁菌门,其在瘤胃发酵过程中起着重要的作用[20-21]。拟杆菌门为反刍动物瘤胃中的第1优势菌群,主要承担着分解蛋白质和碳水化合物、维持胃肠道正常生理功能的作用[22]。厚壁菌门作为第2优势菌群,主要承担降解纤维素和半纤维素、参与能量代谢等[23]。有研究发现,厚壁菌门相对丰度增加,会使得拟杆菌门相对丰度降低,从而造成代谢紊乱[24]。常玮学等[25]发现,在秦川牛的饲粮中添加水解单宁会增加拟杆菌门的相对丰度,降低厚壁菌门的相对丰度。Zhao等[26]研究显示,在绵羊饲粮中添加蒙古葱精油也会增加拟杆菌门的相对丰度,降低厚壁菌门的相对丰度,这与本试验的结果一致。在本试验中,添加0.4%单宁+2.0%裂壶藻粉组出现了第3优势菌群——变形菌门,变形菌门中除含有纤维素降解菌、半纤维素降解菌和蛋白质降解菌等外,还包括许多致病菌[27]。所以同时添加单宁和裂壶藻粉及其添加量对滩羊瘤胃菌群的影响还需要进一步的试验分析。
脱硫菌门是一种肠道有害菌,可以分解短链脂肪酸[28],使机体炎性因子水平升高,并能穿过肠道黏液层在肠道中定植,肠道中脱硫菌门丰度较高时,会产生硫化氢[29]损伤肠道上皮细胞,破坏肠道屏障功能[30],引发溃疡性结肠炎[31]。疣微菌门可以分解多糖类物质,并产生短链脂肪酸,具有抗炎特性,能够有效增强哺乳动物瘤胃及肠道的免疫功能[32]。在本试验中,与对照组相比,试验Ⅰ组脱硫菌门的相对丰度极显著降低,这表明单宁可能通过降低脱硫菌门的相对丰度,改善滩羊的胃肠道健康。虽然试验Ⅲ组可能对滩羊瘤胃健康状况存在不利影响,但同时疣微菌门的相对丰度也显著提高了,由此可能起到了一个中和的作用,使滩羊瘤胃健康状况保持在一个较好的状态。同时,在本试验中还出现了Patescibacteria、浮霉菌门和WPS-2,目前它们在滩羊瘤胃中的作用鲜有报道,探究这些细菌是不是滩羊瘤胃中特有的菌群,或许可作为下一步的研究方向。

Prevotella:普雷沃氏菌属;Others:其他;Rikenellaceae_RC9_gut_group:理研菌科_RC9_肠道群;Succiniclasticum:解琥珀酸菌属;Prevotellaceae_UCG-003:普雷沃氏菌科UCG-003;Succinivibrio:琥珀酸弧菌属;unclassified_Selenomonadaceae:未分类硒藻科:Veillonellaceae_UCG-001:韦荣氏球菌科_UCG-001;Quinella:奎因氏菌属;Desulfovibrio:脱硫弧菌属;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Lachnospiraceae_NK3A20_group:毛螺菌科_NK3A20_群;Selenomonas:月形单胞菌属;Christensenellaceae_R-7_group:克里斯滕森菌科R-7群;Ruminococcus:瘤胃球菌属;Anaerovibrio:厌氧弧菌属;norank_Selenomonadaceae:未排位硒藻科;Fretibacterium:依赖杆菌属;unclassified_Lachnospiraceae:未分类毛螺菌科;norank_Bifidobacteriaceae:未排位双歧杆菌科;Butyrivibrio:丁酸弧菌;unclassified_Prevotellaceae:未分类普雷沃氏菌科;unclassified_Succinivibrionaceae:未分类琥珀酸弧菌科:norank_Bacteroidales_BS11_gut_group:未排位拟杆菌目_BS11_肠道菌群;norank_Bacteroidales_RF16_group:未排位拟杆菌目_RF16_群。
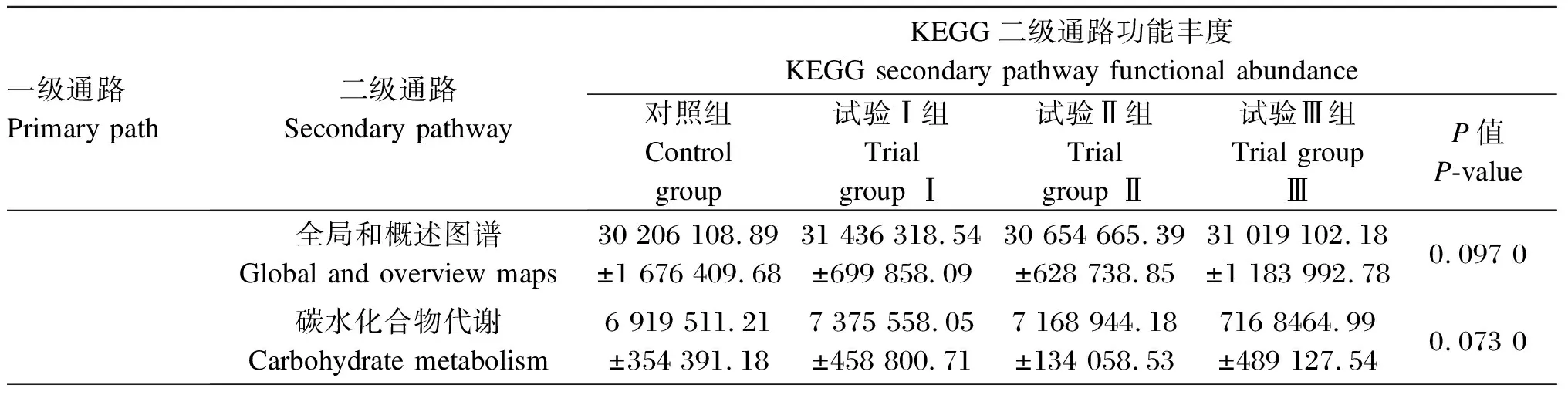
表6 滩羊瘤胃菌群功能丰度KEGG通路分析

续表6一级通路Primary path二级通路Secondary pathwayKEGG二级通路功能丰度KEGG secondary pathway functional abundance对照组 Control group试验Ⅰ组 Trial group Ⅰ试验Ⅱ组 Trial group Ⅱ试验Ⅲ组 Trial group ⅢP值P-value新陈代谢Metabolism氨基酸代谢Amino acid metabolism5 406 665.69±327 148.67ab5 654 024.80±162 557.93a5 364 070.84±112 269.65b5 477 018.16±162 090.01ab0.025 0辅助因子和维生素的代谢Metabolism of cofactors and vitamins3 378 635.29±287 067.783 486 585.29±105 141.413 515 044.26±135 315.203 506 620.93±210 387.410.286 0能量代谢 Energy metabolism3 190 619.90±188 163.853 325 915.58±89 496.043 278 429.06±82 889.593 197 341.15±122 190.630.107 0信号转导Nucleotide metabolism2 089 975.09±142 454.362 221 464.72±124 041.982 189 749.83±81 015.362 167 253.72±108 635.040.157 0聚糖的生物合成和代谢Glycan biosynthesis and metabolism1 393 552.81±173 108.621 545 107.89±170 211.651 560 158.27±136 504.331 498 681.40±188 853.940.084 0遗传信息处理Genetic information processing翻译 Translation2 753 874.95±142 703.312 836 973.10±33 430.512 801 879.46±60 764.402 808 792.21±84 413.810.086 0复制和修复Replication and repair2 378 251.04±125 355.662 469 981.21±42 993.672 430 065.74±52 986.172 423 873.01±74 566.720.063 0环境信息处理Environmental information processing膜运输 Membrane transport1 758 953.53±254 424.771 620 419.99±257 991.501 705 501.99±152 426.761 900 347.72±228 610.610.130 0
在本试验中,普雷沃氏菌属和理研菌科_RC9_肠道群为优势菌属。它们都属于拟杆菌门,可促进胃肠道中碳水化合物的消化吸收,在琥珀酸和丙酸产生的过程中起着重要的作用[33]。与对照组相比,试验Ⅰ组的普雷沃氏菌属和理研菌科_RC9_肠道群相对丰度增加,碳水化合物和能量代谢通路相对丰度增加,表明添加单宁可能会为滩羊提供更多的能量,进而促进其增重。与对照组相比,试验Ⅱ、Ⅲ组的普雷沃氏菌属相对丰度增加,理研菌科_RC9_肠道群相对丰度显著下降,这与高栋[34]的研究结果一致。卓萍等[35]研究发现,韦荣氏球菌可将乳酸转化为乙酸和丙酸,起到改善胃肠道内环境的作用。张莉[36]研究表明,韦荣氏球菌科与氨基酸、辅酶、能量和维生素的代谢,糖苷键代谢及其次级代谢产物呈正相关。在本试验中,与试验Ⅰ组相比,试验Ⅲ组的韦荣氏球菌科_UCG-001相对丰度显著增加,表明添加裂壶藻粉可以改善因单宁对滩羊代谢造成的不利影响。Yang等[37]研究发现,norank_Muribaculaceae是降胆固醇菌属,其与粪便中结合胆汁酸的水平呈负相关。在本试验中,与试验Ⅰ组相比,试验Ⅱ组的norank_Muribaculaceae相对丰度上升,这可能与裂壶藻粉中的多糖类物质有关。此外,基于当前细菌数据库,本研究在滩羊瘤胃菌群内还检测到大量未被分类和排位鉴定的菌属,表明滩羊瘤胃中可能存在一些特定的菌群,同时也反映了目前对微生物区系研究还不足够的事实,在今后的研究中有待于进一步挖掘。
4 结 论
饲粮中添加单宁和裂壶藻粉会提高滩羊的平均日增重,调节瘤胃菌群结构,提高碳水化物化合物和能量代谢等。本试验中,在饲粮中单独添加0.4%单宁的效果最佳,同时添加0.4%单宁和2.0%裂壶藻粉效果次之,而单独添加2.0%裂壶藻粉的效果不太明显。
——“单宁”

