蚕豆及其活性物质对罗非鱼生长性能、血液指标、肌肉抗氧化能力及肌肉品质的影响
符 兵 彭 凯 陈 冰* 黄 文 曹俊明 梁前才 车南青 彭 振 劳成燕
(1.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.广东海洋大学,湛江 524088;3.岭南现代农业科学与技术广东省实验室茂名分中心,茂名 525099;4.茂名市农业科技推广中心,茂名 525099;5.广东忠成农业发展有限公司,茂名 525000)
罗非鱼(tilapia,Oreochromisniloticus)是我国南方养殖的重要经济鱼类,2021年我国罗非鱼养殖总量为166.3万t[1]。近年来,受中美贸易摩擦频发及新冠疫情影响,我国罗非鱼出口严重受创,产品价格持续低迷,罗非鱼产业需要重新瞄准市场,调整、优化、升级产业结构。脆肉罗非鱼的出现成为罗非鱼打开国内市场的突破口。生产实践和试验研究表明,投喂蚕豆(faba bean,ViciafabaL.)可使罗非鱼肉质变得结实而有韧性,口感爽脆而无泥腥味,但由于蚕豆中存在大量抗营养因子,会导致罗非鱼生长性能的降低以及肠道、肝脏等的病变[2-4]。同时,随着脆肉鱼市场的逐步扩大,蚕豆价格上涨较快,饲料成本增加。因此,探索蚕豆活性物质的应用效果,寻找蚕豆的替代物,降低饲料成本是目前的研究热点之一。此外,目前关于罗非鱼脆化机理的研究极少,其机理是否与草鱼(Ctenopharyngodonidella)脆化机理一致尚不明确。
研究发现,饲料中添加2 g/kg的缩合单宁会造成海鲈(Lateolabraxjaponicus)机体的氧化损伤,同时会提高其肌肉纤维密度[5]。3,4-二羟基-L-苯丙氨酸以游离态或β-糖苷态的方式存在于蚕豆和贻贝中,可促进肌肉细胞的分化[6],是治疗帕森斯氏类病药物的主要前体,也可用于工业功能性材料的高效黏合剂[7-8]。还有研究表明,饲喂添加8.0%蚕豆水提取物的膨化料在维持罗非鱼正常生长的同时,可降低氧化损伤,并显著提升其肌肉的硬度和咀嚼性[9]。以上研究结果表明,缩合单宁、3,4-二羟基-L-苯丙氨酸和蚕豆水提取物等蚕豆中的活性物质或提取物很可能参与了鱼肉的脆化。因此,本研究旨在探讨蚕豆、缩合单宁、3,4-二羟基-L-苯丙氨酸和蚕豆水提取物对罗非鱼生长性能、血液指标、肌肉抗氧化能力及肌肉品质的影响,为揭示蚕豆及其活性物质脆化罗非鱼肉的机理提供理论依据。
1 材料与方法
1.1 试验饲料
以豆粕和发酵菜籽粕为主要蛋白质源,高筋面粉为糖源,豆油和磷脂油为主要脂肪源配制常规基础饲料(对照组);在常规基础饲料配方基础上分别添加50.0%的蚕豆粉(甘肃武山县绿源豆类专业合作社,FB组)、4.0%的蚕豆水提取物(西安斯诺特生物科技有限公司,FBWE组)、0.2%的缩合单宁(广州飞禧特生物科技有限公司,CT组)和0.1%的3,4-二羟基-L-苯丙氨酸(湖北艾普蒂生物工程有限公司,DOPA组),并辅以少量鱼粉补充蛋白质和微量调整磷脂油比例,使饲料配方中蛋白质和脂肪水平与基础饲料基本一致。试验饲料组成及营养水平见表1。所有饲料原料经粉碎并全部通过60目标准筛,混合均匀后通过双螺杆挤条机(F-75型,华南理工大学科技实业有限公司)挤压成条,挤压机工作运转部位轴承温度保持在45~50 ℃,然后通过制粒机(G-500型,华南理工大学科技实业有限公司)制成粒径为3 mm的颗粒饲料,55 ℃烘干,自然冷却后放入密封袋中,置于4 ℃下保存备用。

表1 试验饲料组成及营养水平(干物质基础)
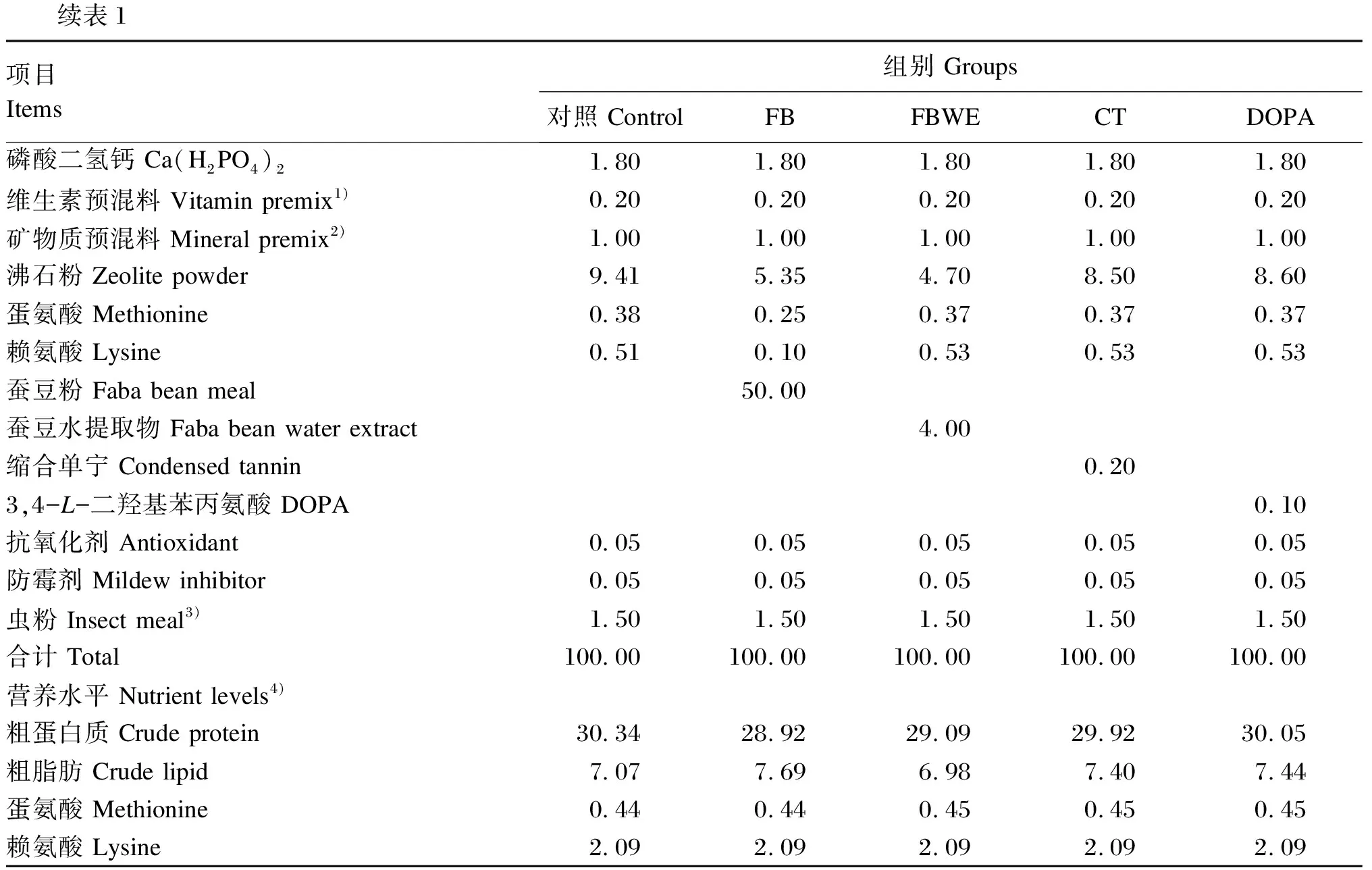
续表1项目Items组别 Groups对照 ControlFBFBWECTDOPA磷酸二氢钙 Ca(H2PO4)2 1.80 1.80 1.80 1.80 1.80 维生素预混料 Vitamin premix1)0.20 0.20 0.20 0.20 0.20 矿物质预混料 Mineral premix2)1.00 1.00 1.00 1.00 1.00 沸石粉 Zeolite powder9.415.354.70 8.508.60 蛋氨酸 Methionine0.38 0.250.37 0.37 0.37 赖氨酸 Lysine0.51 0.100.53 0.53 0.53 蚕豆粉 Faba bean meal50.00蚕豆水提取物 Faba bean water extract4.00缩合单宁 Condensed tannin0.203,4-L-二羟基苯丙氨酸 DOPA0.10抗氧化剂 Antioxidant0.05 0.05 0.05 0.05 0.05 防霉剂 Mildew inhibitor0.05 0.05 0.05 0.05 0.05 虫粉 Insect meal3)1.50 1.50 1.50 1.50 1.50 合计 Total100.00 100.00 100.00 100.00 100.00 营养水平 Nutrient levels4)粗蛋白质 Crude protein30.34 28.9229.09 29.92 30.05 粗脂肪 Crude lipid7.077.696.987.407.44蛋氨酸 Methionine0.44 0.44 0.45 0.450.45赖氨酸 Lysine2.09 2.09 2.09 2.09 2.09
1.2 试验鱼及饲养管理
试验用罗非鱼由广东罗非鱼良种场提供。在水泥暂养池驯养2周后随机选取活泼、健康的的罗非鱼150尾,初始体重为(468.49±10.84) g,随机分为5组,分别命名为对照组及FB、FBWE、CT、DOPA组,每组3个重复,每个重复10尾鱼。饲养试验在广东省农业科学院畜牧研究所水产室养殖系统(每个缸容积约为500 L)进行。5组试验鱼按照组名投喂对应的试验饲料,采用表观饱食投喂方式,每天投喂2次(09:00和17:00),每天记录饲料投喂量、水质情况以及试验鱼死亡情况,试验期为65 d。养殖期间,24 h供氧,水体中溶氧含量>7 mg/L,氨氮含量<0.05 mg/L,亚硝酸盐含量<0.01 mg/L,水温在19.5~21.5 ℃。
1.3 样品采集
养殖试验结束后,禁食24 h,然后统计每缸试验鱼的尾数和总重量,计算终末体重、增重率(WGR)和特定生长率(SGR);统计每缸试验鱼的总摄食量,计算饲料系数(FCR)。每个重复随机取6尾试验鱼测定体长与体重,计算肥满度(CF),分离内脏和肝脏并称重,计算脏体比(VSI)和肝体比(HSI)。每个重复对测定完形态学指标的6尾试验鱼进行尾静脉采血,血液置于含乙二胺四乙酸(EDTA)的2管离心管中,其中一管4 ℃静置12 h后送检,测定血常规指标;另一管常温静置2 h后3 500 r/min离心10 min,取上清液于-80 ℃保存,用于血清生化指标测定。取每个重复采完血的3尾试验鱼去皮,采集肌肉样品,用于肌肉营养成分、游离氨基酸含量和抗氧化指标的测定;剩下的3尾试验鱼去皮后取其背肌(4 cm×3 cm×1 cm),用于质构特性测定。
1.4 检测指标
1.4.1 生长性能与形态学指标
增重率(%)=100×[终末体重(g)-
初始体重(g)]/初始体重(g);
饲料系数=摄食量(g)/[(终末体重(g)-
初始体重(g)];
特定增长率(%/d)=100×[ln终末体重(g)-
ln初始体重(g)]/试验天数(d);
肝体比(%)=100×肝脏重(g)/体重(g);
脏体比(%)=100×内脏重(g)/体重(g);
肥满度(g/cm3)=100×体重(g)/
体长(cm)3。
1.4.2 营养成分含量
饲料和肌肉中的常规营养成分含量采用国标方法测定,其中粗蛋白质含量参照GB/T 6432—2018采用凯氏定氮法测定;粗脂肪含量参照GB/T 6433—2006使用索氏抽提法测定;水分含量参照GB/T 6435—2014采用105 ℃烘干法测定;粗灰分含量参照GB/T 6438—2007使用550 ℃高温灰化法测定。肌肉胶原蛋白含量采用南京建成生物工程研究所生产的试剂盒测定,具体测定方法参考试剂盒说明书。
1.4.3 血液生理生化指标
测定的血常规指标包括白细胞数量(WBC)、红细胞数量(RBC)、血红蛋白含量(HGB)、平均血红蛋白浓度(MCHC)、血小板数量(PLT);测定的血清生化指标包括谷丙转氨酶(ALT)、谷草转氨酶(AST)活性及总胆红素(TBILI)、甘油三酯(TG)、胆固醇(CHOL)和总蛋白(TP)含量。上述血常规指标采用迈瑞BC-5000vet血球仪测定,血清生化指标采用日立7600全自动生化分析仪测定。
1.4.4 肌肉抗氧化指标
肌肉抗氧化指标采用南京建成生物工程所生产的试剂盒并依照说明书步骤测定,其中总超氧化物歧化酶(T-SOD)活性采用羟胺法测定,总抗氧化能力(T-AOC)采用比色法测定,过氧化氢酶(CAT)活性采用可见光法测定,丙二醛(MDA)含量采用2-硫代巴比妥酸(TBA)法测定,谷胱甘肽过氧化物酶(GSH-Px)活性采用比色法测定。
1.4.5 肌肉游离氨基酸含量
准确称取1.0 g肌肉样品,经冷冻干燥后粉碎,参照陈冰等[10]的方法测定游离氨基酸含量。
1.4.6 肌肉质构特性
采用TA.XT.plus型物性测试仪(Stable Micro System公司,英国)分析肌肉质构特性。质构仪参数设置为:圆柱状不锈钢探头,直径5 mm;测试前、中、后速度分别为1、2和5 mm/s;应变模式:下压距离为样品厚度的75%,每个样品下压2次,时间间隔为5 s;触发模式为自动,触发力为5 g。
1.5 数据处理与分析
采用SPSS 22.0 统计软件中的单因素方差分析(one-way ANOVA)和Duncan氏多重比较法对试验结果的差异显著性进行分析。先对数据进行方差齐性检验,若不满足方差齐性,则采用Dunnett-T3检验法进行多重比较。试验结果采用平均值±标准差(mean±SD)表示,差异显著性水平为P<0.05。
2 结 果
2.1 蚕豆及其活性物质对罗非鱼生长性能的影响
由表2可知,与对照组相比,FB组终末体重、增重率、特定生长率显著降低(P<0.05),FBWE、CT、DOPA组则无显著变化(P>0.05)。各试验组的饲料系数与对照组相比无显著差异(P>0.05),但DOPA组饲料系数显著低于FB组(P<0.05)。与对照组相比,FB和FBWE组肥满度显著降低(P<0.05),FB和DOPA组肝体比显著降低(P<0.05),FB组脏体比显著降低(P<0.05)。
2.2 蚕豆及其活性物质对罗非鱼血常规指标的影响
由表3可知,与对照组相比,DOPA组血液中白细胞数量显著降低(P<0.05),FB和FBWE组血液中白细胞数量、红细胞数量和血红蛋白含量显著升高(P<0.05)。血液中平均血红蛋白浓度各组之间无显著差异(P>0.05)。CT组血液中血小板数量显著高于对照组以及FB和DOPA组(P<0.05),但与FBWE组差异不显著(P>0.05)。
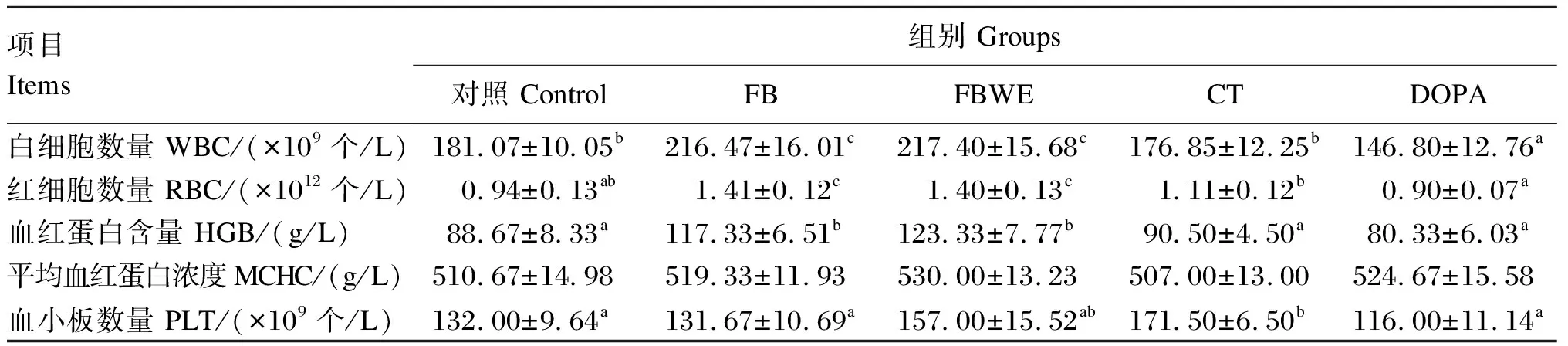
表3 蚕豆及其活性物质对罗非鱼血常规指标的影响
2.3 蚕豆及其活性物质对罗非鱼血清生化指标的影响
由表4可知,与对照组相比,FB、FBWE和CT组血清谷丙转氨酶和谷草转氨酶活性显著升高(P<0.05),DOPA组血清谷丙转氨酶活性显著降低(P<0.05);CT和FBWE组血清总胆红素含量显著升高(P<0.05),FBWE组血清胆固醇含量显著升高(P<0.05)。CT组血清甘油三酯含量显著高于FB组(P<0.05),与其他组差异不显著(P>0.05)。血清总蛋白含量各组之间差异不显著(P>0.05)。

表4 蚕豆及其活性物质对罗非鱼血清生化指标的影响
2.4 蚕豆及其活性物质对罗非鱼肌肉抗氧化指标的影响
由表5可知,与对照组相比,FB组肌肉总超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性以及总抗氧化能力显著降低(P<0.05),FB和FBWE组肌肉丙二醛含量显著升高(P<0.05)。与对照组相比,CT组肌肉总超氧化物歧化酶活性显著升高(P<0.05)。

表5 蚕豆及其活性物质对罗非鱼肌肉抗氧化指标的影响
2.5 蚕豆及其活性物质对罗非鱼肌肉营养成分含量的影响
由表6可知,各组罗非鱼的肌肉水分、粗蛋白质和粗脂肪含量无显著差异(P>0.05)。FBWE和CT组肌肉粗灰分含量显著高于FB组(P<0.05),但与对照组和DOPA组差异不显著(P>0.05)。FB、FBWE和DOPA组肌肉胶原蛋白含量显著高于CT组和对照组(P<0.05)。

表6 蚕豆及其活性物质对罗非鱼肌肉营养成分含量的影响
2.6 蚕豆及其活性物质对罗非鱼肌肉游离氨基酸组成的影响
由表7可知,各组罗非鱼肌肉亮氨酸、苏氨酸、蛋氨酸、赖氨酸、苯丙氨酸、缬氨酸、天冬氨酸、甘氨酸、丝氨酸、精氨酸、酪氨酸、鲜味氨基酸、总必需氨基酸和总氨基酸含量无显著差异(P>0.05)。与对照组相比,FB组肌肉组氨酸和丙氨酸含量显著降低(P<0.05),FBWE组肌肉谷氨酸含量显著升高(P<0.05)。FB组和对照组肌肉异亮氨酸含量显著高于DOPA组(P<0.05),但与FBWE和CT组差异不显著(P>0.05)。
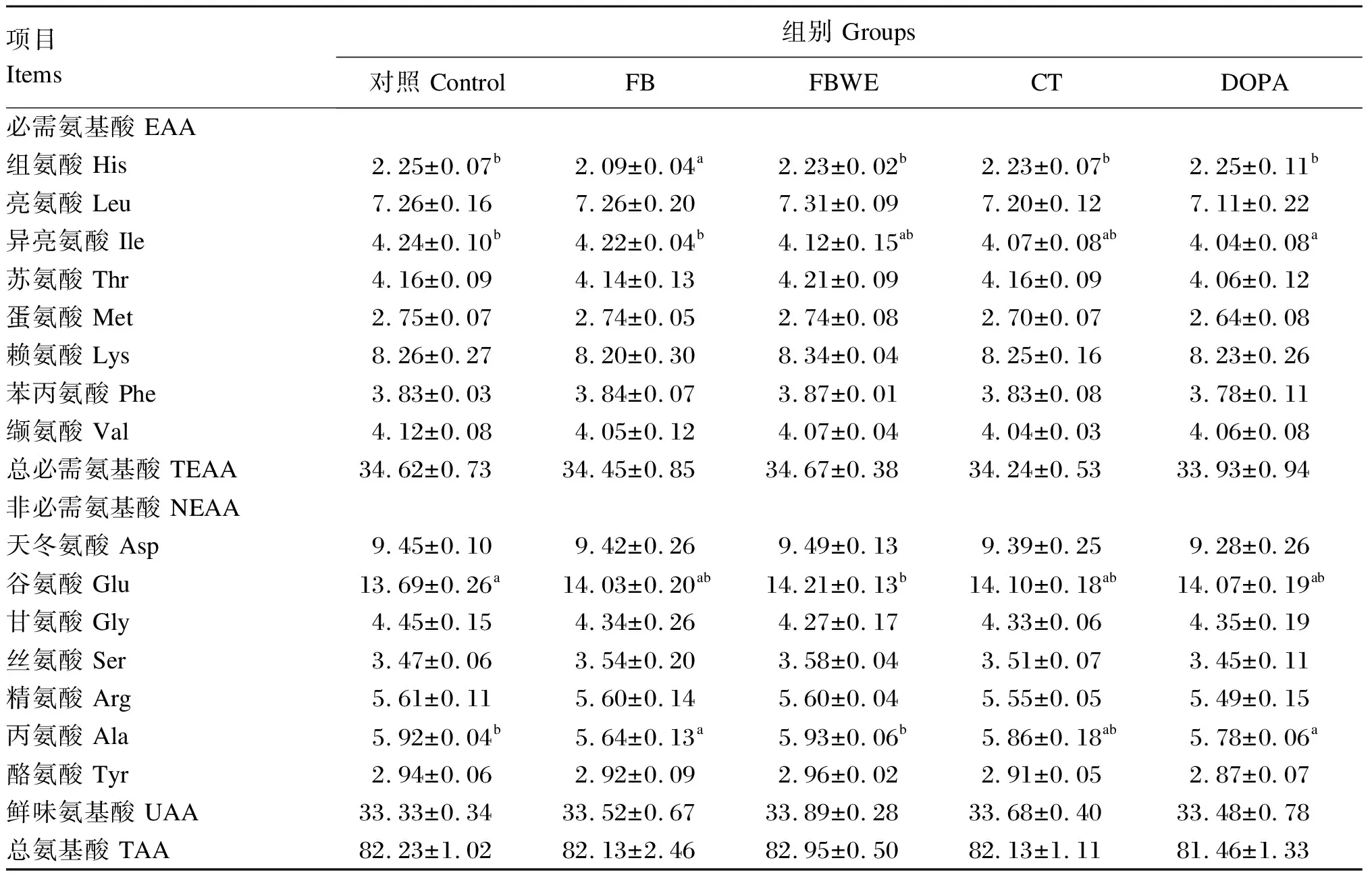
表7 蚕豆及其活性物质对罗非鱼肌肉游离氨基酸组成的影响
2.7 蚕豆及其活性物质对罗非鱼肌肉质构特性的影响
由表8可知,与对照组相比,FB、FBWE、CT和DOPA组肌肉硬度显著升高(P<0.05),其顺序为FB组>DOPA组>FBWE组>CT组>对照组;FB、FBWE和DOPA组肌肉弹性显著升高(P<0.05);FB组肌肉内聚性显著升高(P<0.05),CT组肌肉内聚性显著降低(P<0.05);FB、FBWE、CT和DOPA组肌肉胶黏性显著升高(P<0.05),其顺序为FB组>DOPA组>FBWE组>CT组>对照组;FB、FBWE和DOPA组肌肉咀嚼性显著升高(P<0.05);FB组肌肉回复性显著升高(P<0.05)。

表8 蚕豆及其活性物质对罗非鱼肌肉质构特性的影响
3 讨 论
3.1 蚕豆及其活性物质对罗非鱼生长性能的影响
鉴于脆肉鲩养殖的成功,近年来亦掀起了一股脆肉罗非鱼养殖的热潮。然而,相关研究显示,相较于配合饲料组,蚕豆组罗非鱼会出现增重率、特定生长率和肝体比降低,饲料系数升高等现象[11-13]。本试验中,饲料中添加蚕豆的FB组罗非鱼表现出的生长性能与上述结果一致,这可能归因于蚕豆中存在嘧啶葡糖苷、胰蛋白酶抑制剂、缩合单宁等抗营养因子,在降低饲料适口性的同时破环了肠道的正常结构,从而影响了机体对营养物质的消化和吸收。本试验结果表明,蚕豆水提取物不会影响罗非鱼的增重率,但会显著提高脏体比,降低肥满度。这与Li等[9]的研究结果略有不同,可能是养殖环境和饲料组成不同所致。本试验结果表明,3,4-二羟基-L-苯丙氨酸会显著降低罗非鱼的肝体比,而缩合单宁会显著增加肝体比,这可能归因于3,4-二羟基-L-苯丙氨酸和缩合单宁添加剂量的差异。彭凯等[14]认为,缩合单宁对水产动物生长性能的影响主要取决于缩合单宁的添加剂量和试验对象的品种。此外,Peng等[5]的研究结果表明,饲料中添加2 g/kg的缩合单宁会损伤海鲈的肠道组织结构,破坏肠道菌群平衡,抑制海鲈的生长。而本试验发现,饲料中添加0.2%的缩合单宁对罗非鱼的生长性能无显著影响,这说明罗非鱼对缩合单宁的耐受能力可能要高于海鲈。
3.2 蚕豆及其活性物质对罗非鱼血液指标的影响
血常规指标通常被用作评估鱼类的健康状况,其与机体的代谢、营养状况及疾病密切相关[15-16]。红细胞具有携带氧气和运输营养物质的作用,白细胞在抵抗病原入侵、吞噬异物和产生抗体等方面发挥重要作用,血红蛋白与血液气体运输相关。谭乾开等[17]、毛盼等[18]研究发现,投喂蚕豆的异育银鲫和草鱼会处于缺氧和病理状态,机体会通过代偿机制增加红细胞数量和白细胞数量,以维持生理需求和一定的非特异性免疫能力。本试验结果与上述研究结果一致,FB组罗非鱼表现出最强的“代偿”反应,FB和FBWE组罗非鱼血液携氧能力得到提升,而DOPA组罗非鱼白细胞数量的显著减少则可能与血液中谷丙转氨酶和谷草转氨酶活性的降低有关。此外,CT组罗非鱼血清谷丙转氨酶和谷草转氨酶活性的显著升高表明缩合单宁对罗非鱼机体的损伤要比蚕豆水提取物、3,4-二羟基-L-苯丙氨酸严重;而肌肉抗氧化指标显示,这并非是氧化损伤所致,很可能是该剂量的缩合单宁刺激了某些致炎因子的表达,导致了机体的炎症反应。因为血液中谷丙转氨酶和谷草转氨酶活性的升高标志着肝细胞膜受到破坏,肝功能出现损伤[19],其具体原因有待进一步研究。血液中总胆红素含量能体现肝脏代谢功能[20],当肝功能出现障碍时,总胆红素正常代谢活动受到影响,就会在血液中积累。本试验结果进一步说明,饲料中添加缩合单宁和蚕豆水提取物会损伤罗非鱼的肝功能。
3.3 蚕豆及其活性物质对罗非鱼肌肉抗氧化能力的影响
机体在代谢过程中会产生活性氧(ROS),正常情况下生物体内的ROS处于不断生产和消除的动态平衡状态,当其超出正常阈值水平时会引起组织的“氧化应激”,导致氧化损伤[21]。而机体主要依赖超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶这一酶促体系,来保护细胞免受ROS造成的氧化损伤[22]。鱼体摄入蚕豆后,蚕豆中的嘧啶葡糖苷会使红细胞中的谷胱甘肽(GSH)和ATP快速减少,降低机体消除自由基的能力,造成组织的氧化损伤[23],本试验中FB组的结果与之一致。本试验结果表明,缩合单宁能显著提高罗非鱼肌肉的抗氧化能力,这可能是其激活了Kelch样环氧氯丙烷相关蛋白1(Keap1)-核因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)信号通路,上调了抗氧化酶基因的表达。近年的研究表明,Keap1-Nrf2/ARE信号通路在抵御动物机体抗氧化应激过程中发挥的重要角色[14,24]。3,4-二羟基-L-苯丙氨酸也表现出与缩合单宁相似的抗氧化能力,这可能与3,4-二羟基-L-苯丙氨酸的邻苯二酚基团的强还原性有关[8]。
3.4 蚕豆及其活性物质对罗非鱼肌肉品质的影响
粗蛋白质、粗脂肪和胶原蛋白等营养成分的含量对鱼类肌肉营养品质的评价起着重要作用[25-26]。粗蛋白质和粗脂肪含量易受外界因素影响,胶原蛋白则是由成纤维细胞主要利用细胞内的甘氨酸和脯氨酸合成而来,其与肌肉硬度密切相关[27-28]。研究认为,饲喂蚕豆及其提取物会降低鱼体的粗脂肪含量,显著提高肌肉的胶原蛋白含量[29-30]。本试验结果表明,饲料中添加蚕豆、蚕豆水提取物、缩合单宁和3,4-二羟基-L-苯丙氨酸对肌肉常规营养成分无显著影响,但显著提高了肌肉胶原蛋白含量,其中3,4-二羟基-L-苯丙氨酸和蚕豆水提取物效果较好。这可能是本试验中添加剂量的3,4-二羟基-L-苯丙氨酸和蚕豆水提取物激活了转化生长因子-β(TGF-β)/果蝇母亲抗十肽蛋白(Smads)信号通路,进而上调了果蝇母亲DPP同源物2(samd2)、果蝇母亲DPP同源物4(samd4)、Ⅰ型胶原蛋白α1链(col1α1)以及Ⅰ型胶原蛋白α2链(col1α2)的表达,最终促进肌肉中胶原蛋白的沉积[31-32]。上述研究所得结果的不同可能与养殖密度、养殖环境、投喂方式、饲粮组成等因素不同有关。鱼肉的风味与鱼肉中氨基酸含量密切相关[33],其中鲜味氨基酸(谷氨酸、甘氨酸、丙氨酸、天冬氨酸)含量的高低决定了鱼肉的鲜美程度。研究发现,投喂蚕豆会增加黄河鲤鱼(Cyprinuscarpiohaematopterus)[34]和罗非鱼[35]肌肉中鲜味氨基酸和风味核苷酸含量。本试验结果与之类似,饲料中添加蚕豆、蚕豆水提取物、缩合单宁和3,4-二羟基-L-苯丙氨酸对罗非鱼肌肉总氨基酸含量无显著影响,但略微提高了肌肉鲜味氨基酸的含量。
除了营养成分外,鱼肉品质还可用硬度、咀嚼性、弹性、黏附性和黏结性等质构特性指标进行评价[36]。质构特性测定是通过质构仪模拟食物被咀嚼过程,把质地感官知觉与力学性能、几何特性相结合,形成一系列数据客观的评价食物品质的评定方法。前人研究发现,饲粮中添加缩合单宁和蚕豆水提取物能显著提高海鲈[5]和草鱼[37]肌肉的硬度和咀嚼性,达到“脆化”的效果,改善了鱼肉的口感。本试验结果表明,蚕豆使罗非鱼肉表现出最佳的脆化效果,其次是3,4-二羟基-L-苯丙氨酸和蚕豆水提取物,这与各组罗非鱼肌肉中胶原蛋白含量的高低基本一致。
4 结 论
在本试验条件下,饲料中添加蚕豆会显著降低罗非鱼的生长性能,而添加蚕豆水提取物、缩合单宁和3,4-二羟基-L-苯丙氨酸则对罗非鱼的生长性能无显著影响。此外,饲料中添加缩合单宁能提高罗非鱼肌肉的抗氧化能力,添加蚕豆、蚕豆水提取物和3,4-二羟基-L-苯丙氨酸均能提高罗非鱼肌肉的质构特性,但添加蚕豆、蚕豆水提取物和缩合单宁会损伤罗非鱼的肝功能。由此可见,3,4-二羟基-L-苯丙氨酸或蚕豆水提取物可作为蚕豆的替代物。
——“单宁”

