发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹生长性能、免疫功能、抗氧化能力和肠道健康的影响
庞 栋 戚常乐 叶金云
(湖州师范学院生命科学学院,水生动物繁殖与营养国家地方联合工程实验室,浙江省水生生物资源养护与开发技术研究重点实验室,湖州 313000)
豆粕是我国养殖水产动物饲料中最主要的植物蛋白质源,但我国大豆自给率长期不超过20%,严重依赖进口[1]。自中美贸易冲突以来,豆粕贸易多次被当作谈判筹码,导致豆粕价格不定,供应不稳,给我国水产动物饲料产业健康发展造成严重影响。因此,水产动物饲料产业亟需开发能够替代豆粕的新型植物蛋白质源。
我国是世界第一产棉大国,棉籽粕供应稳定,价格相对低廉,可作为豆粕的潜在替代蛋白质源。但棉籽粕中含有较多的抗营养因子,如棉酚、植酸、单宁等,会造成水产动物抗氧化能力、免疫功能下降[2],肝脏、肠道、肌肉等组织器官受到损伤[3],饲料的适口性也会下降[4-5]。发酵棉籽粕(fermented cottonseed meal,FCM)是使用发酵技术发酵脱毒后的棉籽粕,其抗营养因子含量大幅度降低,营养成分含量和适口性增加,更具应用前景[6-7]。一些学者已经在青鱼(Mylopharyngodonpiceus)[8]、草鱼(Ctenopharyngodonidella)[9]、鲫(Carassiusauratus)[10]、凡纳滨对虾(Litopenaeusvannamei)[11]等水产养殖对象上进行了发酵棉籽粕替代的应用研究,但有关发酵棉籽粕替代豆粕在中华绒螯蟹(Eriocheirsinensis)饲料中的应用鲜有报道。中华绒螯蟹属弓蟹科,绒螯蟹属,又名河蟹、大闸蟹,是中国传统美食珍品,2019年全国年产量超过77万t[12]。植物蛋白质源对水产动物的生长性能、免疫功能、抗氧化能力和肠道菌群结构会造成影响[13-15]。基于此,本试验以发酵棉籽粕替代饲料中不同比例的豆粕,研究其对中华绒螯蟹幼蟹生长性能、血淋巴生化指标、肝胰腺抗氧化指标、肠道组织结构与菌群的影响,以期为发酵棉籽粕在中华绒螯蟹配合饲料中的应用提供理论基础。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕、棉籽粕、发酵棉籽粕、菜籽粕为蛋白质源,鱼油、豆油、大豆卵磷脂为脂肪源,糊化淀粉为糖源,配制5种等氮等脂的试验饲料。5种试验饲料中发酵棉籽粕替代豆粕的比例分别为0(FCM0,作为对照)、20%(FCM20)、40%(FCM40)、60%(FCM60)和80%(FCM80)。试验饲料组成及营养水平见表1。饲料原料经粉碎机粉碎,过60目筛,按照饲料配方称重混匀,加水混合搅拌至适当湿度后,用双螺杆压条机压制、粉碎,制成粒径为1.5 mm的颗粒饲料,至烘箱40 ℃烘12~24 h,直至水分含量小于10%,保存于-20 ℃冰柜中备用。
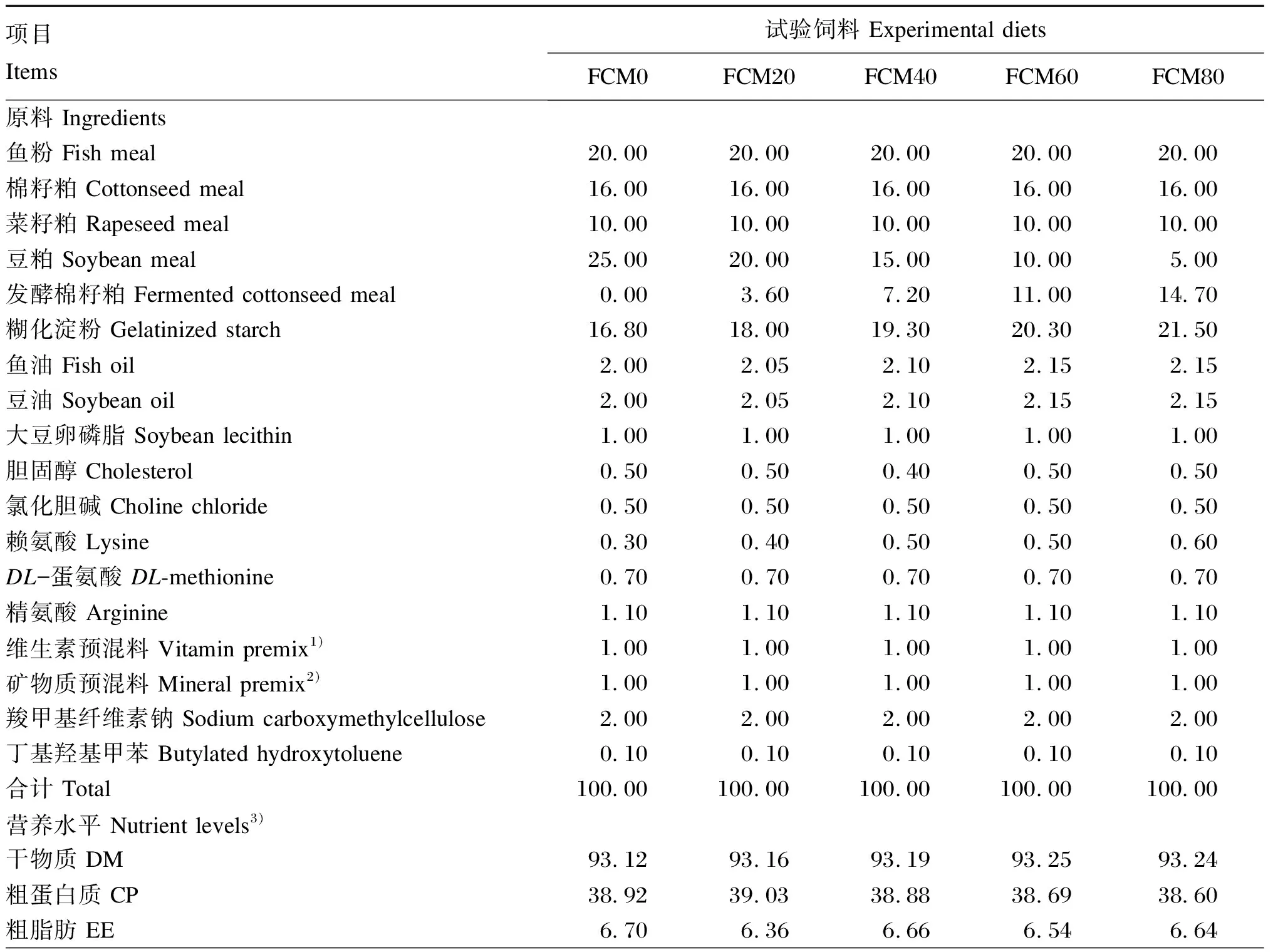
表1 试验饲料组成及营养水平(风干基础)

续表1项目 Items试验饲料 Experimental dietsFCM0FCM20FCM40FCM60FCM80粗灰分 Ash6.886.846.816.756.76游离棉酚 Free gossypol/(mg/kg)144.00175.03206.05238.80270.69
1.2 饲养管理
养殖试验在湖州师范学院水生生物养殖实验中心内进行,中华绒螯蟹苗购于上海崇明某苗种厂。正式养殖试验前,所购中华绒螯蟹苗先在300 L水桶中暂养7 d,暂养期间投喂商业配合饲料。将附肢完整的中华绒螯幼蟹[(0.38±0.01) g]随机分配到20个水桶中,每桶30只,每5桶为1组,共分成5组,分别饲喂1种试验饲料,饲喂期为8周。每个水桶中放置5捆蓝色聚氯乙烯(PVC)软管(长10 cm,直径2.5 cm,每捆5根,用扎带固定)和4块拱形瓦片作为遮蔽物,以减少幼蟹间相互残杀。饲养前加水至水桶4/5高处,充分曝气。养殖期间初始投喂量为每桶幼蟹总重的4%,每日在06:00和18:00投喂,每次投喂量相同。投喂5 h后吸除粪便和残饵,每天更换1/3的养殖用水。在养殖期间,每天检查死蟹情况并称重记录。养殖水温25.0~28.0 ℃,氨氮浓度<0.05 mg/L。
1.3 样品采集
在为期8周的养殖试验结束时,饥饿24 h,然后分别对每桶幼蟹进行计数和称重。所有幼蟹均在冰上麻醉。每桶随机取2只幼蟹保存于-20 ℃,用于体成分分析。每桶随机取8只幼蟹,在幼蟹的第3附肢基部处取血淋巴,总共吸取约3 mL血淋巴,4 ℃保存过夜,经高速冷冻离心机4 000 r/min离心后吸出血清,-20 ℃保存备用;取出肝胰腺,称重后-80 ℃保存用于备用。每桶另随机取5只幼蟹,取出肠道,保存在4%多聚甲醛溶液中,用于切片制作和组织学观察。每组随机取5只幼蟹,取出肠道,保存在-80 ℃用于肠道菌群测序。
1.4 指标测定
1.4.1 生长性能指标计算
使用如下公式计算成活率(SR)、增重率(WGR)、特定生长率(SGR)和肝胰腺指数(HSI):
成活率(%)=100×(终末蟹数/初始蟹数);
增重率(%)=100×(终末体重-
初始体重)/初始体重;
特定生长率(%/d)=100×(ln终末体重-
ln初始体重)/养殖天数;
肝胰腺指数(%)=100×(肝胰腺重/蟹体重)。
1.4.2 饲料和全蟹营养成分分析
饲料和全蟹的水分含量采用105 ℃干燥法测定,粗蛋白质含量采用燃烧法(杜马斯定氮仪)测定,粗脂肪含量采用索氏抽提法测定,粗灰分含量采用马弗炉灼烧法测定,游离棉酚含量参照GB/T 13086—2020测定。
1.4.3 血淋巴生化指标和肝胰腺抗氧化指标测定
称量肝胰腺样品0.1 g左右,按1∶9的比例加入预冷的磷酸盐缓冲液(PBS),加入组织研磨珠2粒进行匀浆,然后在4 ℃下1 500×g离心30 min,吸取上清液,并等分保存在-80 ℃超低温冰箱中。使用南京建成生物工程研究所生产的试剂盒,根据试剂盒说明书的方法测定血淋巴中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)活性以及肝胰腺中还原性谷胱甘肽(GSH)含量、总抗氧化能力(T-AOC)及谷胱甘肽过氧化物氧化酶(GSH-Px)、过氧化氢酶(CAT)、过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)活性。
1.4.4 肠道组织结构观察
将使用4%多聚甲醛固定的肠道组织送至武汉塞维尔生物科技有限公司进行石蜡包埋,制作切片。肠道组织切片采用苏木精-伊红(HE)染色后进行组织结构观察并拍照。
1.4.5 肠道菌群分析
将采集的肠道样本(每组5个重复)送至杭州联川生物技术股份有限公司进行肠道菌群DNA提取、建库和16S rDNA测序分析。进行物种注释分析的数据库为SILVA。鉴定结果已上传至NCBI,SRA登录号:SRX19302757-SRX19302766。
1.5 统计分析
所有数据均使用SPSS 25.0软件进行统计分析。数据通过Shapiro-Wilk和Levene方法进行正态分布检验和方差同质性检验。通过检验后的数据再进行单因素方差分析(one-way ANOVA)。所有数据均以平均值±标准误(mean±SD)表示,各组平均值之间的差异显著性采用Turkey法检验。肠道菌群数据使用成对样品t检验(t-test)方法进行分析。统计学显著差异用P<0.05表示。
2 结果与分析
2.1 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹生长性能的影响
由表2可知,在中华绒螯蟹幼蟹饲料中使用发酵棉籽粕替代不同比例豆粕,各组幼蟹的终末体重、特定生长率、增重率以及成活率均无显著差异(P>0.05)。随着替代比例的增加,肝胰腺指数呈先上升后下降的趋势,以FCM40组的肝胰腺指数最高,显著高于FCM0和FCM80组(P<0.05)。
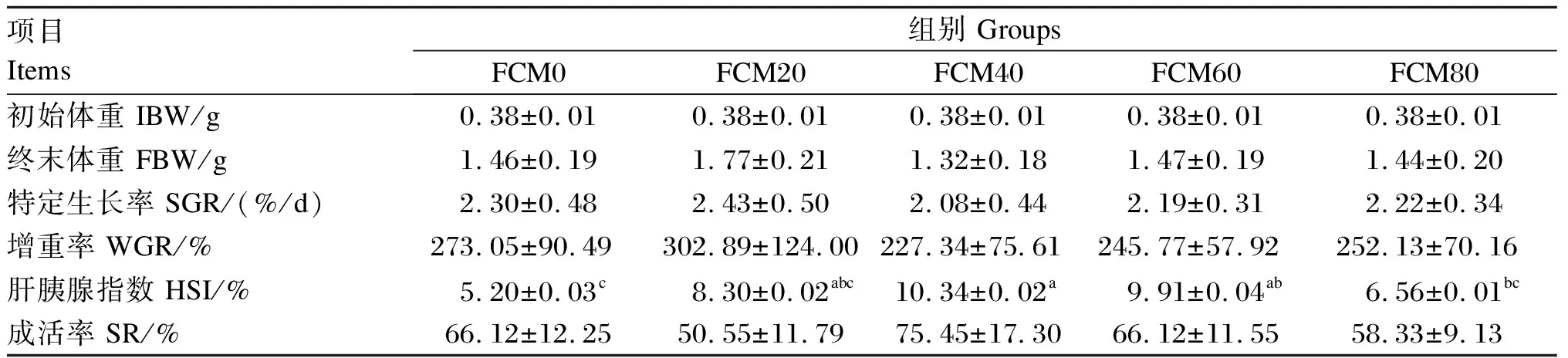
表2 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹生长性能的影响
2.2 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹体成分的影响
由表3可知,在中华绒螯蟹幼蟹饲料中使用发酵棉籽粕替代不同比例豆粕对全蟹水分、粗脂肪和粗蛋白质含量均无显著影响(P>0.05)。FCM20、FCM40和FCM80组全蟹粗灰分含量显著低于FCM0和FCM60组(P<0.05)。
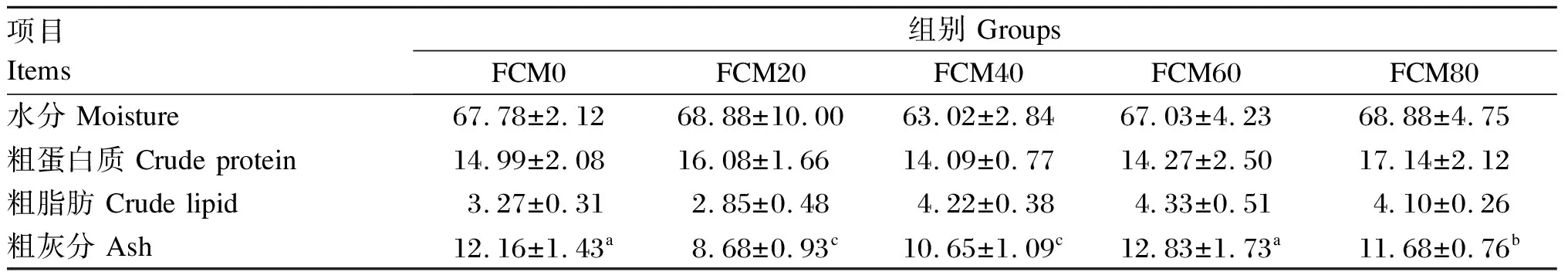
表3 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹体成分的影响(鲜重基础)
2.3 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹血淋巴生化指标的影响
由表4可知,随着替代比例的增加,血淋巴ACP和AKP活性呈现先升高后下降的趋势,且以FCM60组最高,显著高于其他各组(P<0.05)。FCM60组血淋巴ALT活性显著低于其他各组(P<0.05)。随着替代比例的增加,血淋巴中AST活性呈现先下降后上升的趋势,且以FCM40组最低,显著低于其他各组(P<0.05)。
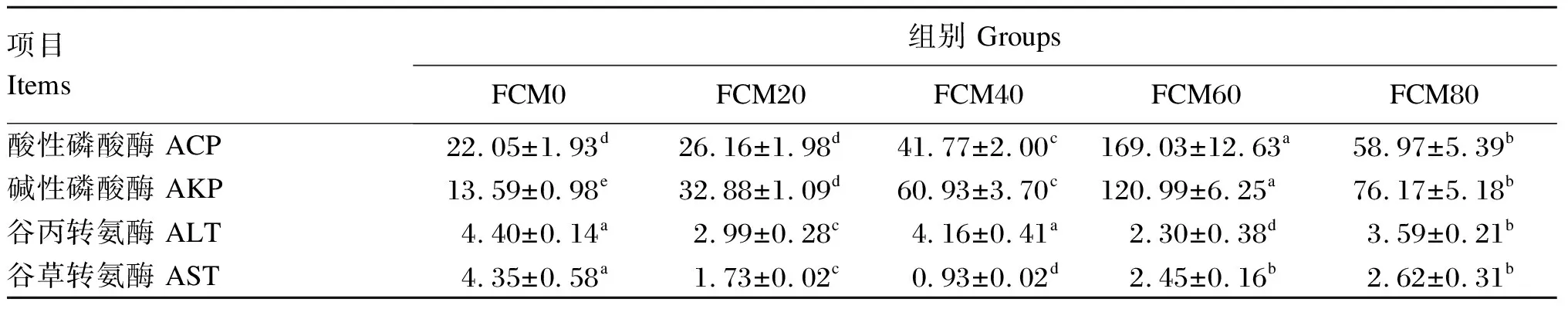
表4 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹血淋巴生化指标的影响
2.4 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹肝胰腺抗氧化指标的影响
由表5可知,FCM40组肝胰腺CAT活性显著高于FCM0组(P<0.05),FCM60和FCM80组则显著低于FCM0组(P<0.05)。与FCM0组相比,各替代组(FCM20、FCM40、FCM60和FCM80组)肝胰腺T-SOD活性显著降低(P<0.05),但在5个替代组中以FCM40组最高。FCM60和FCM80组肝胰腺T-AOC与FCM0组相比显著升高(P<0.05)。各替代组肝胰腺中GSH含量与FCM0组相比均显著升高(P<0.05)。与FCM0组相比,FCM20、FCM40和FCM80组肝胰腺GSH-Px活性显著降低(P<0.05)。

表5 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹肝胰腺抗氧化指标的影响
2.5 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹肠道组织结构的影响
根据生长性能和肝脏抗氧化指标检测结果,选取FCM0、FCM40和FCM80组进行肠道组织结构观察。由图1可知,FCM0组肠绒毛前部围食膜与上皮细胞结合,未见明显脱落情况,上皮细胞排列紧密,未见明显损伤;FCM40组未见围食膜与上皮细胞脱落,个别肠绒毛可见上皮细胞缺损;FCM80组围食膜与上皮细胞脱落,上皮细胞可见明显缺损。
2.6 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹肠道菌群的影响
基于生长性能、肝胰腺抗氧化指标及肠道组织学结果,选取FCM0和FCM40组进行肠道菌群分析。根据加权Unifrac距离,使用主坐标分析(PCoA)图显示FCM0和FCM40组中华绒螯蟹幼蟹肠道菌群的差异。由图2可知,代表2个组样本的色点区域重合,这表明从主坐标分析来看FCM0和FCM40组的肠道菌群组成无显著差异。
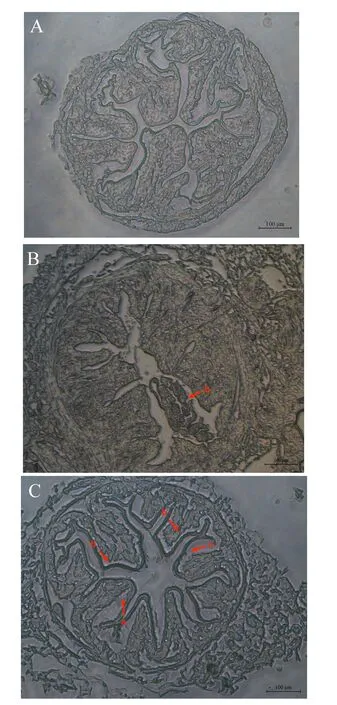
A:FCM0组;B:FCM40组;C:FCM80组。切片观察放大倍数为100×,比例尺长度为100 μm。箭头a显示围食膜从肠道上皮细胞表面脱落;箭头b显示肠道上皮细胞损伤。
由表6可知,FCM0和FCM40组的肠道菌群覆盖率(Goods coverage)都在99.99%以上,说明这2个组的肠道物种均已检测到。2组间肠道菌群操作分类单元(OTUs)数量无显著差异(P>0.05)。pielou_e指数和Chao1指数表现为FCM40组大于FCM0组,表明FCM40组肠道菌群均匀度更大,包含的物种数更多。Shannon指数和Simpson指数表现为FCM40组大于FCM0组。但2组间的上述各项指数均无显著差异(P>0.05)。上述结果说明FCM40组中华绒螯蟹幼蟹肠道菌群的α多样性与FCM40组无显著差异。
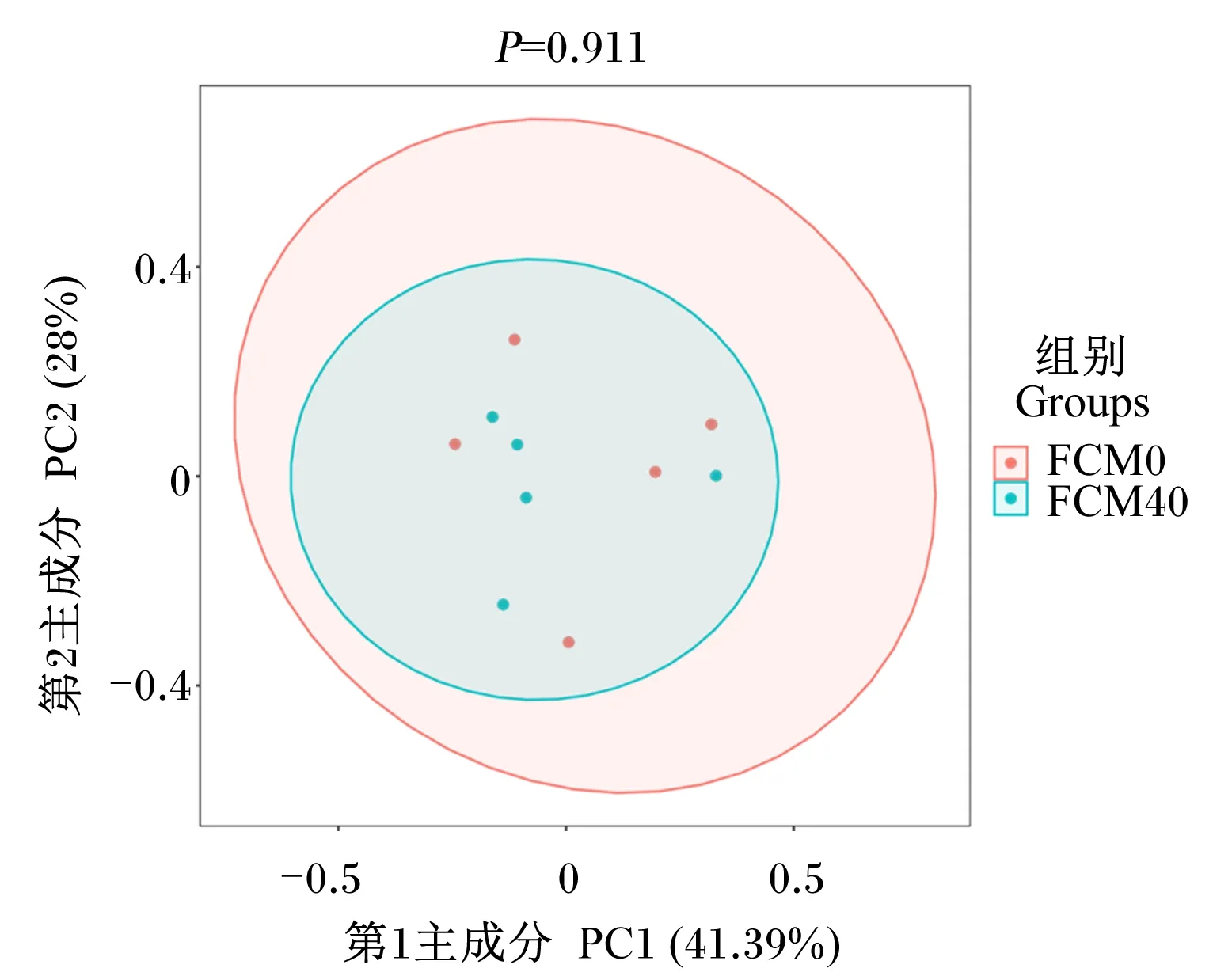
图2 FCM0和FCM40组中华绒螯蟹幼蟹肠道菌群主坐标分析图
图3为FCM0和FCM40组中华绒螯蟹幼蟹肠道菌群门水平组成,对FCM0和FCM40幼蟹肠道主要菌群的相对丰度进行统计分析,结果列于表7。在门水平下,中华绒螯蟹幼蟹肠道菌群中相对丰度排在前面的3个门分别是变形菌门、厚壁菌门和拟杆菌门,它们是中华绒螯蟹幼蟹肠道内的核心菌群。FCM0和FCM40组变形菌门相对丰度分别为47.28%、43.77%,厚壁菌门相对丰度分别为31.74%和32.82%,拟杆菌门相对丰度分别为17.80%和11.61%,2组间均不存在显著差异(P>0.05);FCM0和FCM40组放线菌门相对丰度分别为1.13%和4.17%,浮霉菌门相对丰度分别为0.97%和2.96%,均以FCM40组相对丰度更高,但2组间差异均不显著(P>0.05);FCM0和FCM40组蓝藻门相对丰度分别为0.05%和1.92%,FCM40组显著高于FCM0组(P<0.05);FCM0和FCM40组髌骨细菌门相对丰度分别为0.15%和1.08%,FCM40组相对丰度更高,但2组间差异不显著(P>0.05)。在属水平下,中华绒螯蟹幼蟹肠道菌群主要为ZOR0006(属于厚壁菌门,无属名)、Candidatus_Bacilloplasma、营发酵单细胞属、希瓦氏菌属、气单胞菌属、芽孢杆菌属、不动杆菌属和α-变形菌纲未分类属,这些菌属在FCM0和FCM40组间均无显著差异(P>0.05)。
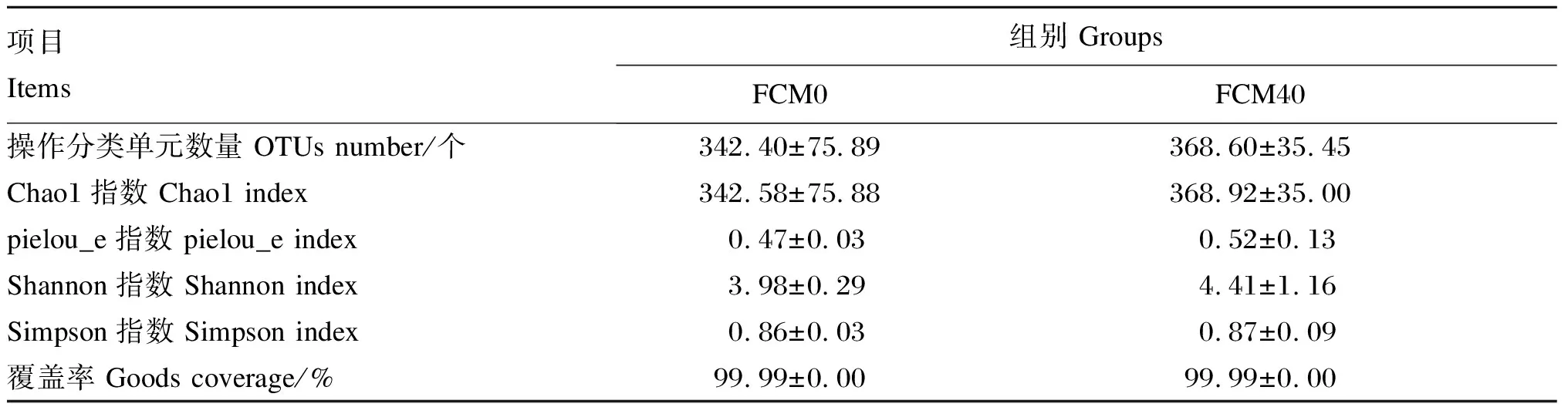
表6 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹肠道菌群α多样性的影响

Proteobacteria:变形菌门;Firmicutes:厚壁菌门;Bacteroidota:拟杆菌门;Actinobacteriota:放线菌门;Planctomycetota:浮霉菌门;Cyanobacteria:蓝藻门; Patescibacteria:髌骨细菌门;Verrucomicrobiota:疣微菌门;Bdellovibrionota:蛭弧菌门;Desulfobacterota:脱硫杆菌门;Myxococcota:黏菌门;Campylobacterota:弯曲菌门;Chloroflexi:绿弯菌门;Acidobacteriota:酸杆菌门;Deferribacterota:铁脱杆菌门;Armatimonadota:装甲菌门;Nitrospirota:硝化螺旋菌门;Gemmatimonadota:芽单胞菌门;Deinococcota:异常球菌门;Fusobacteriota:梭杆菌门;Chlamydiae:衣原体门;Unclassified:未分类。

表7 FCM0和FCM40中华绒螯蟹幼蟹肠道主要菌群的相对丰度

续表7分类水平Taxonomic levels主要菌群Main flora组别 GroupsFCM0FCM40ZOR00069.39±12.0719.19±17.90Candidatus_Bacilloplasma13.42±19.547.76±7.05营发酵单胞菌属 Dysgonomonas13.80±15.567.29±12.92希瓦氏菌属 Shewanella3.45±5.1710.49±12.95属 Genus气单胞菌属 Aeromonas8.62±11.794.24±7.93芽孢杆菌属 Gemmobacter1.06±0.638.37±13.59不动杆菌属 Acinetobacter6.96±11.551.27±2.25α变形菌纲未分类属 Alphaproteobacteria_unclassified4.46±4.383.44±4.28
3 讨 论
3.1 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹生长性能和体成分的影响
生长性能是评价饲料或饲料原料对水产养殖动物影响的重要指标。饲料中添加过量的植物蛋白质源会对水产动物的生长造成负面的影响。例如,杨霞等[16]研究发现,饲料中发酵棉籽粕添加量超过24%时会降低中华绒螯蟹的生长性能和成活率;Sun等[17]的研究指出,使用发酵棉籽粕替代75%的鱼粉会显著降低凡纳滨对虾的生长性能;Sun等[18]研究显示,在黑鲷饲料使用24%的发酵棉籽粕替代鱼粉会降低黑鲷的生长性能和饲料转化率。饲料中不同的植物蛋白质源会影响水产动物的生长性能,但受养殖物种以及替代比例等诸多因素的影响。陈道仁等[9]使用23%的发酵棉籽粕替代9%的豆粕和全部棉籽粕后发现,草鱼的增重率显著提升,饲料系数显著下降。杨景丰等[19]的研究指出,在饲料中使用发酵豆粕替代鱼粉,罗氏沼虾的生长性能随着替代比例的升高总体呈先升高再下降的趋势。本研究结果显示,饲料中使用发酵棉籽粕替代不同比例豆粕对中华绒螯蟹幼蟹的生长性能未产生显著影响,但以发酵棉籽粕替代20%的豆粕(FCM20组)中华绒螯蟹幼蟹的特定生长率、增重率最高。
不同的植物蛋白质源对甲壳动物体成分也有一定影响。Han等[11]研究表明,在低鱼粉饲料中使用发酵棉籽粕部分替代豆粕,凡纳滨对虾的粗脂肪含量显著下降,其粗蛋白质含量随着替代比例的增加呈先上升后下降的趋势。杨霞等[16]研究发现,饲料中使用棉籽粕和发酵棉籽粕替代鱼粉均未对中华绒螯蟹的体成分产生显著影响。本研究中,发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹的粗蛋白质、粗脂肪和水分含量均未产生显著影响,粗灰分含量随着替代比例的升高呈现先上升后下降的趋势。粗灰分含量变化可能与蟹体内微量元素和无机盐含量有关[20],此结果也与Han等[11]在凡纳滨对虾饲料中使用发酵棉籽粕替代豆粕的试验结果相似。
3.2 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹血淋巴生化指标的影响
虾蟹类不具有特异性免疫球蛋白,体液免疫是其重要的免疫方式[21]。ACP和AKP是中华绒螯蟹体内重要的非特异性免疫因子[22]。ALT和AST是肝细胞损伤的标志物[23]。本试验中,使用发酵棉籽粕替代不同比例豆粕后,血淋巴中ACP和AKP活性随替代比例的增加呈先上升后下降趋势,并在FCM60组达到最大值,这表明饲料中添加发酵棉籽粕可使幼蟹血淋巴中体液免疫物质ACP和AKP的活性升高;血淋巴中ALT和AST活性则随替代比例的增加呈下降趋势,这与Cheng等[24]在中华绒螯蟹饲料中添加棉籽粕蛋白水解物所得试验结果相似,表明本试验设定的发酵棉籽粕替代豆粕比例会对中华绒螯蟹幼蟹肝胰腺造成影响。
3.3 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹肝胰腺抗氧化指标的影响

3.4 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹肠道组织结构的影响
围食膜是附于中华绒螯蟹消化道内的多功能薄膜,主要由几丁质和蛋白质构成,具有选择透过性,可以将肠上皮细胞和内容物分开,其还是肠道菌群的主要共生场所[31]。本试验中,发酵棉籽粕替代40%的豆粕时,个别肠绒毛上皮细胞可见损伤;发酵棉籽粕替代80%的豆粕时,肠道围食膜出现明显的脱落,肠道上皮细胞出现明显损伤。植物蛋白质源对肠道造成损伤的原因主要是植物蛋白质源中通常包含多种抗营养因子[32],其中单宁可与围食膜中的蛋白质结合,植酸可以改变肠道内pH导致几丁质溶解。Han等[33]的研究也指出饲料中的植物抗原蛋白会造成幼蟹肠道出现类似损伤。
3.5 发酵棉籽粕替代豆粕对中华绒螯蟹幼蟹肠道菌群的影响
肠道菌群在中华绒螯蟹营养吸收过程中起重要作用,肠道菌群中的芽孢杆菌可以促进多糖和纤维素分解,提高饲料利用率[34]。因此,本试验探究了发酵棉籽粕替代豆粕对幼蟹肠道菌群的影响,试验结果表明,FCM0和FCM40组中华绒螯蟹幼蟹肠道菌群的均匀度(pielou_e指数)、丰富度(Chao1指数)和多样性(Shannon指数、Simpson指数)均无显著差异。此外,测序结果显示,这2个组肠道菌群在门水平上变形菌门、厚壁菌门和拟杆菌门的相对丰度分别为47.28%和43.77%、31.74%和32.82、17.80%和11.61%,变形菌门是绝对优势菌群,其次是厚壁菌门和拟杆菌门;FCM0和FCM40组蓝藻门的相对丰度均较低,分别为0.05%和1.92%,但FCM40组的相对丰度显著高于FCM0组。变形菌门是细菌中最大的一门。有研究指出,变形菌门相对丰度的增加可以改善鱼体的健康状况[35]。在属水平上,FCM0和FCM40组肠道主要菌群的相对丰度均无显著差异,其中主要益生菌是芽孢杆菌属,FCM40组的相对丰度高于FCM0组。ZOR0006属于厚壁菌门,尚无属名,其相对丰度在FCM40组要高于FCM0组。陆宏达等[36]的研究发现,较低品质的池塘养殖中华绒螯蟹肠道菌群中,ZOR0006的相对丰度较高,但并未说明该菌对华绒螯蟹生长及免疫和抗氧化性能的影响。
4 结 论
本试验条件下,发酵棉籽粕替代20%的豆粕可提高中华绒螯蟹幼蟹的生长性能,但未达到显著水平;发酵棉籽粕替代80%的豆粕显著提升了中华绒螯蟹幼蟹的肝胰腺抗氧化能力;发酵棉籽粕替代40%的豆粕不会改变中华绒螯蟹幼蟹肠道主要菌群结构。因此,以生长性能作为评价指标,建议发酵棉籽粕替代豆粕的比例为20%;以肝胰腺和肠道健康为评价指标,发酵棉籽粕替代豆粕比例不宜超过40%。
——全棉籽的加工与利用

