苜蓿源miR168b通过靶向肉碱棕榈酰转移酶1A对奶牛乳腺上皮细胞增殖、凋亡和脂滴积累的调控研究
贾晶莹 刘宝宝 蔡小艳*
(1.宁夏大学农学院,银川 750021;2.宁夏回族自治区反刍动物分子细胞育种重点实验室,银川 750021)
奶牛乳腺由汗腺衍生而来,属于外分泌腺。总体上乳腺分为实质和间质2部分,实质主要由乳腺上皮细胞构成,具有合成、分泌和泌乳功能[1]。乳腺上皮细胞实现泌乳功能过程受到miRNAs的调节。如miR-486高表达促进了奶牛细胞的活性及增殖能力,同时增加了乳糖、乳脂以及乳蛋白的含量;miR-148a高表达显著提高了水牛乳腺上皮细胞的活力,促进了细胞增殖[2-3]。因此,研究miRNAs对乳腺上皮细胞增殖和凋亡的调节和影响,对探究miRNAs影响乳腺上皮细胞生物泌乳具有重要作用和意义。
除了牛自身miRNAs以外,在牛血液中还检测到有外源性植物miR168等miRNAs的出现[4]。生物信息分析也发现,牛、小鼠和人类样本中有植物miRNAs,其中5条植物miRNAs在牛的样本中显著高表达,这些miRNAs主要来自水稻和苜蓿[5]。苜蓿源miR5754被发现有跨界调控功能,可以通过降低人体肺腺癌转移相关转录物1(MALAT1)的稳定性减少癌细胞增殖;苜蓿中的miR162被发现具有调控牛奶乳蛋白的作用[6-7]。由此可见,苜蓿源miRNAs(mtr-miRNAs)具备遗传调节因子和类营养物质的双重特性,能够跨界对人体癌细胞及奶牛乳品质产生调控作用。因此,探究mtr-miRNAs对奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)增殖和凋亡的影响,对明确苜蓿对牛奶产量与品质的分子调控机制有着重要意义。
2012年,张辰宇教授在犊牛血液中检测到了植物源miR168,并且靶向低密度脂蛋白受体衔接蛋白1(LDLRAP1)调节机体脂代谢[4]。本课题组前期研究结果表明,苜蓿源miR168b(mtr-miR168b)的确可以在奶牛体内检测到,并且通过靶向奶牛体内基因发挥调控作用。奶牛乳腺上皮细胞是奶牛乳汁生成和分泌的主要部位。那么mtr-miR168b是否能够对BMECs的增殖、凋亡与脂质生成产生调控作用?本研究基于对这一问题的思考特异性高表达了mtr-miR168b并敲低了其靶基因肉碱棕榈酰转移酶1A(CPT1A)在BMECs中的表达水平,检测mtr-miR168b高表达对BMECs增殖、凋亡和细胞内脂滴生成的影响,以期为后续研究mtr-miRNAs影响牛奶产量与乳品质提供分子层面的支撑。
1 材料与方法
1.1 试验材料
BMECs和HEK-293T细胞来自课题组前期保存。
1.2 试验方法
1.2.1 细胞培养与转染
将BMECs和HEK-293T在含有胎牛血清(10%)、100 μg/mL青霉素、100 μg/mL链霉素的基础DMEM/F12培养基中培养,在5% CO2、37 ℃的恒温加湿培养箱中进行培养。基础培养基中添加5 μg/mL的胰岛素、5 μg/mL的氢化可的松和20 ng/mL的催乳素即为诱导培养基,诱导每2 d更换1次培养基,每4 d收集细胞进行后续试验。细胞转染试剂为Lipo 3000,mtr-miR168b序列模拟物(mtr-miR168b mimics)、mtr-miR168b mimics阴性对照物(NC)、靶基因干扰和干扰片段阴性对照(si-NC)片段委托生物公司合成,通过转染实现在细胞水平高表达miRNAs或干扰靶基因表达,转染48 h后收集细胞进行后续试验。对于进行诱导试验的细胞处理组,转染48 h后更换为诱导培养基进行诱导,此时记为诱导0 d。
1.2.2 细胞活力检测
在细胞转染后6、12、24、36和48 h进行CCK8检测,检测前1 h在孔内加入10 μL的CCK8溶液。1 h后使用酶标仪检测每孔细胞在450 nm处的吸光度。细胞活力计算公式如下:
式中:A(mimic)为具有细胞、CCK8溶液和mimic溶液培养孔的吸光度;A(空白)为具有培养基和CCK8溶液而没有细胞培养孔的吸光度;A(0)为具有细胞而无mimic溶液的培养孔的吸光度。
1.2.3 细胞增殖检测
细胞转染48 h后进行5-乙炔基-2’脱氧尿嘧啶核苷(EdU)试验。参照EdU说明书进行试验试剂配制。使用前将配制好的EdU工作液预热至37 ℃。EdU工作液与细胞培养液等体积加入6孔板,使EdU终浓度为10 μmol/L。孵育2 h后,加入固定液固定细胞15 min。细胞清洗干净后加入通透液,室温孵育15 min。清洗干净后,每孔加入500 μL Click反应液,室温避光孵育30 min。清洗干净后,加入1×Hoechst 33342 1 mL,室温孵育10 min。再次清洗细胞,清洗干净后使用荧光倒置显微镜拍摄荧光图片。
1.2.4 细胞周期与凋亡检测
细胞转染48 h后,分别使用凋亡检测试剂盒和细胞周期和凋亡分析试剂盒,通过流式细胞仪检测细胞凋亡和细胞周期阶段。为了检测细胞凋亡,用胰蛋白酶消化细胞。终止消化后将细胞收集在1.5 mL离心管中,1 000×g离心5 min,去除上清液,并将细胞重新悬浮在1 mL磷酸盐缓冲液(PBS)中。接下来,将细胞在50 ℃的水浴中孵化适当时间刺激细胞凋亡。离心收集细胞,弃去上清液,在细胞颗粒中加入195 μL V-FITC结合液、5 μL V-FITC和10 μL碘化丙啶(PI)。在室温下黑暗中孵化20 min后,用流式细胞仪分析细胞。
为了确定细胞周期阶段,在细胞悬浮后,再次离心,丢弃PBS。加入70%乙醇,吹打混合,在4 ℃下固定24 h。固定后的细胞再次离心,吸干乙醇后弃去,加入PBS重悬并清洗细胞,然后弃去。每管细胞加入500 μL LPI染色液后,用流式细胞仪检测细胞周期。
1.2.5 实时荧光定量PCR(RT-qPCR)检测
提取转染48 h后细胞的总RNA,通过RT-qPCR对mtr-miR168b的表达水平进行检测,使用U6作为内参。同时对细胞增殖、细胞周期和细胞凋亡有关的基因表达水平进行定量检测。收集转染了si-NC和si-CPT1A的细胞进行定量,检测CPT1A表达水平敲低后对下游基因和脂质代谢标志基因表达水平的影响,使用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因。RT-qPCR反应使用实时荧光定量PCR仪(CFX 96 Touch,Bio-Rad,美国)和TaKaRa定量试剂盒。反应体系为预混液TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)10 μL,上、下游引物各0.4 μL,DNA样品(100 ng/μL)2 μL,加入ddH2O将反应体系补至20 μL。反应程序如下:95 ℃,3 min;95 ℃,5 s;60 ℃,30 s;39个循环,95 ℃,10 s。引物信息见表1。

续表1基因 Genes引物序列 Primer sequences (5′—3′)固醇调控元件结合蛋白1 SREBP1F:CAATGTGTGAGAAGGCCAGTR:ACAAGGAGCAGGTCACACAG脂肪酸转位酶36 CD36F:TCCTGGACCCTGAACACTR:ATAATGCCTTGCTGATGC脂蛋白脂肪酶 LPLF:ACGATTATTGCTCAGCATGGR:ACTTTGTACAGGCACAACCG肉碱棕榈酰转移酶1ACPT1AF:TTGCGGCCGCCTTAAGGGACAAGCGATTR:CCTCGAGCAGTCTGATGGAAGGGAA蛋白激酶BAKTF:TCACCATTACGCCACCTGACR:TCCTCTCCATCCTGTGTTGG哺乳动物雷帕霉素靶蛋白mTORF:TGGACACCAACAAGGACGACR:TCCCACTGACCTAAACCCCA
1.2.6 蛋白质免疫印迹(Western blot)
收集转染48 h后的BMECs,用BCA蛋白测定试剂盒测定蛋白浓度。每孔加入100 μg蛋白提取物,通过10%十二烷基磺酸钠(SDS)聚丙烯酰胺凝胶电泳分离,并转移到聚偏二氟乙烯(PVDF)膜上。在室温下用阻断液阻断15 min,将膜与抗体进行孵化。使用GAPDH(AB0036, 1∶3 000, Abways)、增殖细胞核抗原(PCNA)(D220014, 1∶500, Sangon Biotech)、BAX(CY5059, 1∶500, Abways)的一级抗体,二级抗体为山羊抗兔免疫球蛋白G(IgG)(ZB-2301,1∶20 000,ZSGB-生物)。化学发光ECL Western blot系统(Tanon-5200)用于信号检测,使用ImageJ软件测量蛋白表达水平。
1.2.7 氟硼二吡咯(Bodipy)染色
使用二甲基亚砜(DMSO)配制Bodipy工作液,被转染的BMECs分别诱导至第0、4和8天时进行Bodipy染色。染色前使用4%的多聚甲醛固定细胞40 min。清洗干净后加入Bodipy工作液,室温避光染色30 min。再次清洗,加入4,6-二脒基-2-苯基吲哚(DAPI)染色液对细胞核进行染色。清洗干净后,使用荧光倒置显微镜拍摄荧光图片。
1.2.8 双荧光素酶报告靶基因
PCR扩增CPT1A的序列,使用Primer Premier 5软件设计包含mtr-miR168b种子区在内的靶基因3′ UTR区引物(表1),并在引物5′端上分别添加XhoⅠ和NotⅠ的酶切位点和相应的保护碱基。目的片段经双酶切和纯化回收后,与Psicheck-2载体连接,构建CPT1A与Psicheck-2野生型(WT-CPT1A)载体。基因突变型载体(MUT-CPT1A)委托生物公司合成,酶切位点与载体同上。将mtr-miR168b mimics和mtr-miR168b NC分别与构建好的野生型和突变型载体共转染至HEK-293T细胞,转染试剂为Lipo 3 000。转染48 h后,按照双荧光素酶试剂盒说明书步骤收集细胞,对细胞的荧光素酶活性进行检测。
1.2.9 油红O染色
干扰CPT1A的细胞脂质由油红O进行染色,根据试剂公司要求进行试验操作。将诱导0、4与8 d的细胞用PBS洗涤,加入4%多聚甲醛固定15 min。PBS洗涤后加入油红O染色液对细胞中的脂质进行染色,弃去染色液,PBS清洗至无多余染色液后加入Mayer苏木素染色液对细胞核进行染色。弃去Mayer苏木素染色液后在显微镜下观察细胞脂质含量。
1.3 数据统计与分析
RT-qPCR结果用2-ΔΔCt进行处理,每组数据至少设置3个生物学重复和3个技术学重复。使用GraphPad Prism 7软件的t检验对RT-qPCR结果和双荧光结果进行差异显著性分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 mtr-miR168b表达水平检测
RT-qPCR检测转染mtr-miR168b mimics和NC 48 h后mtr-miR168b的表达水平。结果表明,mimics组mtr-miR168b的表达水平极显著高于NC组(P<0.01;图1)。结果证明了转染试验特异性高表达了BMECs中mtr-miR168b,为后续检测mtr-miR168b高表达对细胞增殖、凋亡和脂质代谢提供了研究基础。
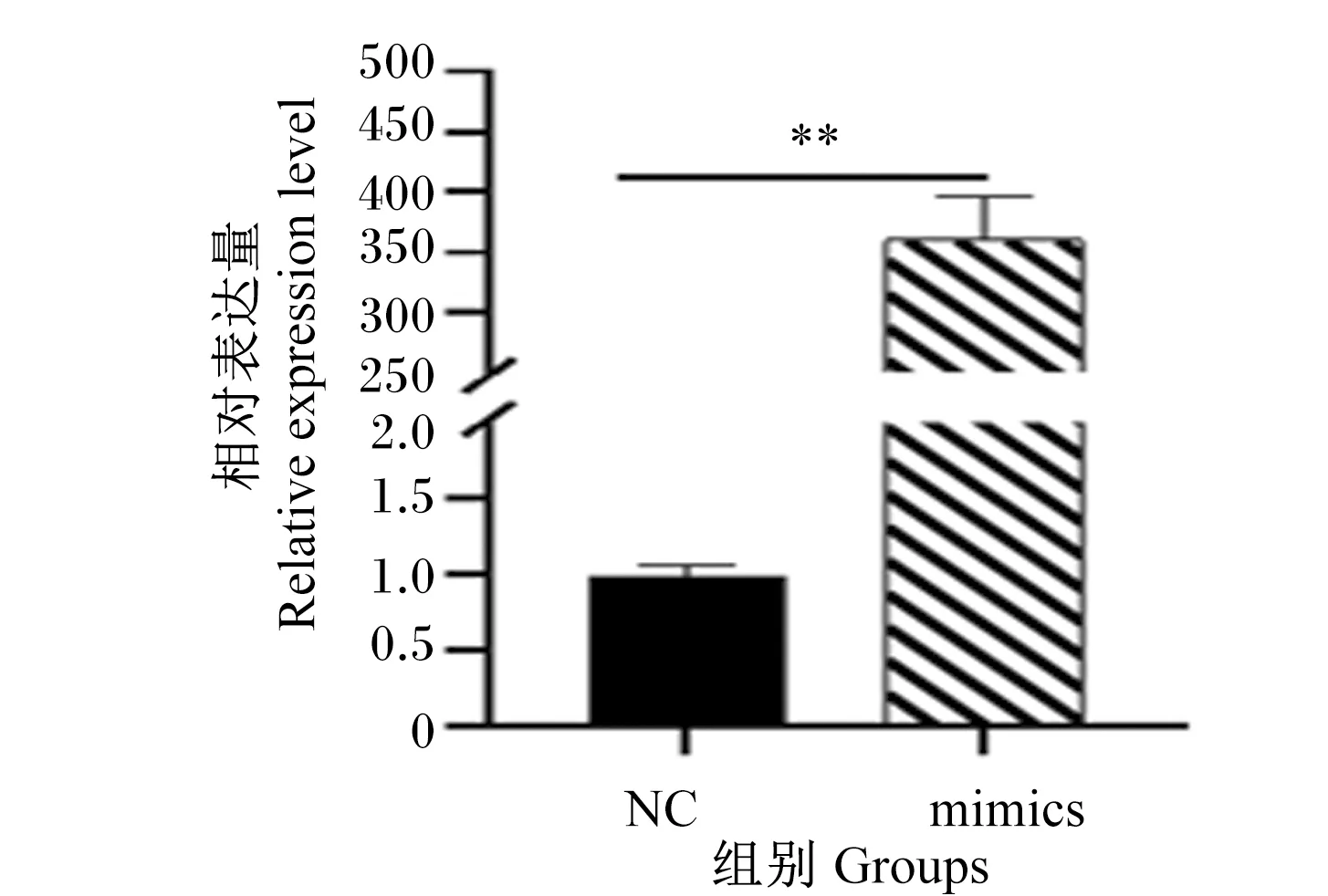
*表示差异显著(P<0.05); **表示差异极显著(P<0.01);ns表示差异不显著(P>0.05)。下图同。
2.2 mtr-miR168b高表达抑制BMECs活力
CCK8法测定mtr-miR168b高表达对BMECs活力的影响。结果表明,与NC组相比,转染mtr-miR168b mimics组的细胞活力极显著降低(P<0.01),并且随着时间的推移,细胞活力也极显著下降(P<0.01),但36 h后细胞活力不会再有显著降低趋势(P>0.05;图2)。
2.3 mtr-miR168b高表达抑制BMECs增殖
通过EdU荧光染色检测mtr-miR168b高表达后对BMECs增殖的影响。红色荧光显示的是加入染色液孵育2 h内新增长细胞的细胞质染色,蓝色荧光为全部细胞的细胞核染色(图3-a)。试验结果表明,mtr-miR168b高表达极显著抑制了细胞增殖(P<0.01;图3-b)。RT-qPCR结果表明,mtr-miR168b mimics组细胞增殖标志基因CDK4和PCNA的表达水平极显著降低(P<0.01; 图3-c)。
2.4 mtr-miR168b高表达对细胞周期的影响
流式细胞仪检测mtr-miR168b高表达后BMECs的细胞周期。结果显示,转染mtr-miR168b后乳腺上皮细胞S期数量减少,G1期数量增加,说明G1~S期进程被延长,细胞增殖受到抑制。细胞周期标志基因CyclinD1和CyclinD2表达水平也极显著降低(P<0.01;图4)。
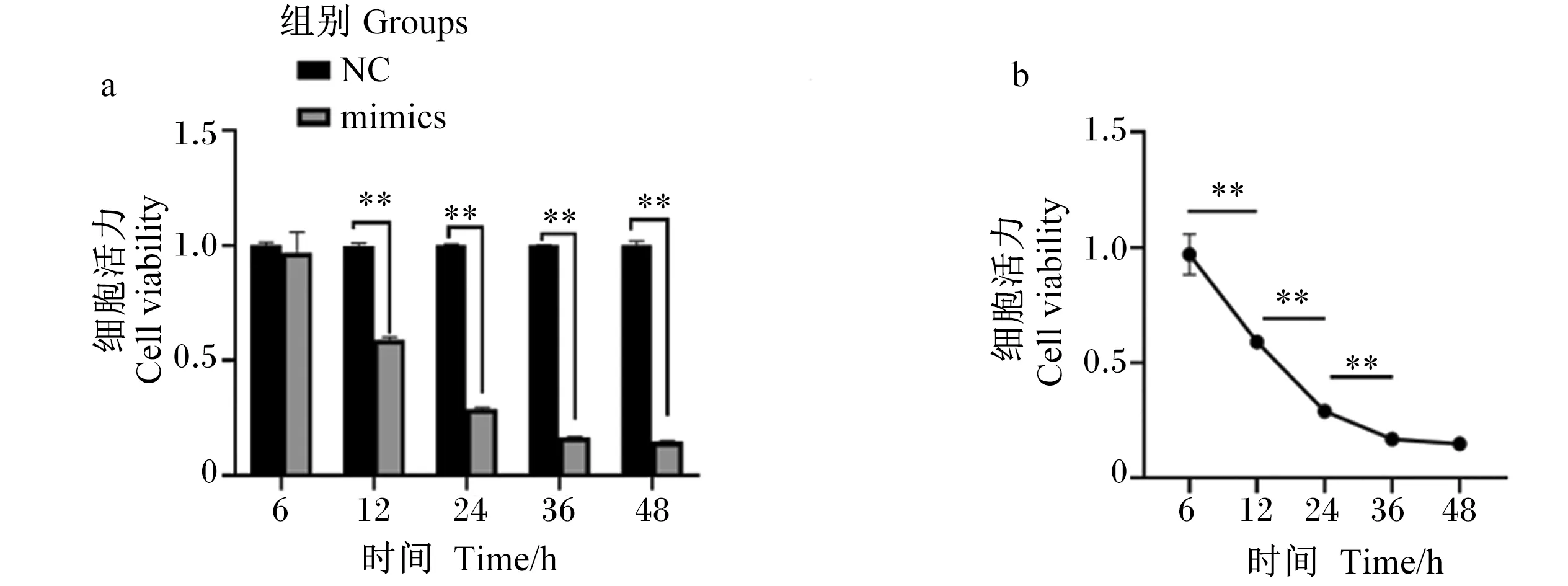
a: 与NC组相比,mimics组细胞活力降低; b: mimics组随着时间推移细胞活力下降。
2.5 mtr-miR168b高表达促进细胞凋亡
细胞凋亡结果(图5)显示,与NC组相比,mtr-miR168b高表达极显著促进了BMECs的凋亡(P<0.01);同时细胞凋亡标志基因BAX表达水平极显著增高(P<0.01)。对PCNA和BAX的蛋白的表达水平进行检测,Western blot蛋白条带显示,与NC组相比,mimics组PCNA蛋白表达水平极显著降低(P<0.01),BAX蛋白表达水平极显著增加(P<0.01),这与定量结果一致。
同时,对AKT和mTOR基因进行检测,结果发现基因表达水平均有显著或极显著降低(P<0.05或P<0.01),推测mtr-miR168b通过AKT-mTOR信号通路调控奶牛乳腺上皮细胞的增殖和凋亡(图5)。
2.6 mtr-miR168b高表达降低BMECs脂滴含量
对诱导0、4和8 d的奶牛乳腺上皮细胞进行Bodipy染色。结果表明,转染mtr-miR168b mimics的细胞荧光强度均低于NC组,mtr-miR168b能够减少Bodipy着色细胞数,降低脂滴含量(图6)。

CDK4:细胞增殖基因周期蛋白依赖性激酶4 cell proliferation gene cyclin dependent kinase 4;PCNA:增殖细胞核抗原 proliferating cell nuclear antigen。

Cyclin D1:细胞周期蛋白D1;Cyclin D2:细胞周期蛋白D2。
2.7 mtr-miR168b靶基因验证
为了明确mtr-miR168b对BMECs的调控机制,通过RT-qPCR和双荧光素酶报告验证了mtr-miR168b与CPT1A基因的靶向关系。试验首先检测了mtr-miR168b高表达后细胞中CPT1A基因的表达水平。结果表明,mimics组CPT1A基因表达水平较NC组极显著降低(图7-a;P<0.01)。构建CPT1A基因野生型和突变型载体进行双荧光素酶报告靶基因(图7-b)。结果显示:WT-CPT1A+mtr-miR168b mimics组较WT-CPT1A+mtr-miR168b NC组荧光素酶活性极显著下降(P<0.01);MUT-CPT1A+mtr-miR168b mimics组与MUT-CPT1A+mtr-miR168b NC组荧光素酶活性差异不显著(图7-c;P>0.05),这证明mtr-miR168b与CPT1A基因具有靶向关系。
2.8 mtr-miR168b靶基因CPT1A干扰片段的筛选
为了揭示CPT1A对BMECs脂质代谢的作用,用特异性siRNA对CPT1A进行沉默。委托公司合成3条CPT1A基因的干扰片段,转染48 h后收集细胞检测CPT1A表达水平,发现干扰1 002位点,80 nmol/L浓度下干扰效率最高(图8-a、图8-b)。后续试验均按上述条件对CPT1A基因进行干扰。si-CPT1A转染后,同时对CPT1A下游基因的表达水平进行检测,发现CPT1A下游基因的表达均受到极显著抑制(P<0.01;图8-c)。

BAX:Bcl2关联X蛋白;Bcl2-associated X protein;PCNA:增殖细胞核抗原 proliferating cell nuclear antigen;GAPDH:甘油醛-3-磷酸脱氢酶 glyceraldehyde-3-phosphate dehydrogenase;AKT:蛋白激酶B protein kinase B;mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin。

图6 mtr-miR168b高表达后Bodipy染色

a: RT-qPCR检测CPT1A基因表达水平;b: mtr-miR168b与构建的靶基因载体序列比对;c:相对荧光素酶活性检测靶基因。

CPT2:肉碱棕榈酰转移酶2 carnitine palmitoyl transferase 2;ACADL:酰基辅酶A脱氢酶长链acyl-CoA dehydrogenase long chain;ACADVL:极长链酰基辅酶 A脱氢酶 very long chain acyl-CoA dehydrogenase;ACADM:酰基辅酶A脱氢酶中链 acyl-CoA dehydrogenase middle chain。
2.9 CPT1A敲低对BMECs活力和凋亡的影响
CCK8法测定CPT1A敲低对BMECs活力的影响。结果表明,与si-NC组相比,转染si-CPT1A组的细胞活力极显著降低(P<0.01),并且随着时间的推移细胞活力也极显著下降(P<0.01;图9-a、图-b)。同时,对增殖标志基因CDK4、PCNA和CyclinD1进行定量,定量结果显示上述基因表达水平在si-CPT1A组极显著降低(P<0.01;图9-c),这与CCK8结果一致。细胞凋亡结果显示,si-CPT1A组晚期凋亡细胞数量增加(图9-d)。上述结果趋势与mtr-miR168b高表达结果趋势一致。
2.10 CPT1A敲低对BMECs脂质代谢基因和脂滴积累的影响
CPT1A沉默后,CD36、PPARγ、SCD1、CEBP/β、SREBP1和LPL等基因在BMECs中的表达水平均极显著下调(P<0.01),证明CPT1A沉默后抑制了BMECs中脂质代谢过程(图10-a)。此外,油红O结果显示,si-CPT1A减少了BMECs中脂滴的生成(图10-b),Bodipy结果表明,转染si-CPT1A组的细胞荧光强度均低于si-NC组,证明si-CPT1A降低脂滴含量(图11)。上述结果表明,mtr-miR168b的靶基因CPT1A表达水平降低,可以抑制BMECs中脂肪的生成,与高表达mtr-miR168结果一致。
3 讨 论
3.1 mtr-miR168b过表达调节BMECs增殖和凋亡
乳腺(乳房)能够分泌乳汁滋养新生儿,是将哺乳动物与其他动物区分开的重要器官。哺乳动物的乳腺会随着动物胚胎期、青春期和生殖期分阶段发育,同时,乳腺也是动物成年后唯一一个还能够进行分化的器官[8]。

CDK4:细胞增殖基因周期蛋白依赖性激酶4 cell proliferation gene cyclin dependent kinase 4;PCNA:增殖细胞核抗原 proliferating cell nuclear antigen;Cyclin D1:细胞周期蛋白D1。
研究人员通过深入研究确定了部分miRNAs调控细胞增殖和凋亡的信号通路,明确了其调控机制。如miR-24-3p通过靶向多发性内分泌腺瘤致病因子1(MEN1)基因调节奶牛乳腺上皮细胞的增殖,并对乳蛋白含量产生影响;miR-103通过靶向磷脂酰肌醇3-激酶(PIK3R1)调节PI3K-AKT信号通路,进而增加了细胞增殖,促进了BMECs脂肪酸的合成;miR-21被上游基因信号转导和转录激活因子3(STAT3)调控,同时靶向胰岛素样生长因子结合蛋白5(IGFBP5),通过该调控网络促进奶牛乳腺上皮细胞的活力和增殖[9-11]。上述研究均为miRNAs促进细胞增殖,对奶牛泌乳具有正向影响,但同时,也有研究发现miRNAs抑制奶牛乳腺上皮细胞增殖。如miR-139高表达抑制了乳腺上皮细胞的增殖,降低了β酪蛋白的蛋白含量;miR-221和miR-15a抑制细胞增殖和活力,降低泌乳量[12-13]。这些miRNAs与本试验研究的mtr-miR168b具有相似的调控结果,即通过调控相关信号通路抑制奶牛乳腺上皮细胞的活力和增殖,促进细胞的凋亡。故根据先前研究进展,推测mtr-miR168b对奶牛乳腺上皮细胞的泌乳功能和乳品质可能也具有负向影响。这与张辰宇教授研究发现的植物miR168靶向低密度脂蛋白受体衔接蛋白1(LDLRAP1)抑制机体脂质代谢的作用相似[4]。不过苜蓿作为优质牧草,含有多种miRNAs,其他miRNAs可能对乳脂具有正向调控作用。并且miRNAs具有多靶向的调节特点,同一miRNAs靶向结合不同的基因对机体的调节作用并不一致,本试验研究结果只能表明mtr-miR168b对BMECs的调节作用,并不能代表苜蓿整体对奶牛的影响。

PPARγ:过氧化物酶体增殖物活化受体γ peroxisome proliferator activated receptor gamma;SCD1:硬脂酰辅酶A去饱和酶1 stearoyl CoA desaturase 1;CEBP/β:转录因子CCAAT增强子结合蛋白β transcription factor CCAAT enhancer binding protein β;SREBP1:固醇调控元件结合蛋白1 sterol regulatory element binding protein1; CD36:脂肪酸转位酶36 fatty acid translocator 36;LPL:脂蛋白脂肪酶 lipoprotein lipase。
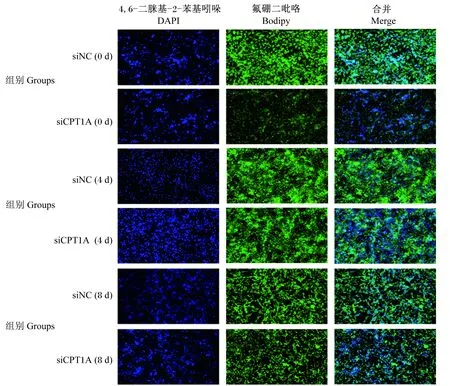
图11 si-CPT1A后Bodipy染色
3.2 mtr-miR168b过表达调节BMECs增殖和凋亡的信号通路
AKT-mTOR信号通路是一个较为典型的调节细胞增殖和凋亡的通路,被完全激活的AKT-mTOR信号通路可以调节细胞的凋亡[14]。AKT-mTOR信号通路表达水平降低,会抑制细胞增殖,有助于细胞周期停滞;而激活AKT-mTOR信号通路则会促进细胞增殖[15-17]。前期课题组生物信息学分析预测结果表明,mtr-miR168b的靶基因显著富集在mTOR信号通路,并且mtr-miR168b跨界靶向的CPT1A基因处于AKT-mTOR信号通路,对其具有调节作用[18]。为了明确mtr-miR168b对细胞增殖和凋亡调节作用的信号通路,试验检测了mtr-miR168b高表达对AKT和mTOR基因的调节作用,结果发现,mtr-miR168b高表达抑制了AKT和mTOR的基因表达水平。此外,前期研究结果还表明,mtr-miR168b通过靶向相关靶基因参与AMP依赖的蛋白激酶(AMPK)信号通路的调节作用。细胞内ATP消耗和AMP水平增加会导致能量应激,同时激活AMPK,而长期能量应激最终会诱发细胞凋亡[19-21]。这也与本试验研究结果一致,即mtr-miR168b高表达激活了AMPK,导致能量应激,最终造成凋亡细胞数量增多。结合前期结论与本研究结果我们推测出了mtr-miR168b可能同时调控AKT-mTOR信号通路和AMPK信号通路影响细胞增殖与凋亡。
CyclinD1和CyclinD2表达水平降低表明细胞凋亡能力增强,细胞增殖能力减弱;PCNA和CDK4基因表达水平降低可抑制癌细胞增殖;BAX是凋亡标志基因,基因与蛋白表达水平升高证明细胞凋亡水平升高[22-26]。对上述增殖与凋亡标志基因和蛋白的水平检测结果提示mtr-miR168b过表达,可以抑制细胞增殖、促进细胞凋亡,这与信号通路调控结果一致。
3.3 mtr-miR168b过表达调节BMECs脂滴生成
为了探究miRNAs对BMECs脂滴生成的影响,对细胞进行了成脂诱导。随着诱导时间延长,细胞凋亡数量增多,脂滴增多,导致细胞数量减少并且黏连情况严重,Bodipy染色结果随着诱导时间的推移细胞形态不明显。但荧光图仍能看出mtr-miR168b高表达后BMECs中绿色荧光强度低于对照组,这表明mtr-miR168b高表达抑制BMECs中脂滴的生成,这会导致牛奶乳脂含量降低,与前期推论mtr-miR168b对BMECs的泌乳功能和乳品质具有负向影响一致。
3.4 mtr-miR168b靶向CPT1A调节BMECs脂滴生成
为了进一步了解mtr-miR168b的作用机制,试验通过双荧光报告验证了mtr-miR168b的靶基因CPT1A。为了明确mtr-miR168b对脂滴生成的抑制作用是否通过靶基因CPT1A发挥作用,试验模拟了mtr-miR168b高表达,CPT1A表达水平降低的情况下BMECs脂质生成的情况。敲低CPT1A表达后,定量检测发现CPT1A通路的下游基因和脂质代谢相关基因表达水平均显著降低。CPT1A的下游基因长链酰基辅酶A脱氢酶(ACADL)、超长链酰基辅酶A脱氢酶(ACADVL)和中链酰基辅酶A脱氢酶(ACADM)基因均为酰基辅酶A脱氢酶,是参与脂肪酸代谢的重要辅酶家族。ACADL是催化脂肪酸氧化中第1步的催化酶,在长链脂肪酸β氧化中起着重要作用,其不足或缺失会造成线粒体功能紊乱进而影响脂质代谢[27]。ACADVL和ACADM基因都能够参与脂质代谢相关生物过程,影响脂肪酸和甘油的合成与分解,在脂质代谢中发挥着至关重要的作用[28-30]。基因定量、油红O染色与Bodipy染色结果均表明CPT1A低表达影响了BMECs脂代谢,抑制细胞脂质的生成,这与mtr-miR168b高表达抑制脂肪酸生成的结果一致,同时证实了研究的假设,即mtr-miR168b通过靶向CPT1A调节BMECs脂质生成。
4 结 论
① 高表达mtr-miR168b显著抑制了BMECs的细胞活力,抑制了细胞的增殖,延长了细胞S~G1期,促进了细胞的凋亡,降低了AKT和mTOR基因的表达水平。
② 高表达mtr-miR168b降低了BMECs中脂滴的积累。
③ 敲低mtr-miR168b的靶基因CPT1A后,BMECs活力被抑制,促进了细胞晚期凋亡,下调CPT1A下游基因表达。
④ 敲低mtr-miR168b的靶基因CPT1A后,降低了脂质代谢标志基因PPARγ、SCD1、CEBP/β、SREBP1、CD36和LPL的表达水平,抑制了BMECs脂滴积累。

