5种益生菌对大鼠肠道感染产肠毒素大肠杆菌的预防效果
蔡熙姮 尹 望 汪凤莲 王红梅 周桂莲 李 勇 贾友刚 张遨然
(新希望六和股份有限公司,畜禽饲料与畜禽产品质量安全控制四川省重点实验室,农业农村部饲料及畜禽产品质量安全控制重点实验室,成都 610023)
产肠毒素大肠杆菌(enterotoxigenicEscherichiacoli,ETEC)是一类引起人和幼畜腹泻的常见致病菌,其依靠黏附因子在宿主肠上皮细胞表面定植,通过在宿主体内大量的繁殖破坏肠道正常微生态平衡,从而引发继发感染,同时还可以通过释放多种肠毒素而诱发炎症,导致宿主的水代谢及电解质代谢失调,最终引发腹泻[1]。初生幼畜感染ETEC后,会引发剧烈水样腹泻从而迅速脱水,发病率和死亡率极高[2]。传统抗生素治疗的弊端显而易见,根据我国目前的禁抗现状,益生菌、益生元、植物提取物、抗菌肽及噬菌体等多种抗生素代替品越来越多的被发现并研究。益生菌是指能在动物机体胃肠道内定植,通过改善宿主胃肠道微生态环境、调节宿主体内微生态平衡来达到对宿主产生益生作用的一类活性微生物。通过拮抗作用、产生具有抑菌能力的代谢产物以及刺激肠道免疫应答等多种方式,益生菌能够起到抑制致病菌在宿主体内定植的作用[3-5]。武真邑等[6]从新鲜猪粪中分离筛选到一株乳酸片球菌ZLP025,其发酵上清液在体外抑菌试验中能有效抑制大肠杆菌生物膜的形成。冯瑜菲等[7]从健康猪体内分离到了6株对致病性大肠杆菌具有抑菌活性的乳酸菌,分析判断其中抑菌成分为有机酸或细菌素。张赛群等[8]筛选到一株短芽孢杆菌PB JK-2,对由于感染大肠杆菌K88小鼠的疾病控制有较好的效果,但会导致小鼠出现死亡。任书男[9]从酸马奶中筛选到一株副干酪乳杆菌,通过对核因子-κB(nuclear factor kappa B,NF-κB)-肌球蛋白轻链激酶(myosin light chain kinase,MLCK)和丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路的干预,实现对大肠杆菌性腹泻的治疗或预防作用。
本研究团队分离、鉴定和保存的菌株唾液乳杆菌(Lactobacillussalivarius)E33、贝莱斯芽孢杆菌(Bacillusvelezensis)F5001、戊糖片球菌(Pediococcuspentosaceus)9601、乳酸片球菌(Pediococcusacidilactici)11403和植物乳杆菌(Lactobacillusplantarum)B6401,对ETEC具有较好的抑制效果。因此,本研究以无特定病原体(SPF)级SD大鼠为研究对象,使用ETEC连续灌胃构建腹泻模型,以硫酸黏菌素作为阳性对照,分别测定在饮水中添加以上5株不同益生菌对ETEC进行攻毒后大鼠的生长性能、脏器指数、血常规指标、血清抗氧化和生化指标以及肝脏抗氧化和生化指标的影响,综合评价其对ETEC感染大鼠的预防作用,从而筛选出效果最好的菌株,为预防动物机体因感染ETEC而产生不良影响提供科学依据。
1 材料与方法
1.1 试验菌株
植物乳杆菌B6401、戊糖片球菌9601、唾液乳杆菌E33、乳酸片球菌11403在MRS培养基上常规培养;贝莱斯芽孢杆菌F5001、ETEC在营养琼脂培养基上常规培养。
1.2 试验动物
3周龄健康SPF级SD雌性大鼠,购自成都达硕试验动物有限公司。
1.3 试验材料
营养琼脂培养基、MRS培养基均购自北京陆桥技术股份有限公司;酶联免疫吸附测定(ELISA)试剂盒购自南京建成生物工程研究所;硫酸黏菌素购自药店。
1.4 试验设计和饲养管理
将80只3周龄SPF级SD雌性健康大鼠随机分成8组,每组10个重复,每个重复1只大鼠。空白对照组(CK组)和阴性对照组(NC组)正常饮水,阳性对照组(AC组)在饮水中添加硫酸黏菌素(20 mg/L),试验1组(EG-1组)、试验2组(EG-2组)、试验3组(EG-3组)、试验4组(EG-4组)和试验5组(EG-5组)分别在饮水中添加唾液乳杆菌E33、贝莱斯芽孢杆菌F5001、戊糖片球菌9601、乳酸片球菌11403和植物乳杆菌B6401新鲜菌液(1×107CFU/mL);试验最后5 d,除CK组外,其他各组每只大鼠每天灌胃1 mL的ETEC菌液(1×1010CFU/mL)进行攻毒,建立腹泻模型。
所有大鼠提前1周适应环境和饮食,笼养,5只/笼。各益生菌和ETEC均过夜培养12 h,使用前通过离心重悬调节菌液浓度。试验期间,所有大鼠均喂食正常饲粮;每3 d更换1次饮用水并重新添加新的菌液;预试期7 d,正试期20 d,最后5 d每天连续对大鼠进行攻毒,最后1次攻毒24 h后将大鼠处死采样。
1.5 样品采集和指标测定
1.5.1 样品采集
试验结束后,对所有大鼠使用水合氯醛进行腹腔注射麻醉,麻醉后通过心脏采血的方式处死,采集的心脏血液分别使用抗凝采血管和促凝采血管收集,抗凝采血管采集的血液(2 mL)用于血常规指标的测定;促凝采血管采集的血液(5 mL)静止30 min后4 000 r/min离心10 min,收集上层血清,用于血清抗氧化、免疫指标及细胞因子含量的测定。对大鼠进行解剖,完整取下心脏、肝脏、脾脏、肺脏和肾脏后分别称重;肝脏冷冻匀浆处理后,用于肝脏抗氧化、生化指标的测定。
1.5.2 生长性能测定
试验期间,每3 d对每个试验组的大鼠逐个称重,称重前断料12 h,记录大鼠体重及耗料量,计算大鼠的平均日增重、平均日采食量及料重比。
1.5.3 脏器指数测定
脏器指数计算公式如下:
脏器指数(%)=100×脏器重量(g)/体重(g)。
1.5.4 血常规指标测定
试验结束,使用抗凝采血管采集大鼠全血,采集完成半小时内送至成都里来医学实验中心进行检测,对各组大鼠血液中的血常规指标进行测定。
1.5.5 血清抗氧化、免疫指标及细胞因子含量测定
采用ELISA试剂盒对各组大鼠血清抗氧化[超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量、总抗氧化能力(T-AOC)]、免疫指标[免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA含量)]及细胞因子[白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)、白细胞介素-12(IL-12)及肿瘤坏死因子(TNF-α)]含量进行测定。
1.5.6 肝脏抗氧化和生化指标测定
采用ELISA试剂盒对各组大鼠肝脏抗氧化(GSH-Px、SOD活性及MDA含量、T-AOC)和生化指标[碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)活性]进行测定。
1.6 数据处理及统计分析
试验数据采用Excel 2010进行整理后,采用SAS 9.4软件进行单因素方差分析,并采用Duncan氏法进行多重比较。P<0.01为差异极显著,P<0.05为差异显著,P>0.05为差异不显著。
2 结果与分析
2.1 大鼠临床表现和存活率
攻毒1 d后,NC组大鼠出现精神沉郁、反应迟钝、进食量减少等现象;攻毒2 d后,NC组部分大鼠开始出现被毛杂乱、眼部产生黄色分泌物等现象;随着攻毒时间的增加,NC组逐渐开始出现大鼠死亡。其他试验组也出现相同症状,但发生时间略晚于NC组。在整个攻毒期间,CK组大鼠被毛光滑、体态活泼、食欲正常且未出现死亡。各组大鼠存活率如表1所示,其中CK、AC及EG-4组大鼠存活率均为100%。
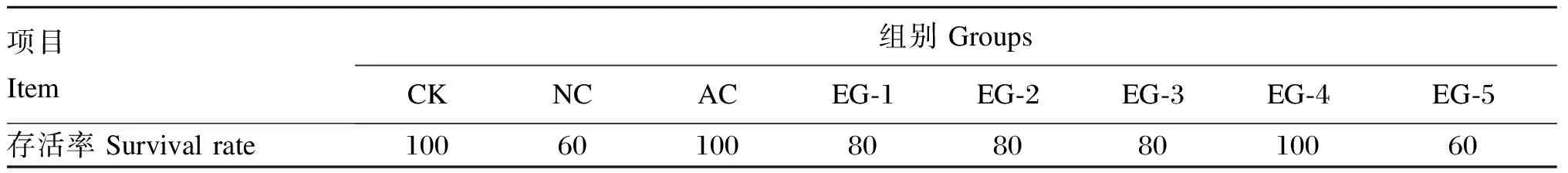
表1 各试验组大鼠存活率
2.2 攻毒前益生菌对大鼠生长性能的影响
攻毒前益生菌对大鼠生长性能的影响如表2所示,除EG-5组外,其他试验组大鼠平均日增重均高于CK组,其中EG-3和EG-1组明显高于CK组;除EG-5组外,其他试验组料重比数据均低于CK组大鼠,其中EG-3和EG-1组料重比最低,为3.72。
2.3 益生菌对大鼠脏器指数的影响
如表3所示,NC组大鼠肝脏指数显著低于EG-4和EG-5组(P<0.05)。各组之间其他脏器指数均差异不显著(P>0.05)。
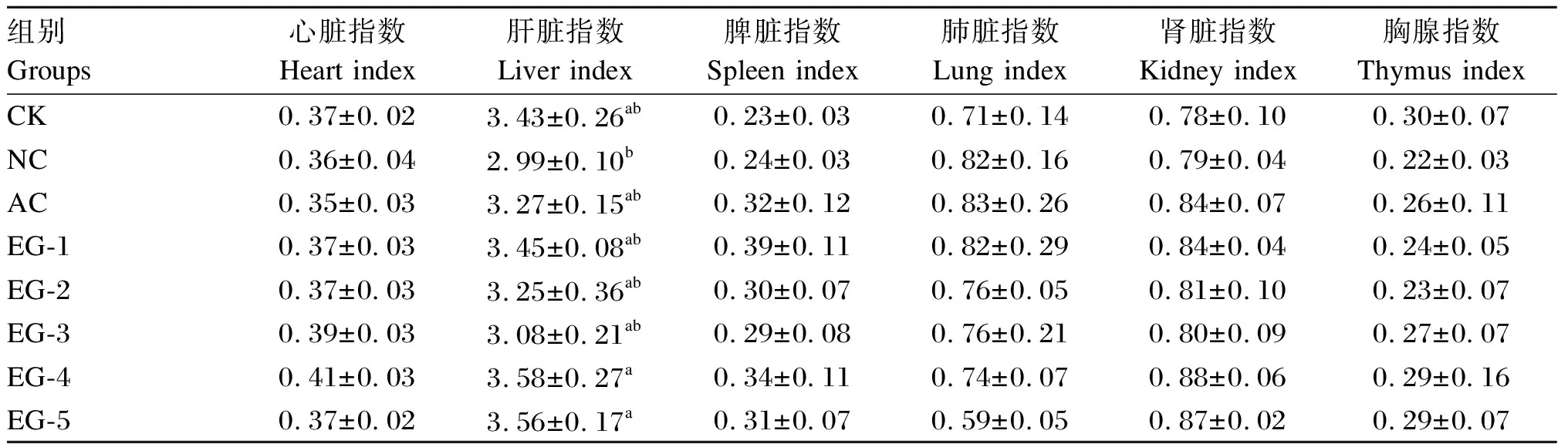
表3 益生菌对大鼠脏器指数的影响
2.4 益生菌对大鼠血常规指标的影响
如表4所示,CK组大鼠血液白细胞数量极显著高于其他各组(P<0.01),EG-5组大鼠血液白细胞数量显著低于EG-1和EG-3组(P<0.05)。CK组大鼠血液淋巴细胞数量极显著高于其他各组(P<0.01)。EG-1、EG-2、EG-4、EG-5及NC组大鼠血液中性粒细胞数量极显著低于CK组(P<0.01),EG-3及AC组大鼠血液中性粒细胞数量显著低于CK组(P<0.05)。各组之间大鼠血液单核细胞、红细胞数量及血红蛋白含量均无显著差异(P>0.05)。

表4 益生菌对大鼠血常规指标的影响
2.5 益生菌对大鼠血清抗氧化指标的影响
如表5所示,与NC组相比,EG-4组大鼠血清SOD活性显著升高(P<0.05),EG-4组和CK组大鼠血清T-AOC显著升高(P<0.05),其余各组大鼠血清SOD活性及T-AOC无显著差异(P>0.05)。各组大鼠血清MDA含量和GSH-Px活性均无显著差异(P>0.05)。

表5 益生菌对大鼠血清抗氧化指标的影响
2.6 益生菌对大鼠血清免疫指标的影响
如表6所示,AC及CK组大鼠血清IgM含量极显著高于EG-3组(P<0.01),AC组大鼠血清IgM含量极显著高于EG-1、EG-2、EG-3、EG-4、EG-5及NC组(P<0.01),CK组大鼠血清IgM含量显著高于EG-1及EG-4组(P<0.05)。NC组大鼠血清IgG含量显著高于EG-4组(P<0.05)。各组之间大鼠血清IgA含量无显著差异(P>0.05)。

表6 益生菌对大鼠血清免疫指标的影响
2.7 益生菌对大鼠血清细胞因子含量的影响
如表7所示,CK、NC、EG-2及EG-5组大鼠血清IL-4含量显著高于EG-1组(P<0.05)。各组之间大鼠血清IL-2、IL-10、IL-12及TNF-α含量均无显著差异(P>0.05)。

表7 益生菌对大鼠血清细胞因子含量的影响
2.8 益生菌对大鼠肝脏抗氧化指标的影响
如表8所示,与CK组相比,NC组大鼠肝脏SOD活性及T-AOC极显著降低(P<0.01),EG-1组大鼠肝脏SOD活性显著降低(P<0.05),其余各组大鼠肝脏SOD活性与T-AOC无显著差异(P>0.05)。各组之间大鼠肝脏MDA含量和GSH-Px活性均无显著差异(P>0.05)。
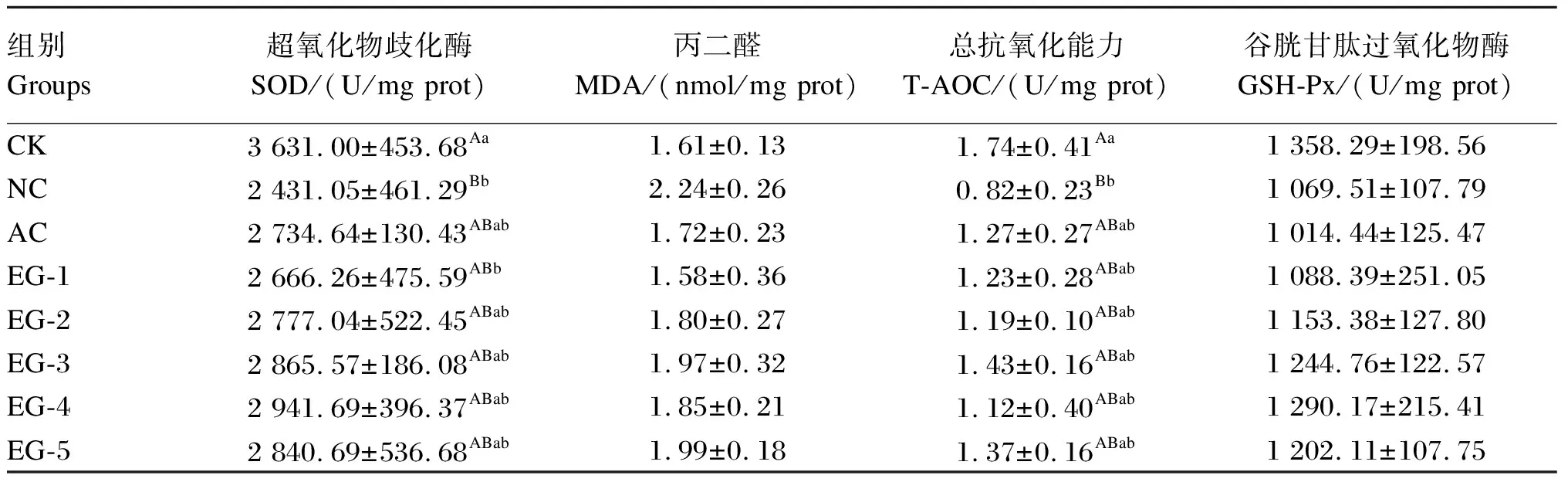
表8 益生菌对大鼠肝脏抗氧化指标的影响
2.9 益生菌对大鼠肝脏生化指标的影响
如表9所示,与CK组相比,NC、EG-1、EG-2、EG-3及EG-5组大鼠肝脏ALP活性极显著升高(P<0.01),AC及EG-4组大鼠肝脏ALP活性显著升高(P<0.05)。EG-1、EG-2、EG-3、EG-4、EG-5及NC组大鼠肝脏ALT活性极显著高于CK组(P<0.01),EG-2、EG-3及NC组大鼠肝脏ALT活性极显著高于EG-5及AC组(P<0.01),EG-1组大鼠肝脏ALT活性极显著高于AC组(P<0.01)。AC组大鼠肝脏ALT活性显著高于CK组(P<0.05),EG-4组大鼠肝脏ALT活性显著高于AC组(P<0.05)。各组之间大鼠肝脏AST活性无显著差异(P>0.05)。
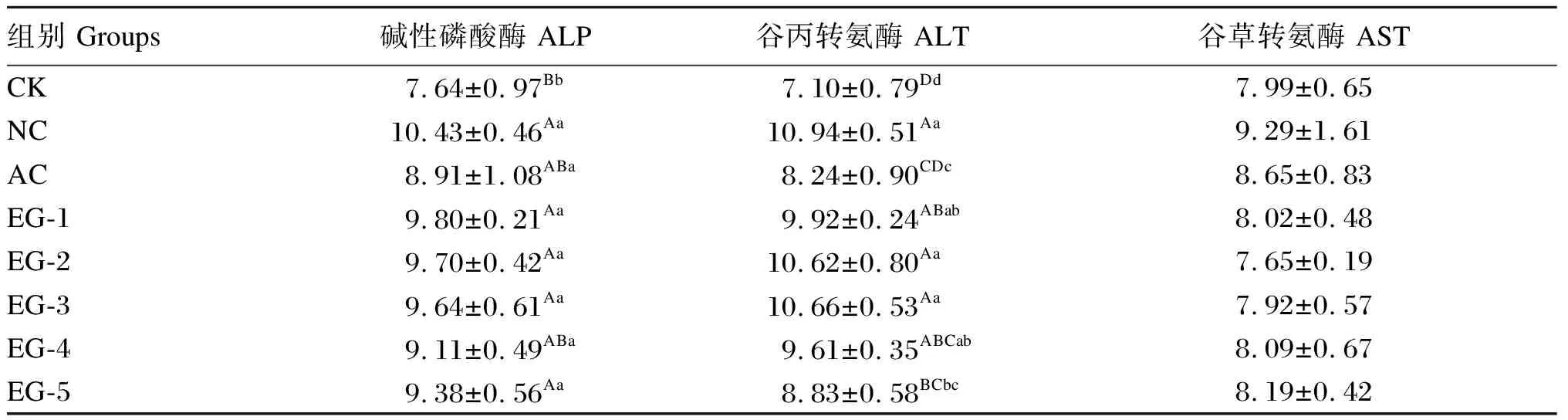
表9 益生菌对大鼠肝脏生化指标的影响
3 讨 论
ETEC是一种外源性致病菌,在宿主体内定植后会引起腹泻甚至引起肠炎的发生[10]。国内外通过建立小鼠模型来研究ETEC的报道有很多,他们通常都是使用腹腔注射或鼻饲的方式来进行模型的构建,这些方法虽然都可以建立稳定的小鼠肠炎模型,但无法很好地阐明ETEC对肠炎的诱发机制[11-12],而经口灌服ETEC的方式诱导的肠炎模型则成为了研究这一类问题的理想模型。本研究通过在大鼠饮用水中添加新鲜的益生菌菌液进行干预,试验后期采用ETEC新鲜菌液直接灌胃的方式建立大鼠肠炎模型,通过监测大鼠临床表现、生长性能及死亡情况,检测其血清抗氧化、免疫指标及细胞因子含量及肝脏抗氧化、生化指标,从而筛选出对ETEC感染诱发的肠炎具有预防作用的益生菌菌株。
本研究发现,在造模前的饲喂中,植物乳杆菌B6401、戊糖片球菌9601、唾液乳杆菌E33、乳酸片球菌11403均对大鼠生长性能有一定促作用;在试验结束后对大鼠存活情况进行分析,EG-4组大鼠存活率为100%,与CK和AC组持平,这表明乳酸片球菌11403明显降低了ETEC感染后的致死率。有研究表明,动物摄入乳酸杆菌和芽孢杆菌可以提高饲料消化率[13],但也有研究发现单一添加芽孢杆菌对动物的生长性能没有明显的促进作用[14-15]。本研究发现,贝莱斯芽孢杆菌F5001对大鼠的生长没有表现出正向调节作用,这种试验结果的差异性可能是由于益生菌的添加方式、动物本身的健康状态、养殖环境的卫生程度以及饲料的组成等条件的不同导致的。还有研究表明,益生菌的益生效果会受到动物肠道微生态环境的影响,其对肠道环境的改善效果更多的表现在肠道菌群的破坏或建立的过程中,故而并不一定会在生长性能上有所体现[16-17]。
脏器指数是指脏器重量占体重的百分比,能够在一定程度上反映动物脏器功能变化和病变情况,脏器功能损伤将导致脏器指数发生明显变化[18]。动物的脏器指数是体内试验中一类重要的生物学指标。有研究表明,脏器指数与体重间存在一定相关性,相关性依据脏器不同而存在差异[19]。肝脏是构成网状内皮系统的重要组成部分,同时也是非特异性免疫的主要器官[20]。本研究发现,ETEC感染可导致大鼠肝脏指数降低,所有试验组益生菌的添加均能够抑制大鼠肝脏指数的下降,表明所有菌株对大鼠ETEC感染导致的肝功能的下降具有一定的有预防作用,其中菌株植物乳杆菌B6401、乳酸片球菌11403和贝莱斯芽孢杆菌F5001对肝功能下降的抑制效果最好。ALP、ALT和AST是反映肝功能的主要指标,其中AST和ALT活性是反映肝脏实质损伤的重要标志。有研究表明,大量的ETEC感染可能引起急性肝脏损伤,同时伴有肝脏AST及ALT活性的明显升高[21]。通常情况下,AST及ALT活性的升高程度与肝脏细胞的受损程度呈正相关[22]。本研究发现,ETEC感染可导致大鼠肝脏ALP、ALT及AST活性升高,其中所有试验组ALP及ALT活性均显著或极显著高于CK组,所有试验组益生菌的添加均能抑制大鼠肝脏内ALP、ALT及AST活性的升高,表明所有菌株对大鼠ETEC感染导致的肝脏损伤均具有一定的有预防作用,其中乳酸片球菌11403和贝莱斯芽孢杆菌F5001对肝脏功能损伤的预防效果最明显。
血细胞主要包括红细胞、白细胞和血小板,其中白细胞是一类重要的免疫细胞,包括中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞和淋巴细胞等,其在血液中的数量变化能够反映动物机体的免疫状态[23]。有研究报道,益生菌可以通过改变血液中部分免疫细胞的比例从而达到调节机体免疫的目的[24]。还有研究报道,细菌感染会导致小鼠外周血的白细胞数量明显升高,8 h后达到峰值,16 h后开始下降,24 h后下降到低于对照组[11]。本研究发现,攻毒1 d后,大鼠血液白细胞、淋巴细胞、中性粒细胞数量均低于CK组,其中EG-1、EG-2、EG-3及AC组大鼠血液白细胞数量高于NC组,EG-1、EG-3及AC组大鼠血液淋巴细胞数量高于NC组,EG-3及AC组大鼠血液中性粒细胞数量高于NC组,表明戊糖片球菌9601对机体细胞免疫具有较好的调节作用。
动物机体抗氧化系统的首道防线主要负责抑制自由基产生,同时抑制脂质过氧化,当机体发生病原菌感染时会产生大量的自由基(如羟基、过氧基等),而过量的自由基可与生物膜结合会导致蛋白质和核酸等大分子物质的损伤,同时还会产生大量的MDA损伤组织细胞,对机体内部环境稳定造成影响,机体自身为减少自由基产生的伤害会相应激发SOD、GSH-Px等抗氧化酶的活性,从而抑制疾病的发生[25-27]。研究表明,腹泻往往伴随着氧化应激反应,从而导致肠道损伤,而益生菌可通过抑制脂质过氧化或清除超氧阴离子等方式在一定程度上保护肠道细胞,减轻自由基产生的氧化应激伤害[28]。本研究发现,ETEC感染会导致大鼠血清及肝脏MDA含量升高,T-AOC以及SOD、GSH-Px活性降低。各益生菌的添加降低了大鼠血清及肝脏MDA含量,同时提高了大鼠血清及肝脏T-AOC以及SOD、GSH-Px活性,其中乳酸片球菌11403的抗氧化能力最好。
机体免疫调节是一个极为复杂的过程,其中伴随着各种免疫球蛋白(IgG、IgM和IgA等)和细胞因子(IL-2、IL-4、IL-10、IL-12和TNF-α等)含量的变化。免疫球蛋白是普遍存在于血液、组织液、淋巴液及外分泌液中的一类参与体液免疫的重要免疫因子,该类免疫因子通过与抗原结合引起免疫反应来抑制病原体对机体的损害[29]。IgG是动物机体内含量最高的免疫球蛋白,IgM是机体初次免疫反应最早产生的免疫球蛋白,IgA分为血清型和分泌型2种,其中血清型IgA主要以无炎症形式对抗原进行清除[30]。本研究发现,ETEC感染会导致大鼠血清IgG和IgA含量升高,血清IgM含量会因清除作用迅速下降,因此除AC组外,其余试验组IgM含量均低于CK组,益生菌的添加使大鼠血清IgG和IgA含量下降,其中EG-1组、EG-2组和EG-5组血清免疫球蛋白含量与CK组最为接近。白细胞介素是一类在白细胞或免疫细胞间相互作用的淋巴因子,其在传递信息、激活与调节免疫细胞、介导T细胞和B细胞活化、增殖与分化在炎症反应的过程中起到重要作用。促炎细胞因子主要包括IL-2、IL-12和TNF-α等,通常调节免疫细胞的生长、活化、分化等,旨在控制并根除细胞内病原体[31]。抗炎细胞因子主要包括IL-4、IL-10等,旨在减轻炎症反应甚至终止炎症反应。本研究发现,ETEC感染会导致大鼠血清IL-4和IL-10含量降低,IL-2、IL-12和TNF-α含量升高,益生菌的添加使ETEC感染大鼠的血清免疫指标和细胞因子含量均有所改善,趋于向CK组靠数值近,其中唾液乳杆菌E33、贝莱斯芽孢杆菌F5001和乳酸片球菌11403对机体免疫的调节效果较好。
4 结 论
饮水中添加益生菌能有效降低大鼠死亡率,同时提高大鼠的生长性能;ETEC会导致大鼠血液白细胞数和淋巴细胞数量下降,益生菌的添加对ETEC感染造成的影响均具有一定的预防效果,其中乳酸片球菌11403的预防效果最好。

