褐藻寡糖对呕吐毒素诱导小鼠肝脏损伤的影响
王毓甜 米金秋 全浩玮 王庆凤 李泽昆 李天天 马秋刚 黄世猛*
(1.中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京 100193;2.国家粮食和物资储备局科学研究院,北京 100037)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)因可引起猪产生呕吐现象,又称为呕吐毒素,主要由禾谷镰刀菌、梨孢镰刀菌等多种镰孢菌属真菌产生,属于单端孢霉菌素类毒素,是畜禽饲料生产中最常见的真菌毒素之一,也是当前全球范围内饲料中污染最为严重的霉菌毒素之一[1]。畜禽采食DON污染的饲粮或饲料原料后,会出现采食量减少、生长性能降低、呕吐、腹泻等症状,甚至死亡,给我国畜禽养殖造成巨大的经济损失[2-4]。本课题组前期研究发现,从吉林、湖南、安徽等区域采集了1 304份饲料原料进行检测,DON检出率为93.56%,超标率为51.76%,其中玉米、玉米副产品和小麦及麸皮的检出率分别高达96.49%、96.59%和100%[5]。侯楠楠等[6]收集我国山东、江苏、东北等地区的饲粮和饲料原料,对DON污染情况进行监测,结果显示DON的污染率达97.22%,超标率为27.42%。最新调研结果表明,2021年调查的我国1 025份饲粮和饲料原料样品中DON检出率均达到88%以上[7]。由此可见,我国饲粮和饲料原料的DON检出率和超标率维持在较高水平。摄入DON污染的饲粮和饲料原料,容易引起畜禽不同程度的中毒情况,其中DON的毒性作用主要表现为细胞毒性、多器官组织病理毒性、神经毒性、免疫毒性、消化道毒性、肝脏毒性和致畸致癌等[8-11]。肝脏作为DON主要作用的靶器官之一,可以导致肝细胞脂肪变性及肝细胞癌,DON可增加肝脏谷丙转氨酶(ALT)和谷草转氨酶(AST)活性,破坏机体氧化/抗氧化酶系统,导致氧化应激,诱导肝脏组织发生病理损伤[12]。DON对肝脏的影响鲜有系统研究[12],肝脏作为机体主要的合成代谢和分解代谢器官,参与能量代谢、异种生物解毒、营养物质代谢和吸收、蛋白质合成和胆汁的产生[13]。研究表明,肝脏是DON主要靶器官之一,DON可改变肝脏组织形态,诱导炎症反应,增加细胞凋亡和氧化应激[14-16]。已有研究证实,添加具有抗炎、抗氧化的功能活性物质,可以改善机体的氧化还原状态,进而缓解炎症和氧化损伤。
褐藻寡糖(alginate oligosaccharides,AOS)也称褐藻胶低聚糖,包括低聚甘露糖醛酸和低聚古罗糖醛酸,是由褐藻胶经过降解得到聚合度为2~25的功能性寡糖[17]。AOS具有非免疫、无毒性、生物可降解的低聚合度特性[17-19],其分子质量小、溶解度高,容易被机体吸收和利用,已有大量研究证实了AOS具有多种活性功能,例如抗氧化、抗炎、抗细胞凋亡、抗菌、抗肿瘤和调节肠道菌群等[20-23]。虽然AOS的各种生物学功能得到广泛关注,但对于AOS是否具有改善DON诱导小鼠肝脏损伤的研究鲜有报道。因此,本试验旨在研究AOS对DON诱导小鼠肝脏损伤的缓解效果,旨在为AOS在畜禽生产中的应用提供理论科学依据。
1 材料与方法
1.1 试验设计
无特异性病原体(SPF)级7周龄雌性C57BL/6J小鼠购自斯贝福(北京)生物科技有限公司。经过1周适应后,将32只8周龄小鼠根据体重随机分为4个组,即对照组(CON组)、褐藻寡糖组(AOS组)、呕吐毒素组(DON组)和褐藻寡糖+呕吐毒素组(AOS+DON组),每组8只小鼠。每笼饲养4只小鼠。本试验共计28 d,分为DON处理前(前21 d)和处理后(后7 d)2个阶段。前21 d,AOS组和AOS+DON组小鼠每天灌胃200 μL(200 mg/kg BW)AOS,CON组和DON组小鼠每天灌胃等体积无菌生理盐水;后7 d,DON组和AOS+DON组小鼠每天灌胃100 μL(4.8 mg/kg BW)DON,CON和DON组小鼠每天灌胃等体积无菌生理盐水。小鼠自由饮水和采食,饲养环境温度为18~22 ℃,相对湿度为35%~44%,12 h光照12 h黑暗。所有涉及小鼠的试验过程均遵循中国农业动物护理和使用伦理委员会的指导方针进行。试验期间每周记录小鼠体重,观察小鼠整体健康状况。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(干物质基础)
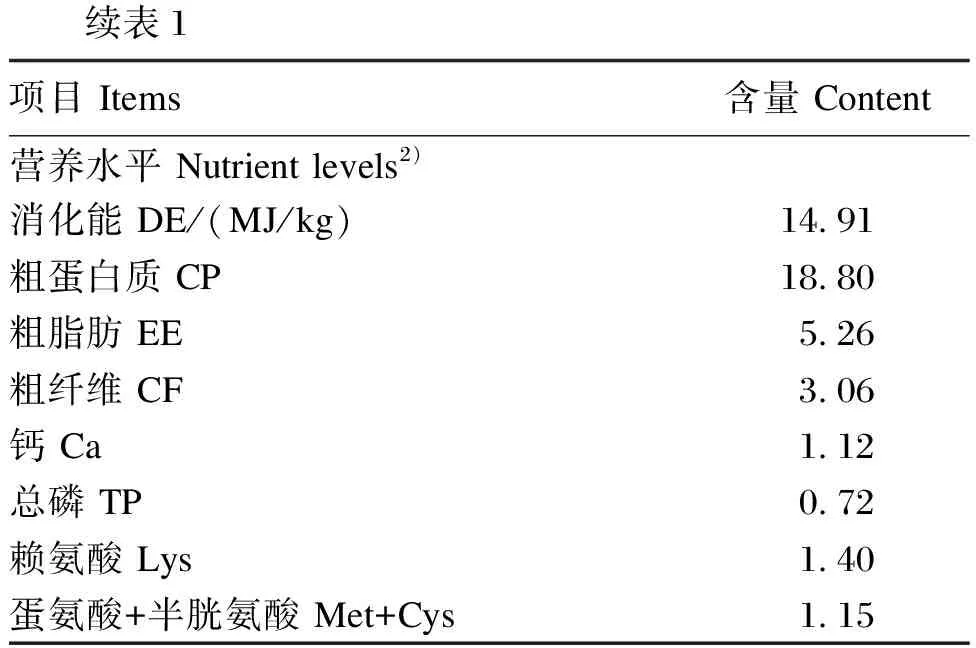
续表1项目 Items含量 Content营养水平 Nutrient levels2)消化能 DE/(MJ/kg)14.91粗蛋白质 CP18.80粗脂肪 EE5.26粗纤维 CF3.06钙 Ca1.12总磷 TP0.72赖氨酸 Lys1.40蛋氨酸+半胱氨酸 Met+Cys1.15
1.2 样品收集
试验结束后,眼球采血法采集小鼠血液,置于无抗凝剂的离心管中,在4 ℃、3 000 r/min离心10 min,分离血清并于-80 ℃保存。随后脱颈处死小鼠,无机械损伤分离肝脏组织,称量肝脏重量并记录,用无菌生理盐水冲洗后,取一份肝脏组织置于4%多聚甲醛溶液中固定保存,用于制备切片;另一份肝脏组织冻存于-80 ℃冰箱用于后续分析。
1.3 测定指标及方法
1.3.1 体重和体增重
每周对小鼠称重并记录数据,统计各组小鼠的8、9、10、11、12周龄的体重和8~11周体增重。
1.3.2 肝脏指数
分离完整肝脏并用无菌磷酸盐缓冲液冲洗,用滤纸吸去水分后称重,计算肝脏指数。
肝脏指数(%)=[肝脏重量(g)/体重(g)]×100。
1.3.3 肝脏组织苏木精-伊红染色和免疫荧光分析
剪取各小鼠肝脏组织,用无菌磷酸盐缓冲液清洗后,固定在4%多聚甲醛溶液中,对其进行脱水、石蜡包埋样品切片,通过苏木精-伊红染色,在光学显微镜下观察并分析肝脏组织病理学变化。在武汉塞维尔生物科技有限公司完成肝脏组织F4/80免疫荧光分析,观察肝脏组织巨噬细胞浸润情况,通过荧光强度平均值反映巨噬细胞含量,并进行统计学分析。
1.3.4 血清和肝脏炎症细胞因子和氧化/抗氧化指标
使用酶联免疫吸附测定(ELISA)分析试剂盒检测小鼠血清白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)和肿瘤坏死因子-α(TNF-α)含量。取肝脏组织样品,冰上解冻后,制备小鼠肝脏组织匀浆样品,取上清测定肝脏炎症细胞因子(IL-1β、IL-6、IL-8、TNF-α和IL-10)含量;同时,取上清使用比色法测定肝脏丙二醛(MDA)含量和总超氧化物歧化酶(T-SOD)活性。以上指标均使用南京建成生物工程研究所生产的试剂盒进行测定。
1.3.5 肝脏功能指标
收集小鼠血清样品,使用全自动血液生化分析系统(AU5400,Beckman Coulter,美国)测定小鼠血清中反映肝脏功能的指标,包括血清AST、AST、乳酸脱氢酶(LDH)活性及甘油三酯(TG)、总胆固醇(TC)含量,均使用南京建成生物工程研究所试剂盒进行测定。
1.4 数据统计分析
所有试验数据采用SPSS 23.0软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏多重比较检验分析组间差异显著性,并分析AOS和DON对小鼠的交互作用。结果用平均值±标准误表示,P<0.05为差异显著。使用GraphPad Prism 9.0软件制作数据图。
2 结果与分析
2.1 AOS对DON诱导小鼠体重及肝脏指数的影响
由表2可知,各组小鼠初始体重(8周龄体重)无显著差异(P>0.05)。给小鼠灌胃AOS后,与CON组相比,AOS组的10和11周龄体重显著增加(P<0.05);且AOS组的8~11周龄体增重显著高于对照组(P<0.05)。DON诱导后,与CON组相比,DON组的12周龄体重显著降低(P<0.05);与DON组相比,AOS+DON组的12周龄体重显著增加(P<0.05)。与CON组相比,DON组的肝脏指数显著增加(P<0.05);与DON组相比,AOS+DON组的肝脏指数显著降低(P<0.05)。12周龄体重、肝脏指数、11~12周龄体重变化存在AOS与DON的显著交互作用(P<0.05)。
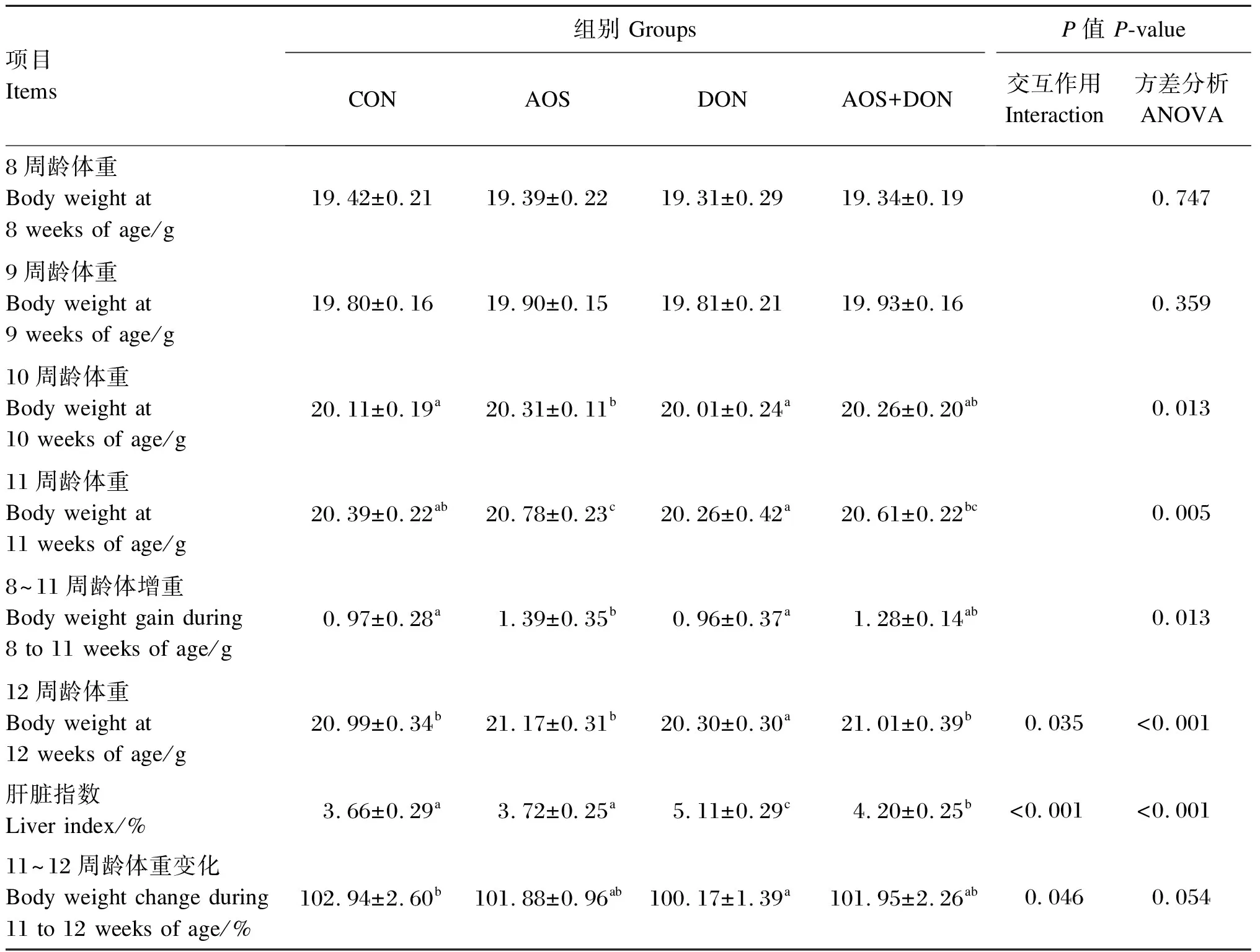
表2 AOS对DON诱导小鼠体重及肝脏指数的影响
2.2 AOS对DON诱导小鼠血清和肝脏炎症细胞因子和氧化/抗氧化指标的影响
如图1可知,与CON组相比,DON组的血清和肝脏IL-1β、IL-68和TNF-α含量显著增加(P<0.05),血清IL-8含量显著增加(P<0.05),提示DON可引起小鼠机体和肝脏组织中促炎细胞因子含量的增加,造成机体出现明显的炎症损伤。与DON组相比,AOS+DON组的血清和肝脏IL-1β、IL-6和TNF-α含量显著降低(P<0.05),血清IL-8含量显著降低(P<0.05);与CON组相比,DON和AOS+DON组的肝脏IL-10含量显著降低(P<0.05)。
与CON组相比,DON组的肝脏MDA含量显著增加(P<0.05),肝脏T-SOD活性显著降低(P<0.05);与DON组相比,AOS+DON组的肝脏MDA含量显著降低(P<0.05),肝脏T-SOD活性显著增加(P<0.05)。与CON组相比,AOS组的肝脏T-SOD活性显著增加(P<0.05)。同时,除肝脏IL-10和T-SOD指标外,其余指标均存在AOS与DON的显著交互作用(PAOS×DON<0.05)。上述结果提示,AOS通过调控多种细胞因子分泌和氧化/抗氧化酶活性缓解DON诱导的小鼠机体和肝脏损伤。
2.3 AOS对DON诱导小鼠肝脏组织病理学的影响
如图2所示,CON组和AOS组小鼠肝脏组织病理学切片中肝细胞结构完整,形态正常,未见明显肝细胞病理损伤、炎症浸润或脂质沉积;DON组小鼠肝脏组织病理学切片中出现肝细胞点状坏死,且变形、肿胀,存在明显炎症浸润、脂质沉积或细胞瘤样病变,呈特征性放射纤维状;AOS+DON组病变程度明显减轻,肝细胞形态明显改善,且脂肪空泡数量减少。
F4/80免疫荧光染色后,与CON组相比,DON组的肝脏巨噬细胞含量显著增加(P<0.05);与DON组相比,AOS+DON组的肝脏巨噬细胞含量显著减少(P<0.05)。
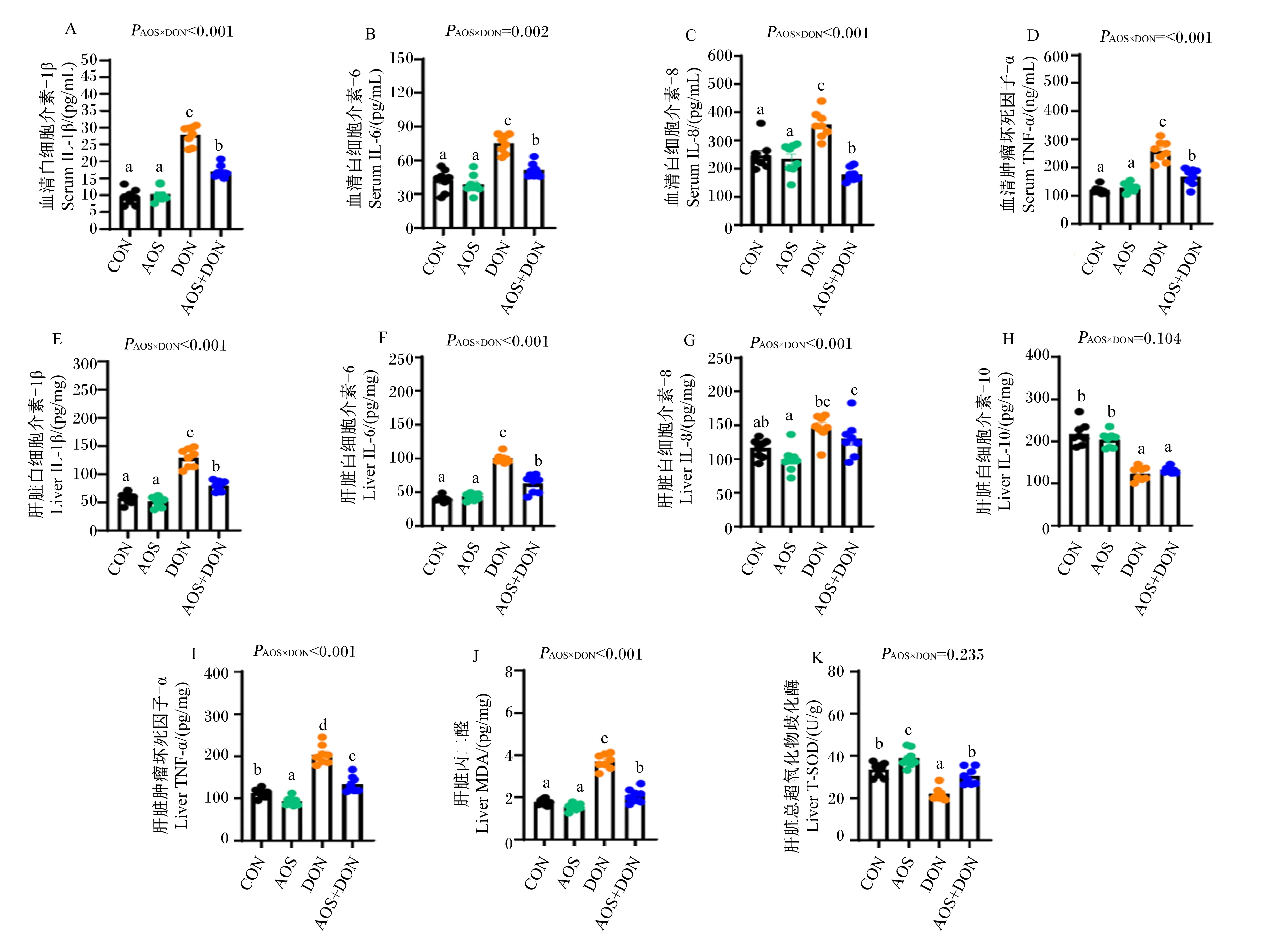
CON:对照组;AOS:褐藻寡糖组;DON:呕吐毒素组;AOS+DON:褐藻寡糖+呕吐毒素组。数据柱标相同或无小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。
2.4 AOS对DON诱导小鼠血清AST、ALT、LDH活性及TG、TC含量的影响
如图3所示,与CON组相比,DON组的血清AST、ALT和LDH活性均显著增加(P<0.05),AOS组的血清AST活性显著降低(P<0.05);与DON组相比,AOS+DON组的血清AST、ALT和LDH活性均显著降低(P<0.05)。与CON组相比,DON组的血清TG和TC含量均显著增加(P<0.05),AOS组的血清TG含量显著降低(P<0.05);与DON组相比,AOS+DON组的血清TG和TC含量均显著降低(P<0.05)。同时,除血清AST和TG指标外,其余指标均存在AOS与DON的显著交互作用(PAOS×DON<0.05)。上述结果提示,AOS对DON诱导的小鼠肝脏损伤有显著缓解效果,尤其在改善小鼠血清中肝脏功能标志性指标方面。

DAPI:4’,6-二脒基-2-苯基吲哚 4’,6-diamidino-2-phenylindole;H&E:苏木精-伊红 hematoxylin eosin。
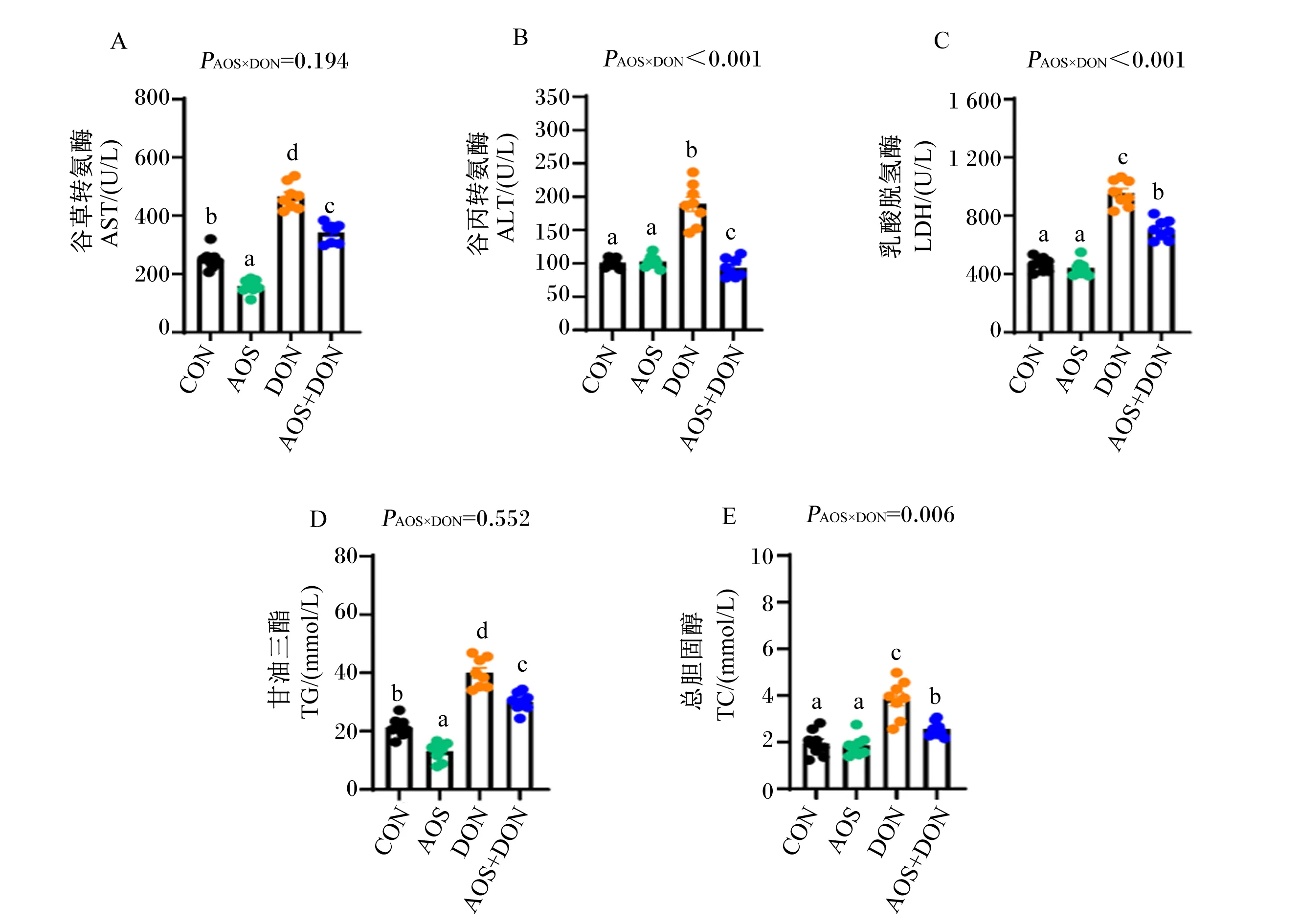
图3 AOS对DON诱导小鼠血清AST、ALT、LDH活性及TG、TC含量的影响
3 讨 论
3.1 AOS对DON诱导小鼠体重及肝脏指数的影响
研究表明,与对照组相比,小鼠采食DON饲粮后,食糜中DON含量升高,造成小鼠胃肠道损伤,进而降低其平均日增重和平均日采食量[24]。与前人研究结果一致,本研究发现DON可导致小鼠体重降低,阻碍其生长;与CON组相比,灌胃3周的AOS可显著增加小鼠体重和体增重;与DON组相比,AOS可缓解DON诱导的小鼠体重降低。张丽等[25]研究表明,饲粮中添加20、40或80 mg/kg AOS显著提升断奶仔猪的平均日增重和平均日采食量,改善仔猪生长性能。刘萍等[26]研究发现,饲粮添加褐藻糖胶可显著降低1~14天仔猪料重比,但对试验全期仔猪平均日增重和平均日采食量无显著影响。
研究发现,给小鼠灌胃放射性同位素示踪标记的DON,血浆和组织的吸收峰值在30 min;小鼠口服DON(25 mg/kg BW),5 min后检测不同组织中DON浓度为:肝脏(19.5±1.9) μg/kg,血浆12.1 μg/mL,肾脏(7.6±0.5) μg/kg,脾脏(7.3±0.8) μg/kg,心脏(6.8±0.9) μg/kg和大脑(0.8±0.1) μg/kg[27]。由此可见,肝脏是机体代谢DON的重要解毒器官之一。本试验研究结果发现,与CON组相比,DON灌胃小鼠可显著增加肝脏指数,表明DON对肝细胞系和实体肝脏组织具有明显的毒性作用[13]。然而,AOS可显著减少DON诱导的小鼠肝脏指数增加。这可能是因为AOS能下调促炎细胞因子的表达,上调抗炎细胞因子的表达和分泌,发挥抗炎和抗氧化损伤功能,进而缓解组织器官的炎症损伤[27]。因此,AOS通过调控小鼠的生长性能和肝脏功能缓解DON诱导的肝脏损伤。
3.2 AOS对DON诱导小鼠血清和肝脏炎症细胞因子和氧化/抗氧化指标的影响
炎症细胞因子含量是反映机体炎症损伤和免疫失调的重要生物标志物[28]。研究发现,DON暴露上调机体炎症反应,并选择性促进机体促炎细胞因子mRNA表达上调,例如DON诱导的仔猪小肠上皮细胞系(IPEC-J2)的细胞损伤是通过促进氧自由基的产生,显著上调与凋亡、炎症相关基因mRNA和蛋白质的表达[29],而通过外源补充杜仲黄酮能显著缓解DON诱导的促炎细胞因子含量的增加[30]。同时,氧化应激是DON诱导的重要毒性机制之一,研究发现,DON可导致小鼠肝脏发生明显的氧化应激,增加肝脏组织中MDA含量和谷胱甘肽过氧化物酶(GPx)活性,降低过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性[31]。且随着DON浓度的增强,对动物的毒性作用加强,导致氧化应激现象加剧,并伴随肝脏组织损伤、免疫失调等现象[32]。大量研究证明,海藻多糖的水解产物寡糖对小鼠肝脏损伤具有一定保护作用。例如,壳寡糖具有良好的抗氧化活性,能够增强体内抗氧化酶活性,在肝脏损伤中起到保护作用,多种植物或海藻来源的多糖或寡糖能不同程度地降低机体促炎细胞因子的合成和分泌[33]。与前人研究结果一致,本试验中DON组的小鼠肝脏MDA含量较CON组显著增加,而AOS可以抑制MDA含量的升高,并提高肝脏T-SOD活性。因此,AOS能够通过降低DON导致的炎症因子分泌,缓解机体炎症损伤,同时中和DON的氧化应激毒性,促进小鼠体内氧化还原代谢平衡。
3.3 AOS对DON诱导小鼠肝脏组织病理学和肝脏功能指标的影响
在本研究中,与健康小鼠相比,DON组肝脏组织出现明显病理变化,出现细胞点状坏死、细胞间界限模糊,且凋亡增多,存在明显脂质沉积,提示了DON导致小鼠肝脏组织出现明显病理损伤,然而,添加AOS可显著缓解上述肝脏病理损伤症状。肝脏和胃肠道是霉菌毒素代谢的主要部位[34],依据最新综述文章,霉菌毒素显著破坏机体的肠道屏障、免疫机能、抗氧化功能、微生态平衡和营养物质代谢等,其中DON造成肠道屏障功能障碍、免疫失调以及细胞死亡等毒性作用较为强烈[35],而且大量研究证实了不同浓度DON可导致机体出现急性或慢性肝脏组织损伤[36],同时,DON能影响动物肝脏组织结构完整性和功能[37]。Peng等[38]研究发现,小鼠摄入DON(25 μg/kg BW)30和90 d会导致肝脏中央静脉周围轻度炎症浸润,IL-1β、IL-6和TNF-α含量升高,ALT活性升高,提示肝脏功能损伤。此外,已有研究证实了DON可引起肝细胞破裂、空泡化和巨噬细胞增殖[14]。与本试验结果一致,均提示了DON可破坏肝脏形态和功能,导致肝脏毒性和炎症。
研究发现,饲粮中添加AOS可激活脂肪酸代谢相关途径,减少肝脏组织脂肪积累,增加抗氧化活性,从而使机体免受氧化损伤[39]。Hao等[33]研究发现,添加AOS 10 mg/kg可改善与免疫和抗肿瘤作用相关的血液代谢产物,从而改善小鼠的肝脏组织损伤,上述结果与本试验结果一致。这提示AOS能够通过减少某些脂质过氧化物的产生,激活小鼠机体内抗氧化防御系统,缓解DON诱导的肝脏损伤。AST、ALT和LDH活性是反映肝脏功能损伤的重要指标,肝细胞发生严重坏死时,上述酶活性显著升高。同时,TC和TG作为血脂的重要组分,如果肝脏发生病变,其含量会有所增加,且其含量升高可促进脂肪肝的发生与发展,一定程度上反映肝脏损伤程度。有研究表明,海藻酸寡糖显著缓解高脂饲粮诱导小鼠血清中肝脏功能损伤指标(AST、ALT和LDH)和血脂代谢指标(TG和TC)异常[40]。与上述结果类似,本试验表明AOS可缓解DON诱导的小鼠脏肝功能紊乱和脂类代谢异常,减少机体脂质过氧化物的产生和肝脏脂质沉积,进而缓解DON诱导的小鼠肝脏损伤。
4 结 论
AOS能够改善肝脏病理学损伤、机体炎症和氧化应激,维护肝脏功能,进而缓解DON诱导的小鼠肝脏损伤。

