维生素C对大鲵生长性能、血液指标以及抗氧化和免疫功能的影响
方揽月 侯静宜 杨理想 李 虹 翟旭亮 薛 洋 向 枭 罗 莉*
(1.西南大学水产学院,淡水鱼类资源与生殖发育教育部重点实验室,重庆 400715;2.重庆市水产技术推广总站,重庆 400400)
维生素C作为一种水溶性维生素,是维持动物正常生长、繁殖和健康所必需的营养素。维生素C是胶原蛋白合成过程中特定酶的必须辅助因子[1],同时参与肉碱及类固醇合成,促进皮肤、软骨和硬骨生成,且在水生动物生长、抗氧化、抗应激和非特异性免疫等方面具有重要作用[2]。水产动物养殖过程中维生素C轻度缺乏会出现动物生长迟滞、皮肤溃烂[3]、脊柱侧弯[4]及细胞凋亡加剧[5]等问题,重度缺乏会导致死亡率升高,造成严重的经济损失[6]。研究发现,动物体内维生素C的合成过程需要关键酶L-古洛内酯氧化酶(L-gulonolactone oxidase,GLO)。大部分两栖动物体内具有GLO,可以自行合成维生素C,但是合成能力相对较弱,不能满足其生长繁殖需要,需从外部摄入[7]。大鲵(Andriasdavidianus)是否具备这种能力有待研究。
大鲵是冷水性名优两栖动物,其不仅肉质鲜美、营养丰富[8],还含有多种生物活性物质,可抗衰老、抗肿瘤,极具药用价值[9],具有巨大的经济价值和养殖潜力,且其饲喂方式逐步由传统饵料鱼转变为配合饲料。目前,关于大鲵营养与饲料方面的研究已展开了营养需求评定[10]、功能性饲料添加剂[11]和中草药提取物[12]等的应用评价。基于维生素C是一种重要的生物抗氧化和免疫调节剂,本研究在饲料中添加不同水平的维生素C,探讨其对大鲵生长性能、血液指标以及抗氧化和免疫功能的影响,旨在明确饲料中维生素C的适宜添加水平,为大鲵饲料配方的优化提供科学依据。
1 材料与方法
1.1 试验材料
本试验所用维生素C为维生素C磷酸酯,有效含量为35%,由北京某科技有限公司提供,生产批号Y14749。
1.2 试验饲料
本试验以鱼粉、鸡肉粉等为蛋白质源,配制成6种等氮等脂的饲料,其中基础饲料组成及营养水平见表1。饲料原料经粉碎机粉碎2次后过60目筛,然后用软颗粒饲料制粒机搅拌混合后制成直径4 mm左右的饲料,于烘箱40 ℃干燥后用双层塑料袋包装并封口。
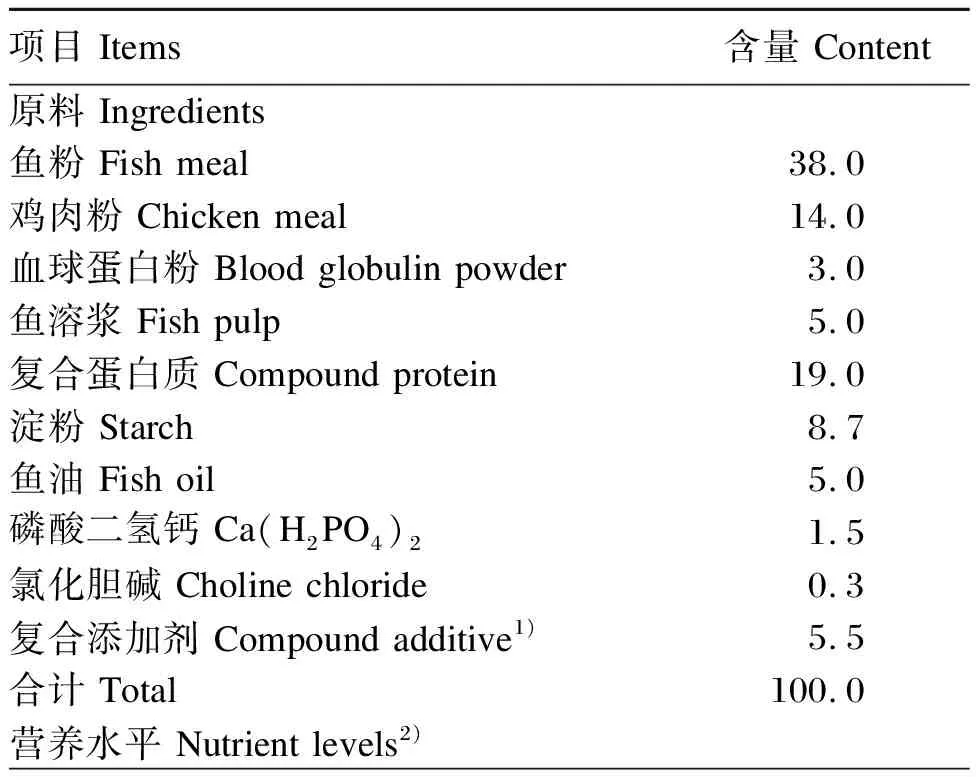
表1 基础饲料组成及营养水平(干物质基础)

续表1项目 Items含量 Content粗蛋白质 CP56.35粗脂肪 EE11.88粗灰分 Ash10.03
1.3 试验设计和饲养管理
试验所选用的大鲵购于陕西汉中绿源大鲵养殖场。正式试验前,使用本课题组创制的配合饲料(粗蛋白质水平为56.35%)[10]驯化大鲵21 d后,选择144尾体质量[(34.14±0.15) g]均匀、体质健壮的大鲵,随机分成6个组,每组3个重复,每个重复8尾大鲵。各组分别在基础饲料中添加0(D0组,对照组)、150(D150组)、300(D300组)、450(D450组)、600(D600组)和750 mg/kg(D750组)的维生素C。试验期90 d。
大鲵饲养于西南大学水产养殖系统(养殖箱规格:70.0 cm×45.0 cm×17.5 cm,容积55 L)中,养殖水面漫过大鲵背部,水源为曝气自来水,每天早晚各换水1次。16:30饱食投喂,2 h后捞取残余饲料并记录重量,连续投喂2 d后停食1 d。养殖期间保持黑暗,水温21~23 ℃,氨氮含量≤0.10 mg/L,亚硝酸盐含量≤0.10 mg/L,溶解氧含量≥6.5 mg/L,pH为6.5~7.0。
1.4 样品采集
试验结束后,将大鲵停食3 d,待肠排空后,用0.01% MS-222溶液麻醉10 min,逐条称重记录。每个重复先随机选取5尾大鲵,采用1 mL注射器从静脉抽取血液立刻进行血常规指标检测;其余血液样本注入含有肝素钠的离心管中制备血浆,用于血浆生化指标的测定。在冰盘中分离大鲵皮肤、背部肌肉、胃、肠道、肝脏、胰脏及脾脏,液氮速冻后置于-80 ℃冰箱。
1.5 指标测定及方法
1.5.1 生长性能
生长性能指标的测定参照徐杭忠等[13]的方法,包括终末体重(FBW)、增重率(WGR)、摄食量(FI)、饲料系数(FCR)、蛋白质效率(PER)和成活率(SR)。
1.5.2 血常规和血浆生化指标
血常规指标采用Sysmex-pocH-100iVD全自动动物血细胞分析仪测定。血浆葡萄糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)含量均采用南京建成生物工程研究所生产的试剂盒测定。
1.5.3 各器官组织和血浆维生素C含量
胃、肠道、肝脏、胰脏、脾脏、皮肤、肌肉及血浆维生素C含量采用比色法测定,试剂盒购自南京建成生物工程研究所,按照说明书操作进行。
1.5.4 各器官组织和血浆抗氧化和免疫指标
胃、肠道、肝脏、胰脏、脾脏、皮肤、肌肉及血浆总抗氧化能力(T-AOC)采用比色法测定,血浆总超氧化物歧化酶(T-SOD)活性采用WST-1法测定,血浆丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定,试剂盒购自南京建成生物工程研究所,按照说明书操作进行。
胃、肠道、肝脏、胰脏、脾脏、皮肤、肌肉及血浆溶菌酶(LZM)活性采用比浊法测定,血浆酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活性采用分光光度法测定,试剂盒购自南京建成生物工程研究所,按照说明书操作进行。
1.6 数据统计与分析
采用SPSS 22.0软件对试验数据进行单因素方差分析(one-way ANOVA),并采用Tukey多重比较法分析组间差异显著性,结果数据用“平均值±标准差(mean±SD)”形式表示,P<0.05表示差异显著。
2 结 果
2.1 维生素C对大鲵生长性能的影响
由表2可知,随着饲料维生素C添加水平的提高,大鲵的FBW、WGR和PER呈现先提高后趋于稳定的变化趋势,且均在D450组达到最高值,并显著高于对照组(D0组)(P<0.05),而D300组、D450组、D600组和D750组间差异不显著(P>0.05);FCR呈现先降低后趋于稳定的变化趋势,且D300组、D450组、D600组和D750组显著低于对照组(P<0.05),而上述4个组之间差异不显著(P>0.05);各组大鲵SR均为100.00%。分别以WGR和FCR为因变量,饲料维生素C添加水平为自变量,建立2个折线模型,得到大鲵饲料中维生素C适宜添加水平分别为311.73(图1)和320.53 mg/kg(图2)。
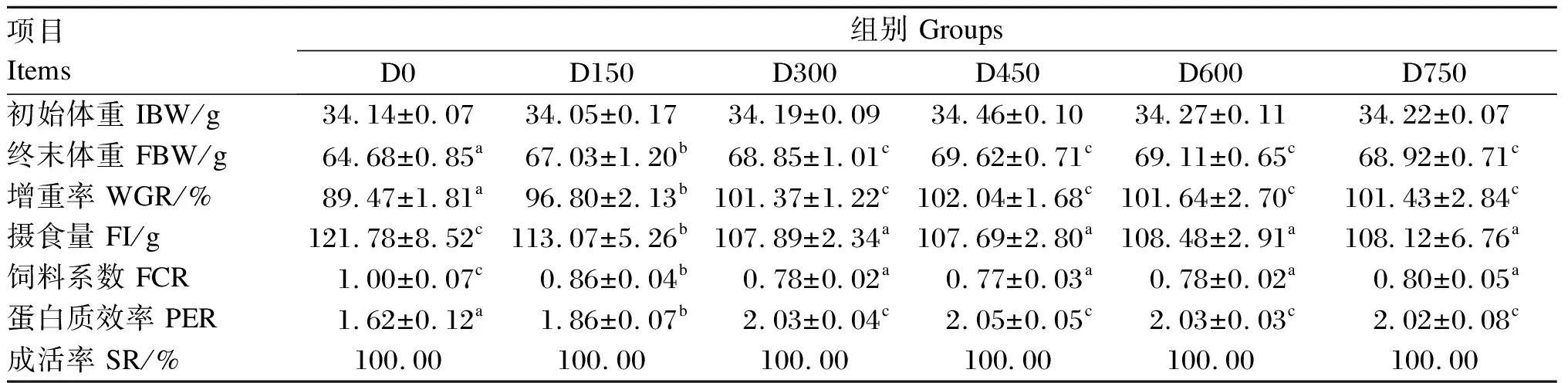
表2 维生素C对大鲵生长性能的影响
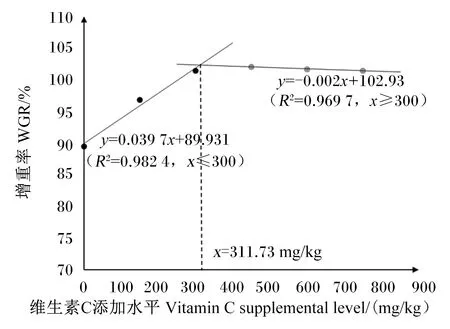
图1 维生素C对大鲵WGR的影响
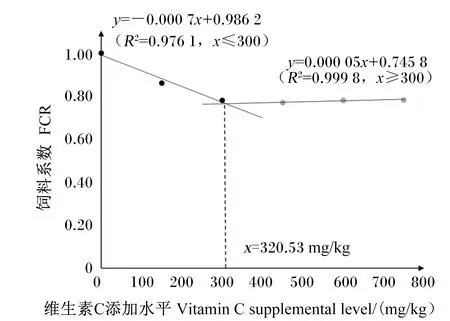
图2 维生素C对大鲵FCR的影响
2.2 维生素C对大鲵血液指标的影响
由表3可知,随着饲料维生素C添加水平的提高,大鲵血液白细胞数量、血栓细胞数量以及血红蛋白含量均呈现先提高后降低的变化趋势。各组之间血液白细胞数量无显著差异(P>0.05);D300组血液血栓细胞数量最高,显著高于其他各组(P<0.05);D300组和D450组血液血红蛋白含量显著高于其他各组(P<0.05)。各组之间血浆GLU、TG、TC、HDL-C和LDL-C含量均无显著差异(P>0.05)。随着饲料维生素C添加水平的提高,血浆MDA含量呈现先降低后趋于稳定的变化趋势,并在D300组达到最低,显著低于对照组和D150组(P<0.05);血浆T-SOD活性则呈现先提高后降低的变化趋势,在D450组达到最高,显著高于其他各组(P<0.05)。随着饲料维生素C添加水平的提高,血浆ACP和AKP活性均呈现先提高后降低的变化趋势,D300组~D750组均显著高于对照组(P<0.05)。
2.3 维生素C对大鲵各器官组织和血浆维生素C含量的影响
由图3可知,随着饲料维生素C添加水平的提高,大鲵肝脏、肌肉、肠道、血浆、胰脏、胃、脾脏和皮肤中的维生素C含量均呈现先提高后趋于稳定的变化趋势。D300组~D750组各器官组织和血浆维生素C含量均显著高于对照组(P<0.05)。此外,维生素C在大鲵各器官组织分布具有较为明显的分布不均等现象,各器官组织按照维生素C含量由高到低排列如下:肝脏>肌肉>肠道>血浆>胰脏、胃、脾脏、皮肤。

图3 维生素C对大鲵各器官组织和血浆维生素C含量的影响
2.4 维生素C对大鲵各器官组织和血浆T-AOC的影响
由图4可知,随着饲料维生素C添加水平的提高,大鲵各器官组织和血浆T-AOC均呈现先提高后趋于稳定的变化趋势,其中D300组~D750组肝脏、脾脏、血浆、肌肉和脾脏T-AOC均显著高于对照组(P<0.05),且肝脏、脾脏和肌肉T-AOC均在D600组最高;D600组和D750组皮肤、胃和肠道T-AOC显著高于对照组(P<0.05)。大鲵各器官组织和血浆T-AOC具有较为明显的分布不均现象,各器官组织和血浆按T-AOC由高到低可排列如下:肝脏>脾脏>血浆>肌肉>皮肤>胃、胰脏和肠道。以2.3中各器官组织和血浆维生素C含量为横坐标,以各器官组织和血浆T-AOC为纵坐标,进行线性回归分析,结果见表4。由表可知,大鲵肝脏、血浆、肌肉和皮肤中的维生素C含量与T-AOC有强相关性[决定系数(R2)>0.64],脾脏、胃、肠道和胰脏中的维生素C含量与T-AOC有弱相关性(0.09≤R2<0.64)。

图4 维生素C对大鲵各器官组织和血浆T-AOC的影响
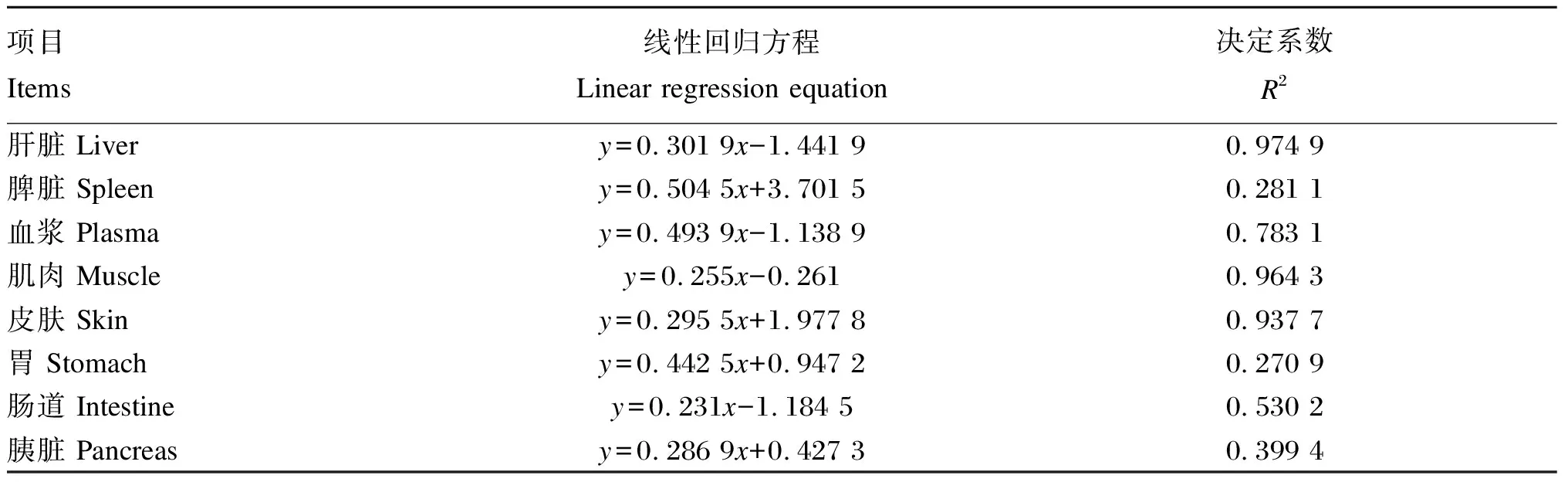
表4 大鲵各器官组织和血浆维生素C含量与T-AOC线性关系
2.5 维生素C对大鲵各器官组织和血浆LZM活性的影响
由图5可知,随着饲料维生素C添加水平的提高,大鲵肝脏、肠道和胰脏LZM活性均呈现先提高后降低的变化趋势,并分别在D450组、D600组和D300组达到最大值,且显著高于对照组(P<0.05);血浆、胃和皮肤LZM活性均呈现先提高后趋于稳定的变化趋势,并分别在D450组、D750组和D600组达到最大值,且显著高于对照组(P<0.05);脾脏LZM活性呈现持续升高的变化趋势,其中D750组较对照组显著提高了44.14%(P<0.05);各组间肌肉LZM活性无显著差异(P>0.05)。大鲵各器官组织和血浆LZM活性具有较为明显的分布不均现象,各器官组织和血浆按LZM活性由高到低可排列如下:肝脏>血浆>肠道>胰脏、脾脏>胃>皮肤>肌肉。以2.3中各器官组织和血浆维生素C含量为横坐标,以各器官组织和血浆LZM活性为纵坐标,进行线性回归分析,结果见表5。由表可知,大鲵肝脏、血浆、皮肤、胃和肠道中的维生素C含量与LZM活性有强相关性(R2>0.64),脾脏、肌肉和胰脏中的维生素C含量与LZM活性有弱相关性(0.09≤R2<0.64)。
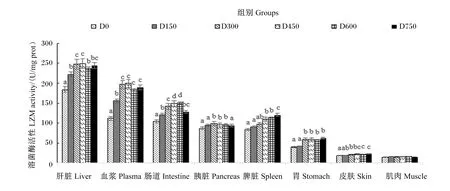
图5 维生素C对大鲵各器官组织和血浆LZM活性的影响
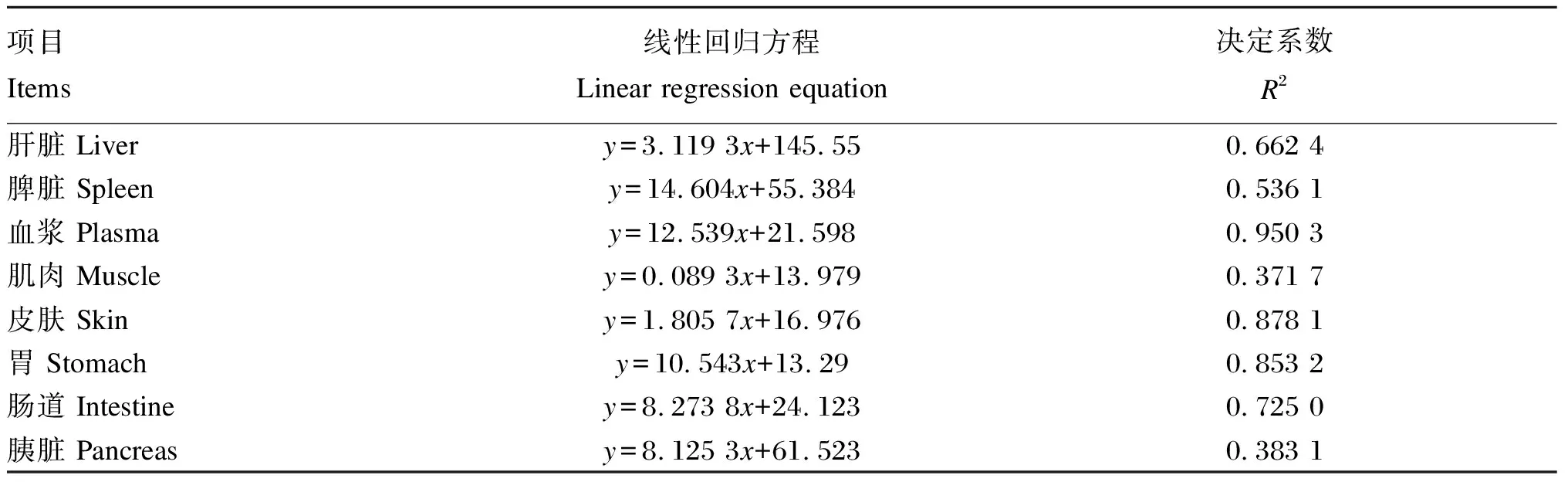
表5 大鲵各器官组织和血浆维生素C含量与LZM活性线性关系
3 讨 论
3.1 维生素C对大鲵生长性能的影响
已有研究发现,饲料中添加维生素C能显著增强银鲳(Pampusargenteus)[14]、大黄鱼(Larimichthyscrocea)[15]和尼罗罗非鱼(Oreochromisniloticus)[16]等鱼类的生长性能。本试验结果发现,维生素C对大鲵各项生长性能指标影响的变化趋势基本一致,饲料添加维生素C能显著提高大鲵WGR和PER,其原因可能是由于维生素C可以促进鱼类体内蛋白质的合成和代谢,促进肌肉生长和发育[17],并且维生素C能够增强大鲵的抗氧化能力,从而减少应激对其产生的负面影响,进而提高大鲵的生长性能和饲料利用率。不过,当维生素C添加水平超过300 mg/kg时,大鲵的生长性能并无显著变化,有些指标随着维生素C添加水平的提高反而略有下降,但没有表现出显著性差异,这与Henrique等[18]的研究结果类似。此外,未添加维生素C的对照组和低水平添加组大鲵未见有维生素C缺乏症产生。研究表明,在饲料不添加维生素C的情况下,许氏平鲉(Sebastesschlegeli)在12~16周时才表现出维生素C的缺乏症[19],本试验中对照组虽未出现较为明显的缺乏症,如皮肤腐烂出血、死亡等症状,但出现了明显的生长性能低下、FCR较高以及血浆抗氧化和免疫能力低下、T-AOC及LZM活性较差于维生素C添加组的现象,推测可能与本试验中的维生素C添加水平并未过量或与养殖周期较短有关。究竟维生素C缺乏能否引起大鲵外表缺乏症状出现,还有待进一步研究证明。
3.2 维生素C对大鲵血液指标的影响
血液中白细胞和血栓细胞数量以及血红蛋白含量与生物体的健康状况关系密切。维生素C对大鲵血液指标的影响是通过抑制白细胞的氧化破坏,增强其流动性以发挥更强的免疫功能[2]。本试验中,当维生素C添加水平为300~450 mg/kg 时,大鲵血液中白细胞数量明显高于对照组,但无显著性差异。临床医学研究表明,维生素C作为强还原剂可对体内血红蛋白的形成予以促进,使血红蛋白含量增高,进而增强综合疗效。Hamre等[20]报道,饲料中添加适宜水平的维生素C可以提高大西洋鲑(Salmosalar)血液中血红蛋白含量,这与本试验的研究结果一致。大鲵血液细胞中的血栓细胞具有凝血作用,其来源目前还没有定论,在大鲵的造血器官发育中,还没有找到其发育的证据[21]。本试验中,饲料添加维生素C能够显著提高大鲵血液中血栓细胞数量,表明饲料中添加维生素C能显著提高血液中的血栓细胞数量。
血浆中的一些脂质参与机体内脂质的转运,如TG、胆固醇等,这些物质能及时反映出机体脂代谢的变化,指示各种异常代谢及病理的相关变化。本研究中,大鲵血浆GLU、TG、TC、HDL-C和LDL-C含量并不受饲料维生素C添加水平的影响,说明饲料中添加维生素C对大鲵血浆脂类转运促进作用不明显。但在大口黑鲈(Micropterussalmoides)[22]中报道,维生素C对血液中脂类的转运有积极作用。猜测出现这种不同结果的原因可能是由于养殖品种和试验方法的不同有关。
T-SOD是一种重要的抗氧化酶,它可以通过自身的催化歧化作用将2个过氧化物自由基转化为水(H2O)和氧气(O2),从而起到清除有害活性氧的作用,是反映鱼类抗氧化能力的重要指标。本研究发现,当维生素C添加水平大于150 mg/kg时,相较于对照组,大鲵血浆T-SOD活性显著升高,这与在军曹鱼(Rachycentroncanadum)[23]中的研究基本一致。此外,本试验中,大鲵血浆MDA含量随着维生素C添加水平的提高呈现先降低后略微升高的趋势,最小值位于D300组。MDA含量不仅可以判定机体脂质过氧化程度,也可间接反映自由基侵害的程度以及生物活性和抗氧化能力的强弱。本试验发现,适宜添加水平的维生素C可以增强机体代谢MDA的能力,在尼罗罗非鱼[24]上的研究中也得到相同的结果,说明饲料中添加维生素C可以提高大鲵的抗氧化能力。
AKP能够通过改变病原体的表面结构,增强被侵袭机体对病原体的识别和吞噬能力,因而有助于提高鱼体的抗病力。ACP是高等动物体内巨噬细胞溶酶体的标志酶,是溶酶体的重要组成部分,在血细胞进行吞噬和包囊反应中,会伴随有ACP的释放。在体内跟AKP一样,ACP参与磷酸基团的转移和代谢。本研究中,大鲵血浆ACP和AKP活性均随着维生素C添加水平的提高均呈现先提高后降低的变化趋势,这与在半滑舌鳎(Cynoglossussemilaevis)[25]上的研究结果基本一致。
3.3 维生素C对大鲵各器官组织和血浆维生素C含量的影响
饲料中维生素C的添加水平直接影响鱼体组织中维生素C的积累,且不同组织对维生素C的积累量存在一定的差异[26]。研究表明,维生素C在鱼体组织中积累量由高到低的顺序以此为脑、肝脏、肌肉和肠道[27]。本试验以大鲵为研究对象,做了较为全面的检测,除肝脏、肌肉及肠道外,还检测了血浆、胰脏、脾脏、皮肤以及肌肉,结果表明,各器官组织和血浆中维生素C含量均随着饲料中维生素C添加水平的提高呈现先提高后趋于稳定的变化趋势,且在D0组~D600组各器官组织和血浆按维生素C含量由高到低可排列如下:肝脏、肌肉、肠道、血浆、胰脏、胃、脾脏、皮肤;而在D750组,脾脏维生素C含量超越了胃和胰脏,有关肝脏、肠道和肌肉中的维生素C含量变化与前人研究结果[27]类似,其余组织维生素C含量比较暂未见报道。本试验中,当饲料维生素C添加水平高于300 mg/kg时,大鲵各器官组织和血浆维生素C含量趋于平稳,表明鱼体各组织对维生素C的积累能力是有限的,当到达一定限度后,机体会降低对维生素C的吸收速率。大量研究证明,肝脏维生素C的含量是推算维生素C需求量最可靠的指标。本试验中,大鲵肝脏对维生素C含量在饲料维生素C添加水平为300~450 mg/kg时达到饱和状态,进一步推测大鲵对维生素C的需求量为300~450 mg/kg。
3.4 维生素C对大鲵各器官组织和血浆T-AOC的影响
T-AOC是反映机体抗氧化水平的重要指标之一。大鲵在人工养殖过程中,易受外界环境影响,产生氧化应激。维生素C是一种水溶性的抗氧化剂,可以中和自由基并给出电子,减少氧化应激对细胞和组织的损伤,在饲料中添加适宜水平维生素C可以提高大鲵体内的维生素C含量,增强抗氧化能力,减少氧化应激的损伤。明建华[28]在对团头鲂(Megalobramaamblycephala)的研究中发现,高水平维生素C可显著提高团头鲂肝脏T-AOC。本试验中,大鲵各器官组织和血浆T-AOC随着饲料中维生素C添加水平的提高基本呈现先提高后趋于稳定的变化趋势,与上述结果类似。此外,本试验中,饲料维生素C添加水平对大鲵各器官组织和血浆T-AOC的影响程度不同,猜测可能与不同组织中维生素C含量的不同有关。本试验通过对各器官组织和血浆维生素C含量与T-AOC进行线性回归分析得出,大鲵各器官组织和血浆维生素C含量与T-AOC确实存在一定的正相关性,这与上述研究结果基本一致。
3.5 维生素C对大鲵各器官组织和血浆LZM活性的影响
许多报道证实,水产动物血清及其他特定组织中都有LZM的存在,其作为吞噬细胞的一种碱性蛋白,主要通过降解细胞壁中的黏多糖,在鱼类的非特异性免疫中起着消炎、抗菌和我保护的作用[29],且LZM在不同组织中的活性是不同的[30]。本试验中,大鲵各器官组织和血浆LZM活性随着饲料中维生素C添加水平的提高均呈现出不同程度的升高趋势,与上述结果基本一致。刘金兰等[31]研究澳洲银鲈(Bidyanusbidyanus)和鲫鱼(Carassiusauratus)不同组织和血清LZM活性从高到低依次为肾脏、血清、肠、脾脏、鳃;而黄颡鱼(Pelteobagrusfulvidraco)和黄鳝(Monopterusalbus)不同组织和血清LZM活性从高到低依次为肾脏、脾脏、肠黏膜、血清、鳃、体表黏液,表明不同的鱼类其不同组织器官LZM活性不同,但亲缘关系较近的鱼类组织间LZM活性相近,这与本试验结果相吻合。本试验通过对各大鲵各器官组织和血浆维生素C含量与LZM活性进行线性回归分析得出,大鲵各器官组织和血浆维生素C含量与LZM活性确实存在一定的正相关性。
4 结 论
① 饲料添加适宜水平维生素C可提高大鲵WGR和PER,降低FCR;分别以WGR和FCR为评价指标,大鲵饲料中维生素C适宜添加水平分别为311.73和320.53 mg/kg。
② 饲料添加适宜水平维生素C可提高大鲵机体抗氧化能力,并提高各器官组织和血浆维生素C含量、T-AOC和LZM活性。
③ 大鲵不同器官组织和血浆维生素C含量存在差异,由高到低其顺序依次为肝脏>肌肉>肠道>血浆>胰脏、胃、脾脏、皮肤,而各器官组织和血浆T-AOC和LZM活性也随之出现正相关变化。

