乙肝临床治愈:欣喜与期待
李亚萍,刘晨瑞,郝 苗,鲁 瑞,党双锁
李亚萍,刘晨瑞,郝苗,鲁瑞,党双锁,西安交通大学第二附属医院感染科 陕西省西安市 710004
0 引言
慢性乙型病毒性肝炎(chronic hepatitis B,CHB)是威胁人类健康的重要疾病.据世界卫生组织(World Health Organization,WHO)估计,全球有近1/3的人感染过乙型肝炎病毒(hepatitis B virus,HBV),中国目前慢性HBV感染者超过8600万人,感染人数仍位居全球首位[1,2].近年来更为我们值得关注的是,全世界约50%-80%的肝癌病例源于慢性HBV感染,且全球新发和死亡的肝细胞癌(hepatocellular carcinoma,HCC)病例中超过一半来自中国[3].在我国,更有超过84%的HCC是由HBV感染导致的[4],HBV感染者发生肝癌的风险是未感染人群的10-30倍[5].因此,对于慢性乙肝的治疗与管理[6,7],延缓肝硬化的进展,减少肝癌的发生就是目前临床亟待解决的优先问题.从2015年起中国慢性乙肝防治指南,提出追求慢乙肝临床治愈设想,国内外众多学者开启了积极探索,到今天为止我们不难找到临床治愈相关研究项目报道,成绩令人欣喜.中国指南2019年版到2022年版也在乙肝临床治愈方面不断更新.至此,慢乙肝临床治愈已然从理想走向现实.但在临床上乙肝治愈欣喜的同时仍有相当一部分的患者还不能实现治愈的目标,要达到较好治疗效果仍有诸多难题需要跨越.
1 临床治愈概念的提出
乙肝的临床治愈探索,必然要从乙肝的抗病毒谈起.众所周知,乙肝抗病毒治疗主要包括两类药物:一是核苷(酸)类药物,另一类是干扰素.1997年随着核苷(酸)类似物(nucleos(t)ide analogues,NAs)的问世、上市,为乙肝抗病毒带来翻天覆地的变化.我们几乎可以说核苷类药物的使用开启了乙肝抗病毒治疗的新纪元,从此CHB的治疗步入抗病毒治疗时代.经过近30年的更新迭代,如今的NAs具有疗效确切、耐药率低、长期不良反应少,且价格可以接受等多种优势.大部分CHB患者在服药期间都可以实现长期病毒学抑制,以改善长期结局[8,9].然而总结大量应用NAs临床数据后发现,NAs对乙肝表面抗原(hepatitis B surface antigen,HBsAg)的清除作用十分有限,年清除率不足1%.但即使如此,这个不足1%的HBsAg的清除率给肝病的学者们燃起乙肝临床治愈的希望.事实上[5],如果真正在单用核苷类药物实现共价闭合环状DNA(covalently closed circular DNA,cccDNA)清除需要至少30到40年[10],换句话说也就是患者几乎要终生服用药物.
2013年Block等学者[11]展开了对CHB“治愈”概念的讨论,然而人们发现即便是急性HBV感染后自发清除的人群,其死于HCC的风险仍然高于未感染过HBV的人群.显然单用“治愈”描述CHB的治疗结果有些局限.因此该学者也率先提出了“功能性治愈(明显病毒学治愈)”概念,即HBsAg的清除和HBV DNA的持续抑制.至此,CHB治愈的类型也被划分为完全治愈(又称为病毒学治愈)和功能性治愈(又称为临床治愈或免疫学治愈)[12].而完全治愈是指血清HBsAg清除,肝内和血清HBV DNA清除(包括肝内cccDNA和整合HBV DNA),血清抗-HBc持续阳性,伴或不伴抗-HBs出现,而由于HBV感染后产生的cccDNA结构稳定且持续存在,且HBV基因组可整合至宿主DNA中,目前缺乏针对cccDNA及整合HBV DNA的特异性靶向药物,所以完全治愈难以实现.相比之下,临床治愈则更容易实现,目前用于临床的一线抗病毒药物NAs和干扰素均有达到临床治愈的可能,因此临床治愈也逐渐成为CHB患者治疗的目标.
2 干扰素的使用助推慢乙肝临床治愈进程
干扰素是广谱抗病毒药物,在乙肝抗病毒治疗中也不会缺席.迄今为止干扰素治疗乙肝已有50余年历程.随着干扰素生产工艺的不断更新,干扰素治疗乙肝也经历了一条曲折的路径.最初短效干扰素在使用时由于疗效有限,副作用大,价格不菲,在尝试使用数年后人们对其疗效极其不满意.直至NAs出现后,大多数临床医生都放弃使用短效干扰素.直到聚乙二醇化干扰素(peg-interferon,Peg-IFN)上市,干扰素这才引起学者和临床医生的关注与使用.2015年,Marcellin等[13]首次报道了以HBsAg清除或血清学转换为治疗目标的研究结果,显示Peg-IFNα联合替诺福韦二吡呋酯(tenofovir disoproxil,TDF)治疗48周HBsAg清除率可达9.1%.这一结果远高于NAs药物临床使用效果,立即在学术界引起轰动,至此人们对乙肝临床治愈目标的追求变得可能.后来的国内外学者开展一些的临床观察研究,发现在某些特定条件下对某些优势人群采用干扰素与NAs联合可以使HBsAg清除率达到40%-55.6%.由此有理由相信乙肝临床治愈已经向我们走来.下表整理了近年来基于Peg-IFNα的不同治疗策略的一些代表性临床治愈研究(表1).
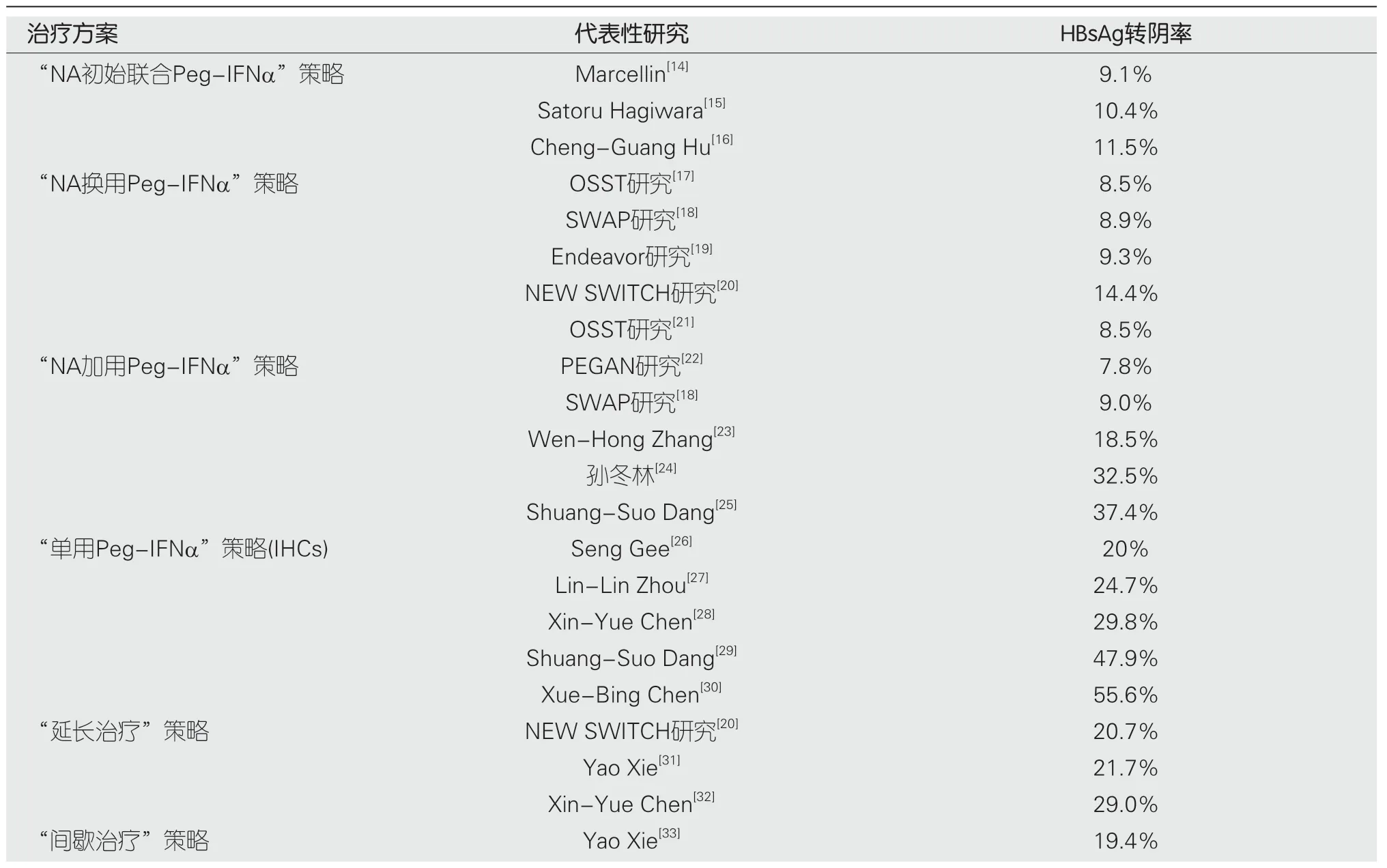
表1 CHB患者基于Peg-IFNα治疗后实现临床治愈的相关研究
3 乙肝临床治愈百花齐放,各显神通
3.1 慢性乙肝临床治愈的实践:不同人群的治愈现状
3.1.1 干扰素治疗的优势人群以及非优势人群的临床治愈难题:Peg-IFNα目前在CHB患者中的总体的临床治愈率仅接近10%,虽然远高于NAs的1%,但其结果仍然不甚理想.研究发现在部分人群中,患者使用Peg-IFNα治疗后的临床治愈率显著高于其他CHB患者.Peg-IFNα治疗的优势人群主要指经NAs治疗1年以上,HBsAg低水平(尤其≤1500 IU/mL)、HBeAg阴性且HBV DNA<2000 IU/mL的患者.我国目前开展的“珠峰项目”、“乙肝脱帽项目”等研究都聚焦Peg-IFNα优势人群,临床治愈率可达30%以上[25].对于非活动性HBsAg携带状态患者(inactive hepatitis B virus carrier,IHC),亚太、欧美指南一致认为IHC患者不建议治疗[34-36].而近年来国内的研究发现,国内IHC人群已经超过3000万[37],且随着年龄的增长,IHC人群发生HBV再激活、肝硬化甚至肝癌的风险仍较高,台湾一项研究纳入1965例IHC患者并平均随访11.5年,其中16%出现HBV再激活,且出现HBV再激活的患者在20年间肝硬化累积发生率高达46%,所有受试者25年肝硬化累积发生率达15%[38].且还有研究发现IHC患者中14%-24%可能进展为HBeAg阴性CHB,近20%可能逆转至HBeAg阳性,25%-62%的IHC患者存在中重度肝脏纤维化改变,3.3%-62%存在中重度肝脏炎症,甚至有10%左右存在肝硬化[39].人种不同可能是造成中国和欧美国家研究结果大相径庭的主要原因.因此近年来对IHC患者的治疗观点发生了明显变化.IHC人群的定义恰好符合Peg-IFNα优势人群的范畴,因此多项研究尝试IHC患者使用Peg-IFNα治疗并成效显著,我中心前期纳入的142例低HBsAg定量Peg-IFNα初治CHB患者中,使用Peg-IFNα 72周后HBsAg清除率可达47.9%[29],荟萃分析发现IHC人群48周总体HBsAg清除率可达47%,结果令人欣喜和振奋.这也说明选择合适的CHB患者进行含Peg-IFNα的治疗能将干扰素优势最大化.
干扰素非优势人群的临床治愈之路该何去何从?当前众多研究者试图拓宽临床治愈人群的研究范围以追求CHB患者的临床治愈的最大化,因此也开始着手非优势人群的临床治愈研究.在非优势人群中的临床治愈项目如“启航项目”、“领航项目”、“绿洲项目”等也正在开展,免疫耐受期患者接受Peg-IFNα治疗后有超过40%的患者可实现HBsAg降至3000 IU/mL以下,这也说明免疫耐受的干扰素非优势人群也可以通过积极治疗逐渐转换为优势人群,有机会实现临床治愈这一更高目标[40].此外,HBeAg阳性初治慢乙肝患者采用基于PEG-IFNα治疗的临床治愈率虽然低于NAs经治优势患者,但是结果却显著优于NAs单药治疗[41].也就是说临床中,对于这些非优势患者,是否有更佳的治疗策略来提升其治愈率,目前也在积极的探索中,如定目标不定疗程的策略、间歇治疗策略等.
3.1.2 特殊人群的乙肝临床治愈:儿童CHB患者的临床治愈研究也取得了突破性进展,儿童CHB患者在经过抗病毒及Peg-IFNα治疗后HBsAg清除率显著提高,开始治疗的年龄越小其临床治愈率越高[42,43],且治疗过程中发现儿童对Peg-IFNα治疗过程中耐受性良好,这一系列研究结果更加坚定了CHB临床治愈的信心.Kansu等[44]2006年的研究表明,拉米夫定(Lamivudine,LAM)与IFN初始联合与LAM 2月后序贯联合IFN相比,HBsAg清除率分别为12.5%、4.6%(P>0.05),关于儿童CHB患者抗病毒治疗获得高临床治愈率这一现象的机制迄今仍未阐明.随后众多真实世界临床研究也显示,儿童CHB抗病毒治疗应答率高,特别是幼龄CHB患儿具有临床治愈的优势因素,越早进行抗病毒治疗,治愈率越高[45].儿童CHB抗病毒疗效和临床治愈率令人鼓舞,为更多CHB临床治愈带来希望.
HBV感染的产妇在分娩后的机体往往处于特殊免疫激活状态,对这部分患者的临床研究也越来越多:国内一项研究纳入HBeAg阳性的产妇,依据患者意愿在孕晚期予以抗病毒治疗,并在产后立即停药,结果发现孕期无论抗病毒与否,产妇产后ALT水平显著升高,且有40%出现肝脏急性炎症[46];还有研究纳入45例合并CHB的产妇,结果发现,24.4%出现ALT急性升高,11.8%获得HBeAg清除,HBeAg阳性产妇产后可能出现免疫激活[47],这或许可以解释产妇产后ALT升高及肝炎的发生.随着胎儿的娩出,产妇的免疫抑制状态被解除,发生肝炎患者的CD8+T细胞及其记忆T细胞亚群和效应T细胞亚群激活,穿孔素和颗粒酶B表达水平升高,可能在破坏免疫耐受和导致肝炎发作中发挥重要作用[48],由此可见产后这一阶段可能是CHB产妇实现临床治愈的良好时机,配合Peg-IFNα治疗有望进一步提高临床治愈率.
3.1.3 临床治愈生物标志物的探索迫在眉睫:随着各种多中心临床研究的开展,Peg-IFNα在CHB患者群体中的使用变得更加普遍,但由于Peg-IFNα也存在一些不良反应,亟需找到某些指标预测Peg-IFNα治疗的效果.这样一方面能给CHB患者带来更多信心,帮助寻找适合Peg-IFNα治疗的人群,另一方面也能在疗效不佳时及时停药,将患者的利益最大化.而HBV DNA虽然可以作为抗病毒治疗的评价指标,但并不能很好预测HBsAg的清除,目前已经明确了3个早期预测指标:基线低HBsAg水平、治疗12/24周HBsAg快速下降、治疗12周ALT升高2倍以上.近年来,多种新型的血清标志物也被用于HBV治疗的疗效预测.HBV RNA由cccDNA转录而来,一定程度上可反映肝脏内cccDNA转录活性水平[49].国外研究发现HBV RNA在实现HBeAg清除的CHB患者中水平更低,且12/24周时的HBV RNA水平可以有效预测HBeAg清除[50],HBV RNA和HBeAg之间存在强正相关性[51].目前在CHB的临床治愈研究中,有研究表明HBV RNA可以作为Peg-IFNα治疗12周时临床应答效果的预测因子[52].一般在患者HBsAg清除时或巩固治疗24周后可考虑停药,但少数患者在停药后可能会出现病毒学复发,其原因可能是残存的cccDNA继续产生HBsAg,因此HBV RNA或许还可作为预测接受Peg-IFNα治疗后停药时机的标志物.
3.2 乙肝临床治愈的前景与期待:新药研究项目如火如荼
3.2.1 HBV感染的免疫发病机制或可作为扩大临床治愈的突破口:随着研究的深入开展,Peg-IFNα抑制和清除HBV实现临床治愈与宿主的抗病毒免疫应答密切相关,而能够预测治愈指标也越来越丰富,概括为三个方面:病毒学指标、生化学指标和免疫学指标.目前病毒学预测指标有HBsAg水平及降幅,HBeAg、HBV DNA、HBcrAg水平及降幅,基线HBV RNA水平等.封波教授团队发表的一篇综述指出更高敏定量的HBsAg清除可能更接近于CHB患者的完全治愈,使用高灵敏的HBsAg检测可能临床治愈持久性更佳,可能作为完全治愈替代标志物[53],但是这还需要更多的研究来探索和证实.生化学预测指标主要是ALT升高.免疫学预测指标有NK细胞、DC细胞、B细胞、滤泡辅助性T细胞、Treg细胞等.CHB是宿主免疫与病毒复制之间复杂的相互作用的结果,先天免疫和适应性免疫细胞均参与其中,机制复杂,而Peg-IFNα已被证实具有激活宿主先天免疫和适应性免疫应答的作用,有利于提高患者的HBsAg清除率.近年学者们在Peg-IFNα联合其他免疫策略实现更好地免疫应答方面做了喜人的成绩.有研究证实Peg-IFNα联合PD-1抑制剂可恢复甚至增强CD8+T细胞的细胞毒效应,具有协同抗肿瘤作用[54],胡鹏等[55]研究证实PD-1+CXCR5+CD8+T细胞不仅具有传统CD8+T细胞的功能,而且能够激活B细胞.PD-1在CXCR5+CD8+T细胞中未表现出耗竭表型.此外,CXCR5+CD8+T细胞对CHB患者病毒血症的控制发挥一定的作用,上述免疫细胞亚群可能为乙肝治愈提供潜在的免疫治疗靶点,相信随着免疫机制的不断探索、新免疫靶点的不断被发现,乙肝治愈的策略将更为丰富.总之临床中诸多因素可影响Peg-IFNα的应答转归,明确Peg-IFNα应答效果的影响因素,尤其是宿主免疫机制的影响将对Peg-IFNα的临床应用具有重要指导意义.
2019年Gane等[56]首次尝试给HBeAg阴性的CHB患者使用PD-1抑制剂纳武单抗,结果发现治疗12周时纳武单抗0.3 mg/kg患者无论是否加用HBV治疗性疫苗,患者HBsAg较基线时平均下降0.3 log10 IU/mL,治疗24周时,纳武单抗0.3 mg/kg患者HBsAg较基线时平均下降0.48 log10 IU/mL.该试点研究首次证明了免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)在非肿瘤慢性HBV感染者中的疗效及安全性,也证明ICIs可以恢复慢性HBV感染患者的HBV特异性免疫反应.有研究提出反复注射IFN也有可能诱导PD-L1的表达,反而可能进一步抑制T细胞功能,IFN-α/γ可诱导肝癌细胞及肝细胞PD-L1的表达,IFN-α/γ-STATA1-PD-L1通路在介导肝脏微环境中介导T细胞低反应性和灭活肝脏浸润的T细胞方面发挥着重要作用[57,58],这种效应被称之为“适应性抵抗”,为机体的自我保护机制,然而这种机制并不利于HBV的清除.因此有学者提出将PD-1抑制剂与Peg-IFNα联用,达到解除免疫抑制,增强对HBsAg的清除作用.国内有学者在小鼠中的研究发现抗-PDL1-IFNα异源二聚体能够增强树突状细胞(DCs)的功能,打破免疫耐受,与乙肝疫苗联合治疗可诱导CHB小鼠产生持久的抗-HBs免疫应答,有望实现持久的HBsAg清除.然而目前在CHB患者中,尚无ICIs联合Peg-IFNα的临床研究,但基于上述研究打下的基础,相信ICIs联合Peg-IFNα或许会在Peg-IFNα的基础上实现更多CHB的临床治愈.
由于HBV的清除与T细胞功能密切相关,近年来针对T细胞本身的改造和利用在HBV临床治愈领域也燃起了更多希望,其中引人注意的是工程化T细胞过继回输技术.该技术是指从患者血液中获得T细胞,通过HBV特异性受体的基因转移技术,对T细胞表面HBV特异性受体改造后进行体外扩增,并将扩增后的工程化T细胞重新输注到患者体内发挥免疫效应的技术[59].目前用于HBV治疗的工程化T细胞主要有2种改造方式-即嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)和特异性T细胞受体(T cell receptor,TCR)改造的T细胞[60-62].有研究发现合并CHB的白血病患者在接受来自具有HBV特异性T细胞应答的捐献者(接种疫苗或HBV自发清除者)的骨髓移植后发生了HBV清除[63,64],还有类似的研究发现在具有HBV特异性适应性免疫的受试者中移植HBsAg阳性肝脏后亦出现HBV清除,且HBV特异性细胞和体液免疫反应增加[65].上述研究均表明过继转移工程HBV特异性T细胞的免疫恢复治疗策略有望成为CHB患者实现临床治愈的新突破.
3.2.2 基于靶向病毒生命周期药物的研发加速乙肝临床治愈进程:现有的药物尚无法彻底清除cccDNA和整合宿主基因的HBV DNA,而目前已经在临床中使用的抗乙肝病毒药物的治疗方案疗效也有限.因此,关于HBV治疗的研究项目和新药也在如火如荼的进行着.在对HBV的生命周期的认识越来越深刻后,药物的研发也开始着手HBV复制的整个过程.目前正在研发的抗HBV药物主要在HBV感染肝细胞并复制的过程中实施阻断抑制,即靶向病毒生命周期发挥抗病毒作用.主要从以下几类机制发挥作用:(1)HBV进入抑制剂:阻断HBV进入肝细胞;(2)核酸聚合物NAPs:抑制肝表面抗原HBsAg的产生;(3)NAs:干扰HBV DNA复制所需的DNA聚合酶,为常见抗病毒口服药物;(4)干扰转录后调控:干扰或抑制HBV的RNA,阻止病毒翻译,起到该机制的药物主要包括RNA干扰(RNA interference,RNAi)及反义寡核普酸(antisense oligonucleotide,ASO);(5)衣壳抑制剂:干扰HBV的蛋白外壳,阻止病毒组装;(6)HBsAg释放抑制剂(图1).

图1 基于靶向病毒生命周期药物的研发.HBV:乙型肝炎病毒;NTCP:牛磺胆酸钠协同转运多肽;cccDNA:共价、闭合、环状DNA;RC DNA:松弛环状DNA;dslDNA:双链线性DNA;pgRNA:前基因组RNA;MVB:多囊体;HBsAg:乙型肝炎表面抗原;HBx:乙型肝炎病毒x蛋白.
4 临床治愈到完全治愈,还有多远?
Peg-IFNα可以从HBV复制的多个环节发挥抗病毒活性,例如在HBV pgRNA逆转录生成HBV DNA的过程中,Peg-IFNα可增强APOBEC3胞苷脱氨酶和干扰素刺激基因的表达,广泛诱导核酸G到A突变和cccDNA降解,从而阻断HBV DNA复制[66,67],消耗cccDNA库;还可诱导下调HBV RNA的合成,促进pgRNA的降解[68,69],这些机制说明Peg-IFNα的使用一定程度上可以促进CHB的完全治愈.然而HBV感染完全治愈的核心旨在清除包括肝内cccDNA和整合HBV DNA在内的所有HBV基因,Peg-IFNα对cccDNA虽然有一定作用,但还是十分有限.而近些年发展壮大的基因编辑技术带来了HBV的完全治愈的曙光.CRISPR(簇状规则间隔短回文重复序列)是原核生物基因组中的一个重复片段,其主要作用是通过Cas9这种酶将整合在原核生物基因组中的病毒源性DNA片段切除,最初在细菌中被发现,是一种细菌为抵抗病毒入侵产生的特殊基因编辑方法.很快,CRISPR-Cas9便成为一种突破性的基因编辑工具,用于治疗多种疾病,其中就包括HBV感染.通过设计与靶DNA序列互补的向导RNA,CRISPR-Cas9系统便可以定向且特异性地切割目标DNA基因组,导致DNA位点特异性的双链断裂,断裂后的两个断端会诱导易错非同源末端连接,且通常会导致移码突变,因此所得基因产物往往是非功能性的截短蛋白,最终结果就是靶DNA基因组的失活[70,71].然而CRISPR-Cas9技术在用于临床之前还需解决潜在挑战.面对挑战,目前也在对CRISPR-Cas9技术不断改进中,用CRISPR介导的基因编辑技术彻底清除所有HBV基因组达到完全治愈,可能也是征服慢性HBV感染的有力工具.
5 结论
总之,不论是在CHB临床队列研究、基础研究、新药研发,优势人群及非优势人群,疗效预测和评估指标,还是抗病毒与免疫调节联合治疗方案及个体化治疗等众多方面仍存在亟待解决的问题和挑战.但CHB的临床治愈仍是值得我们欣喜的可实现的理想治疗目标,未来乙肝完全治愈需要多种药物的组合,相信随着基础与临床研究的不断深入,消除HBV对人类健康的威胁将不再遥远,期待更多的数据和结果.

