绿原酸抑制巨噬细胞激活的机制研究Δ
郑薇 ,郎静 ,黄西凤 ,肖锐 ,白荷 ,贾济 #(.中国人民解放军南部战区总医院麻醉科,广州 5050;.中国人民解放军西部战区总医院骨科,成都 60083)
巨噬细胞过度激活与多种炎症相关疾病的发生发展密切相关,包括川崎病、自身免疫性肝病、肾病和心肌疾病等[1—3]。巨噬细胞过度激活后,可释放多种促炎性细胞因子,包括肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)和IL-6等。上述促炎性细胞因子可通过血液循环损伤体内多个脏器,继而造成脏器功能受损,甚至危及生命[4]。因此,可通过抑制巨噬细胞的过度激活,降低炎症反应水平,进而控制相关疾病的发生发展[5]。
绿原酸是富含于中药金银花中的一种苯丙素类化合物,具有抗炎、抗氧化、抗过敏和利胆等药理作用[6]。目前,关于绿原酸的相关研究多聚焦在抑制炎症反应方面。有研究报道,绿原酸的抗炎机制包括抑制巨噬细胞/小胶质细胞激活和调节p38分裂原激活的蛋白激酶/Toll样受体等细胞信号通路[7],但其详细抑炎机制尚不明确。骨髓细胞2表达的触发受体(triggering receptors expressed on myeloid cells-2,TREM2)是表达于巨噬细胞上的一种蛋白,可调控巨噬细胞激活程度,抑制炎症反应[8]。本研究使用经典致炎物质脂多糖(lipopolysaccharide,LPS)刺激小鼠RAW264.7巨噬细胞,模拟巨噬细胞激活[9],观察绿原酸对LPS所致巨噬细胞激活的影响和TREM2在其中的作用,为阐明绿原酸的抗炎机制提供实验室证据。
1 材料
1.1 主要仪器
Series 2型细胞培养箱购自美国Thermo Fisher Scientific公司;Infinite 200型酶标仪购自瑞士Tecan公司;Criterion型电泳仪和GelDoc Go型凝胶成像系统均购自美国Bio-Rad公司;FV10i型共聚焦显微镜购自日本Olympus公司。
1.2 主要药品与试剂
绿原酸原料药(批号327-97-9,纯度>95%)、DMEM细胞培养基(批号D5796)、胎牛血清(批号9014-87-7)、二甲基亚砜(dimethyl sulfoxide,DMSO)(批号67-68-5)和MTT(批号298-93-1)均购自美国Sigma-Aldrich公司;TNF-α、IL-1β和IL-6促炎性细胞因子检测试剂盒(批号分别为20220314、20220517、20220418)均购自中国南京建成生物工程研究所;兔抗小鼠诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)(批号ab178945)、核因子κB p65(nuclear factor κB p65,NF-κB p65)(批号ab32536)一抗和山羊抗兔IgG预吸附二抗(批号ab7090)均购自英国Abcam公司;TREM2小干扰RNA(TREM2-small interfering RNA,TREM2-siRNA)(批号HU079401)、乱序-siRNA(SC-siRNA,批号SIC001)和转染液(批号L3287)均购自瑞士Qiagen公司;Cy3标记的山羊抗兔荧光二抗(批号A0516)和青链霉素混合溶液(批号C0223)均购自中国碧云天生物技术有限公司。
1.3 细胞系
实验用小鼠RAW264.7巨噬细胞系获赠于中国科学院上海生命科学研究所。RAW264.7巨噬细胞在DMEM细胞培养基中培养,培养基含10%胎牛血清、10 U/mL的青霉素和10 μg/mL的链霉素。培养箱内空气含95%O2和5%CO2,温度为37 ℃,湿度为100%。每2~3 d更换培养基1次,每周以1∶4的比例传代2次。取对数生长期细胞进行后续实验。
2 方法
2.1 LPS造模浓度的筛选
2.1.1 细胞分组及处理
为确定适宜的LPS刺激强度,将细胞分为Control组和不同质量浓度(1、10、100 ng/mL,参考预实验结果设置)LPS处理组。细胞在含有上述药物的培养基/空白培养基内孵育24 h后,进行以下各项检测。
2.1.2 细胞培养上清液中IL-6水平的检测
将细胞接种于24孔板中,密度为5×105个/孔,24 h细胞贴壁后,按“2.1.1”项下方法分组(每组8个复孔)、给药、培养细胞,然后提取各孔细胞培养上清液200 μL置于离心管内,于4 ℃下5 000 r/min离心30 min。离心结束后,吸弃上清液150 μL,根据IL-6试剂盒说明书检测IL-6水平。
2.1.3 细胞中iNOS蛋白表达水平的检测
采用Western blot法检测细胞中iNOS蛋白的表达水平。将细胞接种于6孔板中,密度为1×106个/孔,24 h细胞贴壁后,按“2.1.1”项下方法分组(每组4个复孔)、给药、培养细胞。培养结束后,吸弃上层培养基,采用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗3次(5 min/次),然后每孔加入细胞裂解液500 μL,在4 ℃下裂解5 min,采用细胞刮将细胞收集至清洁的离心管内,在4 ℃下以12 000 r/min离心30 min后,收集上清液,采用Bradford法进行蛋白定量。取蛋白进行高温变性后,进行聚丙烯酰胺凝胶电泳(电压120 V,电泳时间2 h),并转移至聚偏二氟乙烯膜上(转膜电流200 mA,转膜时间2 h),加入5%脱脂奶粉封闭非特异性抗原,4 ℃孵育过夜;加入稀释的iNOS、GAPDH一抗(稀释比例分别为1∶500、1∶1 000),在37 ℃下孵育4 h;洗膜后加入山羊抗兔IgG预吸附二抗(稀释比例为1∶1 000),室温孵育60 min;使用化学发光法显色后,采用凝胶成像系统成像,使用Image Lab软件分析各条带的灰度值,以iNOS蛋白与GAPDH蛋白的灰度值比值表示iNOS蛋白的表达水平。
2.2 绿原酸给药浓度的筛选
2.2.1 细胞分组及处理
参考相关文献中的绿原酸浓度[10],将细胞分为Control组、LPS处理组(10 ng/mL,按“2.1”项下结果设置,下同)和不同浓度绿原酸干预组(培养基分别含0.01、0.1、1 μmol/L 绿原酸和10 ng/mL LPS),每组8个复孔。将细胞在含有上述药物的培养基/空白培养基中常规孵育24 h后,进行以下各项检测。
2.2.2 细胞培养上清液中TNF-α、IL-1β水平的检测
按“2.1.2”项下方法接种细胞,常规培养,待细胞贴壁后,按“2.2.1”项下方法进行细胞分组、给药与培养,然后根据TNF-α和IL-1β试剂盒说明书检测细胞培养上清液中TNF-α、IL-1β水平。
2.2.3 细胞中iNOS、TREM2蛋白表达水平的检测
采用Western blot法检测细胞中iNOS、TREM2蛋白的表达水平。按“2.1.3”项下方法接种细胞,常规培养,待细胞贴壁后,按“2.2.1”项下方法进行细胞分组(每组4个复孔)、给药、培养,按“2.1.3”项下方法进行指标检测。本实验中iNOS、GAPDH、TREM2、β-actin一抗的稀释比例分别为1∶500、1∶1 000、1∶200、1∶1 000。以iNOS蛋白与GAPDH蛋白的灰度值比值表示iNOS蛋白的表达水平,以TREM2蛋白与β-actin蛋白的灰度值比值表示TREM2蛋白的表达水平。
2.2.4 细胞活力的检测
采用MTT法检测细胞活力。将细胞接种于96孔板中,密度为1×105个/孔,待细胞贴壁后,按“2.2.1”项下方法进行细胞分组(每组8个复孔)、给药和培养。培养结束后,每孔加入MTT溶液(5 mg/mL)20 μL,37 ℃孵育4 h后;吸弃上层培养基,每孔加入150 μL的DMSO,振荡15 min,待甲瓒完全溶解后,取空白孔加150 μL蒸馏水作为空白组,在490 nm波长处使用酶标仪检测各孔吸光度,计算细胞活力。细胞活力(%)=(实验组吸光度-空白组吸光度)/(Control组吸光度-空白组吸光度)×100%。
2.3 TREM2在绿原酸抑制巨噬细胞激活中的作用考察
2.3.1 转染TREM2-siRNA对巨噬细胞中TREM2蛋白表达水平的影响
将细胞接种于6孔板中,密度为1×106个/孔。接种24 h后,吸弃上层培养基,每孔加入含90 pmol的TREM2-siRNA转染液1 mL,37 ℃孵育6 h后,吸弃上层转染液;PBS常温清洗3次,每孔加入细胞裂解液200 μL,裂解30 min后,收集细胞;按“2.2.3”项下方法检测细胞中TREM2蛋白的表达水平。实验重复4次。
2.3.2 细胞分组及处理
为观察TREM2在绿原酸抑制巨噬细胞激活中的作用,将细胞分为Control组、LPS处理组(10 ng/mL LPS)、绿原酸+LPS组[培养基含1 μmol/L绿原酸(按“2.2”项下结果设置)和10 ng/mL LPS]、TREM2-siRNA+绿原酸+LPS组(细胞经TREM2-siRNA处理后,再经1 μmol/L绿原酸和10 ng/mL LPS处理)和SC-siRNA+绿原酸+LPS组(细胞经SC-siRNA处理后,再经1 μmol/L绿原酸和10 ng/mL LPS处理),每组8个复孔。在含有上述药物的培养基/空白培养基中孵育24 h后,进行以下各项检测。
2.3.3 干扰TREM2表达后细胞培养上清液中TNF-α、IL-1β水平的检测
按“2.1.2”项下方法接种细胞,常规培养,待细胞贴壁后,按“2.3.2”项下方法进行细胞分组、给药,根据TNF-α、IL-1β试剂盒说明书检测细胞培养上清液中TNF-α、IL-1β水平。
2.3.4 干扰TREM2表达后细胞中iNOS蛋白染色情况的检测
将细胞接种于共聚焦显微镜专用培养皿中,密度为1×105个/孔。接种24 h后,按“2.3.2”项下方法分组处理,吸去上层培养基,每孔加入4%多聚甲醛溶液1 mL固定,30 min后,PBS清洗3次,5 min/次;随后,每孔加入1%牛血清白蛋白1 mL包被非特异性抗原,30 min后,PBS清洗1次;每孔加入iNOS一抗(稀释比例为1∶100),在4 ℃下孵育12 h后,PBS清洗3次,5 min/次;每孔加入Cy3标记的山羊抗兔荧光二抗(稀释比例为1∶100)200 μL,常温避光孵育90 min;随后,每孔加入100 μL的DAPI染液标记细胞核(蓝色),常温避光孵育5 min后,PBS避光清洗3次,5 min/次;采用共聚焦显微镜在532 nm波长处进行观测,并随机选取视野拍照。
2.3.5 干扰TREM2表达后细胞中TREM2、iNOS和NFκB p65蛋白表达水平的检测
按“2.1.3”项下方法接种细胞,常规培养,待细胞贴壁后,按“2.3.2”项下方法分组、处理,每组4个复孔。培养结束后,按“2.1.3”项下方法操作检测TREM2、iNOS和NF-κB p65蛋白表达水平,iNOS、GAPDH、TREM2、βactin、NF-κB p65一抗的稀释比例分别为1∶500、1∶1 000、1∶200、1∶1 000、1∶200。以iNOS蛋白与GAPDH蛋白的灰度值比值表示iNOS蛋白的表达水平,以TREM2、NFκB p65蛋白与β-actin蛋白的灰度值比值分别表示TREM2、NF-κB p65蛋白的表达水平。
2.4 统计学方法
实验数据采用SPSS 20.0软件进行分析处理。所有数据均采用±s表示,组间差异采用单因素方差分析和Tukey多重比较检验进行分析。检验水准α=0.05。
3 结果
3.1 LPS造模浓度的筛选结果
与Control组[(7.25±2.22) pg/mL]比较,10、100 ng/mL LPS处理组细胞培养上清液中IL-6水平[(121.80±8.85)、(126.30±8.65) pg/mL]均显著升高(P<0.05)。与Control组(0.12±0.02)比较,10、100 ng/mL LPS处理组细胞中iNOS蛋白表达水平(0.84±0.06、0.86±0.04)均显著升高(P<0.05),且10、100 ng/mL LPS处理组间细胞中iNOS蛋白表达水平比较差异无统计学意义(P>0.05)。因此,本研究选择质量浓度为10 ng/mL的LPS进行后续实验。iNOS蛋白表达的电泳图见图1。

图1 不同质量浓度LPS作用下巨噬细胞中iNOS蛋白表达的电泳图
3.2 绿原酸给药浓度的筛选结果
结果(图2)显示,与Control组比较,LPS处理组培养基中TNF-α、IL-1β水平显著升高(P<0.05);与LPS处理组比较,0.01、0.1、1 μmol/L绿原酸干预组细胞培养上清液中TNF-α、IL-1β水平均显著降低(P<0.05)。与Control组比较,LPS处理组细胞中iNOS蛋白表达水平显著升高(P<0.05);与LPS处理组比较,0.1 μmol/L绿原酸干预组细胞中iNOS蛋白表达水平显著降低(P<0.05);与0.1 μmol/L绿原酸干预组比较,1 μmol/L绿原酸干预组细胞中iNOS表达水平显著升高(P<0.05),结果见图3A。与LPS处理组比较,0.1 μmol/L绿原酸干预组细胞中TREM2蛋白表达水平显著升高(P<0.05),结果见图3B。此外,上述各处理组间细胞活力比较差异无统计学意义(P>0.05),结果见图4。以上结果表明,0.1 μmol/L绿原酸可显著抑制LPS对巨噬细胞的激活,并提高TREM2蛋白表达水平,且未对细胞增殖产生显著影响,故本研究选择浓度为0.1 μmol/L的绿原酸进行后续实验。
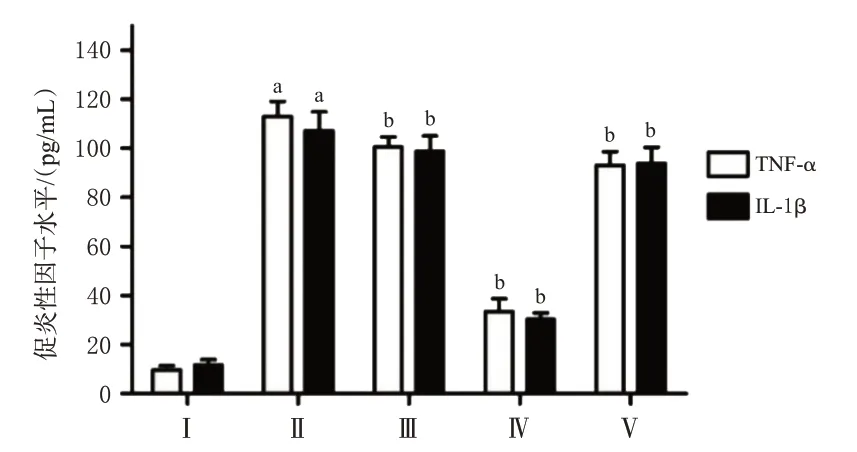
图2 不同浓度绿原酸对巨噬细胞中TNF-α、IL-1β水平的影响(±s,n=8)
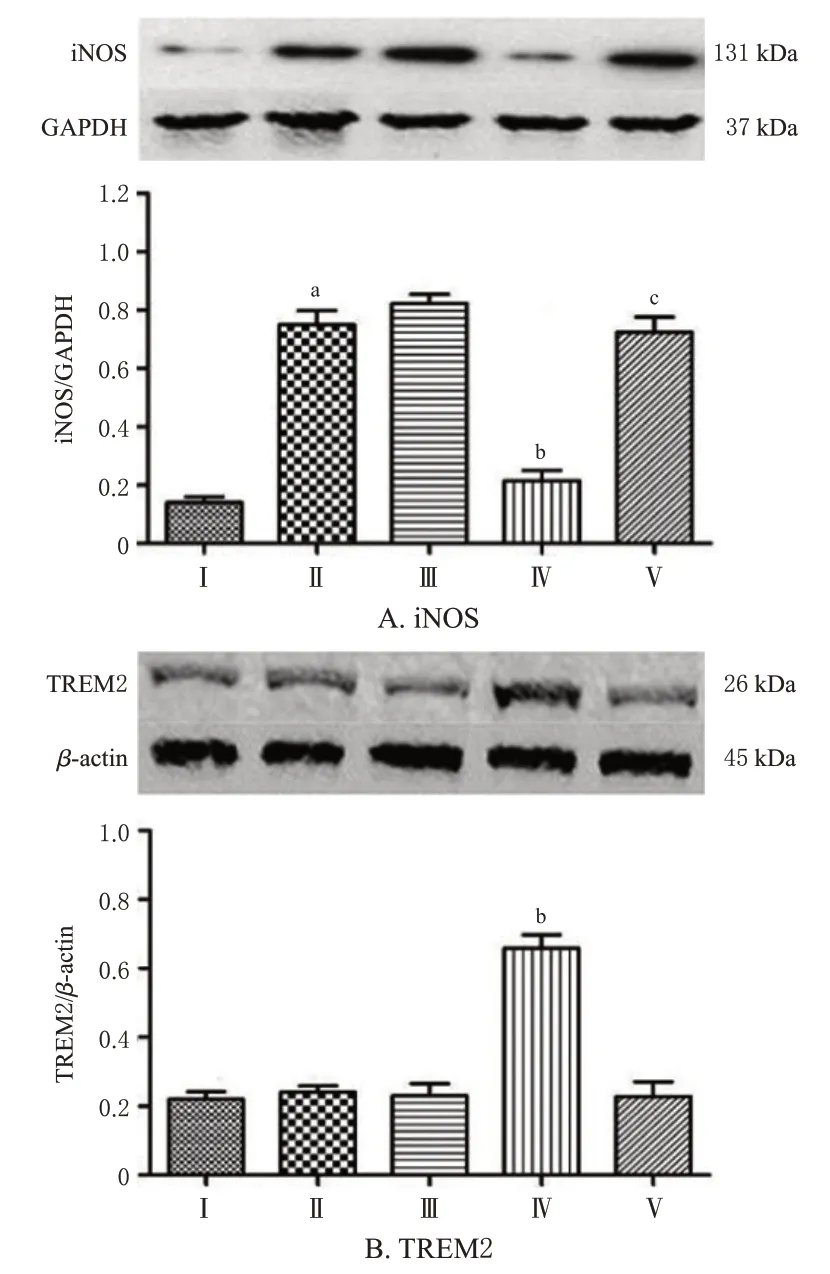
图3 不同浓度绿原酸对巨噬细胞中iNOS、TREM2蛋白表达水平的影响(±s,n=4)

图4 不同浓度绿原酸对巨噬细胞活力的影响(±s,
3.3 TREM2在绿原酸抑制巨噬细胞激活中的作用
3.3.1 转染TREM2-siRNA对巨噬细胞中TREM2蛋白表达水平的影响
结果(图5)显示,TREM2-siRNA可显著降低细胞TREM2蛋白表达水平(P<0.05),表明TREM2-siRNA的干扰有效,可用于后续实验。
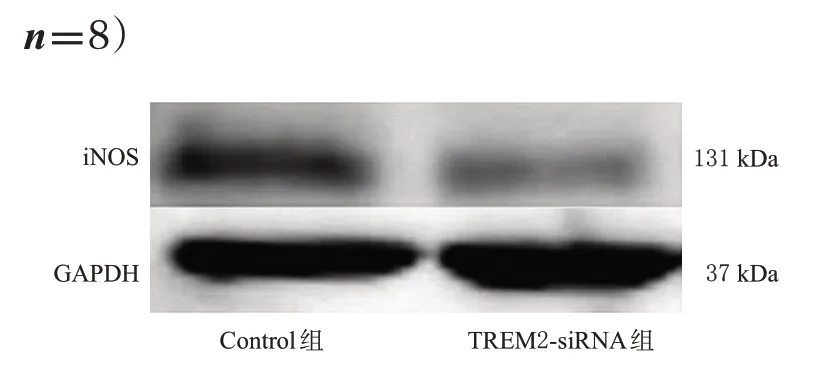
图5 转染TREM2-siRNA干扰细胞TREM2蛋白表达效果验证的电泳图
3.3.2 干扰TREM2表达后对TNF-α、IL-1β水平的影响
与Control组比较,LPS处理组培养基中TNF-α、IL-1β水平均显著升高(P<0.05);与LPS处理组比较,绿原酸+LPS组培养基中TNF-α、IL-1β水平均显著降低(P<0.05);与绿原酸+LPS组比较,TREM2-siRNA+绿原酸+LPS组细胞培养上清液中TNF-α、IL-1β水平均显著升高(P<0.05),而SC-siRNA未对绿原酸抑制TNF-α和IL-1β释放的作用产生显著影响(P>0.05)。结果见图6。

图6 干扰TREM2表达对TNF-α、IL-1β水平的影响(±s,n=8)
3.3.3 干扰TREM2表达对iNOS蛋白染色情况的影响
结果(图7)显示,LPS可明显增加巨噬细胞中iNOS蛋白表达水平(红色),绿原酸可明显降低iNOS蛋白表达水平,TREM2-siRNA显著逆转了绿原酸对iNOS蛋白表达水平的抑制作用,而SC-siRNA未对iNOS的蛋白表达水平产生明显影响。

图7 干扰TREM2表达对iNOS蛋白表达影响的免疫荧光染色图
3.3.4 干扰TREM2表达对TREM2、NF-κB p65和iNOS蛋白表达水平的影响
与Control组比较,LPS处理组细胞中iNOS和NFκB p65蛋白表达水平均显著升高(P<0.05);与LPS处理组比较,绿原酸+LPS组细胞中iNOS和NF-κB p65蛋白表达水平均显著降低、TREM2蛋白表达水平显著升高(P<0.05);与绿原酸+LPS组比较,TREM2-siRNA+绿原酸+LPS组细胞中iNOS和NF-κB p65蛋白表达水平均显著升高、TREM2蛋白表达水平显著降低(P<0.05),TREM2-siRNA明显逆转了绿原酸的上述作用;而SCsiRNA未对绿原酸产生的上述作用造成影响。以上结果表明,绿原酸可通过巨噬细胞TREM2介导,降低LPS引起的巨噬细胞激活。结果见图8、图9。
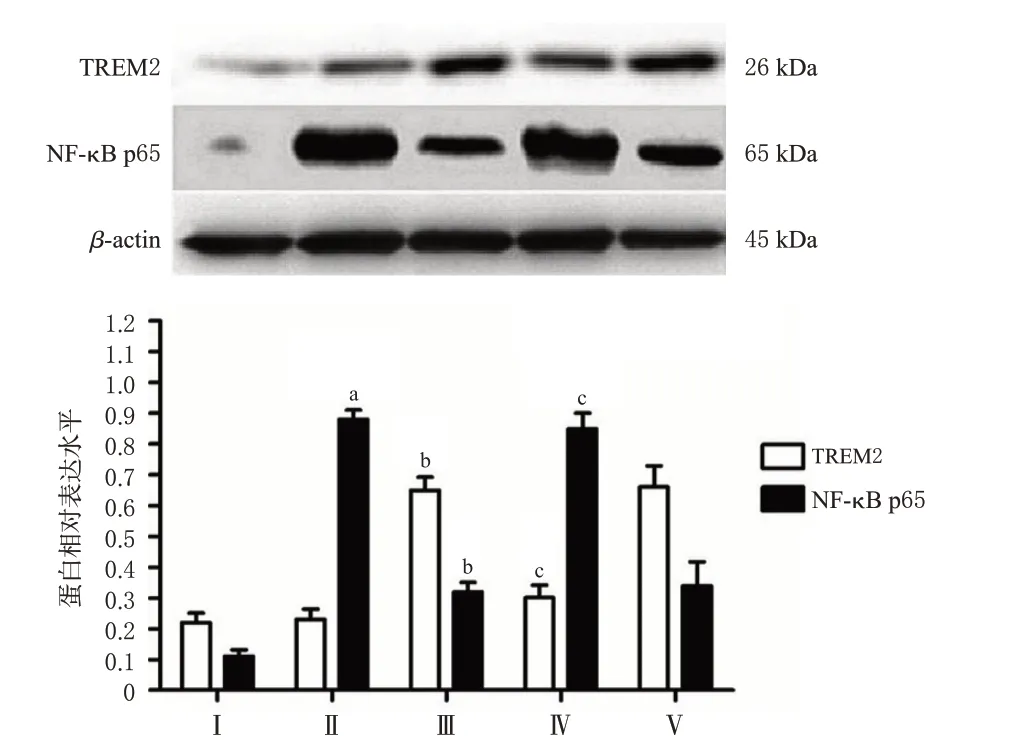
图8 干扰TRME2表达对TREM2和NF-κB p65表达的影响(±s,n=4)

图9 干扰TRME2表达对iNOS表达的影响(±s,n=4)
4 讨论
现代医学研究发现,绿原酸具有抗炎、抗肿瘤、抗氧化和心血管保护等作用[10],但目前其作用机制尚不十分明确,这也大大限制了绿原酸的临床应用。巨噬细胞是一种分布于人体血液循环和肺内的免疫细胞,在炎症反应过程中,巨噬细胞受到刺激后,可分泌大量促炎性细胞因子,如TNF-α、IL-1β和IL-6等,高浓度的促炎性细胞因子可增强人体内的炎症反应程度,对心、脑、肾、肝等多个脏器造成损伤。若巨噬细胞的引起的炎症反应得不到有效控制,可引起全身炎症反应综合征,甚至导致死亡[11]。因此,控制或抑制巨噬细胞的过度激活,被认为是治疗炎症相关疾病的关键环节。目前研究发现,巨噬细胞激活后可处于2种状态:经典激活状态(M1状态)和选择性激活状态(M2状态)。M1状态的巨噬细胞目前认为是有害的,而M2状态的巨噬细胞被认为是有益的。因此,将巨噬细胞调控至M2状态是治疗这类炎症反应相关疾病的关键环节[12—13]。本课题组使用LPS刺激巨噬细胞,引起细胞激活,观察使用绿原酸后对LPS引起巨噬细胞激活水平的影响。结果发现,绿原酸可显著减弱LPS对巨噬细胞的激活作用,降低巨噬细胞的炎症反应程度。促炎性细胞因子(如TNF-α和IL-6)分泌增加和iNOS蛋白表达上调,表明巨噬细胞处于M1激活状态;而绿原酸降低了巨噬细胞促炎性细胞因子分泌和iNOS蛋白表达水平,说明该药物减少了处于M1激活状态的巨噬细胞数量,具有明显的抗炎能力[14]。由于NFκB调控了很多炎症反应相关的基因,且巨噬细胞促炎性细胞因子分泌水平的高低,受NF-κB蛋白表达水平调控[14],因此,本研究检测了巨噬细胞中NF-κB p65的蛋白表达水平。结果发现,LPS刺激可明显升高巨噬细胞中NF-κB p65蛋白表达水平,而绿原酸可明显抑制LPS引起的NF-κB p65蛋白表达上调。以上结果表明,绿原酸可抑制LPS引起的巨噬细胞炎症反应。
髓样细胞触发受体(TREM)是在2000年被发现的一类免疫球蛋白超家族,目前已知TREM家族有3个成员,分别为TREM1、TREM2和TREM3[15]。其中,TREM1和TREM2是目前研究较多的2个TREM家族成员,其结构较为相似,但其功能大有不同——TREM1对炎症反应起着促进和放大的作用,而TREM2对炎症反应起着抑制的作用。研究表明,TREM2表达上调可抑制免疫细胞分泌炎症因子,减轻炎症损伤[16]。研究表明,TREM2基因敲除肺炎模型小鼠与野生型小鼠相比,前者肺炎的严重程度和死亡率显著降低,其机制可能是肺泡巨噬细胞上的TREM2基因敲除后,细胞吞噬能力显著增加,清除细菌等病原微生物的能力增强[17]。另一项研究表明,与巨噬细胞特性类似的小胶质细胞,其TREM2表达上调后,可显著抑制小胶质细胞激活,通过改善小胶质细胞激活状态,即降低M1状态的细胞数量,增加M2状态的细胞数量,减轻脑组织缺血后的炎症反应程度[17]。TREM2是调控炎症细胞(包括小胶质细胞和巨噬细胞)激活状态的重要靶点。早期研究提示,TREM2上调可抑制免疫细胞过度激活,从而抑制促炎性细胞因子分泌,最终降低炎症反应程度[7]。国外也有研究表明,TREM2可通过减轻巨噬细胞激活,减轻炎症反应[18]。在本研究中,研究者采用TREM2-siRNA干扰巨噬细胞的TREM2蛋白表达后,绿原酸在巨噬细胞中产生的抗炎作用被显著逆转。以上结果表明,绿原酸在LPS刺激下的巨噬细胞中产生的抑炎作用,可能是通过细胞上的TREM2蛋白介导的。
综上所述,绿原酸可显著抑制LPS对巨噬细胞的激活,其抗炎作用可能是通过巨噬细胞上的TREM2蛋白介导的。但本研究也有一些不足之处:首先,本研究采用巨噬细胞系作为研究对象,所得结论并非来源于动物或临床研究结果;其次,本研究仅观察了TREM2蛋白的作用,TREM1或TREM3在绿原酸抑制巨噬细胞激活中是否发挥了作用尚不明确。因此在后续研究中,还应采用更多实验对本研究结果进行进一步验证,并探索其更多的作用机制。

