骆驼乳及其制品中非热变性乳铁蛋白含量的快速电泳迁移检测
黄珍,李汉芳,路梦凡,徐丹,舒国伟,黄锐,徐秦峰
(1.陕西科技大学食品科学与工程学院国家羊乳制品加工技术研发专业中心,西安 710021;2.中垦华山牧乳业有限公司,陕西渭南 714000)
0 引言
骆驼乳由于富含乳铁蛋白、免疫球蛋白、溶菌酶等多种保护性蛋白[1-2],具有易于消化吸收、较高的抗菌性、优质的营养成分等多种优势,受到广大消费者的青睐。研究表明,骆驼乳乳铁蛋白(Camel lactoferrin,CLF)可通过与病毒颗粒或受体结合,抵抗病毒的侵袭,具有抗菌、抗氧化、抗癌等作用[3-5]。同时,CLF 对热敏感,热加工工艺会导致其变性,影响其抗微生物活性[6-8]。因此,检测驼乳及其制品中乳铁蛋白的含量对其营养价值的评估具有重要意义。目前,已经建立了多种CLF 的检测方法[9-14]。聚丙烯酰胺凝胶电泳作为一种常见的蛋白分离检测方法,可用于CLF 的分析,成本低但操作复杂、耗时[10,13-14]。高效液相色谱与质谱法联用其特异性、灵敏度、重复性等均能够满足CLF 的定量要求,但前处理复杂,对操作人员技术要求较高,测定结果包含了热变性CLF[12]。采用薄层色谱法可直接在骆驼乳中分离定量出乳铁蛋白,样品前处理简单,仅能用于CLF 半定量检测[11]。因此,依然需要发展操作简便、快速、准确的非热变性CLF 检测方法,用于骆驼乳及乳制品营养品质监管及热处理工艺优化。
实验室前期基于乳铁蛋白特异性结合的DNA 序列,建立了牛源乳铁蛋白的电泳迁移检测方法[15-16],并验证了该方法适用于羊源和人源乳铁蛋白检测[17]。本研究中,进一步考察了该方法对于骆驼源乳铁蛋白CLF 检测的适用性,并且检验了乳铁蛋白热变性对于分析性能的影响,测定了不同热加工处理驼乳制品(冻干驼乳粉、喷雾干燥驼乳粉以及UHT 驼乳)中CLF 含量变化,为骆驼乳制品热加工工艺优化和营养价值评估提供参考。
1 材料与方法
1.1 主要试剂和仪器
牛乳铁蛋白(bovine lactoferrin,BLF)、人源乳铁蛋白(human lactoferrin,HLF)、α-乳白蛋白(α-lactalbumin,α-Lac)纯度≥85%、酪蛋白(Casein)纯度≥90%,均购买自Sigma-Aldrich;羊乳铁蛋白(goat lactoferrin,GLF)纯度≥85%,购买自西安优博生物科技有限公司;DNA1 序列(5’-AGG CAG GAC ACC GTA ACC GGT GCA TCT ATG GCT ACT AGC TCT TCC TGC CT-3’)、DNA2 序列(5’-TCC ATG ACG TTC CTC TCC ATG ACG TTC CTC TCC ATG ACG TTC TTC CTC-3’)、DNA3 序列(5’-TAG AAG ATC AAA -3’)均由上海生工生物工程公司合成;考马斯亮蓝R-250、非预染蛋白Marker 均购买自上海生工生物工程公司;肝素亲和柱购买自北京美正生物科技有限公司;BCA 蛋白定量试剂购买自上海碧云天生物技术有限公司。
高速冷冻离心机,Eppendorf;水平和垂直电泳仪,BIO-RAD;TGel 蓝光凝胶成像系统,天根生化科技有限公司;OS-03U 摇床,北京六一生物科技有限公司;全自动高通量毛细管凝胶电泳仪器(QseP1)、卡夹,光鼎(Bioptic)公司。
1.2 实验材料
CLF 的提取:鲜驼乳在4 ℃,12 000 r/min 下离心10 min 后取中间层溶液,按照肝素亲和柱说明书中的实验步骤(美正生物),进行CLF 的提取纯化,CLF 最终洗脱液采用BCA 蛋白定量试剂盒定量浓度,分装后-20 ℃保存待用。
实验中使用的乳制品为鲜驼乳和UHT 处理的液态驼乳,-20 ℃保存待用。经喷雾干燥驼乳粉(Spray drying,SD)和冷冻干燥驼乳粉(Freeze drying,FD),-20 ℃保存待用。
1.3 检测方法
聚丙烯酰胺凝胶电泳(SDS-PAGE):样品在含有Tris-HCl(pH 6.8)、甘油、2% SDS、β-巯基乙醇、溴酚蓝的上样缓冲液中,95 ℃,5 min 变性。电泳参数:12%电泳预制胶,电压为120 V,电泳时间为90 min;考马斯亮蓝R-250 标记样品中的蛋白条带,脱色后使用凝胶记录系统观察凝胶。以牛、羊、人乳铁蛋白为阳性对照,表征CLF。
琼脂糖凝胶电泳迁移检测:将退火后DNA 加入稀释至一定浓度的CLF 标准溶液或含一定量CLF 的待测样品,混合后上样。电泳参数:3%的琼脂糖凝胶,1×TAE 电泳缓冲液,电压为90 V,电泳时间为25 min。电泳结束后使用蓝光透射仪观察电泳结果。使用数据处理软件WCIF Image J 采集条带灰度值。
全自动毛细管凝胶电泳检测参数为:将退火后((95±0.5)℃,5 min)非荧光标记的DNA 加入稀释至一定浓度的CLF 标准溶液或含一定量CLF 的待测样品,用1×PBS 调整终体积为20 μL。进样电压:4 kV;进样时间:10 s;分离电压:8 kV;分离时间:240 s;毛细管的有效分离长度为13 cm。
1.4 实际样品检测
实际样品前处理:新鲜驼乳在4 ℃,12 000 r/min离心处理10 min,取中间层;驼乳粉溶解方式为称取1 g 奶粉用超纯水定容至7 mL,4 ℃,12 000 r/min 离心处理10 min,取中间层。
实际样品检测:用所建立的检测CLF 的方法,分别检测鲜驼乳(取0.1 μL)、不同加工处理驼乳粉(取0.3 μL)中CLF 的含量。在实际样品中加入CLF 标准品进行加标回收检测。
2 结果与讨论
2.1 驼源乳铁蛋白的提取与表征
由于驼源乳铁蛋白标准品无法通过商业化渠道购买,而研究表明CLF 同其它来源乳铁蛋白一样,能够与肝素高特异性结合[12],因此实验中采用肝素亲和柱从生驼乳中提取CLF。图1(a)为CLF 提取液的SDSPAGE 电泳图,从中可以看出,相比于生驼乳(泳道2),CLF 提取液仅在约80 ku 出现单一的蛋白条带(泳道3),并且与牛、羊、人源乳铁蛋白分子量接近(泳道4-6)[18-19],表明经过肝素亲和柱纯化步骤成功去除掉了绝大部分的酪蛋白和其它乳清蛋白,获得了较高纯度的CLF(纯度>96%),可用于后续实验。
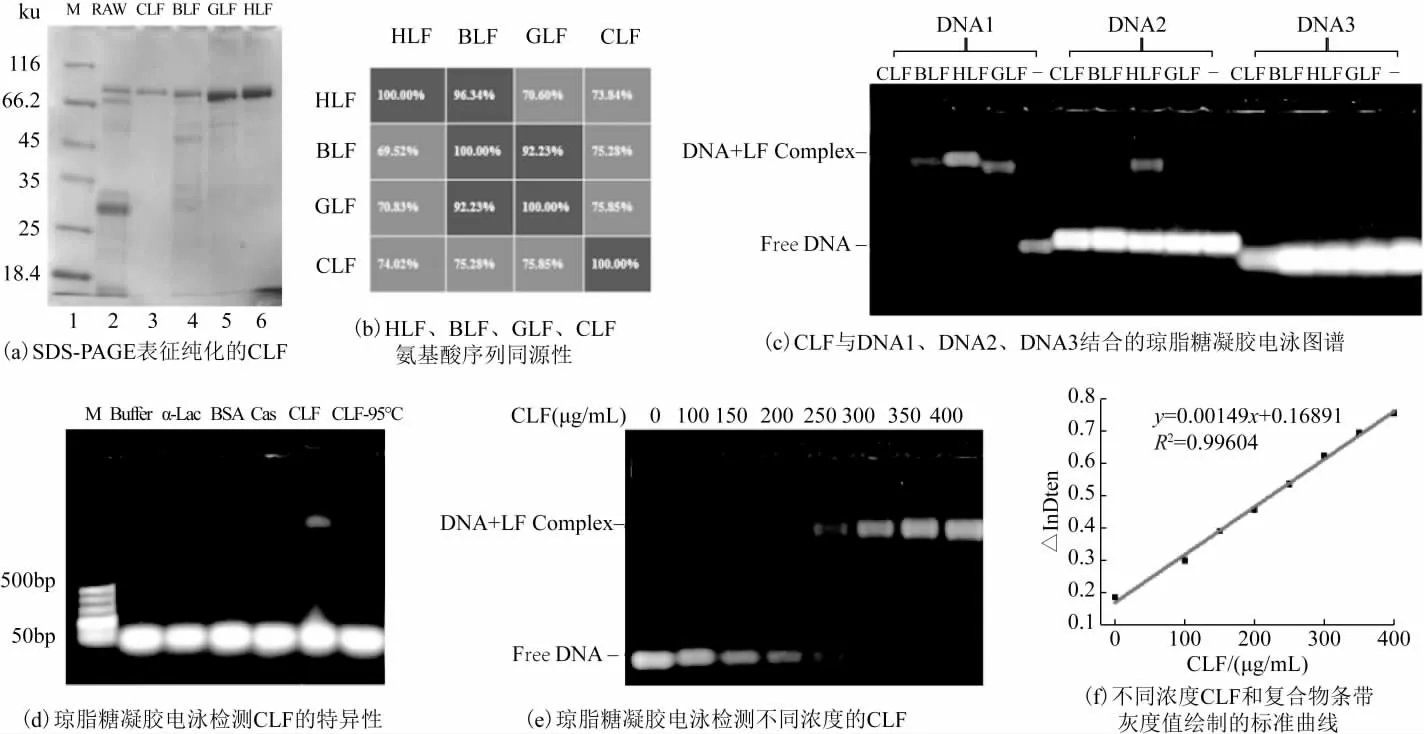
图1 琼脂糖凝胶电泳检测CLF
2.2 驼源乳铁蛋白的琼脂糖凝胶电泳迁移检测
前期研究表明,采用凝胶电泳迁移检测时,对于不同来源乳中乳铁蛋白,其最适的DNA 结合序列有所差异。例如,对于牛源和人源乳铁蛋白,最适的序列为DNA1;而羊乳乳铁蛋白的序列为DNA2[14-17,20-22]。同时,氨基酸序列比对结果表明,CLF 与人源、牛源和羊源乳铁蛋白同源性为约75%,如图1(b)所示。这些差异可能会影响CLF 与DNA 的特异结合。琼脂糖凝胶电泳迁移实验结果表明,如图1(c)所示,CLF 最适的序列为DNA1,与牛源和人源乳铁蛋白一致,因此,对于不同来源的乳铁蛋白,可能存在能够与DNA1 结合的保守序列。
DNA1 序列与CLF 的结合反应具有高特异性,骆驼乳及乳制品中存在的酪蛋白(Cas)和α-乳白蛋白(α-Lac)等乳蛋白均不会出现蛋白质-DNA 复合物条带,如图1(d)所示。随着CLF 浓度增加,DNA-CLF复合物条带的灰度值增加,如图1(e)所示,两者之间呈现良好的线性关系(R2=0.99604),表明DNA1 序列可用于CLF 的定量检测。因此,基于电泳迁移的乳铁蛋白检测方法对于不同来源乳样品具有通用性。
由于乳铁蛋白对热敏感,而乳制品普遍采用热杀菌工艺,进一步考察了CLF 热变性对于检测性能的影响。对于热变性的CLF 样品,未观察到对应的DNACLF 复合物条带,如图1(d)所示,表明DNA1 仅能够结合非热变性的CLF,可能是因为加热变性后乳铁蛋白的构象发生了改变,破坏了DNA 的结合位点。因此,基于DNA 亲和作用的电泳迁移检测方法,检测结果仅为样品中非热变性的乳铁蛋白含量,可以反映出不同热加工工艺的差异。
2.3 驼源乳铁蛋白的毛细管凝胶电泳迁移检测
DNA1 结合序列同样适用于CLF 的毛细管凝胶电泳迁移检测,如图2(a)~2(c)。随着CLF 浓度的增加,体系中游离DNA1 电泳峰面积明显降低,如图2(a)所示,与之前的实验结果一致[17]。以CLF 的浓度为横坐标,游离DNA1 的峰面积为纵坐标绘制工作曲线,线性范围0~120 μg/mL,检出限5.456 μg/mL,如图2(b)所示,明显低于琼脂糖凝胶电泳迁移方法(40.9 μg/mL)。
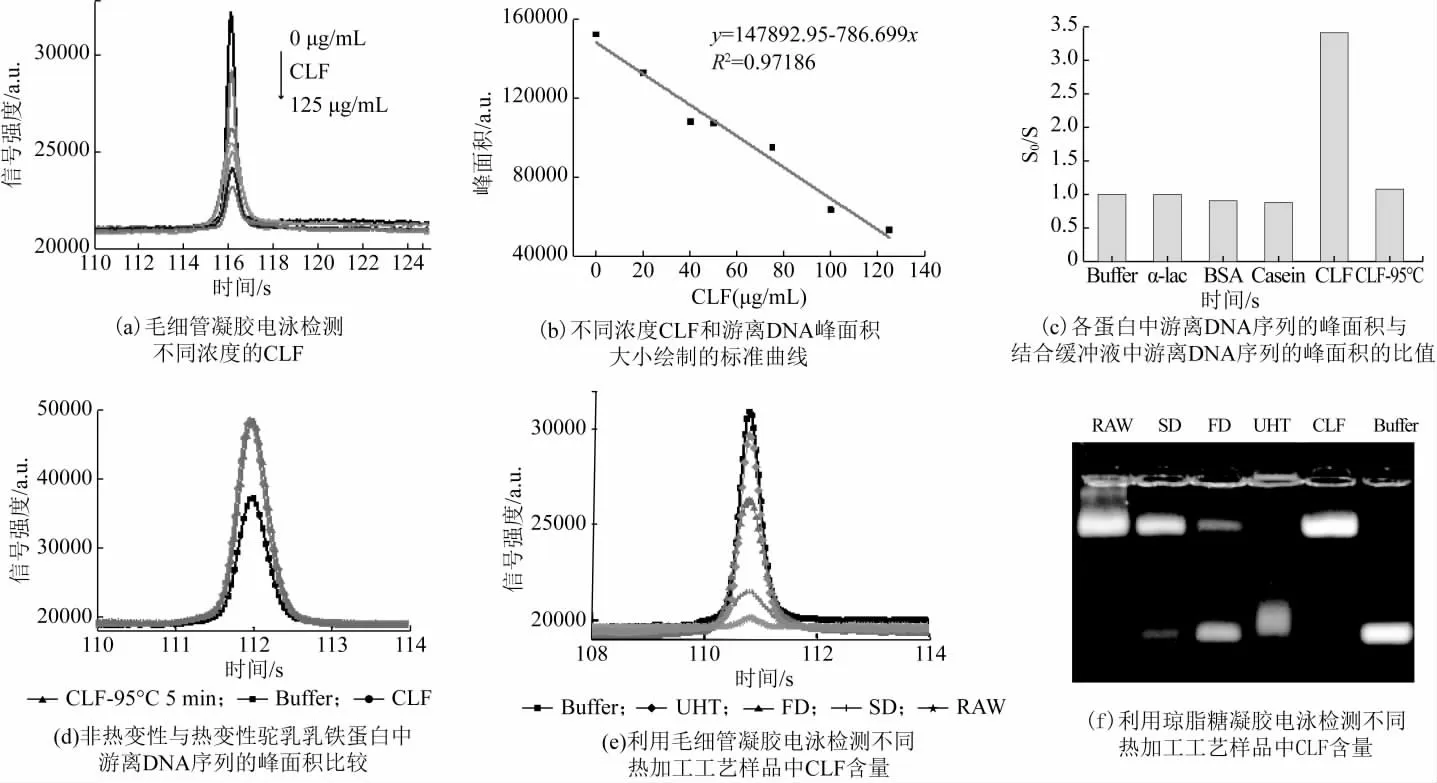
图2 全自动毛细管凝胶电泳检测CLF
只有CLF 的加入使得游离DNA 的峰面积明显降低,表明该方法具有良好的特异性,如图2(c)所示。并且热变性的CLF,不会导致游离的DNA 序列的峰面积减少,如图2(d)所示,表明该方法同样可用于区分活性与热变性乳铁蛋白。此外毛细管凝胶电泳检测时间更短(5 min),因此更适合于实际样品CLF 的快速定量检测。
2.4 实际乳品样品检测
为了验证毛细管凝胶电泳迁移检测方法的实际应用,将其用于鲜驼乳、冻干驼乳粉、喷雾干燥驼乳粉以及UHT 处理的商业驼乳中CLF 含量的测定,如表1 所示。生驼乳中乳铁蛋白含量为4.146 mg/mL,与文献报道(>5.1g/L)结果一致[23]。不同样品的加标回收率在90%~110%之间,表明所建立的方法具有较高的准确性。不同热加工工艺中CLF 含量为:生驼乳>冻干驼乳粉>喷雾干燥驼乳粉>UHT 液态驼乳,如图2(e)~2(f),符合预期[6-8]。因此,所建立的方法能够反映出不同加工工艺的影响。该方法仅需简单除脂与稀释、无需复杂前处理就可实现乳制品中活性CLF 的定量检测,可为驼乳制品生产过程中热加工的营养价值评定提供参考。
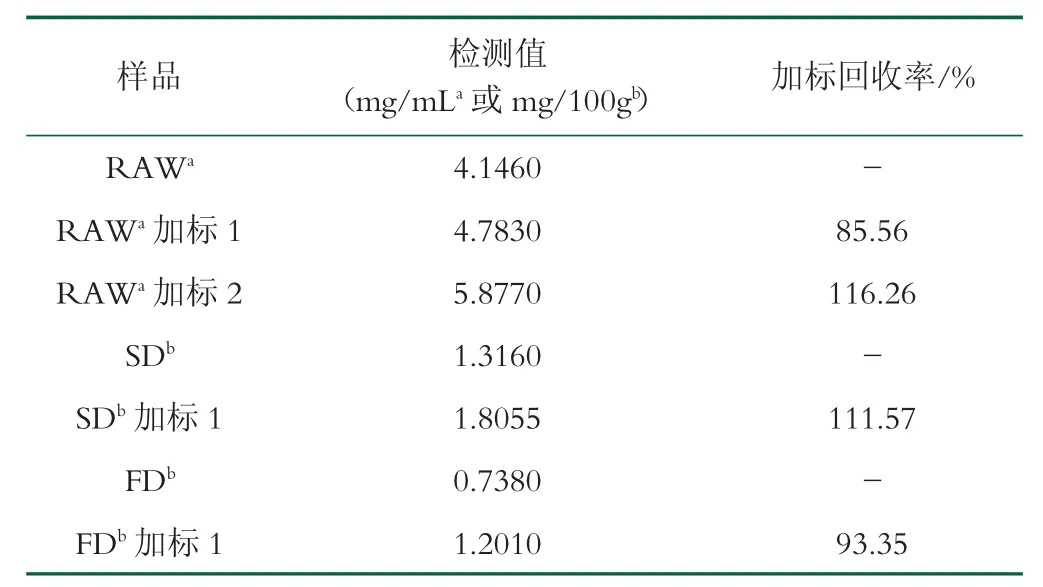
表1 实际样品中驼乳乳铁蛋白的检测结果
3 结论
本文建立了驼源乳铁蛋白含量的快速凝胶电泳迁移检测方法,进一步验证了方法的通用性。该方法灵敏度高,操作简单,避免了传统仪器检测乳铁蛋白繁琐的前处理过程,不依赖大型昂贵仪器,经济节约。同时,由于特异性的DNA 序列仅能够结合非热变性CLF,而不结合变性CLF,实现了乳及乳制品样品中活性CLF 含量的直接检测,因此可以用于各种特色乳制品热加工工艺的精准控制以及乳品营养价值评估。

