青稞源ACE抑制糖肽结构及其稳定性研究
胡香莲, 郦 萍, 周柳莎, 俞瑜媛, 徐海星, 施永清
(浙江工商大学食品与生物工程学院,杭州 310018)
血管紧张素转化酶(angiotensin-I-converting enzyme,ACE)能够在人体内的肾素-血管紧张素系统中起作用,使得血压升高[1]。而市面上治疗高血压的药物如卡托普利等会引起头痛、哮喘、可逆性肾功能障碍和冠状动脉疾病等[2]。天然安全的ACE抑制剂受到广泛关注,目前已经从动植物、水生生物及乳源制备出ACE抑制肽[3]。
青稞(Highland Barley,HB)是一种耐寒、适应性广、产量稳定的高原谷类作物。富含β-葡聚糖、多酚、蛋白(质量分数为12.85%~14.51%)等,是一种优质的植物蛋白源[4]。
微生物分泌多种非特异性蛋白酶分解蛋白质为小分子肽[5],常用来发酵食品蛋白质。乳酸菌常被用来生产生物活性肽,嗜热链球菌发酵乳清蛋白浓缩物具有显著的ACE抑制活性[[6,7];枯草芽孢杆菌发酵豆粕使自发性高血压大鼠收缩压3 h内显著降低[8];植物乳杆菌发酵HB蛋白具有降脂作用[9];HB白酒中鉴定出具有ACE抑制活性的短肽LPVGP、LLSPP同属于酿酒酵母蛋白[10];毛霉、根霉、曲霉等霉菌分泌的淀粉酶和蛋白酶分解淀粉和蛋白质为单糖、多肽、氨基酸等,如甜酒曲单菌发酵HB其葡萄糖、游离氨基酸增加[11,12];与单菌相比,混合发酵显著降低发酵液的抗营养因子并提高营养价值。乳酸菌和米根霉以及米根霉和酵母菌混合发酵HB比单菌发酵的游离氨基酸及抗氧化能力高[13,14,15]。
研究采用嗜热链球菌和米根霉混合发酵青稞制备ACE抑制糖肽,单因素和响应面优化混菌发酵条件,分离纯化青稞降压糖肽并研究其结构和体外稳定性,为青稞蛋白的深度利用提供参考。
1 材料与方法
1.1 材料与试剂
青稞(青海省西宁市);枯草芽孢杆菌(Bacillussubtilis,CICC 10453)、嗜热链球菌Streptococcusthermophilus,CICC 6220、植物乳杆菌(Lactobacillusplantarum,CICC 20283);酿酒酵母(Saccharomycescerevisiae,CICC 1423)、米根霉(Rhizopusoryzae,CICC 41214)、黑曲霉(Aspergillusniger,ATCC16404)、毛霉(Mucor,CICC 3109)。
血管紧张素转换酶(0.25 UN,ACE);马尿酰-组氨酰-亮氨酸(HHL, HPLC级)、茚三酮(HPLC级);三氟乙酸、乙腈(色谱级)等,其他试剂均为分析纯。
1.2 仪器与设备
SPX-250B-Z型生化培养箱,TGL-16gR型台式高速冷冻离心机,Spectramax iD3型多功能酶标仪,UV-2600型紫外-分光光度计,HD-5型电脑紫外检测仪,Nicolet型傅里叶红外光谱仪,BioBasic-18 RP-HPLC色谱柱,Waters 2695型高效液相色谱仪。
1.3 方法
1.3.1 青稞发酵液制备
活化至对数生长期的枯草芽孢杆菌、嗜热链球菌和植物乳杆菌离心后保留菌体,加入等体积0.9%的无菌生理盐水冲洗2次。活化好的酿酒酵母、毛霉、米根霉和黑曲霉用无菌生理盐水冲洗孢子,分别用平板计数法和显微镜血细胞计数使菌悬液或孢子浓度为107CFU/mL。
青稞与水质量比1∶15→打浆→糊化、冷却→接入质量分数2%菌悬液→细菌37 ℃、真菌28 ℃,发酵6 d→离心→上清液测多肽浓度、水解度、ACE抑制率
1.3.2 ACE抑制率、水解度及多肽得率测定
1.3.2.1 ACE抑制率测定
20 μL样品与20 μL HHL(5 mmol/L,用0.1 mol/L的pH 8.3的硼酸钠缓冲液,含0.3 mmol/L NaCl配制)混合,37 ℃保温5 min,加5 μL ACE(0.1 U/mL),37 ℃反应1 h;反应结束后,加入100 μL HCl(1 mol/L)终止反应,加入1.5 mL的乙酸乙酯萃取马尿酸,混合均匀,6 000 r/min下离心5 min,吸取1 mL乙酸乙酯层,经80 ℃水浴烘干,加入3 mL蒸馏水,228 nm处测定吸光度[16]。
(1)
式中:A0为对照组,HHL+ACE的吸光度;A1为对照空白组,不加ACE的吸光度;A2为样品组,样品+HHL+ACE的吸光度;A3为样品空白组,样品+HHL的吸光度。
1.3.2.2 水解度测定
分别吸取0、20、40、60、80、100、120、140 μL酪氨酸标准液(1 mg/mL)补足至400 μL,加100 μL pH 8.0磷酸盐缓冲液,100 μL质量分数1.5%茚三酮溶液,沸水浴15 min后冷却,570 nm处测量[17]。回归方程:y=1.849 1x+0.001 9,R2=0.993 5。
水解度测定:400 μL样品加入100 μL质量分数10%三氟乙酸溶液,离心,取100 μL上清液,补足至400 μL,其余操作步骤同上。
1.3.2.3 多肽得率测定
分别吸取0、60、120、180、240、300、360、420、480、540 μL Gly-Gly-Tyr-Arg四肽标准液(2 mg/mL)补足至600 μL,加入400 μL双缩脲试剂,混合均匀后,离心,上清液于540 nm处测量[18]。回归方程:y=0.068 6x+0.059 3,R2=0.999 4。
多肽含量测定:400 μL样品溶液加入100 μL质量分数10%三氟乙酸溶液,离心,取600 μL上清液,加入400 μL的双缩脲试剂,其余操作步骤相同。多肽得率按式(2)计算。

(2)
1.3.3 混菌发酵工艺优化
固定料液比1∶15、菌种比(嗜热链球菌∶米根霉1∶1)、接菌量2%、温度37 ℃、发酵时间6 d,探究料液比(1∶5、1∶10、1∶15、1∶20、1∶25 g/mL)、菌种比(3∶1、2∶1、3∶2、1∶1、2∶3、1∶2、1∶3)、接菌量(质量分数1%、2%、3%、4%、5%)、温度(25、28、31、34、37 ℃)和发酵时间(2、3、4、5、6、7 d)5个因素进行单因素实验,分别测定ACE抑制率、多肽得率和水解度。
在单因素实验基础上,选择料液比(A)、菌种比(B)、接菌量(C)和发酵时间(D)4个主要因素,进行响应面优化实验,以ACE抑制率为响应值,实验因素及水平设计见表1。
1.3.4 Sephadex G-15分离ACE抑制肽
一定浓度的发酵液上样前经滤膜(0.22 μm)过滤,Sephadex G-15(1.6 cm×60 cm)分离,以超纯水1 mL/min的流速洗脱。采用苯酚硫酸法检测每个试管的多糖含量,收集ACE活性最强的峰[19]。
1.3.5 RP-HPLC分离ACE抑制肽
RP-HPLC(BioBasic-18 250 mm×4.6 mm,300 Å,5 μm),流动相A为0.1%三氟乙酸-水溶液,流动相B为0.1%三氟乙酸-乙腈溶液。梯度洗脱程序为:0~5 min,90% A;5~20 min,90%~70% A;21~30 min,50%~10% A;35~40 min,10%~90% A。进样50 μL,流速0.8 mL/min,柱温25 ℃,检测波长:220 nm。多次收集ACE抑制活性较强的峰并进行纯度鉴定[20]。
1.3.6 傅里叶变换红外光谱
取一定质量的样品与KBr混合,用研钵均匀研细、压片,红外光谱仪扫描4 000~400 cm-1。
1.3.7 β-消除反应
纯化样品一份溶解在0.2 mol/L的NaOH溶液中,45 ℃反应2 h;另一份溶解于蒸馏水中作为空白,紫外扫描200~400 nm的吸收值[21]。
1.3.8 青稞ACE抑制糖肽体外稳定性
1.3.8.1 温度、pH的影响
样品分别在不同温度(20、40、60、80、100 ℃)保温2 h,以及不同pH(2、4、6、8、10),40 ℃下保温2 h,冷却,测定ACE抑制率[22]。
1.3.8.2 NaCl含量影响
样品溶液中加入质量分数0%、2%、4%、6%、8%的NaCl溶液,100 ℃下保持15 min,冷却,测定ACE抑制率[23]。
1.3.8.3 体外模拟胃肠消化影响
样品溶解在pH为2的胃蛋白酶(质量分数1%)溶液中,37 ℃水浴2 h,沸水浴5 min灭酶;经胃蛋白酶酶解的样品调节pH至7后加入胰酶(质量分数1%),37 ℃水浴2 h,沸水浴5 min灭酶[24]。
1.4 数据分析

2 结果与分析
2.1 青稞发酵液制备
由表2可见,单菌发酵中,综合来看嗜热链球菌和米根霉的ACE抑制率、多肽得率和水解度更高。选用两者混合发酵的3个指标也显著高于单菌(P<0.05),可能是米根霉分泌的淀粉酶、蛋白酶分解青稞中的淀粉、蛋白质为低聚糖、短肽等,供嗜热链球菌利用[25],加快蛋白质和肽水解使3个指标上升。故后续实验采用嗜热链球菌和米根霉混合发酵青稞。

表2 菌株筛选结果
2.2 混菌发酵工艺优化
2.2.1 单因素实验结果
由图1可知,料液比为1∶15时,ACE抑制率和水解度达到最高,可能原因是料液比低时,水分不足会降低营养物质的溶解度,从而限制微生物的生长;料液比高时会降低基质孔隙率从而限制氧气交换[26]。
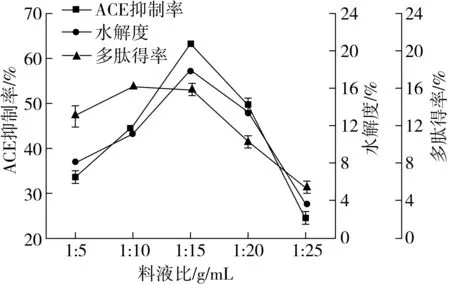
图1 料液比对ACE抑制活性、水解度和多肽得率的影响
由图2可知,菌种比例为1∶1时,ACE抑制率、水解度和多肽得率达到最高,菌种比例3∶1~1∶1,3种指标上升的可能原因是米根霉高产淀粉酶液化糖化HB淀粉,为嗜热链球菌生长提供碳源环境[27];1∶1~3∶1时3种指标下降可能是米根霉过多在HB基质中成为优势菌种,抑制嗜热链球菌的生长[28]。

图2 菌种比对ACE抑制活性、水解度和多肽得率的影响
由图3可知接菌量为2%时,ACE抑制率、水解度和多肽得率皆达到最大。可能是接菌量过低导致微生物分泌的酶不足,而接种量过高时,微生物分泌过多的蛋白酶分解了多肽导致3种指标下降[29]。

图3 接菌量对ACE抑制活性、水解度和多肽得率的影响
由图4可知,37 ℃的ACE抑制率、水解度和多肽得率最高。可能温度过低时微生物生长受到限制导致分泌蛋白酶很少,使得3种指标效果差,与李景等[30]用枯草芽孢杆菌发酵豆粕情况类似。

图4 温度对ACE抑制活性、水解度和多肽得率的影响
由图5可以看出,发酵1~6 d,微生物快速生长,产生大量淀粉酶、蛋白酶分解淀粉和蛋白质,因此3种指标迅速上升,6 d后微生物继续生长会利用发酵基质中产生的多肽使其进一步水解,因而多肽得率下降,水解度上升[31]。
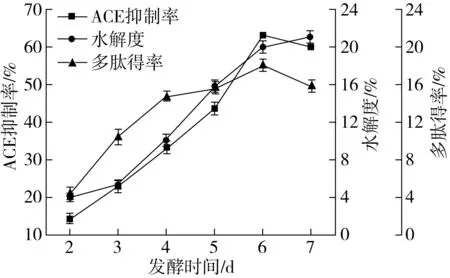
图5 时间对ACE抑制活性、水解度和多肽得率的影响
2.2.2 响应面实验结果
确定发酵温度37 ℃,以ACE抑制率为响应值,选择料液比(A)、菌种比(B)、接菌量(C)和发酵时间(D)4个主要因素的响应面优化实验设计及结果见表3。青稞发酵液的ACE抑制率(Y)对料液比(A)、接菌量(B)、菌种比(C)、发酵时间(D)的多项回归方程:Y=63.07+1.79A+5.37B-0.60C+7.13D+4.30AB+0.87AC+1.89AD-0.12BC+0.73BD-0.16CD-20.80A2-7.51B2-4.25C2-9.80D2和二次项A2、B2、C2、D2的影响极显著,交互项AB影响极显著,4个因素对青稞发酵液ACE抑制率的影响程度为D>B>A>C,即发酵时间>接菌量>料液比>菌种比。
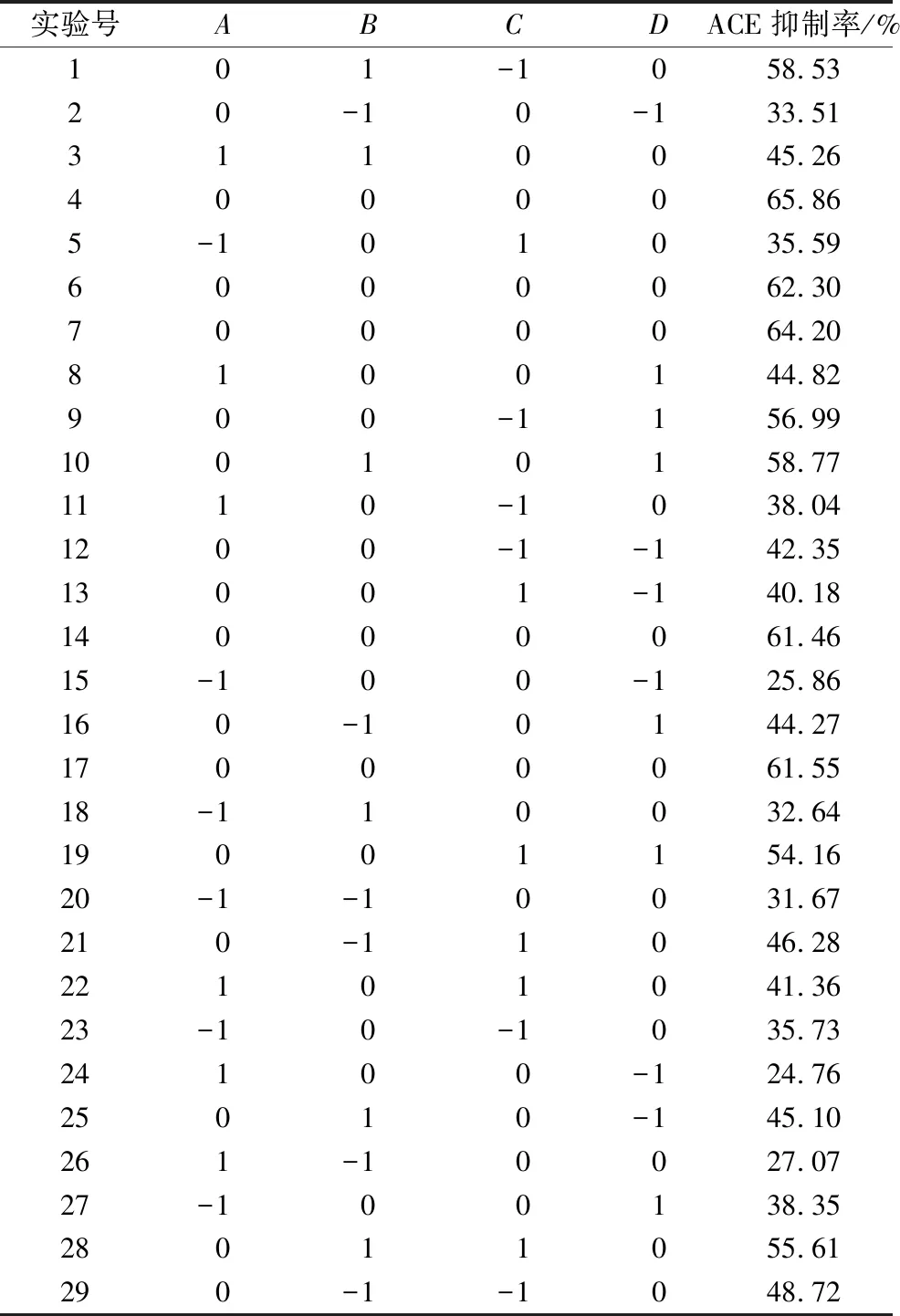
表3 响应面优化实验设计及结果


表4 回归模型方差分析
由图6可知,料液比与接菌量交互作用形成的响应曲面陡,说明交互项AB对ACE抑制率的影响极显著,等高线呈椭圆形,交互作用很明显,与方差分析结果一致。经Design-Expert 8.0.6软件分析得出最佳制备工艺为:料液比1∶15.505,接菌量2.405%,菌种比1.049,发酵6.389 d;模型预测的ACE抑制率为65.665%。根据实际实验的可操作性,稍微调整最佳条件:料液比1.0∶15.5,接菌量2.4%,菌种比1.0,发酵6.4 d,重复3次实验,ACE抑制率为65.79%,与模型预测值基本吻合,说明此模型可用来制备青稞发酵液。

图6 料液比和接菌量对青稞发酵液ACE抑制率影响的响应面图和等高线图
2.3 Sephadex G-15分离ACE抑制肽
青稞发酵液经Sephadex G-15分离得到3个峰,分别命名为A1、A2、A3,3个峰在280、490 nm处均有吸收,表明纯化组分同时含有多糖和蛋白质(图7)。3个峰IC50值分别为31.4、2.0、21.6 mg/mL,故对组分A2进行下一步纯化。
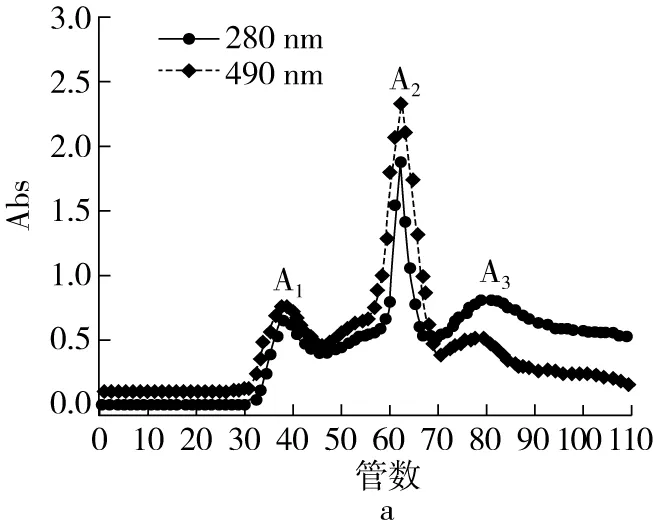
图7 Sephadex G-15分离纯化及其分离峰的ACE抑制活性图
2.4 反相高效液相色谱分离ACE抑制肽
图8a可知,A2组分经RP-HPLC分离后得到9个峰,各个组分冻干后测定ACE抑制活性,结果见图8b,F5组分的ACE抑制活性最高,收集F5组分,进行纯度分析。在保留时间11.678 min处出现信号较强的单一峰(图8c),纯度达95.17%,可进行下一步的结构分析。

注:a A2组分RP-HPLC分离图;b A2组分RP-HPLC分离峰ACE抑制活性;c F5组分纯度鉴定。
2.5 傅里叶变换红外光谱分析
由图9可见,3 405 cm-1附近产生一个宽吸收峰,说明该吸收峰有O—H和N—H伸缩振动,2 933 cm-1左右处有C—H伸缩振动,与黑豆纯糖蛋白的红外谱图类似[32],说明纯化样品有多糖存在;1 638 cm-1附近为肽键的特征吸收峰,说明纯化样品有蛋白存在;1 076、1 034 cm-1附近产生吸收峰,表明糖肽分子可能含有吡喃环[33]。

图9 青稞降压肽的红外光谱图
2.6 β-消除分析
糖肽连接键有O-糖肽键和N-糖肽键2种,前者在碱性条件下被水解,糖肽连接处的丝氨酸或苏氨酸会形成在240 nm处有特征紫外吸收的不饱和氨基酸,而后者对碱稳定。如图10所示,碱处理样品前后240 nm处吸光度值上升,说明发生了β-消去反应,样品中存在O-糖肽键[34]。

图10 青稞降压糖肽的紫外扫描曲线
2.7 青稞ACE抑制糖肽的体外稳定性研究
由图11a可知,随着温度和NaCl含量增高,ACE抑制活性保留率呈下降趋势;100 ℃时仅为53.24%,可能是高温处理使得糖肽结构改变,与ACE结合位点变少[35]。NaCl质量分数为6%~8%时ACE抑制活性保留率在65%左右,可能是钠离子能抑制糖肽活性,浓度越高越容易抑制糖肽活性[36]。pH在4~8时,ACE抑制率较稳定,增大至10时明显下降,可能过碱导致ACE抑制糖肽发生消旋现象,肽链结构改变影响ACE抑制活性[37]。由图11b可知,青稞降压糖肽经体外胃肠模拟消化后,其ACE抑制活性保留率都下降的可能原因是胃蛋白酶和胰酶会继续水解糖肽,使其活性降低[38]。

图11 温度、pH、NaCl含量和体外胃肠模拟消化对青稞ACE抑制糖肽活性的影响
3 结论
单因素和响应面实验优化嗜热链球菌和米根霉混合发酵青稞的最佳工艺参数:料液比1∶15.5,接菌量2.4%,嗜热链球菌∶米根霉为1∶1,发酵6.4 d,ACE抑制率65.79%,接近模型预测值。依次经Sephadex G-15、RP-HPLC分离得到单一组分F5。红外光谱和β消除反应证明F5组分是糖肽,糖苷键为O—糖肽键。但还需通过分析单糖和氨基酸组成研究来进一步了解ACE抑制活性和结构的关系。稳定性研究表明青稞源ACE抑制糖肽存在高温和强碱环境中不稳定性、高NaCl含量中其活性易降低以及在胃肠道环境中易降解的弱点,故今后需进一步提高其稳定性,为开发食品源ACE抑制糖肽创造条件。

