走进“硼”友,探寻硼的命题密码
丁修苓
(山东省日照实验高级中学)
虽然教材中没有专门对硼及硼酸的相关性质进行介绍,但近年高考中多次出现以硼及其化合物为载体的试题,这些试题往往结合新情境、新结构信息考查元素及其化合物知识、氧化还原反应原理、化学平衡及其移动原理等相关知识,一般以选择题、工艺流程题、实验综合题等形式呈现.下面通过高考命题热点对硼及其化合物的知识进行剖析.
1 高考命题频次和考查形式
近年关于“硼”的相关知识考查如表1所示.
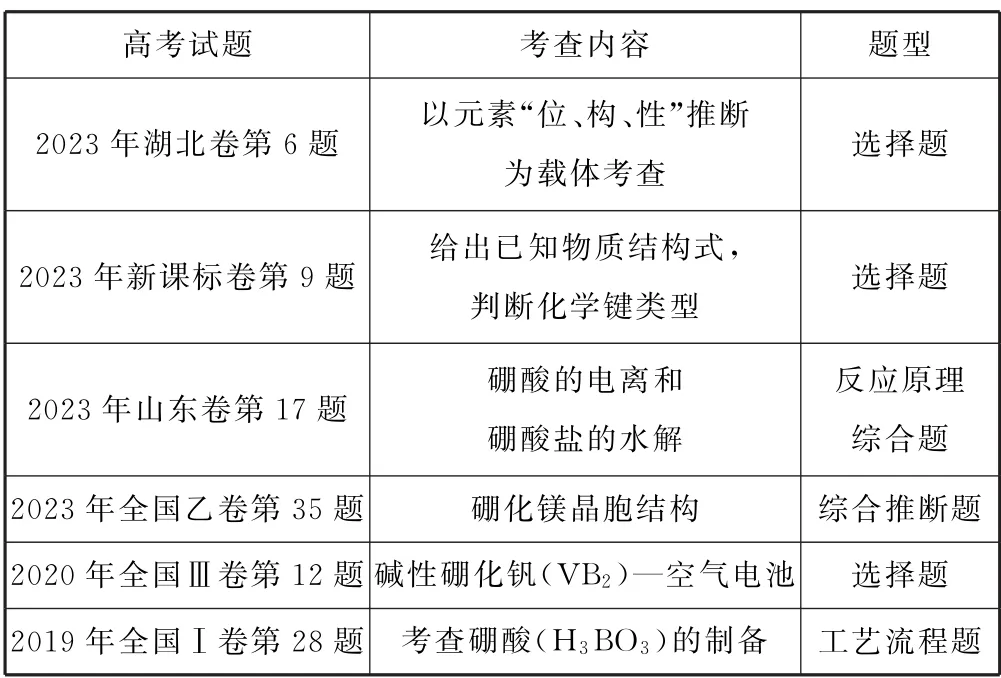
表1
2 硼及其化合物的性质
2.1 硼
1)单质硼有晶体硼和无定形硼两种.晶体硼呈黑灰色,以正二十面体为基本的结构单元,硬度与金刚石的硬度接近,其导电性差,但它的导电率却随着温度的升高而增大,晶体硼化学性质不活泼.无定形硼为棕色粉末,化学性质较为活泼.
2)常温下,硼稳定,仅与F2反应:2B+3F2=2BF3.
4)高温时,无定形硼可以与水蒸气作用生成硼酸:2B+6 H2O(g)2 H3BO3+3 H2.
5)高温时,硼也可以与N2、S、卤素等反应:2B+
6)硼不溶于非氧化性酸,仅被热的氧化性酸(如浓HNO3、浓H2SO4和王水)氧化:
7)无定形硼与Na OH 有类似硅的反应:
2.2 硼酸
正硼酸(H3BO3)是一种白色晶体,有与石墨相似的层状结构,层内的H3BO3分子通过氢键相连(如图1).H3BO3在冷水中溶解度较小,可溶于热水,硼类似于铝,存在偏硼酸,其分子式为HBO2.硼酸是一元酸,在冷水中溶解度较小,可溶于热水.显酸性的原因:H3BO3+H2O⇌H++[B(OH)4]-.

图1
2.3 掌握工业制取硼及其化合物的转化关系
1)转化关系如图2所示.

图2
2)相应步骤涉及的反应.
①硼镁矿与烧碱溶液反应生成可溶于水的偏硼酸钠(NaBO2)和 Mg(OH)2:2 Mg O•B2O3+2 Na OH+H2O=2 NaBO2+2 Mg(OH)2↓.
向偏硼酸钠溶液中通入CO2使NaBO2转化成硼砂:4 NaBO2+CO2+10 H2O =Na2B4O5(OH)4•8 H2O+Na2CO3.
②将硼砂与硫酸反应,得到硼酸:
③硼酸加热分解得到氧化硼:
④用镁或铝还原B2O3制得硼:
⑤硼和Na OH溶液反应生成NaBO2(或Na[B(OH)4])和 H2:2B +2Na OH +2 H2O =2 NaBO2+3 H2↑或2B +2 Na OH +6 H2O =2 Na[B(OH)4]+3 H2↑.
3 经典命题形式回放
3.1 考查与硼相关的元素“位、构、性”推断
例1(2023年湖北卷6)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W 的核外电子数与X 的价层电子数相等,Z2是氧化性最强的单质,4 种元素可形成离子化合物(XY)+(WZ4)-.下列说法正确的是( ).
A.分子的极性:WZ3<XZ3
B.第一电离能:X<Y<Z
C.氧化性:X2Y3<W2Y3
D.键能:X2<Y2<Z2

Z2是氧化性最强的单质,则Z 是F,X、Y、Z相邻,且X、Y、Z 为原子序数依次增加的同一短周期元素,则X 为N元素,Y 为O 元素,W 的核外电子数与X 的价层电子数相等,则W 为B 元素,Z是F元素,则WZ3为BF3,XZ3为NF3,其中前者的价层电子对数为3,空间构型为平面三角形,为非极性分子,后者的价层电子对数为4,有一对孤电子对,空间构型为三角锥形,为极性分子,则分子的极性:WZ3<XZ3,选项A 正确.同一周期元素越靠右,第一电离能越大,但是N 的价层电子排布式为2s22p3,为半充满稳定结构,其第一电离能大于相邻周期的元素,则第一电离能:Y<X<Z,选项B 错误.由以上分析可知,X2Y3为N2O3,W2Y3为B2O3,两种化合物中N 和B的化合价都是+3价,但是N 的非金属性更强一些,故N2O3的氧化性更强一些,选项C 错误.X2为N2,Y2为O2,Z2是F2,其中N2中含氮氮三键,键能较大,选项D 错误.答案为A.
3.2 考查碱性硼化钒(VB2)电池
例2(2020年全国Ⅲ卷12)一种高性能的碱性硼化钒(VB2)—空气电池如图3所示,其中在VB2电极发生反应:

图3
该电池工作时,下列说法错误的是( ).
A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的p H 降低,负极区溶液的p H升高
C.电池总反应为4 VB2+11 O2+20 OH-+6 H2O=
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极

根据图示的电池结构,左侧VB2发生失电子的反应生成和,反应的电极方程式如题干所示,右侧空气中的氧气发生得电子的反应生成OH-,反应的电极方程式为O2+4e-+2 H2O=4 OH-,电池的总反应方程式为4 VB2+11 O2+20 OH-+6 H2O=.当负极通过0.04 mol电子时,正极也通过0.04 mol电子,根据正极的电极方程式,通过0.04 mol电子消耗0.01 mol氧气,在标准状况下为0.224 L,选项A 正确.反应过程中正极生成大量的OH-使正极区溶液的p H 升高,负极消耗OH-使负极区OH-浓度减小,p H 降低,选项B错误.根据分析,电池的总反应为4 VB2+11 O2+20 OH-+6 H2O =,选项C正确.电池中,电子由VB2电极经负载流向复合碳电极,电流流向与电子流向相反,则电流流向为复合碳电极→负载→VB2电极→KOH 溶液→复合碳电极,选项D 正确.答案为B.
3.3 融合信息考查硼酸的电离和硼酸盐的水解
例3(2023年山东卷17,节选)盐湖卤水(主要含Na+、Mg2+、Li+、Cl-、和硼酸根等)是锂盐的重要来源.含硼固体中的B(OH)3在水中存在平衡:B(OH)3+H2O⇌H++[B(OH)4]-(常温下,Ka=10-9.34);B(OH)3与Na OH 溶液反应可制备硼砂[Na2B4O5(OH)4•8 H2O].常温 下,在0.10 mol•L-1硼砂溶液中,[B4O5(OH)4]2-水解生成等物质的量浓度的B(OH)3和[B(OH)4]-,该水解反应的离子方程式为_________,该溶液的p H=_________.

结合题意可知,在0.10 mol•L-1硼砂溶液中,[B4O5(OH)4]2-水解生成等物质的量浓度的B(OH)3和[B(OH)4]-,该水解反应的离子方程式为
由B元素守恒可知,B(OH)3和[B(OH)4]-的浓度均为0.20 mol•L-1,由此列出平衡常数表达式为
所以该溶液的p H=9.24.
3.4 考查硼化镁晶胞结构
例4(2023年全国乙卷35,节选)中国第一辆火星车“祝融号”成功登陆火星.探测发现火星上存在大量橄榄石矿物(MgxFe2-xSi O4).一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影如图4所示,晶胞中含有____个Mg.该物质的化学式为______,B—B最近距离为______.


图4
由题图可知,Mg位于正六棱柱的顶点和面心,由均摊法求出正六棱柱中含有的Mg原子为个,B 在正六棱柱体内共6个,则该物质的化学式为Mg B2.注意:晶胞是晶体结构中最小的结构单元,图4中左侧实线部分是1个晶胞,含有1个Mg;由晶胞沿c轴的投影图可知,B 原子在图中2个正三角形的重心上,该点到顶点的距离是该点到对边中点距离的2倍,顶点到对边的垂线长度为,因此B—B最近距离为
3.5 融合工艺流程考查硼酸的制备
例5(2019年全国Ⅰ卷,节选)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业.一种以硼镁矿(含Mg2B2O5•H2O、Si O2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图5所示.
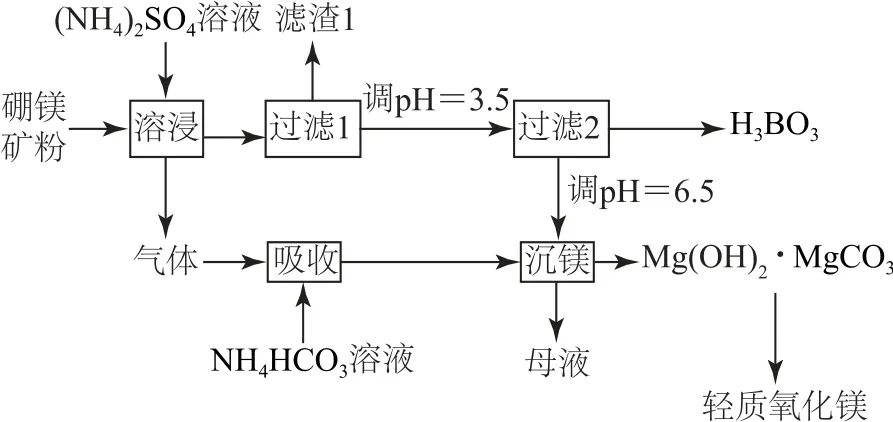
图5
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为________.
(2)“滤渣1”的主要成分有_________.为检验“过滤1”后的滤液中是否含有Fe3+,可选用的化学试剂是________.
(3)根据H3BO3的解离反应:H3BO3+H2O⇌H++[B(OH)4]-,Ka=5.81×10-10,可判断H3BO3是_________酸;在“过滤2”前,将溶液p H 调节至3.5,目的是________.

(1)根据流程图可知,硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,用碳酸氢铵溶液吸收,反应方程式为
(2)滤渣1 为不与硫酸铵溶液反应的Fe2O3、Al2O3、Si O2;检验Fe3+,可选用的化学试剂为KSCN.
(3)由硼酸的解离方程式可知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液p H调节至3.5,目的是将[B(OH)4]-转化为H3BO3,并促进H3BO3析出.
4 解题策略
1)从“价—类”二维图角度学习硼
抓知识原型,用类比思维,硼及其化合物性质类似于铝,构建“价—类”二维图(如图6).
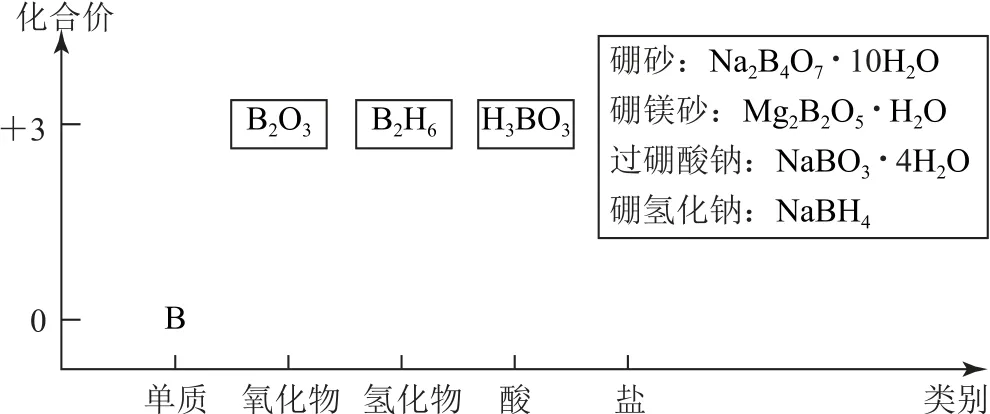
图6
2)从配位键角度理解硼及其化合物的结构
硼容易形成缺电子化合物,如BF3、BCl3和BBr3等.在这些化合物中,硼最外层有6个电子,采取sp2杂化,为平面三角形结构,非极性分子.硼给出空轨道,容易形成配位键.在一些给出化学键结构推断短周期元素类型的试题中,若阴离子结构中某元素X能形成4条键,则X 可能是第ⅢA 族的硼或铝,且这4条键中既有共价键也有配位键;若X 是形成4条键的分子,则X 是第ⅣA 族的碳或硅,若是能形成4条键的阳离子,则该元素可能是第ⅤA 族的氮或磷.
3)从电离角度理解硼酸的弱酸性
电离方程式为H3BO3+H2O⇌[B(OH)4]-+H+,由此可以看出其为一元酸,且[B(OH)4]-中存在共价键和配位键.
(完)

