黄芩苷通过阻断2型固有淋巴细胞激活减轻脓毒症肺损伤机制研究*
温 霞 陈恩就 孙 俊 姜小珍 王珊瑚
1 平阳县人民医院 浙江 平阳 325400
2 温州医科大学附属第二医院 浙江 温州 325000
脓毒症的特征是宿主细胞促炎和抗炎因子的相互作用,导致炎症网络的严重失调[1]。大量炎症细胞因子通过血液循环会造成相关的急性肺、肾脏和其他器官的损伤,因此抗感染治疗成为脓毒症最有效的治疗方法[2]。先天性淋巴细胞(Innate lymphoid cells,ILCs)是近年来备受关注的一类细胞,因为其可以跨越先天免疫系统和适应性免疫系统之间的桥梁,诱导分泌多种细胞因子,这些细胞因子影响感染/损伤部位产生的免疫反应类型[3]。ILCs 根据其分泌的细胞因子可分为3 个亚组,其中第2组ILCs(ILC2s)不仅是启动先天性免疫反应所必需的,而且还通过IL-13 支持Th2 细胞的生成[4]。ILC2s 通常与黏膜屏障表面有关,在调节对入侵病原体的先天性和适应性免疫反应方面起着重要作用。黄芩苷(Baicalin,BA)是从黄芩干根中提取的一种黄酮类化合物,具有多种生物活性[5],可以抑制Th1和Th17反应,促进Treg 反应,从而减轻脓毒症胰腺损伤[6]。关于BA对脓毒症中ILC2s的影响尚不清楚,本研究旨在观察BA对脓毒症肺损伤的改善作用,及其在脓毒症炎症治疗中的潜在分子机制是否涉及ILC2s的调节。
1 材料与方法
1.1 动物模型:于北京维通利华实验动物技术有限公司[许可证编号:SCXK(京)2016-0006]购买50 只雄性C57BL/6 小鼠,体重22~26g(8~10 周龄)。采用盲肠结扎穿孔法(Cecal ligation and puncture,CLP)建立脓毒症模型[6]。将50 只小鼠随机分为5 组(n=10):假手术组、模型组、BA 低剂量组(BA-L,100mg/kg)、BA 中剂量组(BA-M,200mg/kg)和BA 高剂量组(BA-H,300mg/kg)。在无菌条件下中线切一个小口暴露盲肠。随后,在距远端1.5cm 处用丝线结扎盲肠。然后,用一根18 号的针进行两次穿刺,排出少量粪便。之后,盲肠在腹部缝合前被移到腹腔。术后腹腔注射生理盐水(24mL/kg)复苏。假手术组除CLP 外均行手术。BA-L 组、BA-M 组和BA-H 组小鼠灌胃BA(上海纯优生物科技有限公司,纯度≥98%)每日1次,连续3 天。假手术组和模型组每天同时灌胃等量生理盐水。实验中没有小鼠意外死亡。3 天后,麻醉并处死所有小鼠进行外周血和肺组织取样。
1.2 组织病理学和损伤评分:收集肺组织,用4%多聚甲醛固定。组织脱水,包埋在石蜡中,切成5μm厚切片,苏木精和伊红(HE)染色。肺损伤以肺泡充血出血、中性粒细胞浸润血管壁或肺泡壁增厚为特征。每个特征的缺失(0)或存在被分为轻度(1)、中度(2)和重度(3),确定总累积组织学评分[7]。随机选取8 个高倍镜区,平均值为每个标本的病理学评分。
1.3 肺和外周血中ILC2s 的流式细胞术分析:用GentleMacs 小鼠肿瘤组织解离试剂盒(德国Miltenyi Biotec 公司)对肺组织进行混合消化,从肺组织中制备单细胞悬浮液,然后在37℃下用1mg/mL 胶原酶IA 和20μg/mL DNaseI 染色30min。抗凝外周血样本和肺细胞悬浮液通过70μm 尼龙网过滤,红细胞裂解液处理,PBS(含2%胎牛血清)洗涤。首先用抗CD16/32 单克隆抗体(2.4G2,杭州联科生物技术股份有限公司)孵育10min,阻断Fc 受体。然后用APC-effluro 780 结合抗-CD45(美国eBioscience公司)、PerCP-cy5.5-结合抗谱系标记物(CD3e、CD11b、CD45R/B220、Ly-76、Ly-6G 和Ly-6C)(美国BD-Pharmingen公司)、FITC结合抗Thy1.2(美国eBioscience 公司)和APC 结合抗ST2(美国Biolegend 公司)的混合物对细胞进行染色。ILC2s 被鉴定为CD45+Lin-Thy1.2+ST2+。使用流式细胞仪分析样本。
1.4 支气管肺泡灌洗液(BALF)分析:在最后一次给药24h后收集BALF。将气管通过一根22英寸的静脉导管插管,用1mL PBS 对肺进行灌洗,连续3 次获得BALF。将BALF在300rpm、4℃下离心10min。然后收集上清液的样本并在−80℃下储存以进行进一步分析。用流式细胞仪分析细胞总数。BALF 细胞总数和嗜酸性粒细胞数显示为每毫升BALF 的细胞数。使用小鼠ELISA 试剂盒(北京四正柏生物科技有限公司)测定BALF 中IL-4、IL-5 和IL-13水平。
1.5 Western Blotting 分析:将小鼠肺组织进行蛋白质提取。用Pierce BCA 蛋白检测试剂盒检测蛋白质浓度。随后,将蛋白质样品(50μg)用5×样品缓冲液煮沸,并在SDS-PAGE 上电泳转移到聚偏氟乙烯膜上。将膜暴露于封闭缓冲液中2h,在4℃下与一级抗体IL-33(1∶1000)、抗ST2(1∶1000)或GAPDH 抗体(1∶1000;均购自美国Cell Signaling Technology 公司)孵育过夜,然后在室温下与HRP 结合的二级山羊抗兔IgG(1∶2000)一起孵育1h。最后用化学发光法在Tanon 5200 Multi 全自动化学发光(上海天能科技有限公司)观察结果。
1.6 细胞培养与治疗:正常人支气管上皮(NHBE)细胞系购自美国ATCC,并在含10%胎牛血清、100μg/mL链霉素和100 单位/mL 青霉素的DMEM 培养基(美国Invitrogen 公司)中培养。将1×106细胞接种于6 孔板中,加入或不加入100 ng/mL LPS 和BA(1.25、2.5、5.0μmol/L)培养6h。
1.7 RNA 分离与定量PCR 分析:用TRIzol 试剂(美国Ambion 公司)从肺组织匀浆中或细胞中提取RNA。用PrimeScript RT-Master Mix 试剂盒(日本TaKaRa 公司)生成cDNA。使用SYBR Green Master Mix试剂盒(美国Applied Biosystems 公司)在Applied Biosystems ABI 7500(美国Thermo Fisher Scientific 公司)进行实时PCR。靶基因的相对表达用相对定量的比较法计算,并将数据归一化到对照组。基因表达水平用2-△Ct法进行,并标准化为GAPDH 的表达。用于qPCR 扩增的基因特异性引物序列设计见表1。
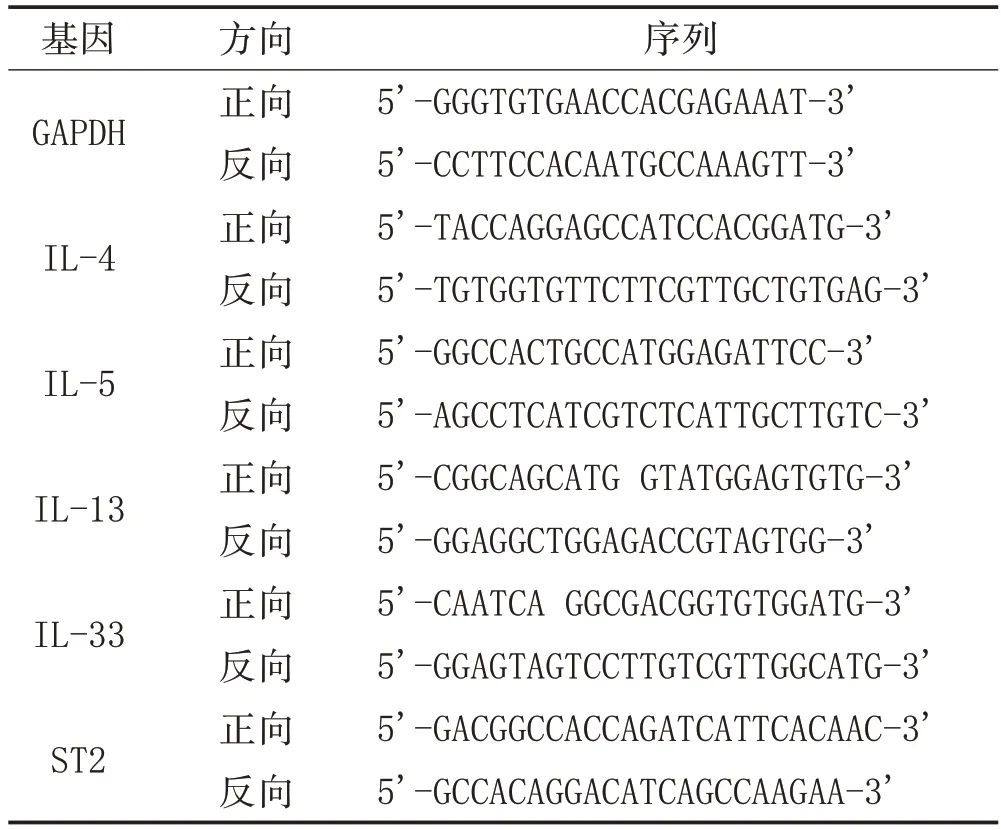
表1 基因特异性引物序列
1.8 数据处理:使用SPSS 21.0 软件进行分析。统计分析采用两组间的t检验或多组间Tukey多重比较检验的单因素方差分析。P<0.05认为具有统计学意义。
2 结果
2.1 BA 对脓毒症小鼠肺组织病理学影响:假手术组小鼠肺标本未见明显组织学改变。CLP 可导致模型组小鼠出现严重的损伤,表现为炎性小体弥漫性浸润,中性粒细胞明显向肺泡腔募集,气管固有层变薄、水肿。值得注意的是,BA 可逆转CLP 对肺组织的影响,尤其是高剂量治疗组。这些结果证明BA 对治疗脓毒症肺部炎症损伤是有益的。

图1 肺组织炎症损伤的HE染色(A)及肺损伤评分(B)
2.2 BA 减轻脓毒症小鼠炎症反应:与对照组比较,模型组BALF 细胞总数和嗜酸性粒细胞明显增多(P<0.001)。用BA 处理可显著降低BALF 中的总细胞数和嗜酸性粒细胞数(P<0.05)(图2A-B)。此外,CLP 可诱导小鼠肺IL-4、IL-5和IL-13基因水平显著上调(P<0.05)。BA 处理不同程度下调肺组织中IL-4、IL-5 和IL-13 mRNA 表达(P<0.05),其中以高剂量BA 作用最强(P<0.01)(图2C)。同样,模型组BALF 中IL-4、IL-5 和IL-13的水平较对照组明显升高(P<0.01),而中、高剂量BA处理后IL-4、IL-5 和IL-13 水平降低(P<0.05)(图2D)。
2.3 BA 通过IL-33/ST2 轴抑制CLP 诱导的小鼠ILC2s成熟:小鼠肺ILC2s 成熟和激活的表型鉴定为ST2、Thy1.2阳性。与Sham组比较,模型组大鼠肺和外周血内ST2+Thy1.2+ILC2s 含量明显增加(P<0.001)。低剂量至高剂量BA 显著降低ST2+Thy1.2+ILC2s 数量(P<0.001)(图3A-B)。IL-33/ST2 轴在肺ILC2s 的激活和引起气道炎症中起关键作用。在模型组中,肺匀浆中IL-33 和ST2 的蛋白和mRNA 表达均上调(P<0.001)。BA 从低剂量到高剂量均显著下调肺匀浆中IL-33和ST2的蛋白和mRNA 表达(P<0.05)(图3C-D)。因此,BA 可以减轻CLP 诱导的气道炎症,其作用机制至少部分通过破坏IL-33/ST2轴抑制ILC2s的成熟。
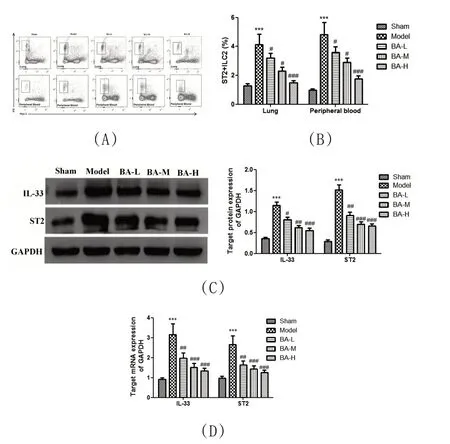
图3 BA通过IL-33/ST2轴抑制CLP诱导的小鼠ILC2s成熟
2.4 BA 抑制LPS 刺激后气道上皮细胞IL-33 的表达:经LPS刺激6小时后,NHBE细胞中IL-33 mRNA表达较对照组显著升高(P<0.01)(图4A)。BA 处理可显著降低LPS 诱导的IL-33 mRNA 表达升高(P<0.01)(图4B)。这些结果表明BA 可能通过下调气道上皮细胞中IL-33 的产生而减弱IL-33/ST2轴介导的炎症反应。

图4 BA抑制LPS刺激后气道上皮细胞IL-33的表达
3 讨论
CLP 模型与其他动物模型相比有许多优点,它符合人类感染的自然过程,表现出相似的血流动力学变化,并诱发不同程度的脓毒症严重程度[8]。在本实验中,CLP 诱导的小鼠肺组织出现严重的损伤。BA 能调节Th1、Th17 和Treg 反应,减轻实验性自身免疫性脑脊髓炎、过敏性哮喘和结肠炎[9]。BA在小儿脓毒症中通过抑制BAX 和促进BCL2 发挥抗急性肾损伤的作用[10]。BA 可抑制巨噬细胞释放高迁移率族盒1,可能是脓毒症相关疾病的潜在治疗策略[11]。本研究中,BA 能显著减轻脓毒症相关性肺损伤和炎症程度,证实了先前报道的BA对脓毒症相关反应有改善作用。
由于肺内ILC2s 被认为是2 型细胞因子传播2 型炎症的早期来源,因此ILC2s可能在介导脓毒症的炎症反应中起关键作用[4]。本研究中,脓毒症小鼠肺内成熟表型的ILC2s数量显著增加,并且BALF中IL-5和IL-13的产生可能部分反映了ILC2s 依赖性免疫反应的促进作用。此外,BA 可抑制肺内ILC2s 成熟。这些证实ILC2s可能作为脓毒症急性肺损伤期间BA治疗的早期靶向炎症细胞。
ILC2s 组成性地表达ST2,并在过敏原激发或感染后迅速对IL-33 作出反应,增殖和细胞因子生成增加[12]。IL-33/ST2 信号对于肺IL-5 和IL-13 的产生和气道嗜酸性粒细胞增多(独立于适应性免疫)是必需的[13]。IL-33 依赖性IL-5 和IL-13 的产生能促进皮肤伤口愈合,是皮肤上皮细胞和免疫系统之间的重要纽带[14]。IL-33 通过促进ILC2s 增殖及其产生IL-4、IL-5和IL-13 来预防实验性脑疟疾[15]。在小鼠模型中,IL-33 通过ST2 信号激活驻留肺部的ILC2s[13]。与此一致,在本研究中,脓毒症小鼠肺中IL-33 和ST2 的表达均上调,而BA 处理后则下调。这些结果提示BA 可能通过IL-33/ST2 轴影响肺内ILC2s 的激活。有研究发现[16],IL-33 在暴露于LPS 的气道上皮细胞中显著上调,而BA则下调。表明BA除抑制ILC2s增殖外,还可能对上皮细胞IL-33产生作用。
综上所述,BA 可以通过靶向IL33/ST2 轴抑制脓毒症小鼠气道中ILC2s介导的炎症反应。此外,BA抑制气道上皮细胞IL-33-ST2 轴,这是一个强有力的促炎途径,在LPS 暴露时触发过炎症级联反应。因此,BA 可作为未来辅助治疗脓毒症的潜在药物。

