橡胶树季风性落叶病病原菌的分离鉴定及其防治药剂筛选
施玉萍, 刘一贤, 李国伟, 唐轶, 戴利铭, 李岚岚, 蔡志英*
(1.云南省热带作物科学研究所,云南省天然橡胶可持续利用研究重点实验室(筹),天然橡胶良种选育与栽培技术国家地方联合工程研究中心,云南 景洪 666100; 2.勐腊县勐捧农场有限责任公司,云南 勐腊 666307;3.勐捧农场社区综合服务中心,云南 勐腊 666307)
橡胶树(Hevea brasiliensis)是一种用于生产商业天然橡胶的重要热带经济作物[1-2],主要种植于海南、广东、广西、福建、云南等热带地区北缘[3]。云南省是我国第一大天然橡胶种植和生产基地[4],且天然橡胶产业作为云南省传统优势特色产业,为全省脱贫攻坚、社会安定团结、边疆稳固发展和保障国家天然橡胶供给提供了强有力的保障[5]。
季风性落叶病是橡胶树的主要病害之一,不仅危害橡胶树的枝条、叶片和果实,还危害割面、树干等部位,引起落叶、落果、割面溃疡等,发病严重时导致胶树停割,胶乳产量减少,病害防治成本增加,给橡胶产业发展造成巨大威胁。引起季风性落叶病的病原菌主要为疫霉属(Phytophthoraspp.)真菌,其在亚洲、非洲和拉丁美洲等世界各橡胶种植区均有报道,且不同地区或国家,甚至同一地区的病原菌种类、分布和严重程度均存在差异[6-9]。我国云南西双版纳垦区自1965年首次发现季风性落叶病以来,发病面积不断扩大,1978年西双版纳垦区5个农场发病面积为301.93 hm2,根据形态学特征将其病原菌鉴定为疫霉属[10]。1984年,临沧、德宏等地首次发现季风性落叶病害,并造成部分胶树停割[11]。1991 年,西双版纳东风农场的发病面积达2 194.56 hm2,占投产胶园的25.3%,停割3 100 余株[12]。2012 年,西双版纳勐捧农场等6 个农场的病害发生总面积约8 729 hm2,其中重病面积933 hm2,停割面积237 hm2,致病菌为云南植胶区分布广泛、致病力较强的柑桔褐腐疫霉(P.citrophthora)[13]。2014 年,季风性落叶病在云南大暴发,西双版纳州嘎洒镇和东风农场受害的橡胶园总面积为8 129.91 hm2,给当地农户造成了巨大损失[14-15];临沧市发病面积共666.7 hm2[16]。2021年8—9 月,西双版纳州勐腊县发生季风性落叶病,灾害面积约120.00 hm2;2022 年7—9 月,西双版纳州多地植胶区发生季风性落叶病,受害面积1 728.40 hm2,其中景洪164.53 hm2、勐满50.67 hm2、勐醒380.17 hm2、东风533.03 hm2、勐捧600.00 hm2,主要受害品系为RRIM 600,病害在临江林段、林段中部及山顶林段均有发生(实地调查,数据未发表)。
西双版纳植胶区橡胶树季风性落叶病自发生以来,关于其病原菌种类、病害防治等进行的系统研究较少。我国已报道的季风性落叶病致病菌有棕榈疫霉(P. palmivora)、恶疫霉(P. cactorum)、柑桔褐腐疫霉(P. citrophthora)、寄生疫霉(P.parasitica)、棕榈疫霉(P. palmivora)、辣椒疫霉(P.capsici)、橡胶疫霉(P. heveae)[17-21],这些致病菌都是根据病原菌的形态特征和生理生化特性来进行分类鉴定的,但疫霉菌属真菌种间或种内的形态变异性较大,仅根据形态特征、生理生化特性、致病性等很难对该属的病原菌种类进行准确鉴定,因此通过相对稳定的形态学特征,同时结合分子生物学方法,能够使疫霉菌的分类更准确。目前,化学防治是控制季风性落叶病的主要手段,但在我国登记用于防治该病害的杀菌剂仍为空白,也未见该病害防治药剂筛选的相关报道,胶农还存在乱用药的情况,因此亟待筛选出有效的防治药剂。
为确定近2 年引起西双版纳植胶区橡胶树落叶病的致病菌,本研究采集感病样本,采用组织分离法和菌丝尖端纯化法进行病原菌的分离、纯化,通过活体接种法测定致病性,然后结合形态学特征和分子生物学方法明确其分类地位;采用菌丝生长速率法测定15 种杀菌剂对该病原菌的抑菌活性,以期为该病的有效防治提供科学依据。
1 材料与方法
1.1 试验材料
供试橡胶树感病叶片分别采自云南景洪橄榄坝农场5 分场(N 21°51′0″, E 100°55′43″,海拔700 m)、景洪市勐仑镇阿克小寨大卡村(N 21°50′27″, E 101°12′9″,海拔800 m)、景洪市东风农场中林生产队16 组(N 21°40′28″, E 100°45′54″,海拔720 m)、勐腊县象明乡曼林村小组臭水河居民点橡胶园(N 21°59′37″, E 101°18′19″,海拔761 m)、勐腊县勐满农场润疆生产队3 组(N 21°23′34″, E 101°18′51″,海拔577 m)。每个采集地选取感病橡胶树10 株,每株选取1 片具有典型症状的叶片。
DNA 提取试剂盒PlantGen DNA Kit 购自北京康为世纪生物科技有限公司;2×Es TaqMasterMix(Dye) 购自康为世纪生物科技股份有限公司;其余试剂均为国产分析纯。扩增仪(Veriti 96 well Thermal Cycler)购自美国Applied Biosystem 公司;DYY-6C 电泳仪购自北京六一仪器厂;UVP 凝胶成像系统购自美国 UVP 公司;SPX-250B-G 恒温培养箱购自上海博迅实业有限公司医疗设备厂。
供试培养基为胡萝卜琼脂(carrot agar,CA)培养基:胡萝卜100 g(切片,100 mL水中浸泡1 h,煮沸5 min,过滤),琼脂粉18 g,蒸馏水1 000 mL;皮氏培养液Petri:Ca(NO3)2·4H2O 0.4 g,KH2PO40.15 g,Mg(NO3)20.15 g,CaCl20.06 g,H2O 1 000 mL。
选取15 种不同剂型杀菌剂测定其对病原菌菌丝生长的抑制,详见表1。

表1 供试杀菌剂Table 1 Information of tested fungicides
1.2 病原菌的分离及鉴定
1.2.1病原菌的分离 在感病叶片或叶柄的病健交界处剪取约5 mm×5 mm 的组织块,置于70%的乙醇中浸泡30 s,1.5%次氯酸钠浸泡60 s,无菌蒸馏水冲洗3次,将消毒过的组织块置于CA 培养基上,28 ℃恒温、黑暗条件下培养。待菌落长出后,采用菌丝尖端挑取法进行病原菌的纯化,将纯化的分离物转接到CA 培养基上,28 ℃培养7 d 后,于4 ℃保存备用或在斜面上加矿物油密封保存。
1.2.2病原菌的形态特征及生理特性 菌落形态:将纯化的病原菌接种于CA 培养基上,28 ℃黑暗培养5 d后记录菌落形态。
孢子囊的诱导:将病原菌在CA 培养基上培养3~4 d,挑取菌落边缘的菌丝块置于载玻片上,滴加皮氏液,28 ℃、连续光照(15 W 日光灯)条件下保湿培养72 h,Lecia DM6B 显微镜下观察并记录孢子囊的形态特征,并随机选取50 个成熟孢子囊测量大小。
生长温度:将病原菌菌丝块(直径5 mm)转接在CA 培养基上,分别于5、10、15、20、25、28、30、35 ℃黑暗培养5 d 后测量菌落直径,每个温度设置3次重复。
1.2.3系统进化分析 将纯化后的病原菌接种到CA培养基上培养7 d,刮取约100 mg菌丝,用试剂盒提取病原菌基因组DNA,于-20 ℃保存备用。采用引物ITS1/ITS4和FM78/FM82(表2)分别进行PCR 扩增。PCR 产物送北京擎科生物科技有限公司昆明实验室测序。
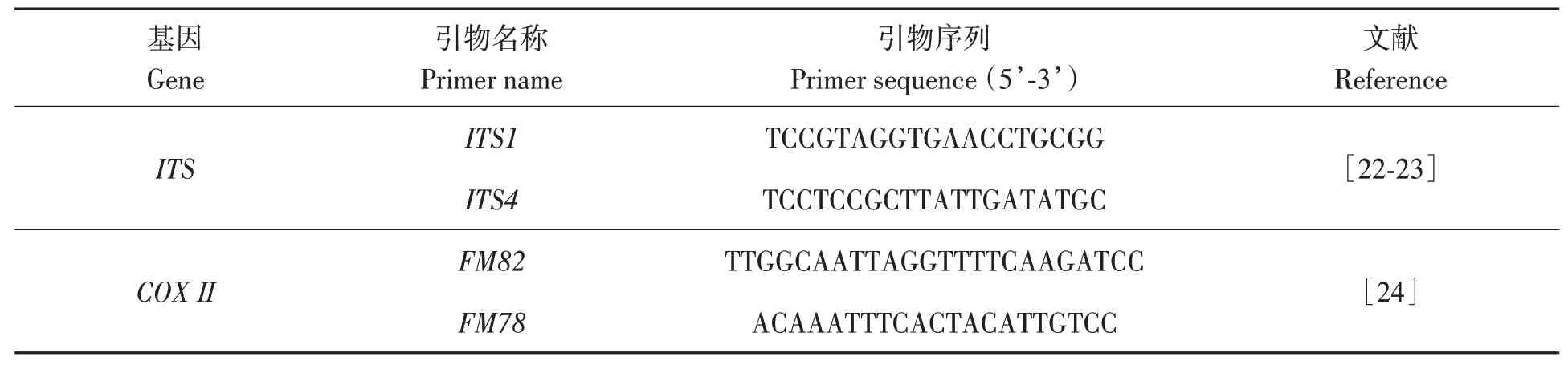
表2 PCR扩增ITS和COXⅡ基因的引物Table 2 Primer used to amplify ITS and COXⅡ genes
将测序所得序列提交GenBank 并与NCBI 数据库已知序列进行BLASTn 比对分析,根据比对结果下载相似菌株序列,按ITS-COX Ⅱ进行序列拼接,利用邻接法((neighbor joining method,NJ)通过MEGA X 软件构建系统发育树,Bootstrap 检验的重复次数设置为1 000。
1.3 病原菌的柯赫氏法则验证
在云南省热带作物科学研究所植保中心大棚的盆栽橡胶苗上进行致病性试验,采用菌丝悬浮液喷雾法进行接种,方法如下:将纯化的菌株在CA 培养基上培养8 d,轻轻刮下培养物,用无菌水匀浆,制成菌丝悬浮液。用喷壶将菌丝悬浮液均匀地喷洒到健康的橡胶嫩叶上;以喷洒无菌清水的橡胶嫩叶为对照。接种后套上塑料袋保湿48 h,每处理6 株,重复3 次。2 d 后逐日观察接种植株的发病情况。根据柯赫氏法则,将接种后发病的橡胶叶片再进行分离,观察分离菌株与原始菌株的培养性状和形态特征是否一致。
1.4 病原菌防治药剂的筛选
用直径为5 mm 的打孔器在活化的病原菌菌落边缘打取菌饼,接入到含不同杀菌剂的CA 培养基上,每个处理3 次重复,以不含杀菌剂的CA培养基为对照,28 ℃培养4 d,用十字交叉法测量菌落直径,计算菌落生长抑制率(式1);并以药剂含量对数为横轴(x),菌落生长抑制率的机率值为纵轴(y)制作毒力曲线,求出毒力回归方程:y=ax+b,计算不同药剂对病原菌的半数效应剂量(EC50)。
1.5 数据统计
采用SPSS 24软件进行数据的统计和分析。
2 结果与分析
2.1 病害的田间症状
病害的主要受害品系为RRIM 600,GT1 品系少量受害,病害在临江林段、林段中部及山顶林段均有发生。受害林段叶片变红、变黄、变稀疏,大量落叶。受害症状主要表现为叶片上有暗绿色至黑褐色水渍状病斑,表面有一层白色霜霉状物;大叶柄基部呈现水渍状黑色病斑,受害变黑的叶柄部通常有白色凝胶渗出(图1)。该病害的田间症状与橡胶树季风性落叶病典型症状一致。

图1 橡胶树落叶病田间症状Fig. 1 Symptoms of abnormal leaf fall diseases on rubber tree in field
2.2 病原菌分离及致病性测定
经组织分离法从橡胶病样上分离获得真菌分离物,经菌丝尖端挑取法纯化后,获得菌落形态相同的20 株分离物,采用活体接种法进行致病性测定,发现所有分离物均能使橡胶树叶片发病,发病症状与田间症状表现一致。
如图2 所示,将分离病原菌接种于健康叶片4 d后,被侵染叶片形成水渍状病斑,表面有白色霜霉层,且病斑边缘有凝胶渗出;去除保湿用的塑料袋后,病斑不再继续扩展。从发病叶片病斑上经反分离,获得与原接种病原菌形态特征相同的分离物,表明获得的分离物为橡胶树落叶病致病菌。

图2 病原菌菌丝悬液接种后的橡胶树叶片症状Fig. 2 Pathogenicity assay conducted on rubber tree leaves with the mycelium suspension and the symptoms
2.3 形态学及生理学特征
分离获得的20 株橡胶树落叶病致病菌分离物具有一致的形态特征和生理学特性。由图3 可知,病原菌在5、10 和35 ℃时不能生长,最适生长温度为25~30 ℃,最高生长温度35 ℃;28 ℃黑暗条件下,病原菌在CA 培养基上生长良好,生长速率为(15.20±0.47) mm·d-1;菌落白色,呈花瓣状,边缘不规则,菌丝紧贴培养基表面生长。
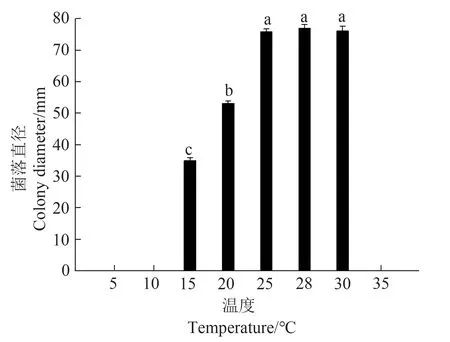
图3 不同温度下病原菌菌丝生长情况Fig. 3 Mycelial growth of the pathogen at different temperature on CA medium
由图4 可知,菌丝粗细较均匀,宽3.15~5.18 µm,分枝处略缢缩,偶有珊瑚状菌丝膨大体,未见厚垣孢子。孢囊梗有简单的合轴分枝,成簇形成。孢子囊椭圆形、卵圆形,大小(14.80~28.81) µm× (10.65~20.19) µm,平均21.15 µm×14.21 µm,长宽比1.49,孢子囊乳突明显,半球形,多数为1个,孢子囊成熟后脱落,孢子囊柄较短,平均11.87 µm。单独培养条件下不形成有性器官。
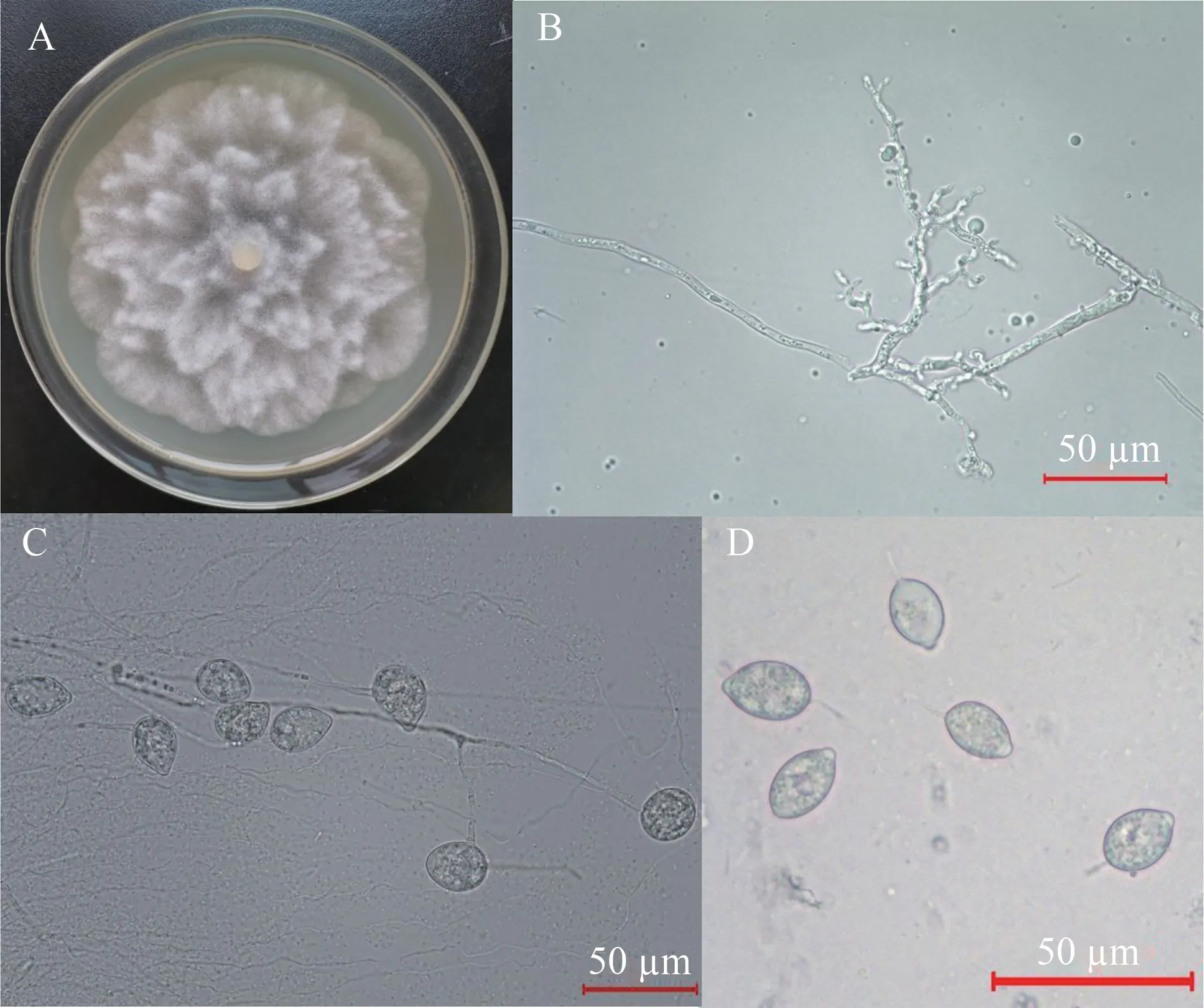
图4 CA培养基上病原菌的形态特征Fig. 4 Culture characteristics and microscopic features of the pathogen on CA culture medium
根据余永年等[20]的橡胶树疫霉种(Phytophthora)分种检索表,结合Chee[9]、中国真菌志(第6 卷)[25]、郑小波等[26]的描述,将病原菌初步鉴定为簇囊疫霉(Phytophthora botryosa)。由此表明,近年西双版纳植胶区橡胶树落叶是由季风性落叶病引起。
2.3 分子生物学分析
为了进一步明确分离菌的分类地位,对其进行分子生物学鉴定。选取菌株ML-2,使用引物ITS1/ITS4扩增产生的rDNA-ITS序列长度为799 bp,登录号:OP753718,BLASTn 同源性比对与簇囊疫霉(P. botryosa)模式菌株CBS 581.69(登录号:MH401211)的相似性达99.75%,与菌株LFDL1.1.1(登录号:KC247900)的相似性为100%;使用引物FM82/FM78扩增的COX Ⅱ基因片段为600 bp,登录号:OP776413,BLASTn 同源性比对与簇囊疫霉(P. botryosa)模式菌株CBS 581.69(登录号:MH760280)的相似性为99.83%,与菌株P1044(登录号:JN618581)的序列相似性为100%。
利用MEGA X 基于ITS和COX Ⅱ序列构建系统进化树,结果(图5)表明,病原菌ML-2 与簇囊疫霉(P. botryosa)聚到同一分支,亲缘关系最近。因此,根据分子生物学分析结果,并结合病原菌形态学及生理学特征,将病原菌ML-2鉴定为簇囊疫霉(P. botryosa)。
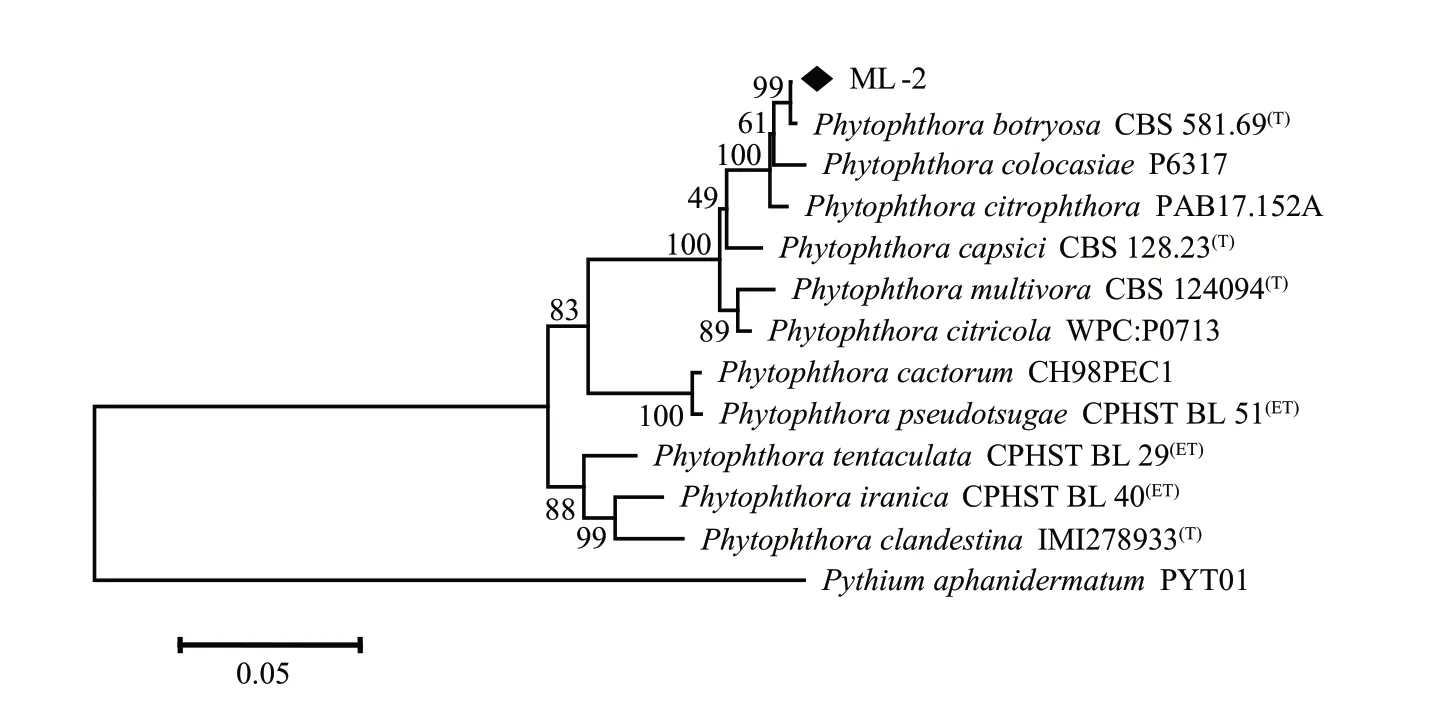
图5 基于ITS-COX Ⅱ基因联合序列的系统发育分析Fig. 5 Phylogenetic analysis based on concatenated sequences of ITS and COX Ⅱ
2.5 防治药剂筛选
由表3 可知,15 种供试药剂对病原菌ML-2 表现出不同的抑制效果,除80%三乙膦酸铝水分散粒剂、250 g·L-1嘧菌酯悬浮剂、500 g·L-1多菌灵悬浮剂外,其余药剂对病原菌均表现出一定的抑制作用,但不同杀菌剂的抑制效果存在差异。48%烯酰·氰霜唑悬浮剂、80%烯酰吗啉水分散粒剂、30%烯酰·甲霜灵水分散粒剂、35%烯酰·霜脲氰悬浮剂、30%氟吡菌胺·甲霜灵水分散粒剂、0.3%四霉素水剂对病原菌ML-2 菌丝生长的抑制效果较好,EC50分别为0.137 1、0.175 9、0.201 7、0.257 7、0.265 1、0.351 0 mg·L-1;其次为25%甲霜·霜霉威可湿性粉剂和72%甲霜·锰锌可湿性粉剂,EC50分别为0.837 4 和3.295 2 mg·L-1;500 mg·L-1多菌灵悬浮剂的抑制效果最差,EC50为20 671.976 3 mg·L-1。
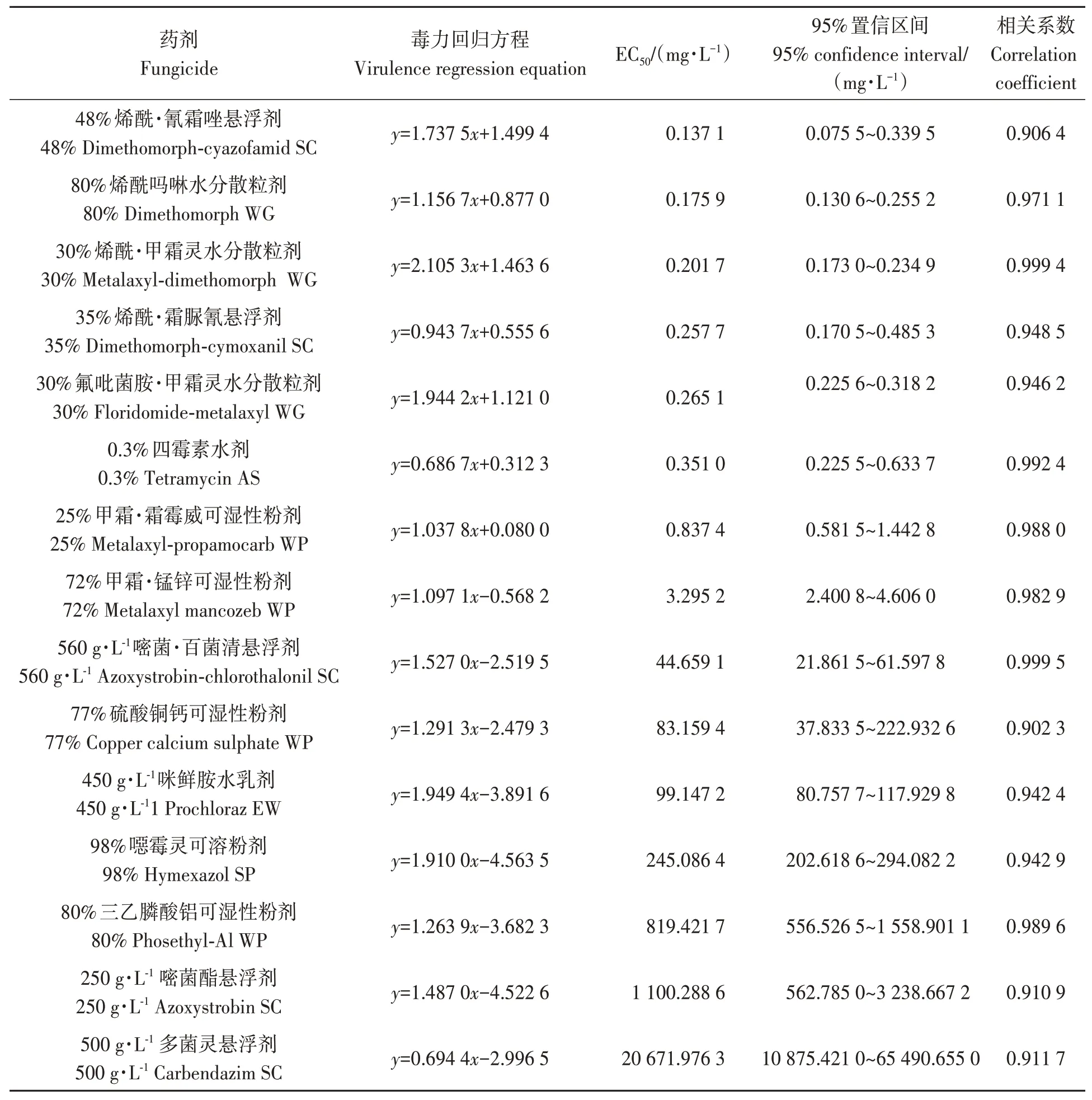
表3 15种杀菌剂的室内毒力测定Table 3 Toxicity of fifteen fungicides to Phytophthora botryosa
3 讨论
本研究通过病原菌分离纯化、柯赫氏法则验证,同时结合形态学特征、生理学特性及分子生物学鉴定,明确了西双版纳州橡胶树非正常落叶是由橡胶树季风性落叶病引起,病原菌为簇囊疫霉(P. botryosa),这是首次在我国植胶区内发现该病原菌侵染引起橡胶树季风性落叶病。簇囊疫霉是越南、泰国、马来西亚等东南亚植胶区季风性落叶病的优势致病菌,但我国仅在福建漳州芋叶上分离到该致病菌。研究表明,柑橘褐腐疫霉(P.citrophthora)是西双版纳地区橡胶树季风性落叶病病原菌的主要优势种[13,27]。本研究未分离到该病原菌,这可能是由于环境条件、栽培时间、栽培管理措施、栽培品系等的改变,导致橡胶树季风性落叶病病原菌的种类、优势种、致病力等也发生变化,亟须开展相关基础研究工作。
Wastie 等[28]研究表明,当连续4 d 最高气温低于32.3 ℃、14 h内相对湿度达到90%,或者当日均降雨量超过2.5 mm 时,橡胶树很容易暴发季风性落叶病。西双版纳植胶区发生季风性落叶病时,正是出现连续8~10 d 的阴雨天气,日照少,相对湿度大,且日最高温度不超过30 ℃。因此,在雨季各植胶区应密切关注天气情况,尽可能及早预防。
目前,生产上防治疫霉属真菌引起的橡胶树季风性落叶病最普遍、有效的方法仍是化学防治,如采用甲霜灵、苯醚锰锌油烟剂喷雾[14],铜油剂、敌菌丹油剂弥雾喷施[29-30],氯氧化铜或胶态铜等铜素杀菌剂溶于油中热雾喷施,甲霜灵可湿性粉剂、64%杀毒矾可湿性粉剂、72%霜霉威水剂喷雾[31]等可防治该病害。但到目前为止,国内尚未见登记用于防治橡胶树季风性落叶病的药剂,也未见防治药剂筛选的相关报道。橡胶树属于高大乔木,在防治药剂剂型的选择上会更倾向于烟雾剂,但随着植保无人机的使用,药剂剂型不再是限制因素。甲霜灵(苯基酰胺类杀菌剂)、烯酰吗啉(羧酸酰胺类)、氰霜唑(磺胺咪唑类)、霜脲氰(氰基乙酰胺类)和嘧菌酯(甲氧基丙烯酸类)是生产上广泛用于防治卵菌病害的内吸性杀菌剂,单独使用一类杀菌剂时,病原菌易对其产生抗药性,导致病害防治失败,不同类型杀菌剂混合使用,在一定程度上可以降低病原菌产生抗药性的机率[32]。本研究测定了15种生产上常用于防治卵菌纲的杀菌剂对橡胶树季风性落叶病病原菌的抑菌活性,结果表明,这几种杀菌剂的复配剂对P. botryosa菌丝生长均具有较好的抑制效果,但250 g·L-1嘧菌酯悬浮剂的抑菌效果较差,这可能是由于嘧菌酯的主要作用是抑制孢子萌发及游动孢子的释放和游动,对病害治疗作用差[33]。本研究表明,0.3%四霉素水剂对该病原菌的菌丝生长也具有较好的抑制效果。四霉素作为广谱、高效、低毒的农用抗生素类生物杀菌剂,不仅可以有效防治病害,还可以诱导寄主体内防御酶活性升高,提高寄主抗病能力[34]。因此0.3%四霉素水剂对防治橡胶树季风性落叶病具有很大的应用潜力,可作为候选药剂单独或与其它类型的杀菌剂混配使用。胶农由于缺乏对病害的正确认识,存在乱用、滥用药剂的情况,例如多菌灵是其经常使用的药剂,但多菌灵对卵菌无活性。因此,加强基层胶农或药剂销售商对病害病原菌种类的认识、选择适合的防治药剂也是今后亟需开展的工作。
本研究表明,48%烯酰·氰霜唑悬浮剂、80%烯酰吗啉水分散粒剂、30%烯酰·甲霜灵水分散粒剂、30%氟吡菌胺·甲霜灵水分散粒剂、35%烯酰·霜脲氰悬浮剂、0.3%四霉素水剂可用作簇囊疫霉引起的橡胶树季风性落叶病防治的备选药剂,为田间药剂防治提供了理论依据,但药剂的最终防效还有待田间试验进一步验证。

