奥马珠单抗治疗慢性自发性荨麻疹疗效相关的标志物
杜志荣,支玉香,李论
慢性自发性荨麻疹(chronic spontaneous urticaria,CSU)是指持续超过6周的自发性皮肤风团伴或不伴血管性水肿,常伴剧烈瘙痒[1]。全球患病率高达1%~2%[2],严重影响患者的生活质量[3]。CSU是一种慢性炎症性皮肤病,其病因及发病机制复杂,涉及多种免疫细胞、细胞因子及炎症介质[2]。目前认为,肥大细胞和嗜碱性粒细胞异常活化及脱颗粒是CSU发作的基本致病过程[4]。
根据EAACI/GA2LEN/EDF/WAO指南,CSU的一线治疗方案为第二代非镇静抗组胺药(second generation antihistamine,sgAH),当常规剂量无法控制症状时,可逐渐增量至四倍作为二线选择[1]。但约有30%的患者,即使使用加倍剂量的sgAH,仍无法控制症状[5]。奥马珠单抗作为一种重组人源化抗免疫球蛋白E(IgE)单克隆抗体,可结合游离IgE,抑制IgE与肥大细胞、嗜碱性粒细胞结合,从而抑制效应细胞活化,阻断IgE介导的炎症反应[6]。欧洲已于2014年将奥马珠单抗批准为治疗CSU的三线药物,并于2022年将奥马珠单抗列为2线药物[1]。

图1 不同应答组患者的基线特征及总IgE预测价值
虽然奥马珠单抗治疗CSU的有效性已得到充分证实[7],但国外报道仍有约10%的患者对奥马珠单抗治疗无应答[8]。由于奥马珠单抗治疗CSU疗效存在个体差异[9],因此探索可预测奥马珠单抗疗效的标志物具有重要临床意义。目前国内相关研究较少。本研究旨在通过回顾性分析奥马珠单抗治疗CSU患者的临床特征及实验室指标,寻找与奥马珠单抗疗效相关的标志物,为我国CSU患者的临床治疗提供参考。
1 对象与方法
1.1 研究对象
纳入2018年12月至2022年3月于北京协和医院变态反应科诊断为CSU并接受奥马珠单抗治疗的71例患者。纳入标准:(1)符合2018年中国荨麻疹诊疗指南中CSU诊断标准[10];(2)所有患者均经过3~4倍常规剂量抗组胺药治疗效果不佳或无效;(3)至少接受12周奥马珠单抗治疗。同时排除胆碱能性、寒冷性、日光性、人工性等诱导性荨麻疹。
1.2 研究方法
1.2.1 临床资料收集:回顾性收集患者的一般资料,包括性别、年龄、体重指数(body mass index,BMI)、病程、伴随疾病,治疗前外周血总IgE、D二聚体、红细胞沉降率(erythrocyte sedimentation rate,ESR)、超敏C反应蛋白(hypersensitivity C-reactive protein,hsCRP)、25羟基维生素D、甲状腺自身抗体、抗核抗体(antinuclear antibodies,ANA)检查结果。
1.2.2 治疗方案:纳入患者均接受奥马珠单抗 (商品名茁乐©,瑞士诺华公司生产)治疗,治疗剂量为300 mg,每4周皮下注射1次,治疗至少12周。
1.2.3 疗效评估:收集患者奥马珠单抗治疗开始前及开始后的第1周及第12周的7天荨麻疹活动度评分 (urticaria activity score,UAS7),确定疾病活动度。UAS7是1周内每日发作的风团数目和瘙痒程度总分,包括风团数量(无风团/24 h=0分;<20个风团/24 h=1分;20~50个风团/24 h=2分;>50个风团/24 h=3分)和瘙痒程度(无瘙痒/24 h=0分;轻度瘙痒/24 h=1分;中度瘙痒/24 h=2分;严重瘙痒/24 h=3分),每日评分为风团与瘙痒总分,范围为0~6分,1周连续最高评分为42分。UAS7严重程度分级:<7分为疾病控制良好;7~15分为轻度;16~27分为中度;≥28分为重度[11-12]。
根据奥马珠单抗治疗反应,将患者分为应答组与无应答组。其中应答组包括早期完全应答,是指奥马珠单抗治疗后1周内CSU症状完全消失(UAS7为0);晚期完全应答,是指奥马珠单抗治疗开始后12周内CSU症状完全消失(UAS7为0);晚期部分应答,是指与基线相比,第12周UAS7至少减少30%。无应答组,是指在第12周UAS7减少低于 30%或病情恶化[13]。
1.3 统计学分析
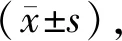
2 结果
2.1 临床特征
共纳入奥马珠单抗治疗CSU患者71例,男性28例(39.4%),女性43例(60.6%);确诊时平均年龄为(42.23±14.08)岁;中位病程为5.5(IQR:2~24)个月;中位基线UAS 7评分为35(IQR:25.5~36.0)。患者BMI中位数为24.28(IQR:22.74~32.28)kg/m2。23.9%(17/71)患者合并过敏性鼻炎,11.3%(8/71)合并过敏性哮喘,1.4%(1/71)合并食物过敏,1.4%(1/71)合并特应性皮炎,4.2%(3/71)合并药物过敏;2例(2.8%)患者合并甲状腺疾病,均为甲状腺功能亢进。
2.2 实验室检查
奥马珠单抗治疗前总IgE中位水平为116(IQR:52.15~273.50)kU/L。64.0%(16/25)患者D二聚体水平升高,18.75%(3/16)ESR水平升高,22.73%(5/22)hsCRP水平升高。25羟基维生素D中位水平为16.60(IQR:11.45~23.70)ng/mL。6.98%(3/43)ANA阳性。15.20%(5/33)抗甲状腺球蛋白抗体阳性,21.20%(7/33)抗甲状腺过氧化酶抗体阳性。
2.3 疗效评估
88.7%(63/71)患者奥马珠单抗治疗有效,中位起效时间为治疗后3(IQR:2~4.75)d。56.30%(40/71)患者对奥马珠单抗治疗完全应答,其中55%(22/40)为早期完全应答,45.0%(18/40)为晚期完全应答。32.4%(23/71)患者对奥马珠单抗治疗晚期部分应答,11.3%(8/71)患者无应答。
根据基线UAS7评分,71例患者中20例为轻-中度(UAS7 7~27分),51例为重度(UAS7≥28分)。奥马珠单抗在轻-中度组的有效率为100%(20/20),其中50.0%(10/20)为早期完全应答,40.0%(8/20)为晚期完全应答,10.0%(2/20)为晚期部分应答;奥马珠单抗在重度组的有效率为84.3%(43/51),其中23.5%(12/51)为早期完全应答,19.6%(10/51)为晚期完全应答,41.2%(21/51)为晚期部分应答,15.7%(8/51)患者无应答。
2.4 与奥马珠单抗疗效相关的影响因素
应答者和无应答者的性别、年龄、BMI、病程、合并过敏性疾病及甲状腺疾病比例、基线UAS7评分比较无显著差异。应答组基线总IgE水平显著高于无应答组(123.5 kU/Lvs.46.6 kU/L,P=0.024)。在总IgE升高的患者中,奥马珠单抗的应答率显著高于总IgE正常的患者(97.8%vs.68.4%P=0.002)。两组患者的D二聚体、ESR、hsCRP、25羟基维生素D水平、ANA阳性率及甲状腺自身抗体阳性率比较均无显著差异(表1)。

表1 奥马珠单抗治疗应答与无应答CSU患者临床资料比较Table 1 Comparison of clinical characteristics between omalizumab response and non-response CSU patients
晚期完全应答患者年龄显著小于晚期部分应答患者(35.35岁vs.46.81岁,P=0.042)(图1A);与晚期完全应答组相比,早期完全应答组及晚期部分应答组奥马珠单抗的起效时间更早(图1B)。四组患者基线总IgE水平存在显著差异(P=0.043),经Bonferroni法进一步两两比较显示,与无应答组相比,晚期完全应答患者总IgE水平显著高于无应答组(P=0.03),早期完全应答及晚期部分应答组患者总IgE水平比无应答组高,但差异无统计学意义(图1C)。早期完全应答、晚期完全应答及晚期部分应答三组间总IgE水平比较无统计学差异(表2)。

表2 临床和实验室指标与奥马珠单抗疗效的关系
2.5 ROC曲线分析总IgE水平对奥马珠单抗治疗CSU疗效的预测价值
ROC曲线分析显示,总IgE水平预测CSU患者使用奥马珠单抗疗效的ROC曲线下面积为0.764(95%CI:0.520~1.000,P=0.024)。总IgE的最佳临界值为56.1 kU/L,敏感度为81.0%,特异度为85.7%(图1D)。
基线总IgE水平低于56.1 kU/L,奥马珠单抗效果欠佳,治疗12周后有35.3%(6/17)的患者无应答;而基线总 IgE水平高于56.1 kU/L时,治疗 12 周后仅有 2.1%(1/48)无应答。
3 讨论
CSU是由肥大细胞和嗜碱性粒细胞病理性激活所致[4],其确切机制仍不清楚。可能涉及两种类型的自身免疫机制[14],一种为自身过敏,由抗自身抗原(如甲状腺过氧化物酶,双链DNA,组织因子或IL-24等)的IgE抗体驱动;另一种为自身免疫,由抗IgE或抗高亲和力IgE受体(FcεRI)的IgG自身抗体引起。奥马珠单抗可通过选择性地与游离IgE结合,降低游离IgE水平,阻止IgE与肥大细胞、嗜碱性粒细胞以及其他携带FcεRI的细胞(如树突状细胞)上的FcεRI结合。随着游离IgE的减少,空置的FcεRI内化和降解,FcεRI的数量也随之减少[15],进而抑制CSU的临床症状。
多项临床研究证实了奥马珠单抗治疗CSU的有效性。与本研究结果类似,一项针对中国人群的研究显示,在奥马珠单抗治疗第12周,疾病达到部分或完全控制的比例为78.0%;治疗24周,奥马珠单抗有效率达89.8%[16]。一项针对470例意大利CSU患者的多中心回顾性研究显示,经12周奥马珠单抗治疗,约70%患者得到完全缓解,其中约65%的患者为早期完全应答,约35%的患者为晚期完全应答[13]。荟萃分析显示,奥马珠单抗治疗CSU的完全应答率为72.2%,部分应答率为17.8%[17]。本研究发现,88.7%的患者奥马珠单抗治疗12周后达到部分或完全应答,56.3%的患者完全应答,其中55.0%为早期完全应答,45.0%为晚期完全应答。进一步根据患者基线UAS7评分对患者进行分层,发现奥马珠单抗在轻-中度组的有效率高于重度组(100%vs.84.3%)。轻-中度组中,50%为早期完全应答,40%为晚期完全应答,10%为晚期部分应答。由此可见,奥马珠单抗疗效可能受基线病情严重程度影响。本研究中奥马珠单抗治疗CSU总体应答率较低,可能与单中心研究人群病情较重及选择的观察终点时间较短有关。本研究显示晚期完全应答患者年龄明显小于晚期部分应答患者,但应答组与无应答组之间以及三个应答组组间患者年龄无差异。既往文献未发现年龄与奥马珠单抗疗效的关系,故年龄与治疗反应的关系尚不明确[18]。与晚期完全应答组相比,早期完全应答组起效时间更早,但该差异也存在于晚期完全应答组及晚期部分应答组,故起效时间早,不一定可达到完全应答的治疗效果,因此无法根据奥马珠单抗的起效时间,预测治疗12周是否可达到完全应答。
与既往研究结果[19-21]一致,本研究奥马珠单抗应答组CSU患者的基线总IgE水平显著高于无应答组(123.5 kU/Lvs.46.6 kU/L,P=0.024)。一项多中心回顾性研究证实,升高的基线IgE水平与奥马珠单抗治疗完全应答相关[22]。Straesser等[23]研究发现,对奥马珠单抗无应答的患者IgE水平显著低于部分应答者和完全应答者。本研究发现,不同应答组的基线总IgE水平不同,但上述差异均无统计学意义;只有无应答组与晚期完全应答组之间的总IgE水平差异具有统计学意义。因此,本研究仅可根据基线总IgE水平评估奥马珠单抗是否有效,但无法根据基线总IgE水平推断奥马珠单抗的应答程度。考虑到按照奥马珠单抗的不同应答程度分组后各组样本量较小,本结论有待在大样本研究中进一步验证。本研究显示,总IgE水平高于56.1 kU/L时,奥马珠单抗治疗效果更好。Ertas 等[19]研究显示,基线总IgE水平低于43 kU/L,奥马珠单抗效果不好,治疗12周后有33%的患者无应答;而基线总 IgE水平高于43 kU/L时,治疗 12 周后仅有5%无应答。
CSU的发病与自身免疫密切相关[24]。ANA是一组针对细胞核中相应抗原的自身抗体,在CSU患者中的阳性率为10%~14%[25]。与之类似,本研究ANA阳性率为6.98%。文献报道,在自身免疫(IgG自身抗体)引起的CSU患者中,奥马珠单抗疗效较差[26]。本研究奥马珠单抗无应答组ANA阳性率高于应答组,但差异无统计学意义,有待进一步完善大样本研究。凝血级联反应可能参与CSU发病[27]。研究表明,在奥马珠单抗治疗有效的CSU患者中,D二聚体基线水平显著高于奥马珠单抗无效的患者[20]。在重度CSU患者中,血浆D二聚体基线水平升高与奥马珠单抗的迅速反应有关。但本研究及Marzano等[13]研究均未发现基线D二聚体水平与奥马珠单抗疗效的相关性,需要进一步完善前瞻性研究。
作为单中心回顾性研究,本研究存在样本量小及部分临床数据不全等不足,研究结果尚需大样本前瞻性研究进一步验证。目前国内关于奥马珠单抗治疗CSU疗效相关标志物的研究有限,本研究通过分析奥马珠单抗治疗CSU患者的临床特征及疗效,有助于了解中国人群与奥马珠单抗疗效相关的标志物,对临床治疗有一定的指导意义。
综上所述,CSU患者的基线总IgE水平与奥马珠单抗疗效有关,基线总IgE水平大于56.1 kU/L,预示奥马珠单抗治疗有效。ANA及D二聚体与奥马珠单抗疗效之间的相关性有待进一步研究。

