激素和逆境胁迫对大豆维生素E和γ-TMT表达的影响
白苗 田雯青 武帅 王敏 王利祥 岳爱琴 牛景萍 张永坡高春艳 张武霞 郭数进 杜维俊 赵晋忠
(1. 山西农业大学农学院,太谷 030801;2. 山西农业大学基础部,太谷 030801;3. 山西农业大学生命科学学院,太谷 030801)
维生素E又名生育酚[1],能够抗不孕、抗氧化、保持红细胞完整性、调节体内DNA的生物合成,是最主要的抗氧化剂之一。天然维生素E广泛存在于各种油料种子及植物油中。大豆中维生素E含量约为18.90 mg/100 g,远远超过所有谷类食品[2]。膳食中,维生素E的主要来源就是大豆[3-4]。维生素E是光合产物α-、β-、γ-和δ-生育酚的总称,它们都有抗氧化特性,由于人类肝脏中有α-生育酚转移蛋白,所以α-生育酚具有最高的相对维生素E活性(100%),β-、γ-和δ-生育酚的维生素E活性分别为50%、10%和3%。γ-生育酚甲基转移酶(γ-TMT)催化δ-和γ-生育酚转化为β-和α-生育酚,是决定植物维生素E组分及活性的关键酶之一[5]。
维生素E在作物生长发育抵御逆境胁迫发挥重要作用,在改善动物和人类内脏功能,保持生物体健康方面的研究非常多。目前,关于大豆籽粒维生素E含量积累研究相对较多,例如,气候条件[6-7]、稀土镧、铈[8]对大豆籽粒维生素E组分含量及品质的影响、大豆维生素E组分含量特异种质的鉴定及优异种质资源的挖掘[9]等,而对于维生素E响应激素和逆境胁迫的研究相对较少。通过对模式植物拟南芥外源喷施5 mmol/L维生素E发现,经处理的拟南芥单株种子产量显著高于野生型拟南芥,且提升了拟南芥的抗氧化能力[10-11],表明根茎叶中维生素E组分含量与植物抗逆性有关。Cela等[12]和Casadesús等[13]发现在拟南芥乙烯信号传导(EIN3‑1)、感知(ETR1‑1)和乙烯过量产生(ETO1‑1)的突变体中,EIN3‑1的突变延迟了α-生育酚与水分胁迫相关基因的增加,并导致α-生育酚水平降低约30%,而ETR1‑1和ETO1‑1突变体在叶片老化过程中α-生育酚水平急剧增加(高达5倍),表明乙烯感知和乙烯信号传导可能参与水分胁迫和叶片老化过程中生育酚生物合成的调控。Maeda等[14]和König等[15]证明低温处理的VTE2具有独特的多不饱和脂肪酸(PUFAs)组成,与野生类型相比,亚麻酸(18:3)水平较低,亚油酸水平(18:2)较高,生育酚在低温下调节拟南芥的质外多不饱和脂肪酸代谢。
γ-生育酚甲基转移酶(γ-TMT)可以催化生物活性较低的γ-生育酚甲基化生成更高生物活性的α-生育酚,γ-TMT产物是决定植物维生素E组分及活性的关键酶之一。目前,大豆γ-生育酚甲基转移酶基因应对激素和逆境胁迫的研究较少,董强[16]对大豆植株进行低温胁迫处理,观察到低温胁迫使叶片中总维生素E含量增加,GmTMT‑2转录本很高,揭示了基因在低温胁迫下的重要作用。通过对紫花苜蓿[17]、辣椒[18]、花生[19-20]等作物的γ-生育酚甲基转移酶基因在抗旱抗盐等逆境方面的研究表明,过量表达MsTMT显著促进紫花苜蓿叶片中α-生育酚的合成及总生育酚含量的提高,转基因苜蓿抗旱性显著增强,叶片氧化损伤显著减轻,渗透调节物质积累增多[21-23]。贾会丽等[24]发现MsTMT在紫花苜蓿叶片中表达量最高,受NaCl、PEG及黑暗诱导后MsTMT表达上调,低温胁迫后MsTMT表达下降,外源ABA不影响MsTMT的表达。在干旱条件下,过表达拟南芥VTE1到转基因烟草中,叶绿素含量较野生型增加,VTE1可用于增加植物的维生素E含量,并增强对环境胁迫的耐受性[25-28]。研究者从拟南芥中分离出来两个胁迫诱导启动子和龙葵的VTE2.1基因,在胁迫诱导型启动子控制下转基因烟草植株在干旱条件下表现出α-生育酚水平的增加,增加植物体内维生素E的含量,并减少环境胁迫对植物的不利影响[29-30]。
目前,关于大豆富含维生素E的研究主要集中在大豆种子维生素E积累方面研究,鲜见关于维生素E及其合成关键酶γ-TMT参与大豆激素和逆境胁迫响应的报道。
本研究通过对大豆在激素和逆境胁迫下幼苗各组织维生素组分含量及γ-TMT的表达模式进行研究,探讨大豆维生素E组分含量及其γ-TMT表达与激素和逆境的关系,从而为维生素E参与逆境胁迫开辟新思路。
1 材料与方法
1.1 材料
试验大豆品种为晋大88号,由山西农业大学选育,是山西省主栽品种之一。
1.2 方法
1.2.1 γ-TMT1-γ‑TMT3的生物信息学分析 利用DNAMAN进行氨基酸序列比对;利用MG2C2.0进行染色体定位;利用Plant‑CARE、Tbtools预测启动子的顺式作用元件。
1.2.2 逆境胁迫环境下植物形态生理指标的测定 在温度、湿度合适的专用苗室内进行试验,将大豆种子播种于20 cm×15 cm的育苗盆中,以蛭石作为基质,每穴2株,3次重复,采用随机区组设计。待真叶完全展开后,以浓度为150 mmol/L NaCl、330 mmol/L H2O2、100 mmol/L PEG、300 mg/L SA、0.20 mg/L ABA低氮营养液进行胁迫处理,等量低氮营养液为对照,每2 d浇水1次,每盆浇水1.5 L[31-34]。二出复叶完全展开时,用SPAD‑502型叶绿素测定仪测定顶叶到一叶SPAD值,每隔3 d测量1次。第16天对维生素E、株高、鲜重、含水量等各指标测定。
1.2.3 逆境胁迫环境下植物根、茎、叶维生素E含量的测定 采用高效液相色谱法测定大豆维生素E[35-36]。选取处理后的根、茎、叶组织于‑20℃保存24 h后,在冷冻干燥箱中冷冻干燥48 h,研磨成粉,取0.100 0 g加入抗坏血酸0.125 g、70%乙醇提取液3 mL,振荡混匀30 s,超声提取20 min,再加入正己烷6 mL,振荡混匀30 s,超声提取15 min,取出后12 000 r/min离心8 min,上清液使用平衡浓缩仪氮气下吹干,复溶于甲醇中备用。色谱条件:流动相为甲醇,柱温35℃,检测波长295 nm,流速1.0 mL/min,测量维生素E中各组分含量。
1.2.4 逆境胁迫环境下γ-TMT的表达分析 选取经SA、H2O2、PEG、ABA处理后0、3、8、18、36和48 h的幼苗根、叶,以及经NaCl处理后0、4、8、18、36和72 h的幼苗根、叶。选取生长状态一致的材料,每个样品3次生物学重复[37-40]。液氮速冻,‑80℃保存备用。利用Bio‑Rad CFX96实时荧光定量PCR仪,采用全式金TransStart®Tip Green qPCR Super‑Mix试剂盒进行荧光定量PCR。根据γ-TMT序列,使用Primer Premier6软件设计实时荧光定量PCR引物(表1),GmCYP2为内参基因。计算γ-TMT的相对表达。
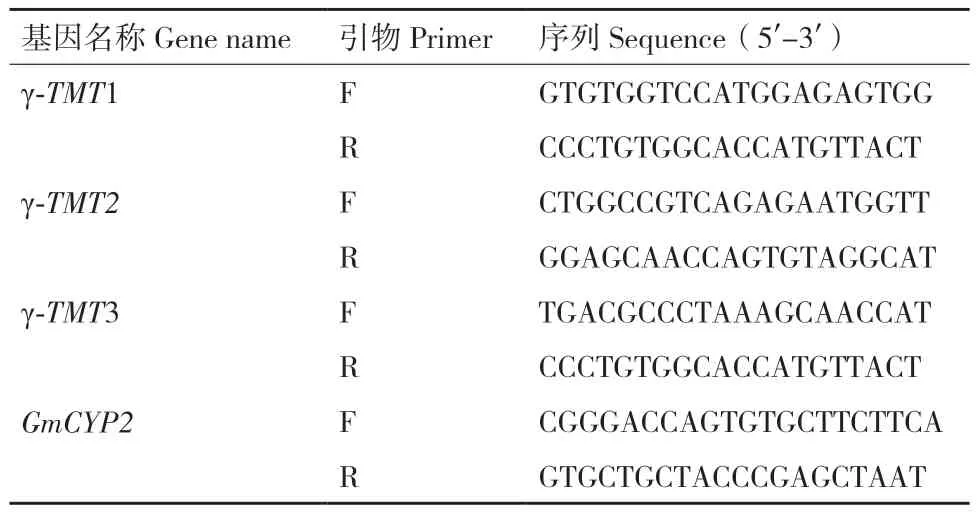
表1 γ-TMT的RT-qPCR扩增引物Table 1 Primers for RT-qPCR amplification of γ-TMT gene
2 结果
2.1 大豆γ-TMT的家族成员数量及染色体定位
大豆基因组中有3个γ-TMT,命名为γ-TMT1-γ‑TMT3。由染色体定位分析可知,γ-TMT1定位区间是在大豆第12染色体的1 020 482-1 023 990 bp,γ-TMT2定位区间在大豆第12染色体的1 028 184-1 031 945 bp,γ-TMT1和γ-TMT2定位区间比较靠近,γ-TMT3定位区间是在大豆第9染色体的45 209 996-45 214 333 bp。
2.2 γ-TMT氨基酸序列比对
通过序列比对发现(图1),γ-TMT1-γ-TMT3氨基酸序列相似性为80.15%,其中,有5个谷氨酸差异和7个丝氨酸差异,推测γ-生育酚甲基转移酶更多的丝氨酸差异可能是为甲基化反应提供更多的亚甲基集团以及反应所需的能量,催化反应的进行。

图1 γ-TMT氨基酸序列的比对Fig. 1 Amino acid sequence alignment of γ-TMT
2.3 γ-TMT上游2 000 bp启动子顺式作用元件的预测
γ-TMT1的上游顺式作用元件有脱落酸应答元件、植物抗旱元件、茉莉酸甲酯反应相关的调节因子、参与光反应的顺式作用调节元件、光响应的顺式调节元件、光敏感元件的一部分、参与防御和应激反应、参与水杨酸反应、光响应元件的一部分等,这些皆是参与胁迫、激素、伤害的元件。γ-TMT2的上游顺式作用元件有参与脱落酸反应的元件、厌氧诱导中必不可少的元件、植物抗旱元件、茉莉酸甲酯反应相关的调节因子、参与光反应的顺式作用调节元件、光响应要素、普通顺式作用元件参与低温反应的元件、参与防御和应激反应的顺式作用元件等,这些皆是参与胁迫、激素、伤害的元件。γ-TMT3的上游顺式作用元件有参与脱落酸反应的元件、植物抗旱元件、参与光反应的顺式作用调节元件、参与赤霉素反应的顺式作用元件、参与防御和应激反应的顺式作用元件、参与水杨酸反应元件等,这些皆是参与胁迫、激素、伤害的元件(图2)。
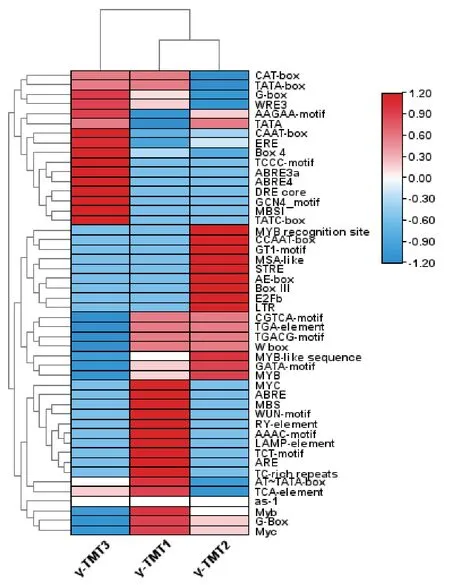
图2 γ-TMT启动子顺式作用元件预测热图Fig. 2 Prediction heat map of γ-TMT gene promoter cisacting element
2.4 不同激素和胁迫环境下植物幼苗生理形态的分析
2.4.1 不同激素和胁迫环境下叶片SPAD值 经PEG、SA、NaCl、ABA和H2O2处理7 d时,观察植物理化形态,株高、长势均低于对照,叶色却深于对照,SPAD值大于对照。随着植株生长,对照叶片湿润有光泽,而处理的材料叶片干涩萎蔫。经ABA处理13 d的植株萎蔫,经H2O2处理的植株叶片微卷曲,经PEG处理的叶片微卷、叶色微黄。同时,处理材料的叶片SPAD值伴随叶片水分的减少而降低,可能是胁迫处理阻止了Na+、CI-等离子流向叶片,使叶绿素的合成受到影响,活性氧的大量积累也导致叶绿素的合成遭受破坏,同时加速了叶绿素的降解。处理16 d时,对照长势旺盛,株高最高,SPAD值最低,推测由于实验室光强稍微过盛,叶片或叶绿体暴露在强光下会导致叶绿素含量下降,光合作用下降,叶绿素蛋白质复合物中的PSII核心的CPa受损,影响了LHCP,抑制PSII的活性,最终导致SPAD值降低(图3)。
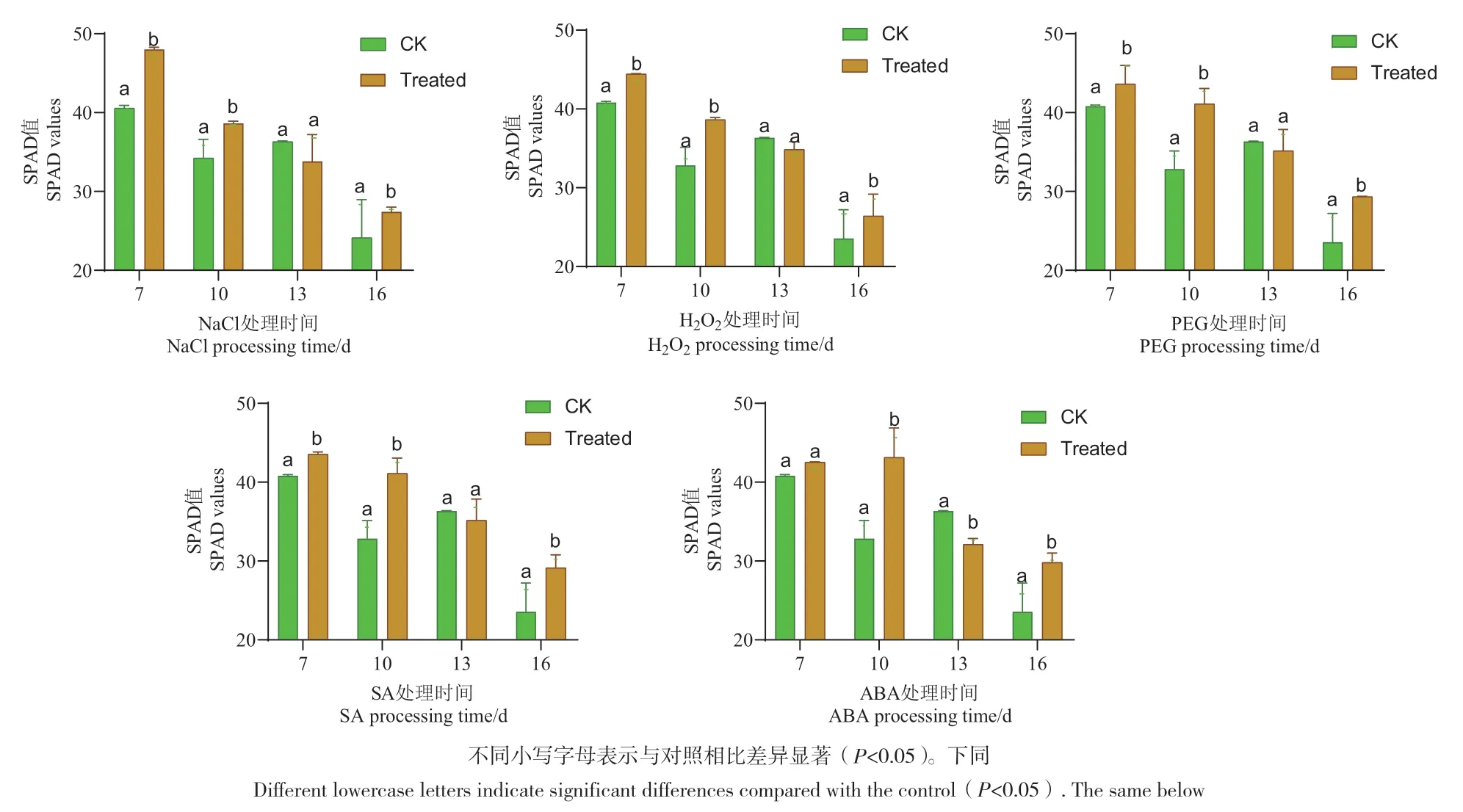
图3 激素和逆境胁迫环境下SPAD值Fig. 3 SPAD values in hormonal and adversely stress environment
2.4.2 不同激素和胁迫环境下植株鲜重、干重、含水量及株高的变化 由结果可知,NaCl、H2O2、PEG、SA、ABA处理后材料的株高约为CK的0.45、0.31、0.65、0.29和0.31倍,与CK相比,激素和胁迫处理后材料的株高显著低于CK的株高;NaCl、H2O2、PEG、SA、ABA处理后材料的鲜重约为CK的0.63、0.38、0.83、0.47和0.38倍,处理后材料鲜重显著低于CK。NaCl、H2O2、PEG、SA、ABA处理后材料的干重约为CK的0.84、0.41、0.83、0.70和0.60倍,与CK相比,H2O2处理后材料的干重显著低于CK,SA、ABA、PEG、NaCl处理后材料的干重低于CK。NaCl、H2O2、PEG、SA、ABA处理后材料的含水量约为CK的0.84、0.92、0.99、0.94和0.95倍,与CK相比,NaCl、H2O2、SA、ABA处理后材料的含水量显著低于CK,PEG处理后材料的含水量低于CK。CK三出复叶、第二次三出复叶抽出的时间显著早于激素和胁迫处理的植株,表明激素和逆境胁迫环境下大豆植株的生长被显著抑制。材料株高、鲜重干重以及含水量皆小于CK,植株生长处于一种受压迫的不利条件(图4)。
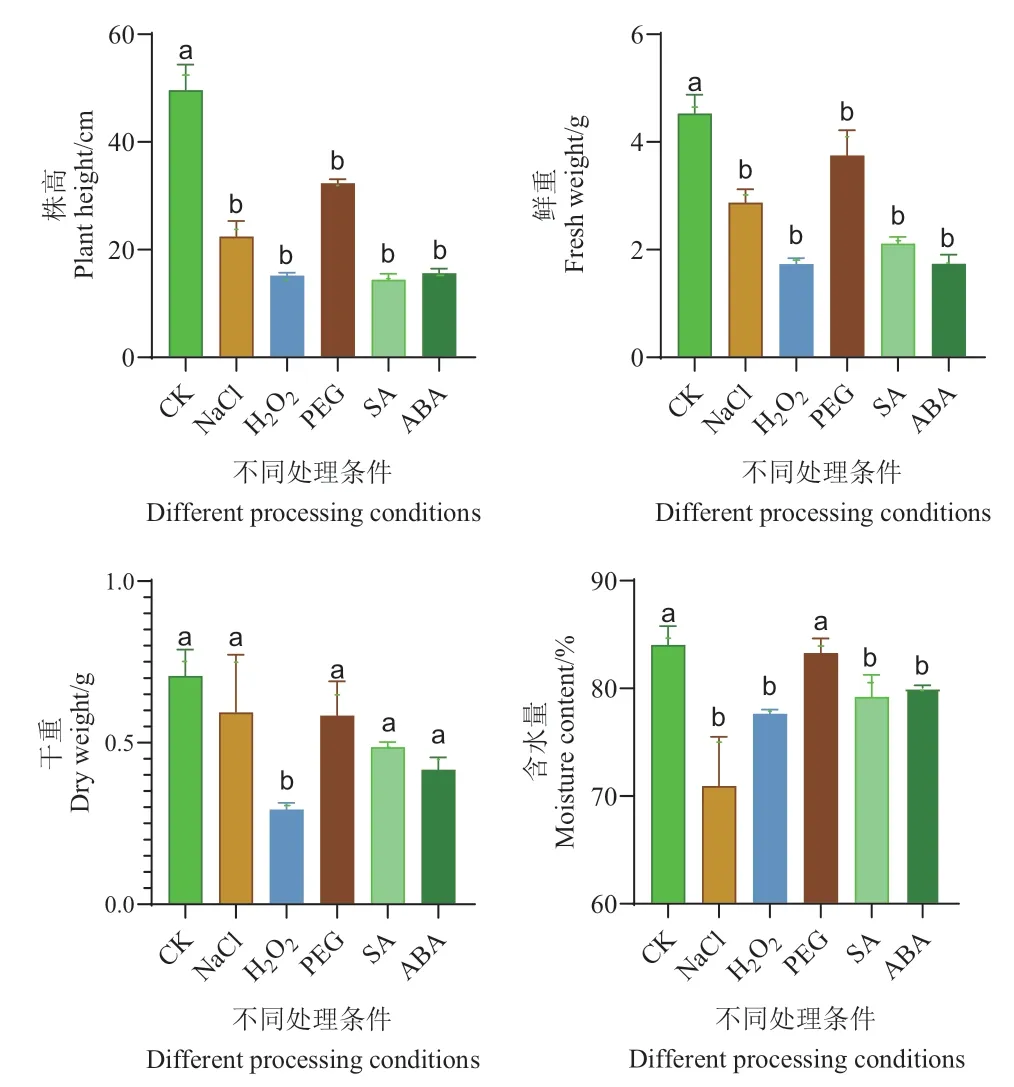
图4 激素和逆境胁迫环境下植物各生理指标测定Fig. 4 Determination of physiological indexes of plants under hormonal and adversely stress environment
2.5 逆境胁迫环境下植物根茎叶维生素E含量测定
2.5.1 逆境胁迫环境下植物根茎叶维生素E含量分析 晋大88经激素和逆境处理生长期16 d后,对其根茎叶维生素E含量进行测定,由表2可知,各生育酚标准品的线性回归方程R2≥0.999 7,说明各生育酚质量浓度与峰面积的线性条件良好。与CK相比,PEG、NaCl、H2O2、ABA、SA处理后的叶中总维生素E含量平均值约为CK总维生素E含量平均值的0.85、0.94、0.90、0.97和0.78倍(表3),激素和胁迫处理后的总维生素E含量平均值小于CK总维生素E含量平均值;在茎中,PEG处理后的总维生素E含量平均值约为CK总维生素E含量平均值的0.42倍,NaCl处理后的总维生素E含量平均值约为CK总维生素E含量平均值的0.18倍(表4),在晋大88的茎中,PEG、NaCl处理后的总维生素E含量平均值显著低于CK总维生素E含量平均值。激素和胁迫条件下大豆叶中维生素E含量被抑制,茎中维生素E含量被显著抑制。
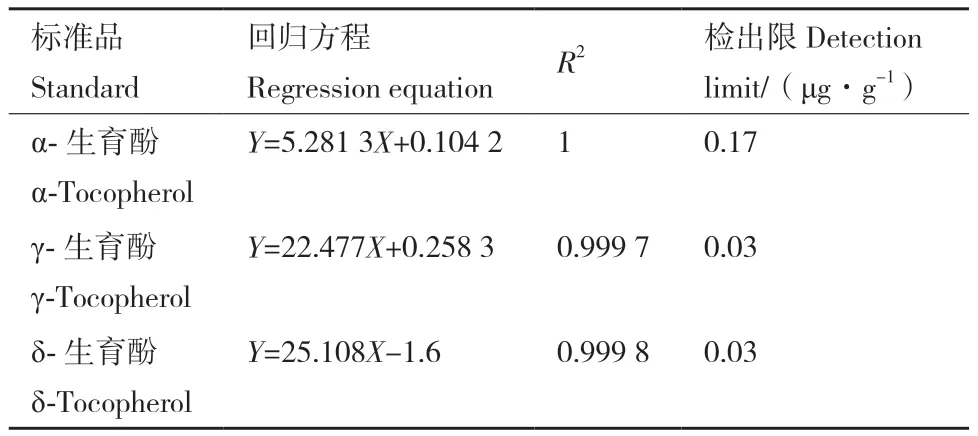
表2 生育酚标准品的回归方程与检出限Table 2 Regression equation and detection limit of tocopherol standard

表3 激素和逆境胁迫环境下大豆叶中维生素E含量分析Table 3 Analysis of vitamin E content in soybean leaves under hormonal and adversely stress environment

表4 激素和逆境胁迫环境下大豆茎中维生素E含量分析Table 4 Analysis of vitamin E content in soybean stems under hormonal and adversely stress environment
2.5.2 逆境胁迫环境下植物根茎叶维生素E组分含量分析 CK以及PEG、NaCl处理的茎中有少许的γ-生育酚和δ-生育酚,α-生育酚含量检测不出来(表4)。在CK和激素胁迫处理的植株叶中,γ-生育酚>α-生育酚>δ-生育酚(表3),在茎中,γ-生育酚>δ-生育酚(表4)。
在晋大88叶中,与CK相比,PEG、NaCl、H2O2、ABA、SA处理后的α-生育酚含量平均值约为CK的0.58、0.71、0.42、0.56和0.56倍(表3),PEG、NaCl、ABA、SA处理后的α-生育酚含量平均值低于CK,H2O2处理后的α-生育酚含量平均值显著低于CK。与CK相比,PEG、NaCl、H2O2、ABA、SA处理后的γ-生育酚含量平均值约为CK的0.96、1.18、1.14、1.14和0.87倍(表3),CK高于PEG、SA处理后的γ-生育酚的含量,低于H2O2、NaCl、ABA处理后的γ-生育酚的含量,H2O2、NaCl、ABA处理一定程度上提高了γ-生育酚的含量。与CK相比,PEG、NaCl、H2O2、ABA、SA处理后的δ-生育酚含量平均值约为CK的0.57、0.59、0.22、0.51和0.53倍(表3),PEG、NaCl、ABA、SA处理后的δ-生育酚含量低于CK,H2O2处理后的δ-生育酚含量显著低于CK(表3)。在晋大88茎中,与CK相比,PEG处理后的γ-生育酚含量平均值约为CK的0.37倍,NaCl处理后的γ-生育酚含量平均值约为CK的0.12倍,PEG和NaCl处理后的γ-生育酚含量显著低于CK(表4)。与CK相比,PEG处理后的δ-生育酚含量平均值约为CK的1.19倍,NaCl处理后的δ-生育酚含量平均值约为CK的1.20倍,PEG和NaCl处理后的δ-生育酚含量高于CK(表4)。
2.6 γ-TMT对逆境胁迫条件的响应分析
2.6.1 γ-TMT1对逆境胁迫条件的响应 为探究γ-TMT1-γ‑TMT3是否与激素和逆境响应相关,对大豆幼苗进行SA、ABA、H2O2、PEG 和NaCl胁迫处理,检测处理不同时间该基因的表达情况。经SA处理18 h时,叶中γ-TMT1相对表达量最高,约为对照的45.05倍,基因相对表达表现上调。经SA处理3 h时,根中基因相对表达量最高,约为对照的84.2倍,基因相对表达表现上调;经ABA处理48 h时,叶中γ-TMT1相对表达量最低,约为对照的0.02倍,基因相对表达量受到显著抑制。经ABA处理36 h时,根中基因相对表达量最高,约为对照的50.16倍,3 h时,基因相对表达量最低,约为对照的1.12倍,呈持续上调趋势;经H2O2处理8 h时,叶中γ-TMT1相对表达量最高,约为对照的24.9倍,36 h时,基因相对表达量最低,约为对照的6.13倍,呈上调趋势。经H2O2处理8 h时,根中基因相对表达量最高,约为对照的9.54倍,呈上调趋势;经PEG处理18 h,γ-TMT1在叶中相对表达量最高,约为对照的3.34倍,呈上调趋势。经PEG处理48 h,基因在根中相对表达量最低,约为对照的0.001倍,表达量受到显著抑制;经NaCl处理4 h,γ-TMT1在叶中相对表达量最高,约为对照的110.82倍,18 h时,基因相对表达量最低,约为对照的0.78倍。经NaCl处理36 h,基因在根中的相对表达量最高,约为对照的39.90倍,8 h时,基因相对表达量最低,约为对照的1.28倍(图5)。
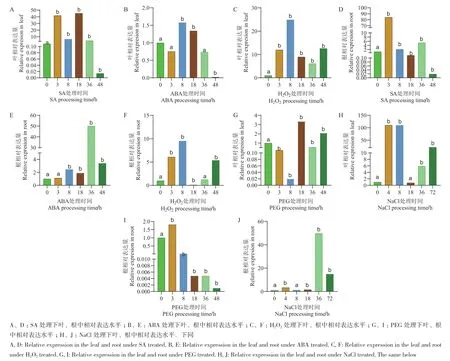
图5 激素及逆境胁迫环境下γ-TMT1的表达分析Fig. 5 Analysis of γ-TMT1 gene expressions in hormonal and advsrsely stress environment
2.6.2 γ-TMT2对逆境胁迫条件的响应 经SA处理48 h时,γ-TMT2在叶中表达量最低,约为对照的0.001倍,表达受到显著抑制。在根中表达量呈先升高后降低趋势,48 h时,基因相对表达量最低,约为对照的0.001倍,表达受到显著抑制;在ABA处理条件下,3 h时,γ-TMT2在叶中表达量最低,约为对照的0.006倍,表达受到显著抑制。3 h时,在根中表达量最低,约为对照的0.72倍,18 h时,基因表达量最高,约为对照的100.34倍,呈上调趋势;在H2O2处理条件下,48 h时,γ-TMT2在叶中表达量最高,约为对照的12.8倍,总体呈上调趋势。8 h时,在根中表达量最高,约为对照的1.8倍,呈上调趋势。在PEG处理条件下,3 h时,γ-TMT2在叶和根中的相对表达量显著下降,8 h之后无显著变化;在NaCl处理条件下,72 h时,γ-TMT2在叶中的表达量最低,约为对照的0.001倍,表达受到显著抑制。36 h时,在根中的表达量最高,约为对照的12.85倍,总体呈上调趋势(图6)。
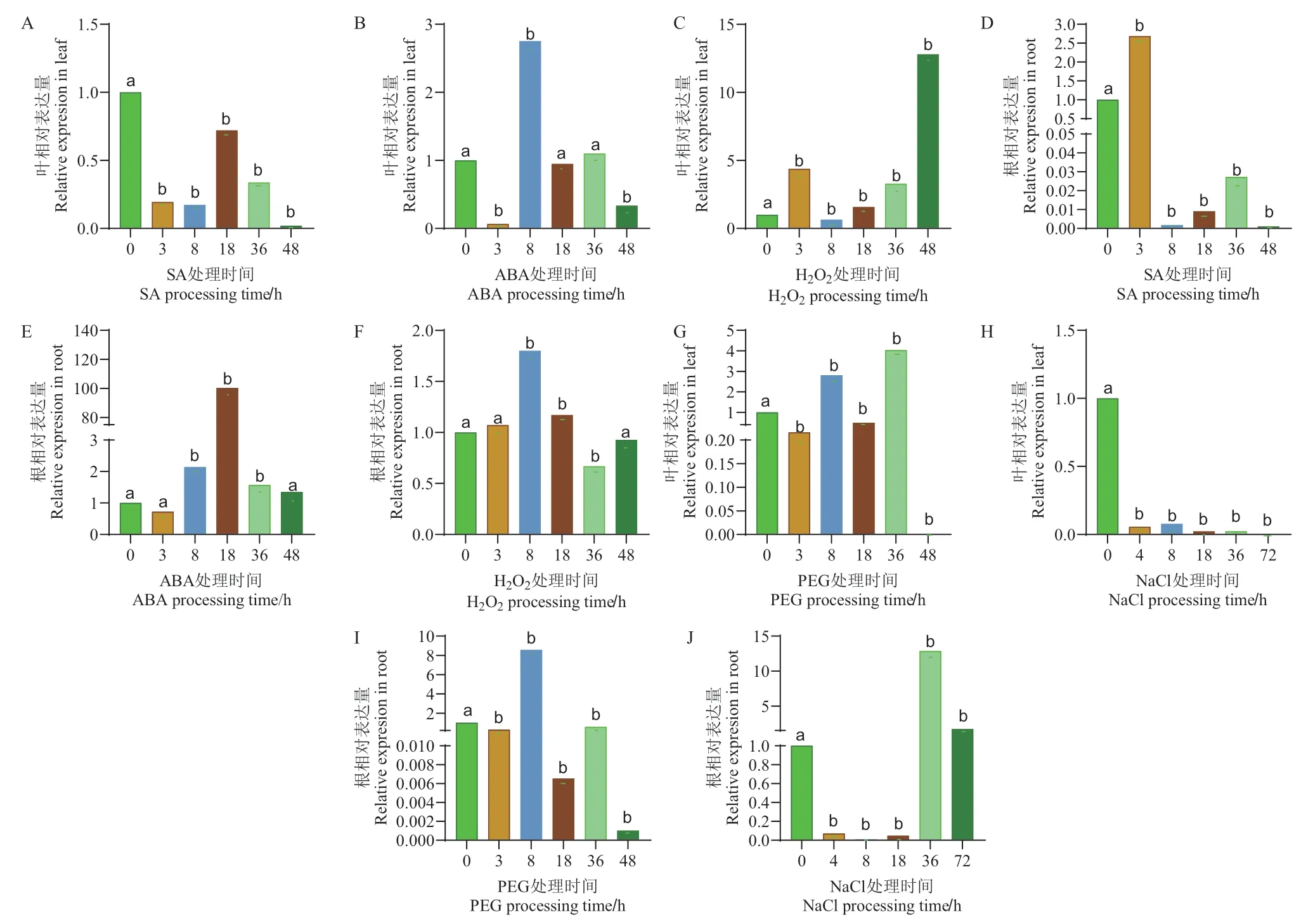
图6 激素及逆境胁迫环境下γ-TMT2基因表达分析Fig. 6 Analysis of γ-TMT2 gene expressions in hormonal and adversely stress environment
2.6.3 γ-TMT3对逆境胁迫条件的响应 在SA处理条件下,48 h时,γ-TMT3在叶中表达量最低,约为对照的0.002倍,表达受到显著抑制。36 h时,在根中的表达量最高,约为对照的16.4倍,总体呈上调趋势。在ABA处理条件下,18 h时,γ-TMT3在叶中表达量最高,约为对照的2.09倍,48 h时,基因表达量最低,约为对照的0.435倍,总体呈下调趋势。48 h时,在根中的表达量最高,约为对照的87.35倍,8 h时,表达量最低,约为对照的0.36倍,总体呈上调趋势;在H2O2处理条件下,18 h时,γ-TMT3在叶中基因的表达量最低,约为对照的0.15倍,总体表现显著下调。在根中,表达先下降后上升,呈上调趋势;在PEG处理条件下,8 h时,γ-TMT3在叶中相对表达量最高,约为对照的11.7倍,之后开始下降,72 h时表达量最低,约为对照的0.001倍,表达受到显著抑制。36 h时,在根中的表达量最高,约为对照的716.6倍,总体呈上调趋势;在NaCl处理条件下,36 h时,γ-TMT3在叶中的表达量最高,约为对照的0.32倍,表达受到显著抑制。36 h时,在根中的表达量最高,约为对照的16.37倍,4 h时,表达量最低,约为对照的0.774倍,总体呈上调趋势(图7)。
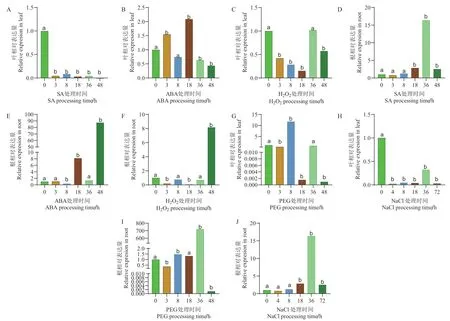
图7 激素及逆境胁迫环境下γ-TMT3基因表达分析Fig. 7 Analysis of γ-TMT3 gene expressions in hormonal and adversely stress environment
3 讨论
3.1 γ-TMT氨基酸序列比对、基因家族成员数量及染色体定位分析
γ-TMT氨基酸序列相似性为80.15%,保守位点相对分散,其中,共有5个谷氨酸差异,7个丝氨酸差异,推测γ-生育酚甲基转移酶更多的丝氨酸差异可能是为甲基化反应提供更多的亚甲基集团以及反应所需的能量,催化反应的进行。在植物中谷氨酰胺由谷氨酰胺合成酶催化谷氨酸而来,谷氨酸在柠檬酸循环下经过谷氨酸脱氢酶催化α-酮戊二酸还原氨化而来。丝氨酸由糖酵解途径转化而来,糖酵解是糖分解代谢和生物体取得能量的主要方式,同时柠檬酸循环又是三大营养素(糖、脂、氨基酸)的最终代谢通路和联系枢纽[41]。因此,谷氨酸和丝氨酸差异可能在γ-生育酚甲基转移酶能量代谢中具有较大作用,这些差异位点的氨基酸或许更多在能量供应上促进γ-生育酚甲基转移酶的作用。丝氨酸羟甲基转移酶是催化丝氨酸和甘氨酸之间可逆互换的分子,在光照作用下C3植物甘氨酸合成的速率很快,光呼吸中甘氨酸的脱羧作用为其他生物合成反应提供C1单位,SHMT催化一个亚甲基基团从丝氨酸转移到四氢叶酸上以供胸苷酸合成直接使用。利用13C核磁共振技术和多13C‑标记底物进行研究,在非光合组织细胞线粒体中,由GDC/SHMT系统催化甘氨酸的分解,丝氨酸-甘氨酸循环的最后平衡可能是氧化1分子丝氨酸产生2个C1单位、1个CO2和1个NH3,该反应可能在蛋白快速周转、细胞快速分裂、在有高蛋白酶活性的衰老组织、细胞程序性死亡的组织中起重要作用[42]。由此推测γ-生育酚甲基转移酶更多的丝氨酸差异其原因可能是为甲基化反应提供更多的亚甲基集团以及反应所需的能量,催化反应的进行。γ-TMT在大豆基因组中成员数量有3个,命名为γ-TMT1-γ‑TMT3。γ-TMT1的定位区间是在大豆第12染色体1 020 482-1 023 990 bp,γ-TMT2的定位区间是在大豆第12染色体1 028 184-1 031 945 bp,定位区间比较靠近,γ-TMT3的定位区间是在第9染色体45 209 996-45 214 333 bp。此外,还对油棕[43]、棉花[44]、辣椒、花生等γ-TMT进行了生物信息学分析。郭娟等[18]克隆了贵州商业辣椒‘黔椒4号’的γ-TMT,获得编码该酶的cDNA全长序列,并利用生物信息学相关软件对γ-TMT氨基酸同源性进行比对、开放阅读框、疏水性、磷酸化位点、跨膜区、二硫键、信号肽、亚细胞定位、二级结构以及三级结构等进行预测分析,辣椒γ-TMT基因开放阅读框长1 110 bp,编码369个氨基酸,γ- TMT编码的蛋白是一种亲水性蛋白,该蛋白没有明显的跨膜结构域,不存在信号肽,为非分泌蛋白。亚细胞定位得知,辣椒的γ- TMT在叶绿体基质中存在的几率最高,为93.8%,预测该基因主要是在植物细胞的叶绿体基质中发挥作用,初步预测辣椒与马铃薯、番茄的亲缘关系相对较近。刘婷[19]从花生栽培种A、B两个亚基因组中成功克隆出两个生育酚甲基转移酶基因(γ-TMT),分别命名为Ahγ-TMT1和Ahγ-TMT2,生物信息学分析表明,Ahγ-TMT1编码区全长为3 111 bp,Ahγ-TMT2编码区全长为3 124 bp,都含有6个外显子和5个内含子,且开放阅读框长均为1 059 bp,编码352个氨基酸。
3.2 激素和胁迫环境下大豆形态生理指标
激素和胁迫处理后的株高和鲜重显著低于CK的株高和鲜重,H2O2处理后的植株干重显著低于CK的干重,NaCl、H2O2、SA、ABA处理后的植株含水量显著低于CK的含水量,激素和胁迫环境导致植物生长滞缓。第7天时胁迫和激素处理的材料株高、长势均低于CK,叶色却深于CK,SPAD值大于CK,第13天处理材料叶片SPAD值伴随着叶片水分的减少而降低,可能是胁迫处理阻止了Na+,Cl-等离子流向叶片,使叶绿素的合成受到影响,活性氧的大量积累也导致叶绿素的合成遭受破坏,同时加速了叶绿素的降解[45]。第16天CK株高最高,SPAD值也最低,推测由于实验室光强稍微过盛,叶片或叶绿体暴露在强光下会导致叶绿素含量下降,光合作用下降,叶绿素蛋白质复合物中的PSII核心的CPa受损,影响了LHCP,抑制PSII的活性,最终导致SPAD值降低[46-47]。有学者以野大豆为实验材料,检测快速叶绿素荧光和820 nm光反射来研究盐胁迫对光系统化学活性的影响,结果显示野大豆幼苗叶片叶绿素a含量显著降低[48]。
3.3 大豆维生素组分含量对激素和逆境胁迫的响应分析
维生素E主要存在晋大88叶中,茎中有少量,激素和胁迫条件下叶中维生素E含量被抑制,茎中维生素E含量被显著抑制。在叶中,维生素E在对照和激素胁迫处理的植株叶中,γ-生育酚>α-生育酚>δ-生育酚;在茎中,γ-生育酚>δ-生育酚。在叶中PEG、SA、NaCl、ABA处理后的α、δ-生育酚含量高于CK的α、δ-生育酚含量,H2O2处理后的α、δ-生育酚含量显著高于CK的α、δ-生育酚含量,激素和胁迫条件下叶中α-生育酚和δ-生育酚含量被抑制,CK高于PEG、SA处理后的γ-生育酚的含量,低于H2O2、NaCl、ABA处理后的γ-生育酚的含量,H2O2、NaCl、ABA处理一定程度上提高了的γ-生育酚含量。茎中α-生育酚的含量为0,与CK相比,PEG和NaCl处理后的茎中γ-生育酚含量显著低于CK的γ-生育酚含量,PEG和NaCl处理后的茎中δ-生育酚含量高于CK的δ-生育酚含量。
3.4 γ-TMT启动子顺式作用元件预测及对激素处理和胁迫的响应分析
γ-TMT的启动子含有胁迫、伤害、激素响应等多种顺式作用元件,表明γ-TMT可能参与调控复杂的非生物胁迫响应。研究者对γ-TMT的启动子顺式作用元件进行了预测[49-50]。FAE1是脂肪酸链延长酶的组分,在油料种子的胚中特异性表达,张明等[51]通过以拟南芥基因组为模板设计引物并且扩增到该基因启动子片段,与甘蓝型油菜γ-生育酚甲基转移酶(γ-TMT)基因连接,将构建成的表达载体pFAE1‑TMT通过农杆菌介导转化到大豆胚尖,获得了2株转γ-TMT大豆植株。Tewari等[52]对大豆γ-生育酚甲基转移酶基因启动子进行了克隆及功能分析。前人研究表明γ-TMT启动子多态性可能与一些大豆品种的高α-生育酚浓度有关[53-55],为了解大豆品种α-生育酚含量遗传变异的分子基础,对高α-生育酚含量大豆品种和低α-生育酚含量大豆品种γ-TMT上游1.4 kb的启动子区进行了克隆,在核心启动子区域外观察到7个单核苷酸多态性,基于缺失启动子结构分析进一步阐明这些SNP影响γ-TMT启动子活性和α-生育酚的浓度[56-57]。
目前,国内关于大豆维生素E合成关键酶基因γ-TMT对非生物胁迫及激素诱导响应的研究较少,进一步利用RT‑qPCR方法分析激素和胁迫诱导下的表达模式,在激素和逆境胁迫下,γ-TMT1受H2O2、NaCl、SA诱导后叶和根中表达上调,受ABA诱导后叶中表达下调,根中表达上调,受PEG诱导后叶中表达上调,根中表达下调;γ-TMT2受H2O2诱导后叶和根中表达上调,受SA诱导后叶和根中表达下调,而在NaCl、ABA诱导后叶中表达下调,根中表达上调;γ-TMT3受H2O2、PEG、ABA、SA、NaCl诱导后根中表达上调,叶中表达下调。结合前面对盐胁迫条件下大豆维生素E及各组分含量的测定,大豆叶中γ-生育酚含量增加,而γ-TMT2、γ-TMT3的表达明显下调,由于γ-生育酚甲基转移酶(γ-TMT)可以催化γ-生育酚转化为α-生育酚,推测γ-TMT2、γ-TMT3影响盐胁迫条件下维生素E组分含量,在盐胁迫条件下γ-TMT2、γ-TMT3表达量的下降导致大豆叶中γ-生育酚含量的增加。在苜蓿和油菜中发现γ-TMT的过表达可以增加α-生育酚的积累,在调控紫花苜蓿对PEG模拟干旱胁迫的响应中起积极作用,其机制可能涉及活性氧清除系统、气孔发育和多种激素信号通路[58-59]。研究人员发现α-生育酚对逆境毒害的抵抗和减轻作用,玉米耐镉ZmVTE4编码γ-生育酚甲基转移酶通过其产物α-生育酚减轻镉毒性[60-61],在Cd逆境胁迫下,筛选获得具有耐Cd特性的玉米ZmVTE4,通过异源表达ZmVTE4增强了酵母和烟草对Cd的耐受性,增加玉米叶片的生育酚含量,烟草叶片γ-生育酚和α-生育酚的含量也增加。由此可见,在逆境胁迫下会促进γ-生育酚转化成α-生育酚,增加α-生育酚的含量。
4 结论
激素和逆境胁迫显著抑制大豆植株的生长。维生素E主要存在于叶中,茎中有少量。在激素和逆境胁迫处理时,α-生育酚和δ-生育酚被抑制。其中,γ-TMT1受NaCl诱导后,叶和根中表达上调。γ-TMT2受NaCl诱导后叶中表达下调,在根中表达上调。γ-TMT3受NaCl诱导后,在根中表达上调,叶中表达下调。盐胁迫条件下,γ-TMT2、γ-TMT3表达量的下降导致大豆叶中γ-生育酚含量的增加,γ-TMT2、γ-TMT3影响盐胁迫条件下维生素E组分的含量。

