消化道炎性纤维性息肉36 例临床病理分析
姚佳凯
胃肠道炎性纤维性息肉(IFP)系发生于消化道的良性间叶性肿瘤[1],首次报道于1949年,学者Vanek[2]将其称为“胃肠道黏膜下肉芽肿伴嗜酸性粒细胞浸润”;首次正式命名是在1953年,由学者Helwig等[3]将其定义为IFP。因其机制不明,临床少见,且症状及大体无特征性,年轻及基层医师可能对其认识不足。本研究回顾分析了36 例IFP 患者的组织学特征和免疫表型,同时复习相关文献,以提高对IFP的诊断和鉴别诊断能力,报道如下。
1 资料与方法
1.1 一般资料 收集湖州市第一人民医院病理科2013年1月至2023年1月收治的36 例IFP 患者,其中男19 例,女17 例;年龄43 ~75 岁,中位年龄55 岁;肿物最大径0.1 ~4.5 cm,中位最大径2.3 cm;发生部位:胃30 例(胃窦25 例、胃体4 例、幽门1例),肠道5 例(结肠3 例、直肠1 例、小肠1 例伴发肠套),食管1 例;主要临床表现:食欲不振、腹部不适(腹胀、腹痛、腹泻等)。内镜检查:均表现为黏膜下息肉样或隆起性肿物。多数患者病理检查前诊断为胃肠道间质瘤(GIST)或增生性息肉。本研究经湖州市第一人民医院医学科研与临床试验伦理委员会审批通过。
1.2 方法 标本均经10%中性甲醛固定,石蜡包埋,常规切片,HE 染色,光镜观察。免疫组化采用Eli-Vision 两步法,染色步骤按试剂盒说明书进行。 一抗包括CD34、Vimentin、CD117、Dog1、S-100、SMA、Desmin、ALK、Ki-67,均购自福州迈新公司,用已知阳性切片作为阳性对照,以PBS 代替一抗作为阴性对照。
2 结果
2.1 巨检 本研究36 例IFP 均表现为黏膜下息肉样或隆起性肿物,肿物最大径0.1 ~4.5 cm,其中3例带蒂。病灶黏膜表面光滑,切面境界较清楚,呈灰白色,质地中等,无包膜。
2.2 镜检 低倍镜下IFP病灶主要位于胃肠道的黏膜下层,累及范围没有到达或超过肌层,间质内可见明显增生的梭形细胞、数量不等的血管以及急慢性炎细胞分布;高倍镜下可见急慢性炎细胞中有较多的嗜酸性粒细胞,病灶组织中梭形细胞,形态温和,细胞核小,染色质均一,核分裂象少见,大部分梭形细胞弥漫分布于间质中,但也可见部分梭形细胞聚集在血管或腺体周围,形成“洋葱皮样”或“同心圆状”样结构。本组18 例可见典型的独特组织学形态:温和的梭形细胞聚集在血管(17 例,见图1)或腺体(1 例,见图2)周围,呈现出“洋葱皮样”或“同心圆状”结构,并且在间质内,可见较多嗜酸性粒细胞浸润,见图3。
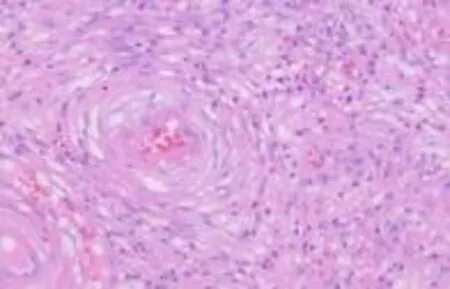
图1 梭形细胞围绕血管(HE,×200)
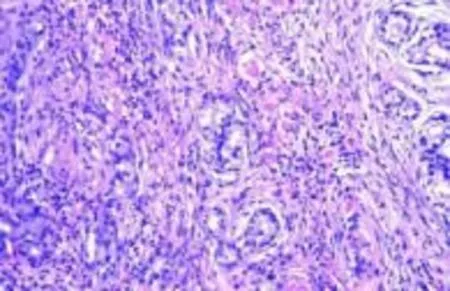
图2 梭形细胞围绕腺体(HE,×100)

图3 梭形细胞间嗜酸性粒细胞浸润(HE,×400)
2.3 免疫组化 病灶中的梭形细胞CD34 及Vimentin 呈弥漫阳性,但不表达CD117、Dog1、S-100、SMA、Desmin及ALK,且Ki-67 增殖指数较低(不足4%+),见图4 ~6。
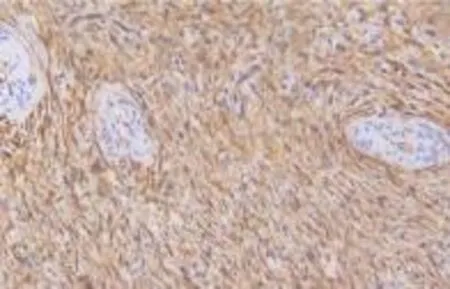
图4 梭形细胞CD34 弥漫阳性(HE,×200)
图5 梭形细胞Vimentin 弥漫阳性(HE,×200)
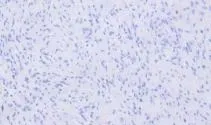
图6 Ki-67 增殖指数较低(HE,×200)
3 讨论
IFP 在消化道任意部位均可发生[4],其中胃最常见(以胃窦部最多见),约占70%;其次为小肠,占23%;食管、空肠、回肠、结肠、直肠等部位较少见。男女发病率无明显差异性,好发于成人,肿物最大径多在1 ~5 cm,常小于2 cm。本研究36 例IFP 中,最多见部位为胃窦25 例,男女比例近1∶1,患者中位年龄55 岁,肿物最大径0.1 ~4.5 cm,本研究中18例可见典型的独特组织学形态:温和的梭形细胞聚集在血管或腺体周围,呈现出“洋葱皮样”或“同心圆状”结构,而且病灶组织内可见较多嗜酸性粒细胞,梭形细胞免疫组化均呈Vimentin、CD34 弥漫阳性,Ki-67 增殖指数较低(不足4%+),与其他文献报道基本相符。IFP 临床上多数患者无明显不适症状或系体检发现,少数患者临床症状可以表现为食欲不振、腹部不适(腹胀、腹痛、腹泻等),极少数患者出现肠套叠及肠梗阻等症状,本研究中除1 例患者因肠套手术中发现外,其余均为体检时发现。
目前没有明确的研究能够证明IFP 的组织起源及发病机制。在世界各国学者对IFP 的研究过程中,最开始IFP 被认为可能是一种机体应激反应过程中产生的非肿瘤性病变;后来有学者觉得IPF 的发病部位、免疫组化以及分子检测和GIST 有相似之处,故考虑其两者之间有一定的联系[5-6]。有文献报道部分IFP 还可表达CD35、Calponin、SMA 等[7]免疫标记,故认为它可能起源于树突状细胞。但随着分子生物学的不断发展,不断有学者研究发现IFP 中存在血小板衍生生长因子受体A(PDGFRA)的基因激活突变,因此该基因突变可能是其重要发病机制之一[8-12],在不断地研究发展中,第4 版世界卫生组织(WHO)分类将IFP 归类到了消化道良性肿瘤中。
IFP 是胃肠道少见的良性间叶性肿瘤[1],无特征性临床表现,多为体检时发现,依靠内镜、CT等辅助检查不易与其他间质瘤或息肉样病变相鉴别,需要通过大体形态、术后病理、免疫组化检查及分子检测共同分析后才可明确诊断。IFP罕有侵犯固有肌层[13],其病变多位于黏膜下层,有独特的组织形态学,而且病灶组织内可见较多嗜酸性粒细胞,这对于初步诊断非常有帮助。免疫组化染色有助于进一步确诊。报道的大部分病例中梭型细胞几乎都弥漫表达Vimentin、CD34,不同程度表达SMA、HHF-35、PDGFRA等,Ki-67 增殖指数较低;但所有病例均不表达DOG1、CD117、S-100、ALK1、NSE 及Desmin。
分子检测方面,有研究发现IFP中存在PDGFRA基因突变,主要为12 和18 号外显子突变,研究分析表明发生于胃的IFP 相较于肠道的IFP,其PDGFRA基因突变率会更高,而且发现PDGFRA 基因突变存在“热点区域”,即胃IFP 的基因突变主要为第18 号外显子D842V 突变,而小肠IFP 的基因突变主要为12 号外显子S566-E571 delins R 突变。本研究36 例病例中,有9 例(其中7 例为胃窦IFP,1 例结肠IFP,1 例小肠IFP)进行了基因检测,结果仅提示4 例(胃窦IFP)出现PDGFRA 基因突变,且均为第18 号外显子D842V 突变。本研究对比文献发现,PDGFRA基因突变的确存在“热点区域”,但PDGFRA 基因突变率及突变位点有所不同,总结分析后,发现存在以下几方面可能:(1)病变样本量及病变部位不同,部分病例病变小或瘤细胞成分较少,提取DNA会导致质量下降,可引起假阴性结果;(2)IFP除了PDGFRA基因已知热点区域以外,还存在其他位点的突变。但最终还需要大样本检测及更深一步的研究。
由于镜下IFP 病灶以梭形细胞为主,故需与以下疾病鉴别。(1)胃肠道GIST:虽然其发生部位、组织学形态与IFP 相似,但GIST 镜下多呈条束状或旋涡状排列,梭形细胞呈流水样或弥漫分布,不形成“洋葱皮样”或“同心圆状”的独特外观,间质内嗜酸性粒细胞少见,免疫组化特异性表达CD117 和DOG1,基因检测多显示KIT(70%~80%)或PDGFRA(10%~15%)基因突变。(2)炎性肌纤维母细胞肿瘤(IMT):虽然IMT 镜下也表现为梭形细胞增生及慢性炎症细胞浸润,但IFP 多以嗜酸性粒细胞为主,而IMT 常伴有淋巴组织增生,且后者免疫组化多表达ALK,瘤细胞CD34 阴性。(3)平滑肌瘤:肿瘤细胞和IFP一样呈梭形,但其胞质更加红染,细胞核呈雪茄状,肿瘤细胞免疫组化显示SMA 和Desmin 阳性,可与IFP 鉴别。(4)神经鞘瘤:梭形肿瘤细胞呈束状、波浪状或栅栏状排列,疏松区域与密集区相间,可见淋巴细胞聚集呈套包饶肿瘤周边,肿瘤细胞表达S-100,可与IFP 鉴别。(5)滤泡树突细胞肿瘤:肿瘤细胞免疫组化呈CD21、CD23、CD35 阳性表达,可与IFP 相鉴别。
利益冲突 所有作者声明无利益冲突

