miRNAs 在肝细胞肝癌发生机制中的研究进展
毛玉熠,王志炜,童铭炯,王建忠,费迎明
原发性肝癌主要包括肝细胞癌(HCC)、肝内胆管癌及混合性肝癌,其中HCC 占80%以上。随着现代医学技术的发展,诸如异常凝血酶原、甲胎蛋白异质体及高尔基体蛋白73 等实验室检查可为HCC的早期诊断提供依据,肝脏切除术、射频消融术及肝移植术等治疗手段使部分早期HCC 得到控制。流行病学数据结果显示,HCC 预后依旧较差,究其原因主要是早期HCC无明显症状及体征,多数患者明确诊断时就已进展成晚期。miRNA 是一类广泛存在于真核生物中的小分子非编码RNA,参与生物体中的多种生理、病理过程。多项研究证实,一些miRNAs能调控肿瘤的发生发展,故往往在大多数癌症中是失调的。本文就miRNAs 在HCC 发病机制中的分子及功能作用进行综述,报道如下。
1 miRNAs 概述
非编码RNA具体是指不能编码蛋白质的RNA,包括长20 ~30 个核苷酸碱基的小分子RNA 和长度>200 个核苷酸的长非编码RNA(LncRNA)。小分子非编码RNA 主要包括miRNA、小干扰RNA(siRNA)、piwi 相互作用RNA(piRNA)等。miRNA是一类广泛存在于真核生物体内的单链内源性非编码小分子RNA,其对靶基因的信使RNA(mRNAs)的作用取决于两者转录体序列互补程度,通过发挥引导酶切、阻遏靶基因翻译或结合抑制方式,进而起到基因调节作用。
研究发现,miRNAs 也能够调控各种肿瘤抑制因子或致癌基因,多项实验证实在大多数癌症中miRNAs 表达是失调的,这些失调往往与表观遗传变异或基因突变相关。故miRNAs 的表达情况对癌症的发生、发展、诊断及预后具有重要意义[1-2]。也有学者指出,miRNAs 的表达失调与肝脏代谢紊乱,肝损伤,肝纤维化,甚至HCC 的发生发展均有密切相关性[3],这些miRNAs为HCC诊断、治疗及评估预后提供了新靶点,具有可靠的临床研究价值。
2 HCC 可能的发病机制
HCC 的发病机制是一个多阶段、多步骤的复杂过程,分为启动、促进、进展阶段。在启动阶段,如过量酒精、肝炎病毒、致癌物等均能促使肝脏DNA 受损,赋予转化细胞恶性生长能力;在促进阶段,肝脏持续受炎症刺激,导致基因组不稳定,进而出现细胞异常增殖,部分异常细胞衰老、凋亡后,机体能及时清除异常细胞,但在进展阶段,这些异常增殖细胞未能及时被清除,而进一步演变成具有恶性表型的肿瘤,进行无限增殖,最后出现侵袭及转移。故深入探究肝脏恶性肿瘤的侵袭、转移的具体分子机制对抑制肝癌复发转移、延长患者生存时间及提高患者生活质量具有重要意义。
随着新一代测序技术的逐步成熟,研究人员通过全外显子测序及肝癌全基因DNA 拷贝数分析发现肝癌发生、诊治和预防过程中主要通过以下多个信号通路及炎症因子进行调控如P53 信号通路、Wnt/ -catenin 信号通路、STAT3 信号通路等[4]。近来,也有众多临床研究及实验表明,肠道菌群的失调在慢性肝病发展成HCC的过程中也起到关键作用,其可能与抗肿瘤免疫应答相关[5]。
值得注意的是,无论是肝炎病毒感染、非酒精性脂肪性肝病、酒精性肝病、药物性肝病、毒物或寄生虫等引起的慢性肝脏炎症或DNA 受损,均可诱导HCC 的发生。
3 miRNAs在HCC发生过程中对肝再生的作用机制
与其他器官相比,肝脏具有显著的再生能力,在急性肝损伤时,肝细胞和胆道上皮细胞(BECs)可通过不断增殖、控制炎症反应、重建损伤区域恢复肝脏体积及功能。在长期持续损伤的情况下,肝细胞衰老,肝脏会逐渐失去再生能力,慢性炎症随之而来,促进活化的肝星状细胞(aHSC)持续激活,导致肝组织内细胞外基质ECM 过度沉积,进而形成肝纤维化,最终导致HCC[4]。有研究指出,HCC 的发生发展及复发转移也与正常肝再生和异常肝再生之间失衡相关。异常肝再生是指异常表达的肝再生调控因子及相关受体,紊乱激活或失活的信号通路,失序的组织结构改变等,统称为异常或恶化的肝再生[6]。
3.1 miRNAs 对HCC 细胞增殖的影响 在肝损伤后的肝再生过程中,肝细胞需要经历启动、增殖及终止3 个阶段。在启动阶段,肝细胞受细胞因子如白介素-6(IL-6)和肿瘤坏死因子-(TNF- )的刺激后,从G0 进入到G1 期。在随后的增殖阶段,G1 期肝细胞在细胞生长因子HGF的刺激下,以周期素依赖性促进细胞增殖。当肝细胞体积及功能恢复正常时,肝再生进入终止阶段,肝细胞在TGF- 和actin 的刺激下终止增殖,回到G0 期。肝脏再生受到多种分子机制的精确控制。近年来,miRNAs 被证明在细胞增殖过程中发挥关键作用。
研究显示,多种miRNAs 在部分肝切术后3 ~24 h明显上调,其作为细胞增殖的起始信号,为肝细胞再生提供负反馈,促进肝细胞增殖[7]。多项实验表明,miR-21 在肝再生的增殖阶段起到至关重要的作用。体外实验证实[8],miR-21 可以通过靶向抑制抑癌基因PTEN 加速肝细胞进行DNA 合成。Lv 等[9]通过敲除大鼠中的Dicer1 基因发现miR-21 明显下调会导致肝再生抑制,其主要通过靶向抑制抑癌基因PTEN 和Ras 同源家族成员B(Rhob)发挥调控作用。miR-221 也被证实为一种促增殖基因,其可调控p27 表达发挥生物学作用[10]。有学者研究显示[11],miR-155-5p 可通过靶向下调CTHRC1 的表达,促进Wnt/ -catenin 信号通路激活,致使肝癌细胞增殖。与上述miRNAs 不同,miR-26a 可能是HCC 再生过程中的负调控因子。Zhou 等[12]通过对部分肝切除术后的小鼠模型进行研究发现,24 h 内miR-26a 的表达显著下调,其可能通过调节特定细胞周期影响肿瘤细胞增殖过程。也有研究发现miR-26a 的上调通过抑制Zeste基因增强子同源物2EZH2 的表达进而阻遏肝肿瘤细胞增殖及迁移[13]。
3.2 miRNAs对肝癌细胞的凋亡的影响 凋亡是指高度调控的细胞自主有序的死亡,它发生于生物体各个生长发育阶段,还用于严格控制细胞数量,其可通过清除受损细胞在肝脏脂肪变性、肝脏炎症及纤维化,甚至HCC 中发挥作用。一些miRNAs 可以通过靶向抑制细胞凋亡通路分子,影响HCC的发生进展。
研究人员发现,在严重肝脏疾病中,miR-15b 和miR-16 在肝脏组织中均呈现上调趋势。An 等发现miR-15b 和miR-16 可以通过靶向常见的抗凋亡基因BCL2 介导TNF 下调进而促进肝癌细胞凋亡,延缓HCC 进展。除了参与肝癌细胞增殖,miR-26a 还介导着肝癌细胞的凋亡。体外实验证实[14],miR-26a靶向癌基因MDM2 下调,激活MDM2/P53 负反馈环,刺激抑癌基因P53 上调,促进肝细胞凋亡。miR-125b 的异常表达在各种癌症中都很常见。
4 miRNAs 对HCC 发生发展的作用机制
HCC 细胞具有高度多样化的细胞群,称之为肿瘤的异质性。HCC 的发生发展不仅仅与肿瘤细胞异质性相关,还与微环境之间的相互作用密切联系。肿瘤免疫微环境通过免疫抑制致使免疫逃逸,促进HCC 增殖、侵袭与转移,其过程复杂多样,目前国内外研究尚未完全明确机制。但已有学者证实,miRNAs几乎参与整个HCC 发生发展阶段,即便是早期HCC患者中,某些miRNAs 在组织或血清中也体现了其差异性,这为临床早期诊断及治疗HCC 提供重要依据。
4.1 促进HCC发生发展的miRNAs miR-155 参与各种肝脏疾病发病过程,可能致使肝癌发生发展[3]。Xin 等[15]发现miR-155 通过抑制翻译H3F3A 促使细胞周期蛋白CDK2 与CyclinE 相互作用,进而抑制抑癌基因P21WAF1/CIP1 的表达,促进了肝癌细胞的生长。研究显示[16],miR-155 可以通过靶向SOCS1蛋白激活STAT3 信号,导致基质金属蛋白酶9(MMP9)的上调,促使HCC 的侵袭转移。有研究通过对HCC 患者进行血清学检测发现其miR-155 水平明显高于正常人群,根据其敏感性及特异性结果对比,认为miR-155 或可成为HCC诊断及预后判断的指标之一[17-18]。Frundt 等[19]通过对HCC 患者的血浆测定发现miR-192、miR-146 表达失调,且呈现高表达,是HCC和肝硬化患者有希望的诊断和预后标志物。
4.2 抑制HCC 发生发展的miRNAs miR-34a 已被证实是抑癌基因P53 的直接靶标,在人类多种癌症组织中呈异常表达,或可成为肿瘤诊断或判断预后的生物学标志物[20]。它在病毒性肝炎、NAFLD、NASH、酒精肝、肝纤维化和HCC 等肝脏疾病中发挥关键作用[21]。有研究发现,miR-34a 靶向抑制间质表皮转化因子(MET)进而抑制HCC 细胞增殖、分化、转移及凋亡,延缓肿瘤的侵袭与生长。但在-catenin 突变亚型的HCC 中,研究发现miR-34a 呈过表达状态,Gougelet等[22]证实miR-34a抑制剂可以通过靶向肿瘤抑制因子HNF-4 ,下调细胞周期蛋白D1进而发挥抗肝癌细胞增殖活性,这为HCC不同亚型患者个体化治疗奠定了理论基础。在一项体内研究发现,miR-29 过表达通过直接靶向抗凋亡蛋白如BCL2 和MCL1 诱导细胞凋亡,显著抑制HCC 发生进展[3]。Fang 等[23]研究发现,miR-29b 通过靶向抑制MMP-2 的表达,进而损害内皮细胞中的血管内皮生长因子受体2(VEGF R2)信号传导通路,延缓HCC肿瘤血管生成、侵袭及转移。此外,各类肝炎中炎症诱导的miR-122 下调会导致肝脏癌变,这提示并增miR-122 可能是预防肝炎患者HCC 发生的有效策略[24]。Dong 等[25]研究证实,miR-145-5p 可直接靶向下调SPATS2,进而消除对HCC 恶性表型的调节作用,miR-145-5p 可作为HCC 的潜在治疗靶标。
5 小结与展望
证据表明,多种miRNAs 在HCC 生物学过程中均发挥了至关重要的调控作用,其可促进或抑制HCC 进展,见表1。miRNAs 在肝癌患者中的异常表达,有助于为临床寻求潜在的早期诊断HCC的生物标志物和预后标志物。
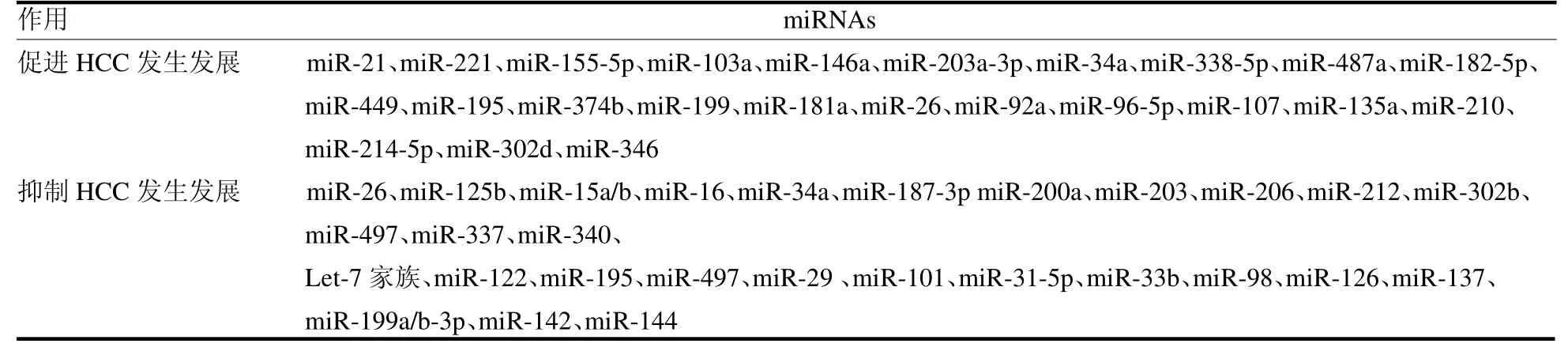
表1 可能参与HCC 发生发展的miRNAs
利益冲突 所有作者声明无利益冲突

