三元体系NiSO4-CuSO4-H2O 298.15 K相平衡研究
唐婉格,宁志强,谢宏伟,宋秋实
(东北大学 冶金学院,辽宁 沈阳 110819)
随着资源的匮乏和环保要求的提高,矿中有价资源的清洁高效利用成为研究的焦点。硫酸镍是镍矿湿法冶金过程中一种重要产品,氧化镍矿和硫化镍矿在酸性浸出过程中,都会产生可溶性的硫酸盐,一些杂质组分保持在固相中,形成固液两相,浸出液经过萃取分离,实现有价金属的提取[1-2]。在浸出液中铜和镍含量较高,铜、镍主要以硫酸盐和硫化物形式存在,有回收利用价值。回收浸出过程中的铜镍资源不仅减少资源浪费,而且保护环境。
水盐体系相图是研究相平衡问题的重要工具,是化工冶金生产过程[3]、流程研发、产品回收利用[4]的重要依据,也是盐类析出、溶解的重要工具。镍、铜两种元素在化学周期表中位置相邻,硫酸盐型镍铜有相似的化学性质,可以通过研究系统的固液相平衡,调节溶液浓度、pH值等参数,当浸出液中溶解的硫酸盐与固相中的盐达到固液相平衡时,浸出液对硫酸盐的提取能力就达到了一个极限水平。
对于含硫酸盐型水溶液相平衡的研究,目前主要是Li+[5-6]、K+[7-8]、Na+[9-10]、Rb+[11]、Mg2+[12-13]、Cd2+[14]等硫酸盐相平衡研究,含有 Ni2+、Cu2+硫酸盐型相平衡研究较少。文章研究三元体系NiSO4-CuSO4-H2O在298.15 K相平衡关系和物化性质,测定各组分溶解度及相应液相的物化性质,绘制该体系相图、物化性质—组成图。应用Pitzer电解质溶液模型,计算298.15 K三元体系NiSO4-CuSO4-H2O平衡液相组分的活度系数,得到平衡常数,为硫酸镍铜的浸出与分离提供基础热力学数据。
1 实验
1.1 仪器与试剂
实验所用主要仪器见表1。
实验主要药品:NiSO4·6H2O(分析纯,精度≥98.5%)和CuSO4·5H2O(分析纯,精度≥99.0%),均为天津致远生产的分析纯试剂。实验用水为去离子水,电导率小于1.0×105S/m。
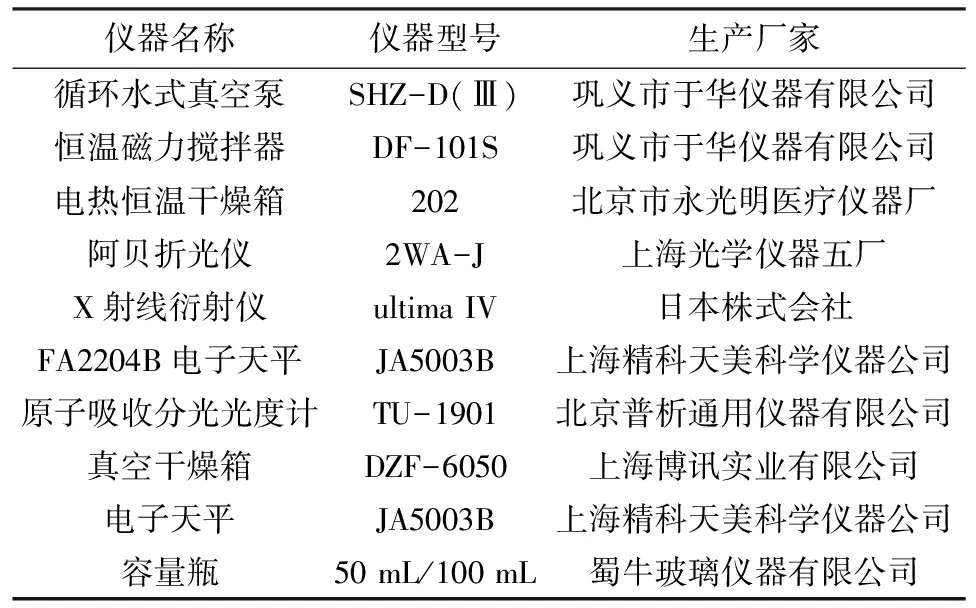
表1 主要实验仪器Tab.1 The main experimental apparatuses
1.2 实验方法
采用等温溶解平衡法[15]开展三元体系NiSO4-CuSO4-H2O在 298.15 K稳定相平衡实验。在NiSO4饱和溶液中加入定量CuSO4·5H2O后,放置于恒温磁力搅拌水浴中以促进CuSO4·5H2O溶解,温度控制为(25 ± 0.01) ℃,搅拌速率为350 r/min,间隔30 min量取上清液测定折光率,连续三次的测量值相差不超过0.5%即认为体系液相组分达到固液平衡。固液平衡后,通过真空泵抽滤进行固液分离,测定平衡液相折光率、pH值,用原子吸收分光光度计测定平衡液相Ni2+、Cu2+浓度;将得到的湿固相烘干研磨后,进行XRD分析。
1.3 分析方法
2 结果与讨论
2.1 三元体系相图结果分析
三元体系NiSO4-CuSO4-H2O在298.15 K时的溶解度、溶液pH值、折光率等测定结果列于表2。图1是体系共饱和点E处平衡固相的X射线粉晶衍射图。图2是三元体系 NiSO4-CuSO4-H2O在298.15 K下的稳定相图。

表2 298.15 K三元体系NiSO4-CuSO4-H2O相平衡溶解度和物化性质Tab.2 Phase equilibrium solubility and physicochemical properties of 298.15 K ternary system NiSO4-CuSO4-H2O

续表2 (Continue)

图1 共饱和E点处XRD图Fig.1 XRD pattern at point E of cosaturation
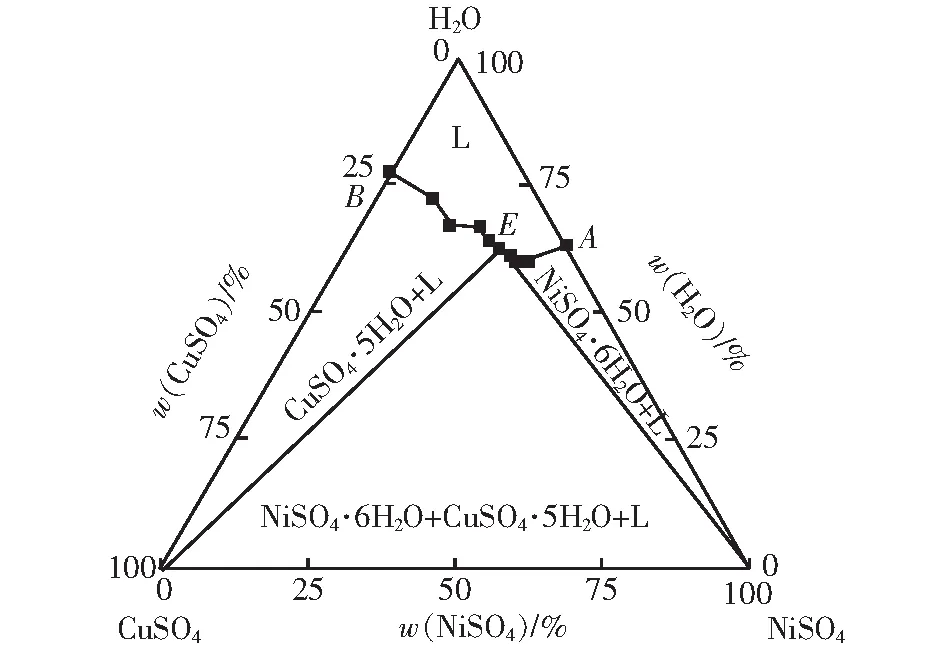
图2 298.15 K条件下三元体系NiSO4-CuSO4-H2O稳定相图Fig.2 Stable phase diagram of ternary system NiSO4-CuSO4-H2O at 298.15 K
298.15 K 三元体系NiSO4-CuSO4-H2O是简单共饱和型相图,只产生对应盐的水合物,未生成新盐或固溶体。稳定相图包含1个共饱和点、2条单变量曲线、3个固相结晶区。点A是二元体系NiSO4-H2O的饱和点,w(NiSO4)=26.76%;点B是二元体系CuSO4-H2O的饱和点,w(CuSO4)=22.54%;点E是共饱和点(L+NiSO4·6H2O+CuSO4·5H2O),液相质量分数w(NiSO4)=23.33%,w(CuSO4)=12.60%。单变量曲线AE是NiSO4·6H2O+L区和L区分界线,单变量曲线BE是CuSO4·5H2O+L区和L区分界线。3个结晶区包括:NiSO4·6H2O+L区、CuSO4·5H2O+L区和NiSO4·6H2O+CuSO4·5H2O+L区。从图2中看出,CuSO4的结晶区大于NiSO4的结晶区,说明硫酸镍在水中的溶解度大于硫酸铜在水中的溶解度。随着硫酸铜不断加入,由于硫酸铜对硫酸镍的盐析作用,体系中的硫酸镍质量分数逐渐减小[18-19]。
2.2 三元体系物化性质结果分析
298.15 K 三元体系NiSO4-CuSO4-H2O的物化性质随着硫酸镍含量的变化见图3。由于298.15 K下硫酸镍的溶解度大于硫酸铜的溶解度,因此平衡液相中硫酸镍的含量是影响平衡液相中物化性质的主要原因。由图3可以看出,随着溶液中硫酸镍含量的变化,平衡液相折光率、蜜度和pH值呈现规则变化。由图3(a)可见,溶液折光率在硫酸镍质量分数0%~23.33%范围内随硫酸镍质量分数的增加而增大,在共饱和点E处达到极值后,在硫酸镍质量分数在23.33%~36.76%范围内随硫酸镍质量分数的增加而逐渐降低;在共饱和点E处折光率最大为1.399 0。
由图3(b)可以看出,溶液密度在硫酸镍质量分数0%~23.33%范围内,随硫酸镍质量分数的增加而增大,在共饱和点E处达到极值后,在硫酸镍质量分数在23.33%~36.76%范围内随硫酸镍质量分数的增加而逐渐降低;在共饱和点E处密度最大为1.322 4。
由图3(c)可以看出,溶液pH值在硫酸镍质量分数0%~23.33%范围内,随硫酸镍质量分数的增加变化不明显,在硫酸镍质量分数23.33%~36.76%范围内随硫酸镍质量分数的增加,在共饱和点E处开始逐步升高。体系平衡固相的结晶析出的pH值环境在3.02~4.23,均为酸性。
根据经验公式[20]计算折光率:
(1)
式中:n0,n分别为298.15 K纯水的折光率1.333 89[21]和溶液的折光率;a,b为折光率特征系数,由二元体系饱和点求得,分别为0.001 10和0.001 078;NiSO4%、CuSO4%分别为溶液中两种组分的质量分数。
计算结果见表3,折光率计算值与实际测量值最大相对偏差为0.67%,计算值与实验值吻合较好,说明经验公式适用三元体系NiSO4-CuSO4-H2O 298.15 K稳定相平衡计算,实验数据可靠。

表3 298.15 K条件下三元体系NiSO4-CuSO4-H2O平衡液相的折光率计算值与实测值对比Tab.3 Comparison of calculated and measured refraction values of equilibrium liquid phase of ternary system NiSO4-CuSO4-H2O at 298.15 K
2.3 三元共饱和点活度系数计算
根据Pitzer离子相互作用模型[22-24]对共饱和点处平衡液相中的活度系数计算,进而求出平衡常数,见表4。

表4 298.15 K条件下三元体系NiSO4-CuSO4-H2O的单盐参数及混合离子相互作用参数Tab.4 Single salt parameters and mixed ion interaction parameters of ternary salt system NiSO4-CuSO4-H2O at 298.15 K
(1)将上述溶液中的质量分数转化成离子的摩尔分数
mNiSO4=2.353 8(mol/kg H2O)
mCuSO4=1.229 1(mol/kg H2O)

(2)求系数
(2)
(3)
g(x)=2[1-(1+x)exp(-x)]/x2
(4)
g′(x)=-2[1-(1+x+x2/2)exp(-x)]/x2
(5)
298.15 K时2-2型电解质,α1=1.4 kg1/2/mol1/2,α2=12.0 kg1/2/mol1/2,将I=7.165 8,Z=14.331 6,I1/2=2.676 9,e-1.4I1/2=0.023 57,e-1.2I1/2=1.120 07×10-14代入式(4)、式(5)可得:g(1.4I1/2)=0.252 9,g′(1.4I1/2)=-0.229 3,g(12I1/2)=0.003 876,g′(12I1/2)=-0.003 876。
(6)
(7)
(8)
F=-Aφ[I1/2/(1+1.2I1/2)+
(9)
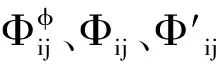
(10)
Φij=θij+Eθij
(11)
(12)
Eij=(ZiZj/4I)[J(xij)-J(xii)/2-J(xij)/2]
(13)

xiiJ′(xii)/2-xijJ′(xij)/2]xij
(14)
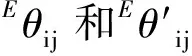
(3)求lnγNi2+

(15)
lnγNi2+=-0.093 97,γNi2+=0.910 3
(4)求lnγCu2+
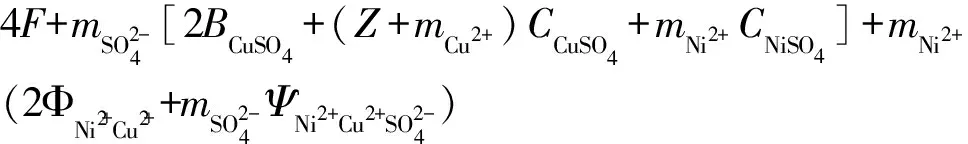
lnγCu2+=0.338 5,γCu2+=1.402 9
(16)

(17)
(6)求NiSO4和CuSO4平均活度系数
(18)
(19)
γ±NiSO4=0.901 9,γ±CuSO4=1.119 6
2.4 三元共饱和点平衡常数计算
三元体系NiSO4-CuSO4-H2O含有共同阴离子的三元混合体系,根据化学平衡原理,硫酸镍、硫酸铜在溶液中达到溶解平衡时,它们的溶解平衡常数K是一个常数。根据Pitzer模型对共饱和点处平衡液相进行活度系数计算,进而求出平衡常数,计算结果为KNiSO4=6.859 9,KCuSO4=5.520 1。
(20)
(21)
(22)
(23)
3 结论
采用等温溶解平衡法获得了三元体系NiSO4-CuSO4-H2O在298.15 K平衡体系组分的溶解度和物理化学性质,得到如下结论:
1)三元体系NiSO4-CuSO4-H2O在298.15 K下的稳定相图为简单共饱和型,只产生对应盐的水合物,未产生新盐或固溶体。平衡相图有1个共饱点,2条单变量曲线,4个部分区:一个不饱和液相区(L),一个两固一液区(2S+L),两个一固一液区(S+L),二元体系NiSO4-H2O饱和点质量分数为w(NiSO4)=26.76%;二元体系CuSO4-H2O的饱和点质量分数为w(CuSO4)=22.54% ,三元体系共饱和点,对应固相为NiSO4·6H2O+CuSO4·5H2O,液相质量分数w(NiSO4)=23.33%,w(CuSO4)=12.60%。
2)平衡液相溶液的折光率、密度和pH值随硫酸镍含量的变化呈规则变化。溶液折光率和密度在硫酸镍质量分数0%~23.33%范围内随硫酸镍质量分数的增加而增加,在共饱和点E处达到极值后,在硫酸镍质量分数在23.33%~36.76%范围内随硫酸镍质量分数的增加而逐渐降低;在共饱和点E处折光率最大为1.399 0,密度最大为1.322 4。溶液pH值在硫酸镍质量分数0%~23.33%范围内随硫酸镍质量分数的增加变化不明显,在硫酸镍质量分数23.33%~36.76%范围内随硫酸镍质量分数的增加,在共饱和点E处开始逐步升高。体系平衡固相的结晶析出的pH值环境在3.02~4.23。
3) 硫酸镍、硫酸铜在溶液中达到溶解平衡时,它们的溶解平衡常数K是一个常数。基于Pitzer模型进行体系共饱和点平衡液相活度系数计算,将活度系数γ±NiSO4=0.901 9,γ±CuSO4=1.119 6带入平衡常数中,求得KNiSO4=6.859 9,KCuSO4=5.520 1。由于硫酸铜对硫酸镍的盐析作用,通过调节硫酸铜的加入量,有利于硫酸镍晶体析出,为回收利用含铜镍型硫酸盐提供理论基础的参考依据。

