钛种植体表面Ag/HA涂层的制备及其生物活性
张 岚,吴伟菁,余亚选
(厦门医学院 药学系,福建 厦门 361023)
钛合金材料具有高断裂韧度和抗弯折强度等性能,能够作为替代人牙硬质的重要口腔植入材料,在口腔钛种植体表面制备功能性羟基磷灰石[Ca10(PO4)6(OH)2,HA]涂层成为研究的热点[1-3],纳米HA作为骨和牙硬组织相类似的化学和物理特性,常用于骨再生替换材料,具有良好的生物相容性,能够促进成骨细胞在涂层表面粘附和成骨分化,也是目前作为种植体材料表面改性的重要材料[4-6],但是羟基磷灰石本身抗菌性较差,作为改性涂层仍然会出现植入感染及其与邻近骨连接的缺失,这些并发症可导致组织愈合时间延长甚至种植治疗的失败[7]。Inga Grigoraviciute-Puroniene等[8]采用溶胶凝胶法制备Ca10(PO4)6(OH)2∶Ag粉体,但得到的晶体是微米级颗粒相比于纳米HA颗粒在生物活性方面较差。Umit Erdem等[9]在牙本质表面浸涂掺杂银羟基磷灰石材料,使牙本质小管充满HA-Ag材料,具有较好的抗过敏、抗菌性和生物相容性用于治疗龋齿,但是浸涂层均匀性较差,两者均未涉及到种植体表面的应用,适用范围小。
文章采用水热法预制纳米Ca10(PO4)6(OH)2∶Ag粉体,使用TEM、FTIR、XRD表征其成分、组成,采用电泳沉积法[6]在口腔用种植体钛表面沉积均匀Ca10(PO4)6(OH)2∶Ag涂层,涂层烧结处理后预期得到致密纳米Ca10(PO4)6(OH)2∶Ag涂层,对改性后的钛表面沉涂层进行体外成骨细胞粘附和增殖测试表征,并评价其作为口腔种植体的应用前景。
1 实验
1.1 实验材料
1.1.1 实验试剂
(CH3COO)2Ca·H2O、(NH4)2HPO4、H2NCONH2、正丁醇、丙酮、双氧水、浓氨水(以上试剂均购于国药厦门试剂公司),去离子水,口腔钛种植体(宝鸡英耐特医用钛有限公司),小鼠骨骼肌细胞C2C12(ATCC号:CRL-1772TM)购于中国科学院细胞库。
1.1.2 实验仪器
DDY-6B稳压稳流电泳仪、500 mL内衬聚四氟乙烯的水热高压釜、KQ-100VDB型数控超声清洗器、SX3-3-10陶瓷纤维马弗炉、FLEXSEM 1000场发射扫描电子显微镜(SEM) 、HITACHI HT770型透射电子显微镜(TEM)、SHIMADZU XRD-6100型X射线粉末衍射(XRD)仪、BRUKER ALPHA型红外光谱仪(FTIR)。
1.2 实验方法
1.2.1 纳米Ca10(PO4)6(OH)2∶Ag粉体制备
按照表1数据Ca/P比约为1.67配置溶液,向100 mL烧杯中加入35 mL去离子水,分别加入AgNO3、(CH3COO)2Ca·H2O进行溶解,与事先溶解的35 mL (NH4)2HPO4溶液混合后搅拌均匀,再加入表面活性剂SDS和尿素(H2NCONH2),搅拌15 min后转移至水热反应釜中,放入烘箱调节恒温120 ℃加热10 h,自然冷却后取出离心,经去离子水洗涤,乙醇洗涤后得到的固体在60 ℃下烘干5 h得到产物,利用TEM、FTIR、XRD、EDS分析粉体的组成和结构。
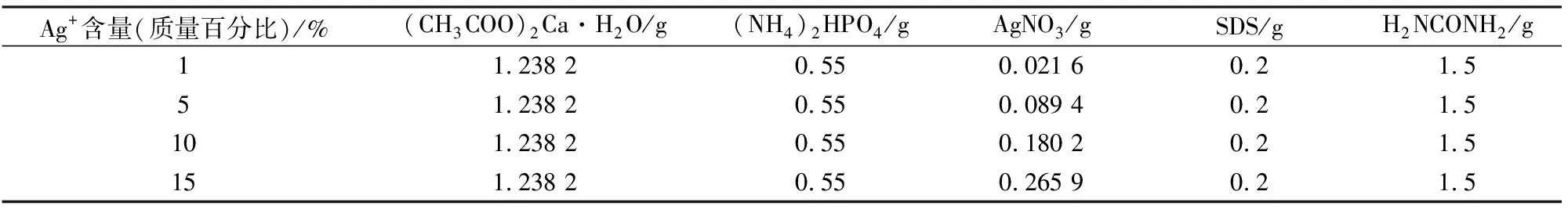
表1 水热法制备纳米Ca10(PO4)6(OH)2 ∶Ag粉体的组成Tab.1 Ingredients of silver-doped hydroxyapatite [Ca10(PO4)6(OH)2 ∶Ag] by a hydrothermal method
1.2.2 Ca10(PO4)6(OH)2∶Ag涂层制备
电子天平称取球磨过的纳米HA、添加剂和造孔剂,加入至100 mL烧杯中,以40 mL正丁醇为分散溶剂,搅拌均匀,缓慢滴加0.5 mL三乙醇胺改善颗粒悬浮状况[10],烧杯置于超声仪中超声分散1 h,静置陈化24 h待用。将口腔种植体钛表面平整后放置于烧杯中加双氧水/氨水超声除油刻蚀,丙酮超声除油,二次蒸馏水水洗晾干,以石墨为阳极,口腔钛种植体为阴极,距离0.7 cm,调节电压45 V,电泳沉积时间120 s,取出放置在干燥器待用。将沉积的复合涂层放置于马弗炉中以10 ℃/min速率程序升温700 ℃,保温2 h,烧结后自然冷却,隔天取出,干燥器中存放。
1.2.3 体外生物活性实验
体外生物活性采用10%的胎牛血清(FBS)和1%双抗(PS)的DMEM培养基(高糖),将小鼠骨骼肌细胞接种于培养板中,置于恒温 37 ℃、CO2体积分数为5%的细胞培养箱中培养,每24 h更换新鲜培养基,每天观察细胞生长。将培养的细胞悬浮液接种在放置样品的六孔板中,每组重复3孔,培养时间为24 h,采用PBS漂洗,用3%的戊二醛、1.5%的多聚甲醛混合固定液低温固定30 min,不同浓度乙醇进行梯度脱水,最后用丙酮脱水5min,取出样品后采用真空烘干机中干燥,粘样品至铜台,喷金处理后采用SEM表征细胞的粘附情况。
2 结果与讨论
2.1 TEM分析
当Ag+含量为15%(质量百分比,下同)时,水热合成的粉体TEM图如图1,制备的粉体形状呈棒状,长度在100~250 nm之间,直径约为20 nm,尺寸分布较均匀,见图1(a)。单根纳米棒的选取电子衍射SAED见图1(b),对应的晶体衍射斑点明亮,阵列整齐,该晶体属于典型的单晶结构,这与HA晶相一致[11]。说明水热合成的粉体为纳米HA晶体,同时Ag+的掺杂没有改变HA的晶相。

图1 Ag+含量为15%所得粉体的 TEM(a)和SAED图(b)Fig.1 TEM(a) and SAED(b) micrographs of sample with the amount of Ag+ 15%
2.2 FTIR分析
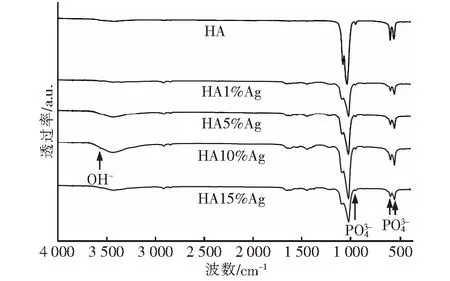
图2 不同含量Ag+掺杂羟基磷灰石得的FTIR图谱Fig.2 FTIR spectra of Ca10(PO4)6(OH)2:Ag with different contents
2.3 XRD分析
随着Ag+的掺杂含量的增加,一系列X射线衍射峰见图3。与未掺杂Ag+的HA的标准卡片(JCPDS-09-0432)衍射峰基本一致,且不存在任何第二相如 CaO、Ag3PO4或β-TCP ,表明Ag+已成功取代Ca2+形成了晶体,同时又不会干扰羟基磷灰石的晶格,这也与TEM分析结果相一致,晶相可能的形成过程如下[13]。
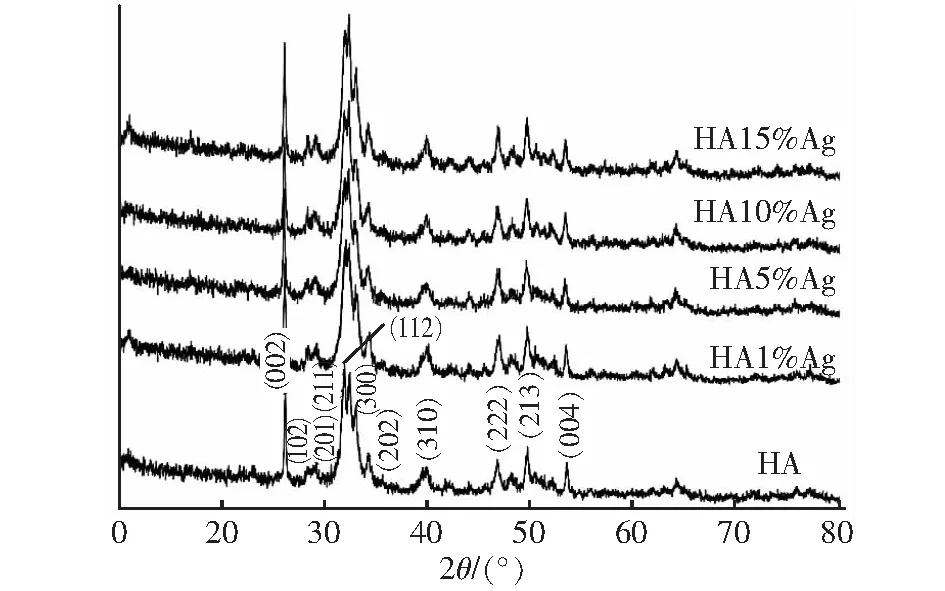
图3 不同含量Ag+掺杂Ca10(PO4)6(OH)2 ∶Ag XRD图谱Fig.3 XRD patterns of Ca10(PO4)6(OH)2 ∶Ag with different contents
2.4 体外生物活性分析
体外细胞培养是评价涂层生物活性的重要手段之一[15],在钛种植体表面电泳Ag/HA涂层,处理后的涂层在小鼠骨骼肌细胞的细胞培养箱中培养24 h后的扫描电镜图,见图4。相比于Ag掺杂HA涂层,见图4(b)、图4(c)、图4(d)及图4(e),纯HA涂层上面小鼠骨骼肌细胞生长较缓慢,伪足没有向外延伸,粘附性也不强见图4(a),可以看到小鼠骨骼肌细胞在不同Ag+含量掺杂Ag/HA的涂层表面生长较好,放大倍数后发现细胞能够自主生长,细胞间交互交联,细胞的伪足不断向外延伸,细胞粘附涂层表面贴合紧密,继续观察单个细胞大小达到25.9 μm以上,见图4(e),说明Ag+的掺杂能够促进小鼠骨骼肌细胞在HA涂层表面的生长,使HA涂层具有良好的生物活性[16]。
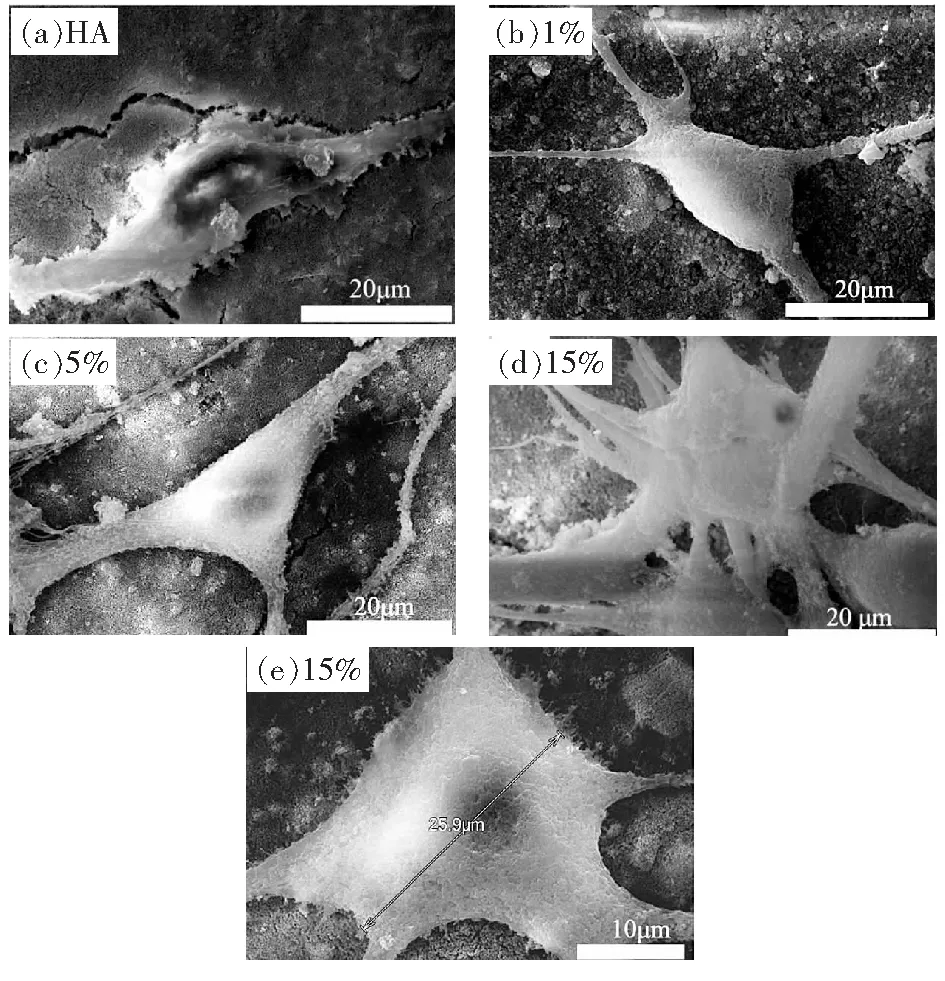
图4 Ag/HA涂层表面小鼠骨骼肌细胞的生长情况Fig.4 Growth of mouse skeletal muscle cells on the Ag/HA coating observed by SEM
3 结论
水热法合成Ca10(PO4)6(OH)2的过程中掺杂不同含量Ag+,通过TEM、FTIR、XRD、EDS表征表明长度在100~250 nm之间,直径约为20 nm的纳米Ag/HA粉体,Ag+的掺杂并没有改变Ca10(PO4)6(OH)2晶相,在钛种植体表面电泳沉积Ag/HA涂层,经过体外细胞评价显示,小鼠骨骼肌细胞在涂层表面能够粘附并有效增长,随着Ag+含量的增加细胞伪足不断向外延伸,逐渐形成良好的细胞形态,相比于纯HA涂层具有更好的生物活性和生物相容性,综上所述,经过Ag/HA涂层改性后的钛种植体具有较好的应用前景。

