黄芪建中汤对脾胃虚寒证胃溃疡大鼠胃黏膜保护作用的机制研究
周赛男,刘 琴,周 姝,韩运宗,陈思清,符 佳*
1.湖南中医药大学第一附属医院,湖南 长沙410007;2.湖南中医药大学,湖南 长沙410208
胃溃疡(gastric ulcer, GU)是常见的胃肠道疾病之一,每年影响全球超过1 万人口,其严重则可能引起胃出血、胃穿孔,甚至也有产生癌变的倾向[1]。近年,由于生活水平的提高以及饮食习惯的改变,GU 的发病趋于年轻化,并且发病率有所上升。 尽管目前现代医学治疗GU 的手段能在一定程度上缓解胃黏膜损伤的状况,但仍有复发率高、不良反应明显的局限性[2]。
黄芪建中汤是记载于《金匮要略》的经典方剂,其基于GU 脾胃虚寒之病机和“脾主卫”的理论组方,临床治疗GU 效果满意[3-4]。 研究发现,黄芪建中汤有抗炎和促进胃黏膜修复与愈合的作用[5-6],然而其具体机制有待进一步研究。
GU 发病机制尚未完全明了,胃黏膜防御机制和攻击机制的失衡是诱导其发病的关键[7]。 研究表明[8-10],HGF/c-Met 通路在胃上皮细胞广泛分布,是介导PI3K/AKT 信号途径的起始点;HGF 与c-Met受体结合后,c-Met 自身的酪氨酸发生磷酸化,进而激活PI3K/AKT 信号通路中的关键分子,进而调节细胞增殖、分化、迁移及有丝分裂等多个过程,发挥修复黏膜损伤、调节免疫的功能。 研究证实[11],白细胞介素-18(interleukin-18, IL-18)、白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)均为促炎因子,其释放过多可产生炎症反应,诱发或加重GU。 本研究旨在通过检测GU 模型大鼠血清炎症因子及胃组织中HGF、c-Met、PI3K、AKT、EGFR 等的表达,探讨黄芪建中汤治疗GU 的作用机制。
1 材料
1.1 实验动物
7 周龄Wistar 大鼠60 只,均为雄性,体质量190~210 g。实验动物购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0004]。 分笼喂养于湖南中医药大学动物实验中心(清洁级),温度为24~26 ℃且湿度维持在50%~70%,明暗各12 h/d,喂普通的饲料,自由摄水。本研究由湖南中医药大学第一附属医院实验动物伦理委员会批准(ZYFY20190120)。
1.2 药物及制备
奥美拉唑肠溶片(阿斯利康制药有限公司,批号:02002750)。 黄芪建中汤(饴糖30 g、大枣6 枚、生姜9 g、炙甘草6 g、桂枝9 g、芍药18 g、黄芪22 g);小承气汤(大黄12 g、厚朴6 g、枳实9 g),全部中药均来自湖南中医药大学第一附属医院。 药物经湖南中医药大学第一附属医院龙红萍副研究员进行鉴定,均符合《中华人民共和国药典》要求。 中药汤液制备法:将上述药材使用蒸馏水浸泡30 min 后,再煎煮2 次,混合后趁热过滤,最后对药液进行浓缩(每1 mL 药液含1 g 生药),低温存放。
1.3 主要试剂
HGF 抗体(英国Abcam 公司,批号:ab134152);c-Met 抗体、ERK1/2 抗体(美国affinity 公司,批号:25869-1-AP);TNF-α、IL-1β、IL-6 试剂盒(武汉华美生物工程有限公司,批号分别为CSB-E11987r、CSB-E08055r、CSB-E04640r);PI3K 抗体(美国CST公司,批号:4249);p-AKT 抗体、AKT 抗体(美国Proteintech 公司,批号分别为66444-1-Ig、10176-2-AP);EGFR 抗体(英国abcam 公司,批号:ab52894);琼脂糖(西班牙BIOWEST 公司,批号:111860)。
1.4 主要仪器
光学显微镜(Motic 仪器公司,型号:B10T);酶标仪(深圳市汇松科技发展有限公司,型号:MB-530);水平琼脂糖电泳槽(中国北京六一公司, 型号:DY CP-31DN);精密pH 计(中国雷磁公司,型号:PHS-3C);切片刀(莱卡公司,型号:M199);电热恒温培养箱(北京市永光明医疗仪器有限公司,型号:DHP-500)。
2 方法
2.1 分组
将实验大鼠随机分成正常组、模型组、中药组和西药组。 每组15 只。
2.2 造模
据参考文献[12]复制模型,对大鼠适应性喂养7 d后,先以小承气汤隔日灌胃1 次,灌胃当天不喂食,次日不限饮食,共10 d。 于第11 日时,禁食但允许自由饮水24 h 后,用耗气破气法+饥饱失常法+冰醋酸法建立GU 大鼠模型,即将大鼠用戊巴比妥(30 mg/kg)麻醉处理后固定在鼠板上,在无菌操作下,从左肋下纵行切开腹壁,轻拉出全胃,把一根塑料管(直径约6 mm)垂直放在胃前壁浆膜面与窦体交汇处,倒入冰醋酸灼烧胃1 min,使用适量生理盐水轻轻擦拭后,还纳胃至腹腔,缝合伤口,同时涂红霉素眼膏抗感染。造模成功的标准[13]:胃黏膜损伤指数升高、胃黏膜绒毛间有明显的出血发生,伴有黏液细胞严重脱落。
2.3 给药
中药组灌以黄芪建中汤10 mL/(kg·d),即6.8 g/(kg·d), 剂量根据人类剂量33 g/d 以及人和大鼠体表面积换算;西药组灌以奥美拉唑10 mL/(kg·d),即4.2 mg/(kg·d),剂量根据人类40 mg/d 以及人和大鼠体表面积换算。 另外两组则灌以等体积蒸馏水。 用10 mL/kg 的体积喂各组大鼠,1 次/d,共持续药物干预20 d。
2.4 标本采集
结束药物干预后,每组大鼠禁食但准许摄水24 h。首先麻醉各组大鼠,从腹主动脉收集到血以后,逐层剪开腹腔,取胃剪开,去除内容物后将其清洗干净,胃组织一半采取多聚甲醛固定,另一半直接存放到-80 ℃冰箱。
2.5 指标检测
2.5.1 一般状态观察及体质量变化 观察各组大鼠的活动度、精神状态、粪便状况等一般状态,同时记录大鼠体质量的增长情况。
2.5.2 胃溃疡指数(ulcel index, UI)的计算 应用10 倍放大镜观察记录溃疡灶的大小,同时采取Guth[14]标准以计算胃UI。 具体算法:(1)黏膜出现斑点或者糜烂,1 分;(2)黏膜糜烂长度<1 mm,1 分;(3)黏膜损伤长度达l~2 mm,3 分;(4)黏膜损伤长度达2~3 mm,4分;(5)损伤长度>4 mm,5 分。 损伤的宽度>2 mm,总评分加倍。 由两人同时完成评估,UI 取二人计算结果的平均值。
2.5.3 HE 染色检测胃组织病理变化 胃组织通过脱水、石蜡包埋、切成大小约4 μm 的切片,再采用HE 染色常规方法规范进行,在显微镜下观察。
2.5.4 ELISA 检测血清TNF-α、IL-6 和IL-1β 水平
将收集到的腹主动脉血放在室温下待其凝固,再以3 500 r/min 离心20 min,离心半径为5.5 cm,获得上清液,对应ELISA 试剂盒说明书仔细操作检测炎症介质的含量。
2.5.5 免疫组织化学检测胃组织HGF、c-Met 蛋白表达水平 取各组的胃组织,经石蜡包埋、切片、二甲苯脱蜡、脱水,再进行热修复抗原,然后漂洗3 次后封闭。 先滴加稀释后的一抗(HGF、c-Met 抗体稀释比例均为1∶50),4 ℃条件下处理过夜。 冲洗3 次后加入二抗(100 μL 左右)。经DAB 显色后,将细胞核复染苏木素、返蓝、脱水,再封片处理,采取显微镜收集图像并分析。
2.5.6 RT-PCR 检 测 胃 组 织HGF、c-Met、PI3K 和EGFR 的mRNA 表达水平 取每组约0.02 g 的胃组织,采用Trizol 提取出总RNA,再用逆转录试剂盒合成产物cDNA。 扩增条件:预变性:95 ℃30 s;循环反应:95 ℃10 s,60 ℃30 s,循环40 次;熔解曲线:95 ℃15 s,60 ℃60 s,95 ℃15 s。根据2-△△Ct法计算目标mRNA 的相对表达量。 引物序列(由上海生工合成)见表1。

表1 引物序列表
2.5.7 Western blot 检测胃组织PI3K、p-AKT、EGFR的蛋白表达水平 取适量胃组织,向其中加入RIPA裂解液并反复研磨至组织溶解,离心后获取上清液。SDS-PAGE 变性电泳将蛋白按分子量大小分开,完成蛋白转膜,再采取封闭液把膜封闭。然后滴加稀释后的一抗(PI3K、AKT、p-AKT、EGFR、β-actin 分别以1∶1 000、1∶1 000、1∶15 000、1∶2 000、1∶5 000 稀释),孵育过后进行封闭,孵育二抗之后再次进行显色。 经化学发光成像系统收集图像,借助Quantity one软件算出灰度值。
2.6 统计学分析
本研究的全部数据的分析均应用SPSS 22.0 统计软件。 计量资料采取“±s”表示。 符合正态性分布和方差齐性,多组间的比较则采用单因素方差分析,若符合正态性分布但不符合方差齐性,则选用LSD法,若不符合正态性分布和方差齐性,则采用秩和检验。 以P<0.05 表示差异有统计学意义。
3 结果
3.1 黄芪建中汤对模型大鼠一般情况及体质量增长情况的影响
正常组大鼠的精神状态和活动程度从造模到取材前情况均良好,毛发正常,粪便成形,同时体质量进行性增加;与正常组比,模型组大鼠精神状态较差,反应不灵敏,毛发稀疏且萎黄,粪便不成形,体质量增长率明显降低(P<0.05);与模型组比,中药组和西药组精神欠佳、毛发稀疏、稀便、反应迟钝等情况均改善,体质量增长速度也有所加快(P<0.05);两组之间差异无统计学意义(P>0.05)。 详见表2。
表2 各组大鼠体质量变化情况(±s,n=3)
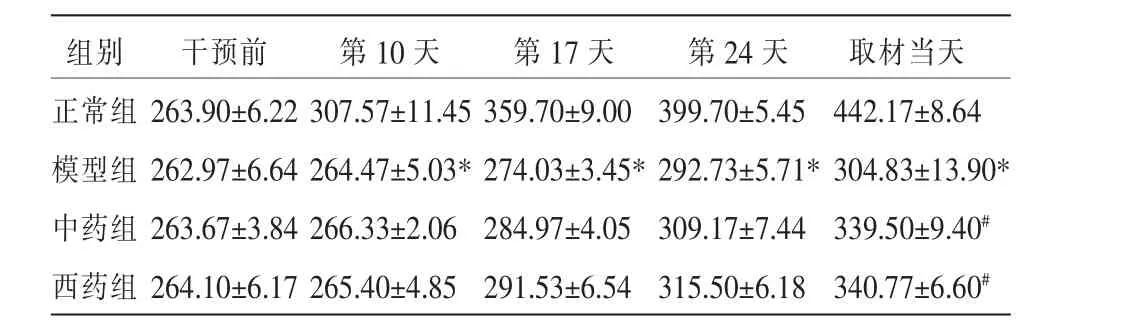
表2 各组大鼠体质量变化情况(±s,n=3)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
组别正常组模型组中药组西药组取材当天442.17±8.64 304.83±13.90*339.50±9.40#340.77±6.60#干预前263.90±6.22 262.97±6.64 263.67±3.84 264.10±6.17第10 天307.57±11.45 264.47±5.03*266.33±2.06 265.40±4.85第17 天359.70±9.00 274.03±3.45*284.97±4.05 291.53±6.54第24 天399.70±5.45 292.73±5.71*309.17±7.44 315.50±6.18
3.2 黄芪建中汤对模型大鼠UI 的影响
相比正常组,模型组大鼠的UI 明显升高(P<0.05);中药组UI 较模型组下降(P<0.05)。详见表3。
表3 黄芪建中汤对模型大鼠UI 的影响(±s,n=3)
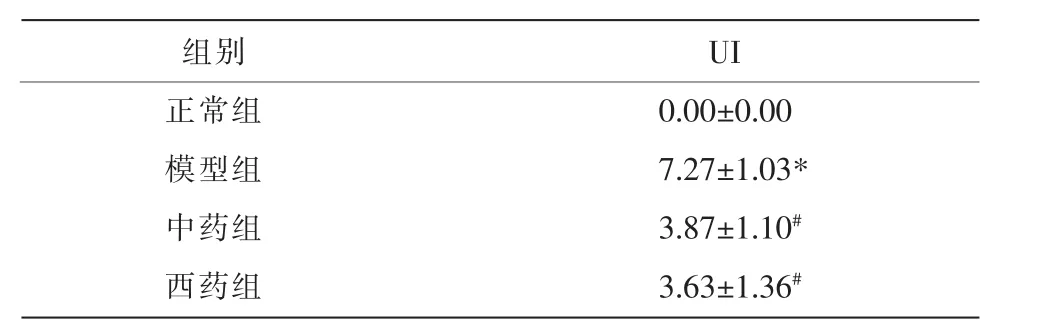
表3 黄芪建中汤对模型大鼠UI 的影响(±s,n=3)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
组别正常组模型组中药组西药组UI 0.00±0.00 7.27±1.03*3.87±1.10#3.63±1.36#
3.3 各组大鼠胃组织形态的观察
正常组大鼠胃黏膜上皮组织的形态完整,单层柱状细胞相互之间排列规整,没有出血或脱落;与正常组比,模型组大鼠胃黏膜绒毛间有明显的出血发生,伴有黏液细胞严重脱皮。与模型组相比,中药组和西药组的黏膜损伤程度均有明显的改善;中药组与西药组比较差异无统计学意义(P>0.05)。 详见图1。
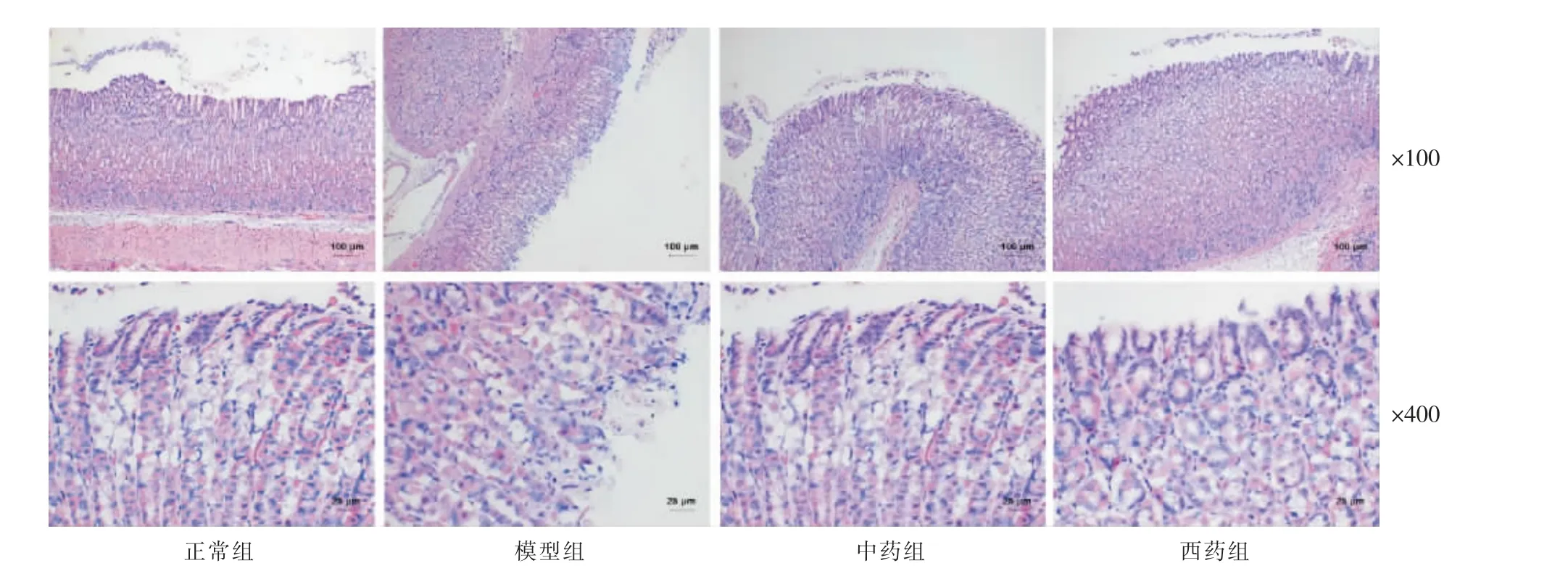
图1 各组大鼠胃组织形态(HE 染色)
3.4 黄芪建中汤对模型大鼠血清TNF-α、IL-6 和IL-1β 含量的影响
与正常组比较,模型组TNF-α、IL-6 及IL-1β显著升高(P<0.05);与模型组比,中药组与西药组TNF-α、IL-6 及IL-1β 显著下降(P<0.05);中药组与西药组比较差异无统计学意义。 详见表4。
表4 黄芪建中汤对模型大鼠血清炎性因子的影响(±s,ng/mL,n=3)

表4 黄芪建中汤对模型大鼠血清炎性因子的影响(±s,ng/mL,n=3)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
组别正常组模型组西药组中药组TNF-α 7.46±0.59 29.04±2.77*13.29±2.14#19.10±1.46#IL-6 38.57±3.24 90.40±5.18*53.10±3.52#72.84±3.81#IL-1β 215.78±8.30 1 045.45±55.09*433.88±21.13#582.73±22.80#
3.5 黄芪建中汤对模型大鼠胃组织中HGF、c-Met的蛋白表达水平的影响
与正常组比较,模型组胃HGF 蛋白表达显著升高(P<0.05);与模型组比较,中药组和西药组的HGF蛋白表达明显增加(P<0.05);中药组与西药组比较,差异无统计学意义(P>0.05);各组间c-Met 水平无明显差异(P>0.05)。 详见表5 和图2—3。
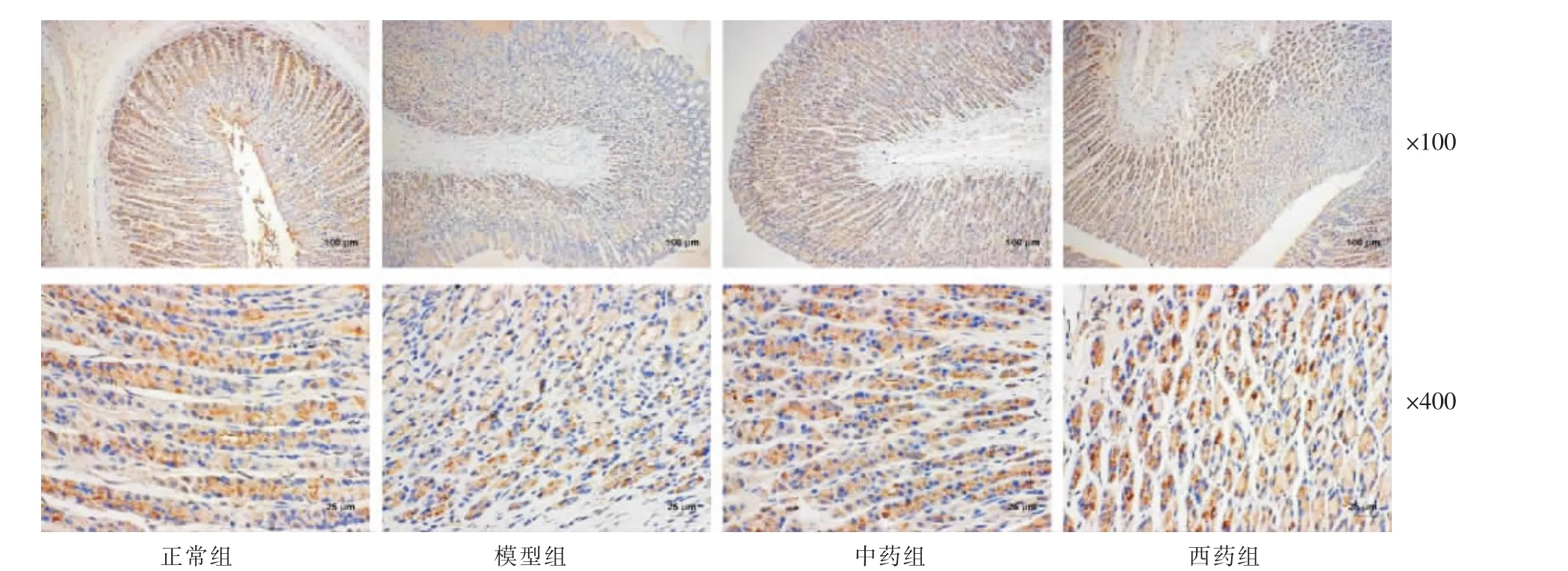
图2 黄芪建中汤对模型大鼠胃组织HGF 表达的影响(免疫组织化学)
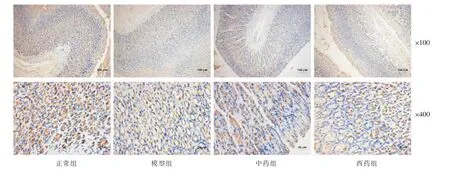
图3 黄芪建中汤对模型大鼠胃组织c-Met 表达的影响(免疫组织化学)
表5 黄芪建中汤对模型大鼠胃组织中HGF、c-Met 的蛋白表达水平的影响(±s,n=3)

表5 黄芪建中汤对模型大鼠胃组织中HGF、c-Met 的蛋白表达水平的影响(±s,n=3)
注:与正常组比较,*P<0.05;与模型组比较,P<0.05。
?
3.6 黄芪建中汤对模型大鼠HGF、c-Met、PI3K、AKT 和EGFR 的mRNA 表达水平的影响
与正常组比较,模型组胃HGF、c-Met mRNA表达水平显著上升(P<0.05),PI3K、EGFR mRNA 表达水平显著下降(P<0.05);与模型组比较,中药组和西药组胃HGF、c-Met、PI3K 和EGFR mRNA 表达水平均上升(P<0.05),且中药组与西药组比较,差异无统计学意义(P>0.05);各组间AKT mRNA 水平无明显差异(P>0.05)。 详见表6。
表6 黄芪建中汤对模型大鼠HGF、c-Met、PI3K、AKT 及EGFR 的mRNA 表达水平的影响(±s,n=3)

表6 黄芪建中汤对模型大鼠HGF、c-Met、PI3K、AKT 及EGFR 的mRNA 表达水平的影响(±s,n=3)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
组别正常组模型组西药组中药组HGF 0.33±0.05 0.72±0.04*0.99±0.03#0.86±0.01#c-Met 0.26±0.03 0.49±0.06*0.97±0.04#0.72±0.02#PI3K 3.80±0.17 0.97±0.03*1.97±0.15#2.20±0.42#AKT 3.24±0.43 3.09±0.45 3.21±0.19 3.32±0.33 EGFR 1.02±0.03 0.31±0.00*0.82±0.04#0.65±0.04#
3.7 黄芪建中汤对模型大鼠胃组织PI3K、p-AKT和EGFR 蛋白表达水平的影响
与正常组比,模型组胃PI3K、p-AKT 和EGFR蛋白表达明显降低(P<0.05);与模型组比,中药组和西药组胃PI3K、p-AKT 和EGFR 蛋白表达明显上升(P<0.05);中药组与西药组比较,差异无统计学意义(P>0.05)。 详见表7、图4。

图4 各组大鼠PI3K、p-AKT 及EGFR 的蛋白表达
表7 黄芪建中汤对模型大鼠胃组织PI3K、p-AKT 和EGFR 蛋白表达水平的影响(±s,n=3)

表7 黄芪建中汤对模型大鼠胃组织PI3K、p-AKT 和EGFR 蛋白表达水平的影响(±s,n=3)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
组别正常组模型组黄芪建中汤组奥美拉唑组PI3K/β-actin 0.63±0.04 0.23±0.02*0.50±0.05#0.48±0.04#p-AKT/β-actin 0.61±0.04 0.20±0.02*0.49±0.04#0.44±0.04#EGFR/β-actin 0.47±0.02 0.18±0.03*0.28±0.02#0.32±0.02#
4 讨论
GU 是一种以胃黏膜深度坏死性缺损为主要病理表现的消化疾病。确切的发病机制不明,可能与幽门螺杆菌感染、胃酸分泌过多、黏膜修复功能下降、非甾体抗炎药等造成黏膜损伤有关[15]。目前,西医主要治疗药物有抗酸药、质子泵抑制剂、胃黏膜保护剂等,但都存在不良反应等缺陷。近年研究中,中医药治疗GU 优势显著[16]。 中医学认为GU 属于“胃脘痛”“痞满”等疾病范畴,脾胃虚寒证为其常见证型之一。寒邪侵犯胃脘致气血失养、阳气受损,不荣则痛。黄芪建中汤具有温脾暖胃、补中益气及止痛的功效,可针对脾胃虚寒之病机改善胃部痛证。 方中黄芪补气升阳,饴糖健脾,共为君药;桂枝驱风寒,白芍止痛,共为臣药;生姜温中散寒,大枣补血,同为佐药;炙甘草解中焦脾胃之痛,调和诸药,为使药。 现代药理学研究证实[17-18],黄芪、甘草具有保护胃黏膜的作用,桂枝、芍药具有抑制胃酸分泌的作用。 本实验中GU 模型大鼠在给予黄芪建中汤灌胃之后,其一般状态好转,体质量增长速度加快,UI 降低,胃组织病理改变改善,表明黄芪建中汤对GU 大鼠胃黏膜损伤具有一定的修复作用。
最新研究表明[19],胃黏膜上皮细胞增殖与凋亡失衡在GU 的发生发展中起关键作用。正常状态下,胃黏膜上皮细胞的凋亡与增殖保持平衡。 而炎性介质、胃酸、幽门螺杆菌感染等各类刺激因素均可加速细胞凋亡,损害增殖和凋亡的平衡,进而引起胃黏膜损伤、GU 发生[20]。 HGF/c-Met、PI3K/AKT 信号途径被抑制是诱发GU 发病的两条重要信号通路[21]。HGF 属于一种多效能的生长因子,其与受体c-Met结合后,能激活PI3K/AKT 通路促进上皮细胞增殖、迁移、再上皮化和胃腺重建[22]。 PI3K 属于一种脂质激酶,其激活后能磷酸化AKT,使其具有活性,且动物实验表明,激活PI3K/AKT 途径能发挥促进胃上皮细胞增殖、抑制凋亡的作用[23-24]。 EGFR 是一种跨膜糖蛋白,可与EGF 结合构成二聚体,发挥减少胃酸分泌、促进胃溃疡愈合、修复黏膜损伤的生物功能[25]。本实验结果也显示,模型组大鼠胃组织HGF、c-Met mRNA 及HGF 蛋白表达显著升高,PI3K mRNA 及PI3K、p-AKT、EGFR 蛋白表达水平显著降低;而经黄 芪 建 中 汤 干 预 后HGF、c-Met、PI3K mRNA 及HGF、PI3K、p-AKT、EGFR 蛋白表达水平显著高于模型组;但各组间c-Met 蛋白表达水平差异无统计学意义。 以上表明黄芪建中汤对GU 胃上皮细胞增殖有明显的促进作用。 修复GU 黏膜损伤。
炎症亦是GU 发病机制中的关键因素,且多种炎症细胞因子参与其中[26]。正常情况下,巨噬细胞应答炎症信号处在较低水平。 研究发现[27-29],在有害因素刺激下,巨噬细胞功能发生改变,分泌促炎因子TNF-α;TNF-α 可进一步促进IL-1β、IL-6 等其他促炎因子的产生,直接引起胃黏膜损伤,亦可促进中性粒细胞聚集在炎症部位,从而分解连接蛋白、破坏黏膜屏障,诱发或加重GU。 本次研究发现,经黄芪建中汤灌胃给药后,GU 大鼠血清中IL-6、IL-β、TNF-α 含量显著降低,提示黄芪建中汤能有效抑制GU 大鼠炎症反应。
综上所述,黄芪建中汤能有效改善GU 大鼠胃黏膜损伤,其机制可能与激活HGF/c-Met、PI3K/AKT信号途径以促进胃上皮细胞增殖及减轻炎症反应有关。本研究为临床防治GU 提供新的思路与靶点,但黄芪建中汤治疗GU 的分子机制仍需进一步探索。

