品读课程标准 深研流程真题 明确复习方向
——以2022年河北卷第15题工艺流程题为例
米日新 魏利巍
(河北省石家庄市鹿泉区第一中学)
《普通高中化学课程标准》(2017年版2020年修订,以下简称《课程标准》)坚持以习近平新时代中国特色社会主义思想为指导,落实立德树人的根本任务,聚焦学科核心素养的培养,制定了学业质量标准,是高考命题的依据。高考工艺流程试题紧扣《课程标准》,注重理论联系实际,通过创设真实情境,适度增加开放性与灵活性,突出学科关键能力和思维品质的考查,实现科学服务选才的目的。然而,许多教师在分析此类高考试题时,无法从《课程标准》中找到命题依据,无法准确把握复习方向。下面以“2022年河北省学业水平等级性考试”第15题——工艺流程题为例,引领大家品读《课程标准》、理解命题依据、寻找复习方向。
【2022年河北卷,15题】以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如下:
回答下列问题:
(1)红渣的主要成分为________(填化学式),滤渣①的主要成分为________(填化学式)。
(2)黄铁矿研细的目的是______________________。
(3)还原工序中,不生成S单质的反应的化学方程式为______________________。
(4)工序①的名称为________,所得母液循环使用。
(5)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为________,氧化工序发生反应的离子方程式为______________________。
(6)若用还原工序得到的滤液制备Fe2O3·xH2O和(NH4)2SO4,所加试剂为________和________(填化学式,不引入杂质)。
一、品读试题,理清核心价值、核心素养、关键能力和必备知识之间的关系
(一)引导学生欣赏化学的价值,做好画龙点睛之笔
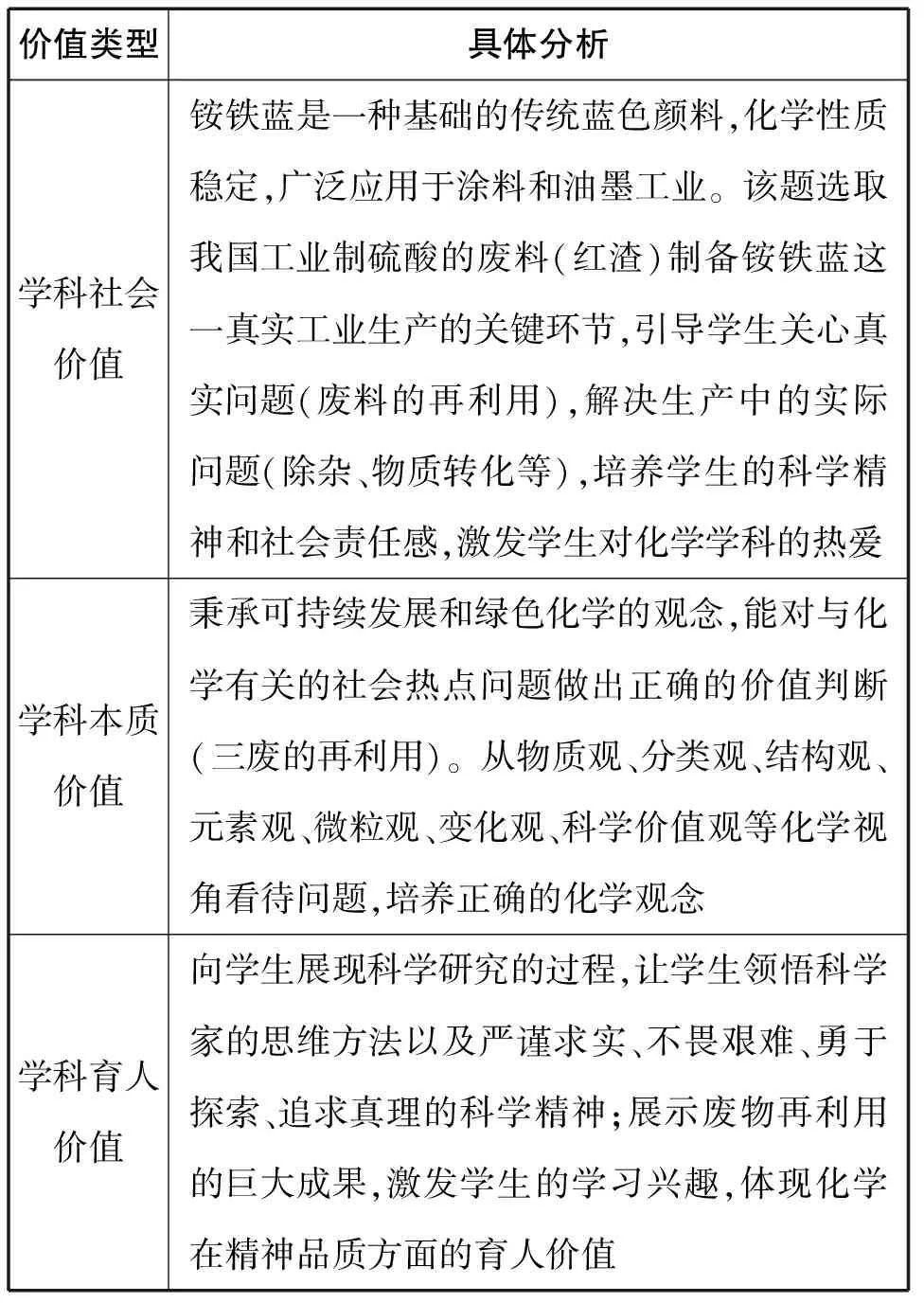
价值类型具体分析学科社会价值铵铁蓝是一种基础的传统蓝色颜料,化学性质稳定,广泛应用于涂料和油墨工业。该题选取我国工业制硫酸的废料(红渣)制备铵铁蓝这一真实工业生产的关键环节,引导学生关心真实问题(废料的再利用),解决生产中的实际问题(除杂、物质转化等),培养学生的科学精神和社会责任感,激发学生对化学学科的热爱学科本质价值秉承可持续发展和绿色化学的观念,能对与化学有关的社会热点问题做出正确的价值判断(三废的再利用)。从物质观、分类观、结构观、元素观、微粒观、变化观、科学价值观等化学视角看待问题,培养正确的化学观念学科育人价值向学生展现科学研究的过程,让学生领悟科学家的思维方法以及严谨求实、不畏艰难、勇于探索、追求真理的科学精神;展示废物再利用的巨大成果,激发学生的学习兴趣,体现化学在精神品质方面的育人价值
(二)认真研究、学习运用关键能力是核心素养养成的必由之路

关键能力具体内容试题分析理解与辨析能力既包括对已学知识的掌握和应用能力,又包括获取陌生知识和信息的能力。该能力要求学生能辨识模型、图表、文字、符号等各种类型的信息,从中提取关键内容,并能与已学知识进行整合,最终解答化学问题获取有关信息:题头、题干、题尾中文字,流程图,化学式,问题要求都是信息,选取用于解决问题的有效信息。辨析基本概念:化合价、化学方程式、离子方程式、化学式等,既是基本概念,也是必备知识。必须按要求作答,例如:(1)(3)(5)(6)分析与推测能力由知识的抽象理论到具体应用,包括判断物质结构、分析物质性质、预测反应现象和推断反应结果判断物质结构:(5)中化合价的判断;分析物质性质:(6)中物质的转化、(5)中离子方程式的书写、(3)中化学方程式的书写归纳与论证能力由个别现象到一般规律的要求包括识别有效证据、科学推理论证、处理转化数据和归纳总结规律识别有效证据:(5)中“白色沉淀”Fe(NH4)2Fe(CN)6和(3)中不生成S单质;科学推理论证:离子方程式中产物Fe(NH4)Fe(CN)6拆不拆等探究与创新能力该能力要求学生根据实验目的和要求,设计探究方案、描述实验现象、分析实验数据、评价探究方案设计探究方案:用还原工序得到的滤液制备Fe2O3·xH2O 和(NH4)2SO4,物质转化需要的试剂,不引入新的杂质
(三)夯实必备知识,为能力和素养的形成打好基础
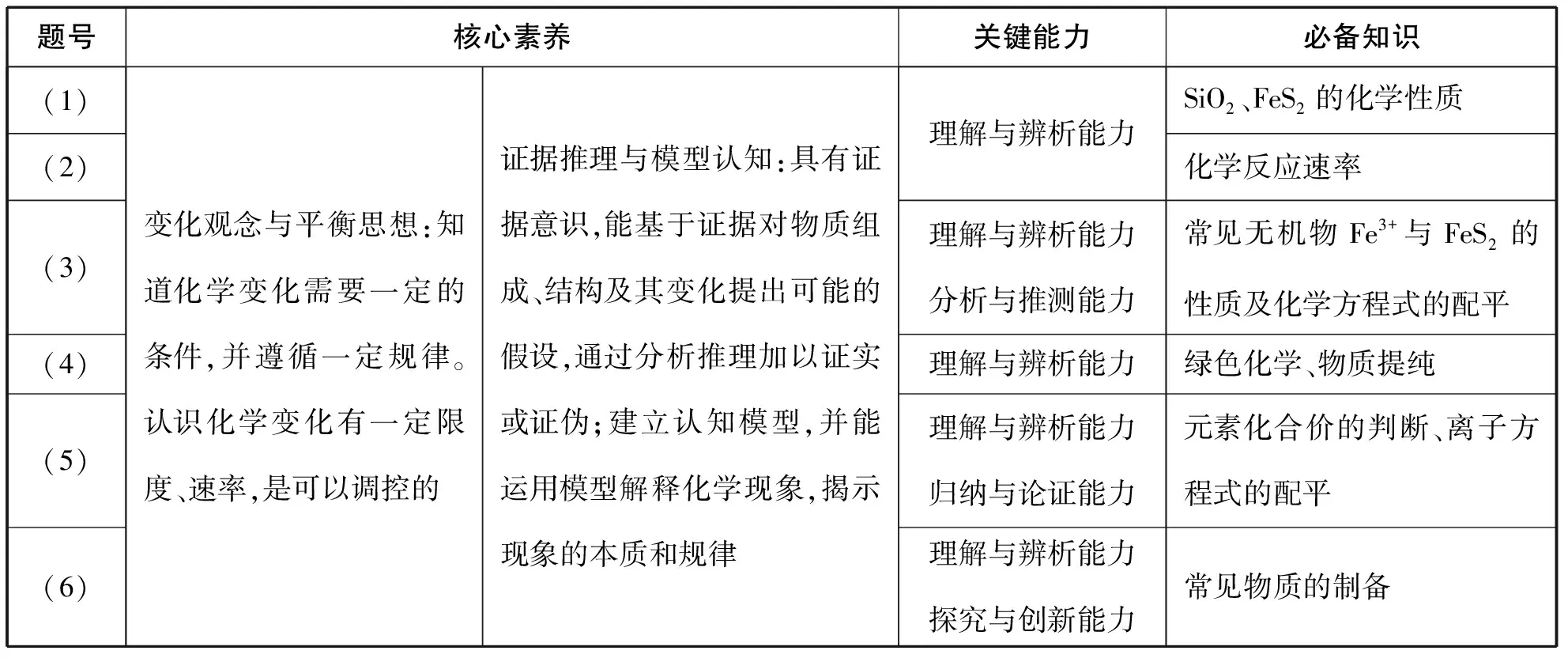
题号核心素养关键能力必备知识(1)(2)(3)(4)(5)(6)变化观念与平衡思想:知道化学变化需要一定的条件,并遵循一定规律。认识化学变化有一定限度、速率,是可以调控的证据推理与模型认知:具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪;建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律理解与辨析能力理解与辨析能力分析与推测能力理解与辨析能力理解与辨析能力归纳与论证能力理解与辨析能力探究与创新能力SiO2、FeS2的化学性质化学反应速率常见无机物Fe3+与FeS2的性质及化学方程式的配平绿色化学、物质提纯元素化合价的判断、离子方程式的配平常见物质的制备
二、品读课程标准,构建思维模型
【课标要求】能选择简明、合理的表征方法描述和说明化学变化的本质和规律,能根据化学反应原理预测物质转化的产物。
【模型建构1】产物预测及反应方程式书写模型
运用“证据→推理→符号表达”的思路,书写新情境下的反应方程式。
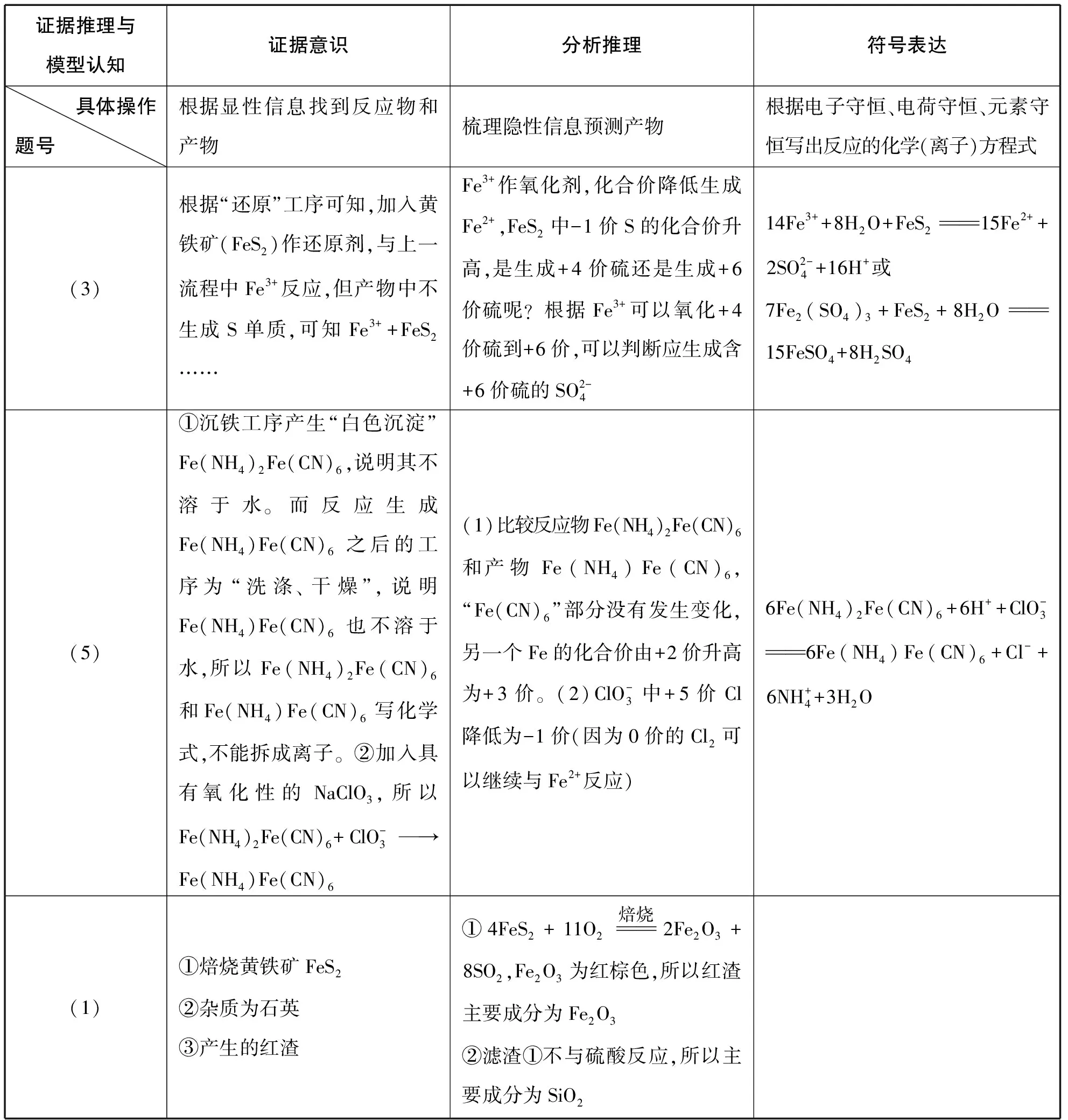
证据推理与模型认知证据意识分析推理符号表达 具体操作题号 根据显性信息找到反应物和产物梳理隐性信息预测产物根据电子守恒、电荷守恒、元素守恒写出反应的化学(离子)方程式(3)根据“还原”工序可知,加入黄铁矿(FeS2)作还原剂,与上一流程中Fe3+反应,但产物中不生成S单质,可知Fe3++FeS2……Fe3+作氧化剂,化合价降低生成Fe2+,FeS2中-1价S的化合价升高,是生成+4价硫还是生成+6价硫呢?根据Fe3+可以氧化+4价硫到+6价,可以判断应生成含+6价硫的SO2-414Fe3++8H2O+FeS2 15Fe2++2SO2-4+16H+或7Fe2(SO4)3+FeS2+8H2O 15FeSO4+8H2SO4(5)①沉铁工序产生“白色沉淀”Fe(NH4)2Fe(CN)6,说明其不溶于水。而反应生成Fe(NH4)Fe(CN)6 之后的工序为“洗涤、干燥”,说明Fe(NH4)Fe(CN)6 也不溶于水,所以Fe(NH4)2Fe(CN)6和Fe(NH4)Fe(CN)6写化学式,不能拆成离子。②加入具有氧化性的NaClO3,所以Fe(NH4)2Fe(CN)6+ClO-3→Fe(NH4)Fe(CN)6(1)比较反应物Fe(NH4)2Fe(CN)6和产物Fe(NH4)Fe(CN)6,“Fe(CN)6”部分没有发生变化,另一个Fe的化合价由+2价升高为+3价。(2)ClO-3中+5价Cl降低为-1价(因为0价的Cl2可以继续与Fe2+反应)6Fe(NH4)2Fe(CN)6+6H++ClO-3 6Fe(NH4)Fe(CN)6+Cl-+6NH+4+3H2O(1)①焙烧黄铁矿FeS2②杂质为石英③产生的红渣①4FeS2+11O2焙烧 2Fe2O3+8SO2,Fe2O3为红棕色,所以红渣主要成分为Fe2O3②滤渣①不与硫酸反应,所以主要成分为SiO2
【课标要求】能基于“绿色化学”理念设计无机化合物制备的方案。
【模型建构2】从物质性质、绿色化学角度建立物质制备与试剂选择的思维模型
【模型建构3】从化合价角度、物质类别角度和元素守恒角度建立物质转化的思维模型
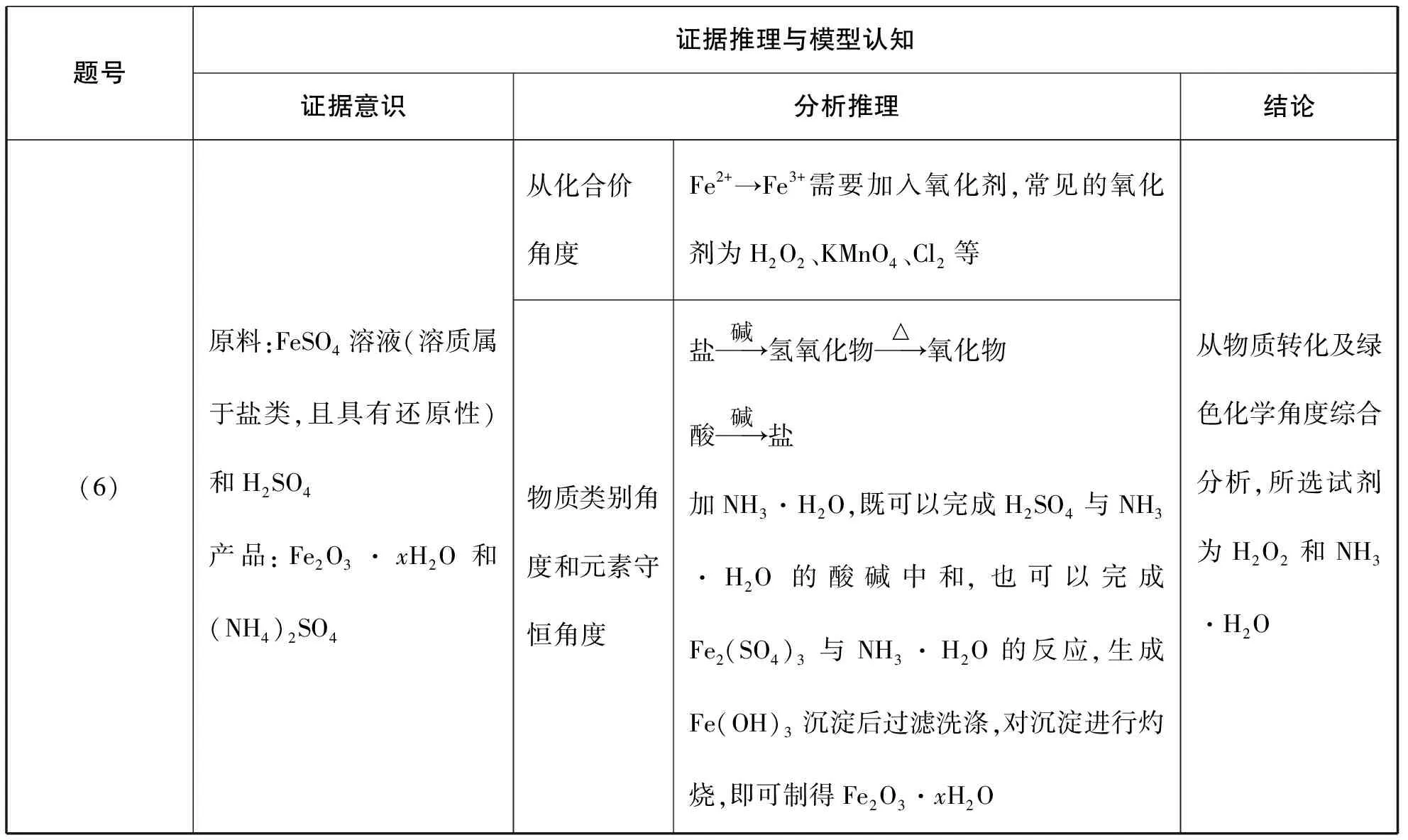
题号证据推理与模型认知证据意识分析推理结论(6)原料:FeSO4溶液(溶质属于盐类,且具有还原性)和H2SO4产品:Fe2O3·xH2O和(NH4)2SO4从化合价角度Fe2+→Fe3+需要加入氧化剂,常见的氧化剂为H2O2、KMnO4、Cl2等物质类别角度和元素守恒角度盐碱→氢氧化物△→氧化物酸碱→盐加NH3·H2O,既可以完成H2SO4与NH3·H2O的酸碱中和,也可以完成Fe2(SO4)3 与NH3·H2O的反应,生成Fe(OH)3 沉淀后过滤洗涤,对沉淀进行灼烧,即可制得Fe2O3·xH2O从物质转化及绿色化学角度综合分析,所选试剂为H2O2和NH3·H2O
【模型建构4】从溶液到晶体的思维模型

题号蒸发结晶蒸发浓缩、冷却结晶、过滤洗涤加热结晶、趁热过滤、洗涤(4)适用于物质溶解度随温度变化不大的物质,耗能较高适用于得到受热易分解或含结晶水的产品,如由FeSO4溶液得到绿矾(FeSO4·7H2O)等适用于产品的溶解度随温度升高而降低的物质
分析可知,前一个程序为还原,产生滤渣,所得液体(剩余的H2SO4和产生的FeSO4)进入工序①;从溶液中得到晶体,所以工序①的名称为蒸发浓缩、冷却结晶、过滤洗涤,所得母液主要含有H2SO4,可以循环利用。
【课标要求】能从调控反应速率、提高反应转化率等方面综合分析反应的条件,提出有效控制反应条件的措施。
【模型建构5】提高反应速率的思维模型:升高温度、增大浓度、增大压强、加入催化剂、增大接触面积。
问题(2)黄铁矿研细的主要目的是增大固液接触面积,加快反应速率,提高黄铁矿的利用率。
【课标要求】结合真实情境中的应用实例或通过实验探究,了解物质的性质和应用。
【模型建构6】利用批判性思维解决习惯性思维与新情境的思维冲突

证据推理与模型认知证据意识分析推理结论具体操作题号 根据显性信息找到反应物和产物抓住题干情境信息,分析反应过程,预测其他产物根据守恒完成反应的化学(离子)方程式(3)反应物:FeS2和Fe2(SO4)3产物:不生成S单质习惯性思维:FeS2中-1价的S元素,一般被氧化成SO2或S单质新情境的思维:“还原工序中,不生成S单质”抓住题干情境信息,分析反应过程:Fe3+氧化-1价S元素,得到SO2-3或者SO2-4,因Fe3+可以氧化SO2-3,所以最终得到SO2-414Fe3++8H2O+FeS2 15Fe2++2SO2-4+16H+或7Fe2(SO4)3+FeS2+8H2O 15FeSO4+8H2SO4(5)反应物:Fe(NH4)2Fe(CN)6和NaClO3产物:Fe(NH4)Fe(CN)6习惯性思维:Fe(NH4)2Fe(CN)6中Fe2+被氧化成Fe3+新情境的思维:根据产物分析可知“Fe(CN)6”部分没有发生变化抓住题干情境信息,分析反应过程:Fe(NH4)2Fe(CN)6 只有前一部分Fe的化合价由+2价升高到+3价,ClO-3中+5 价Cl降低为-1价(因为0价的Cl2可以继续与Fe2+反应)6Fe(NH4)2Fe(CN)6+6H++ClO-3 6Fe(NH4)Fe(CN)6+Cl-+6NH+4+3H2O
三、高考命题趋势预测
(一)情境千变万化,但考查物质转化、物质的分离提纯不变
无机化学工艺流程题是以实际的工业生产为背景,从化合价变化角度、物质类别角度和新信息角度思考物质转化。考查高中常见的非金属元素(Si、N、S、Cl等)和金属元素(Al、Fe、Ca、Mg、Zn、Cu等)的单质及其化合物的性质和相互转化。从沉淀过滤、萃取分液、结晶、蒸馏角度思考物质的分离提纯。
(二)内容考查千变万化,但题型结构基本稳定
1.题型结构基本稳定,一般由“试题情境+流程图+设问”三部分组成。
2.流程图结构基本稳定,呈现形式一般包括三行:第一行为试剂线,第二行为操作线,第三行为杂质线;呈现形式的三个阶段,每一阶段承载的任务如图所示:
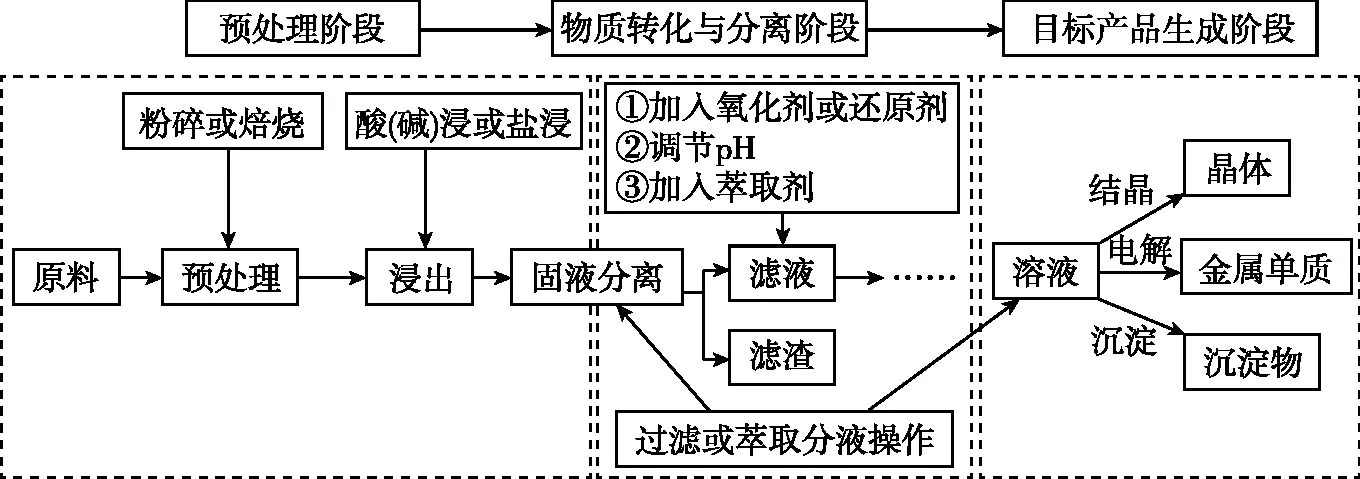
(三)设问包罗万象,但考查点有据可查
1.预处理阶段,明确各种操作的目的。
2.物质转化与分离阶段,利用氧化还原反应、控制反应条件和“调pH”等实现物质的转化,通过过滤、萃取等方法达到分离除杂的目的。


