双酶法辅助提取百香果原花青素及其抗氧化性研究
唐鹏程,王雪亭,尚文文,胡静雯
(1.江苏食品药品职业技术学院药学院,江苏淮安 223003;2.江苏食品药品职业技术学院本科生院,江苏淮安 223003)
原花青素(Proantho cyanidins,PC) 作为公认的天然抗氧化剂是植物中广泛存在的一大类多酚化合物的总称[1-2],具有消除自由基的能力,能够高效地消除超氧阴离子自由基和羟基自由基,其清除自由基的能力是维E 的50 倍。虽然不是最强抗氧化剂,但是基于其水溶性的性质,总体吸收率远远领先于其他物质。
目前,从植物中提取原花青素的研究中已发现莲子壳[3]、蓝莓[4]、白刺果[5]、珊瑚树叶[6]、锁阳[7]、油茶壳[8]中都存在原花青素。近期的研究表明,百香果也含有原花青素[9-10]。利用双酶辅助法提取百香果中原花青素,通过优化提取工艺,提高原花青素得率,并检测其抗氧化活性。
1 材料与试剂
百香果,市售;
原花青素标准品、十二水合硫酸铁胺(Ⅲ)、浓盐酸、正丁醇、无水乙醇、DPPH 试剂。
2 试验方法
2.1 原花青素提取
取新鲜百香果5 颗,去籽,用粉碎机粉碎1 min,得提取原料。准确称取百香果原料1 g,纤维素酶和果胶酶10 mg。置于50 mL 烧杯中加入纯水10 mL 并滴入酶,于恒温40 ℃下与酶反应30 min。再添加乙醇溶液10 mL,升高温度到70 ℃后,提取1 h,制得百香果皮中的原花青素的提取母液。
百香果原花青素提取率的计算公式:
2.2 原花青素检测
试验方法采用Lawrence J Porter 等人[11]的铁盐催化比色法。
2.2.1 配制铁盐催化比色法显色剂溶液
将1.029 8 g 十二水合硫酸铁铵(Ⅲ) 精确称量并溶于浓度为2 mol/L 的盐酸溶液4 mL 中,得到质量分数为2%的硫酸铁铵溶液;另外,将正丁醇与浓度为2 mol/L 的盐酸溶液按体积比V(正丁醇)∶V(盐酸)=95∶5 混合均匀,即得正丁醇- 盐酸溶液[12]。
2.2.2 原花青素测定
取10 mL 的试管,在其中分别加入样液1.0 mL、正丁醇- 盐酸溶液6.0 mL 和质量分数2%的硫酸铁铵溶液0.2 mL 后,振荡试管使其中液体充分混合均匀,在水浴100 ℃下反应40 min,反应结束后放在冰水中冷却至常温,使用紫外可见分光光度计于波长547 nm 下检测该混合液的吸光度,以此来有效实现对原花青素含量的测定[12]。
2.2.3 建立原花青素标准曲线
称取50.0 mg 的原花青素标准品放在25 mL 的容量瓶当中,使用无水乙醇将其定容至容量瓶的刻度线,充分摇匀后得到质量浓度为2 mg/mL 的原花青素标准品溶液。以4 mL 为基准,配制稀释溶液使其各组的质量浓度分别为0,0.04,0.08,0.12,0.16,0.2 mg/mL,于波长547 nm 处测定各质量浓度的吸光度,建立吸光度对原花青素质量浓度的标准曲线[12],得线性方程为:A=5.304 3C+0.004 86,R2=0.985 9。
标准曲线见图1。

图1 标准曲线
2.3 果胶酶和纤维素酶配比的筛选
分别取10 mg 的果胶酶和纤维素酶溶于10 mL纯水。取百香果1 g 加入20 mL 纯水,按10 ∶0,9∶1,8∶2,7∶3,6∶4,5∶5,4∶6,3∶7,2∶8,1∶9,0∶10 的配比和1 组不加酶的对照组共分成12 组,在40 ℃下与酶反应30 min,加入乙醇溶液10 mL,升高温度到70 ℃,提取1 h。比较各组提取率,得出酶的最佳配比。
2.4 混合酶最佳反应条件的确定
2.4.1 酶解温度的确定
取百香果1 g,在果胶酶与纤维素酶配比为7∶3,溶液pH 值为4,乙醇体积分数为50%,料液比为1∶15(g∶mL),酶解时间1 h,测量温度分别为30,35,40,45,50,55,60 ℃时对酶活性的影响。
2.4.2 酶解pH 值的确定
取百香果1 g,果胶酶与纤维素酶的配比为7∶3,乙醇体积分数为50%,料液比为1∶15(g∶mL),酶解温度为40 ℃,酶解时间为1 h,酶解pH 值为3.0,3.5,4.0,4.5,5.0,5.5,6.0,分别观察酶溶解时的pH 值对酶活性的影响。
2.4.3 酶解时间的确定
取百香果1 g 时,果胶酶与纤维素酶的配比为7∶3,乙醇体积分数为50%,料液比为1∶15(g∶mL),酶解温度为40 ℃,溶液pH 值为4,酶解时间为0.50,0.75,1.00,1.25,1.50,1.75,2.00 h 时对酶活性的影响。
2.4.4 正交试验
在酶解温度、酶解pH 值和酶解时间3 个单因素的条件下,以提取率为考查指标进行设计正交试验。
正交试验的因素与水平设计见表1。
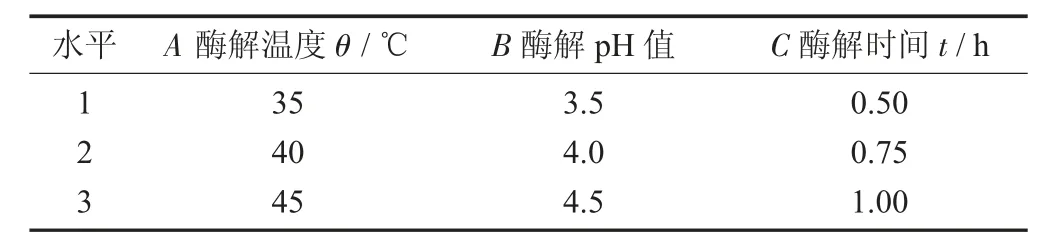
表1 正交试验的因素与水平设计
2.5 不同提取条件对百香果原花青素提取率的影响
2.5.1 反应温度对百香果原花青素提取率的影响
取百香果1 g,以酶的最适条件处理,在乙醇体积分数50%,料液比1∶15(g∶mL),反应时间1 h,酶解温度分别为30,40,50,60,70,80,90,100 ℃时,研究酶解温度对原花青素提取率的影响。
2.5.2 乙醇体积分数对百香果原花青素提取率的影响
取百香果1 g,以酶的最适条件处理,在酶解温度70 ℃,料液比1∶15(g∶mL),酶解时间1 h 的条件下考查乙醇体积分数分别为30%,40%,50%,60%,70%,80%对原花青素提取率的影响。
2.5.3 料液比对百香果原花青素提取率的影响
取百香果1 g,以酶的最适条件处理,在酶解温度70 ℃,乙醇体积分数50%,酶解时间1 h,料液比分别为1∶5,1∶10,1∶15,1∶20,1∶25(g∶mL) 时,研究料液比对原花青素提取率的影响。
2.5.4 酶解时间对百香果原花青素提取率的影响
取百香果1 g,以酶的最适条件处理,在酶解温度70 ℃,乙醇体积分数50%,料液比1∶15(g∶mL),酶解时间分别为0.5,1.0,1.5,2.0,2.5 h时,研究酶解时间对原花青素提取率的影响。
2.6 响应面法优化百香果原花青素提取工艺
在单因素的条件下,选定温度为70 ℃时进行反应,把乙醇体积分数、料液比和酶解时间作为变量,用百香果皮中提取的原花青素提取率作为响应值,运用Minitab 19 软件,进行L9(34)试验。
L9(34)因素与水平设计见表2。

表2 L9(34)因素与水平设计
2.7 抗氧化性检测
取1.8 mg DPPH 用乙醇溶液50 mL 定容,得DPPH- 乙醇溶液。取4 mL DPPH- 乙醇溶液,分别加入不同浓度的百香果原花青素样品液,振荡后,避光静置30 min,于波长517 nm 处测定吸光度,进行3 组平行试验,计算百香果原花青素对DPPH 自由基的清除活性[13]。清除率计算公式为:
式中:A0——避光前的吸光度;
A1——静置30 min 后的吸光度。
3 结果与分析
3.1 果胶酶和纤维素酶的最佳配比的确定
2 种酶的不同配比对百香果中花青素提取率的影响见表3,2 种酶的不同配比对百香果中花青素提取率的影响见图2。

表3 2 种酶的不同配比对百香果中花青素提取率的影响

图2 2 种酶的不同配比对百香果中花青素提取率的影响
由图2 可知,果胶酶的加入对百香果中原花青素的提取率有促进作用,当果胶酶∶纤维素酶达到7∶3 时,提取率会达到最大值。
3.2 混合酶最佳酶解条件的确定
3.2.1 酶解温度的确定
研究酶解温度分别为30,35,40,45,50,55,60 ℃时,原花青素的提取率。
酶解温度对提取率的影响见图3。

图3 酶解温度对提取率的影响
由图3 可知,适当提高温度可以提高酶活性。当酶解温度超过40 ℃时,酶活性降低。因此,最佳酶解温度为40 ℃。
3.2.2 酶解pH 值的确定
研究酶解pH 值分别为3.0,3.5,4.0,4.5,5.0,5.5,6.0 时,原花青素的提取率。
pH 值对提取率的影响见图4。

图4 pH 值对提取率的影响
由图4 可知,该混合酶在pH 值为4 时,提取率达到0.025%,酶活性最高,随着pH 值增大,提取率显著下降,酶活性迅速下降。
3.2.3 酶解时间的确定
研究酶解时间分别为0.50,0.75,1.00,1.25,1.50,1.75,2.00 h 时,原花青素的提取率。
酶解时间对提取率的影响见图5。
由图5 可知,用双酶辅助提取时,酶解时间0.75 h 的提取率最大,随着酶解时间的延长原花青素得率逐渐降低。
3.2.4 正交试验
正交试验结果见表4。
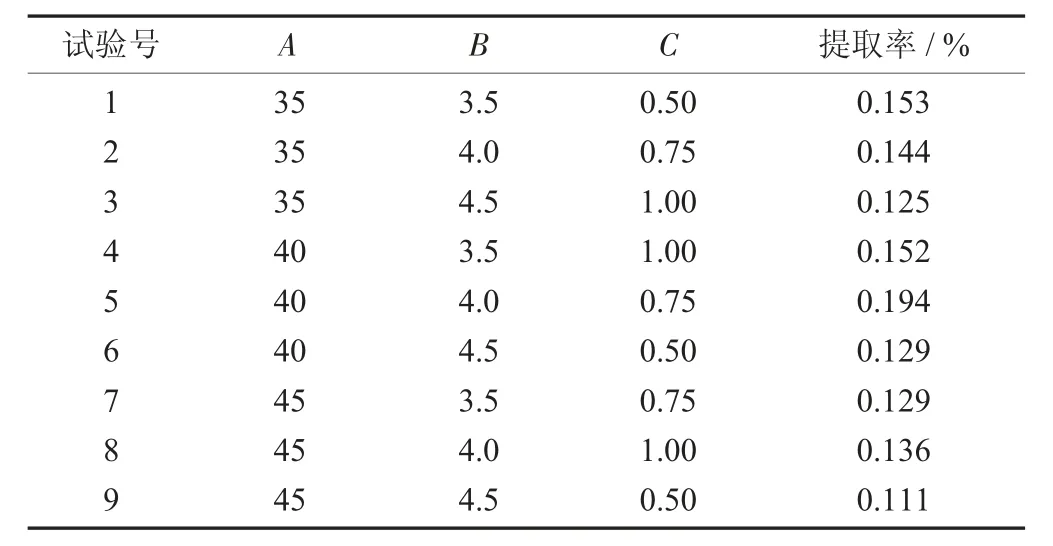
表4 正交试验结果
由表4 可知,当酶解温度为40 ℃,酶溶解pH值为4,酶解时间为0.75 h 时是酶解的最适条件,与单因素试验结果一致。
3.3 不同提取条件对百香果中原花青素提取率的影响
3.3.1 酶解温度对百香果中原花青素提取率的影响
酶解温度对提取率的影响见图6。
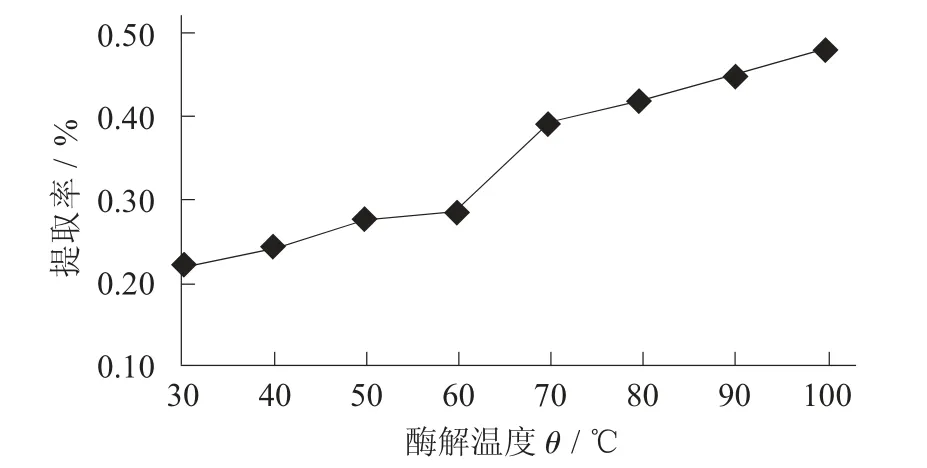
图6 酶解温度对提取率的影响
由图6 可知,百香果中原花青素的提取率随着酶解温度的上升逐渐增长。酶解温度对酶解体系的萃取效果具有双重效应。一方面,温度升高有利于改善体系传质效能,加大扩散系数,利于原花青素向溶剂中扩散,提高萃取率;另一方面,随着提取温度的升高,短时间内高温分解原花青素的量低于提取的原花青素的量。为避免乙醇大量挥发,影响料液比和乙醇体积分数,酶解温度定为70 ℃。
3.3.2 乙醇体积分数对百香果原花青素提取率的影响
乙醇体积分数对提取率的影响见图7。
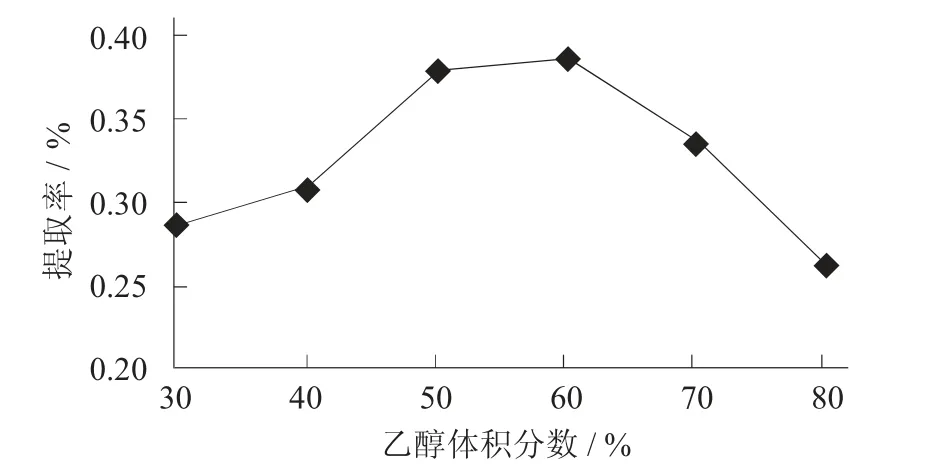
图7 乙醇体积分数对提取率的影响
由图7 可知,当乙醇体积分数过低或过高都不利于百香果皮中原花青素的提取,当乙醇体积分数达到60%时,原花青素的提取率达到了最佳值0.39%。原花青素作为多酚化合物,容易溶解在水和大多数的有机溶剂当中,当从百香果皮中提取出的原花青素的极性与当前系统的极性相像时,更容易被提取。
3.3.3 料液比对百香果原花青素提取率的影响
料液比对提取率的影响见图8。

图8 料液比对提取率的影响
由图8 可知,从百香果中提取原花青素的速率随料液比先增加后降低。当料液比为1∶10(g∶mL),提取率达到最佳值0.52%。
3.3.4 酶解时间对百香果原花青素提取率的影响
酶解时间对提取率的影响见图9。
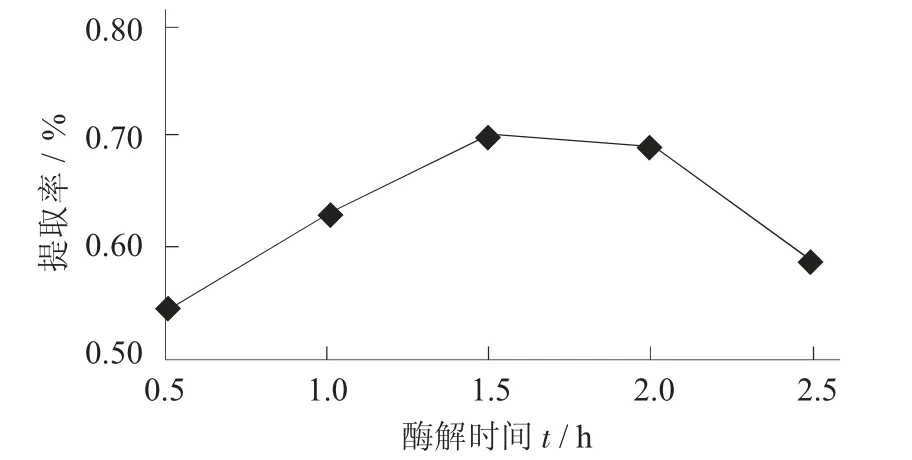
图9 酶解时间对提取率的影响
由图9 可知,当酶解时间不充足时,存在于百香果皮中的原花青素不能完全扩散到乙醇和水的混合溶剂当中,使得体系萃取的效果不完全;当酶解时间超过2.0 h 时,原花青素会因为分解量激增,对产率的提高造成不利影响。当酶解时间为1.5 h 时,可以实现对百香果中原花青素的有效提取。
3.4 响应面法优化百香果原花青素的提取工艺
3.4.1 建立模型
响应试验结果见表5。
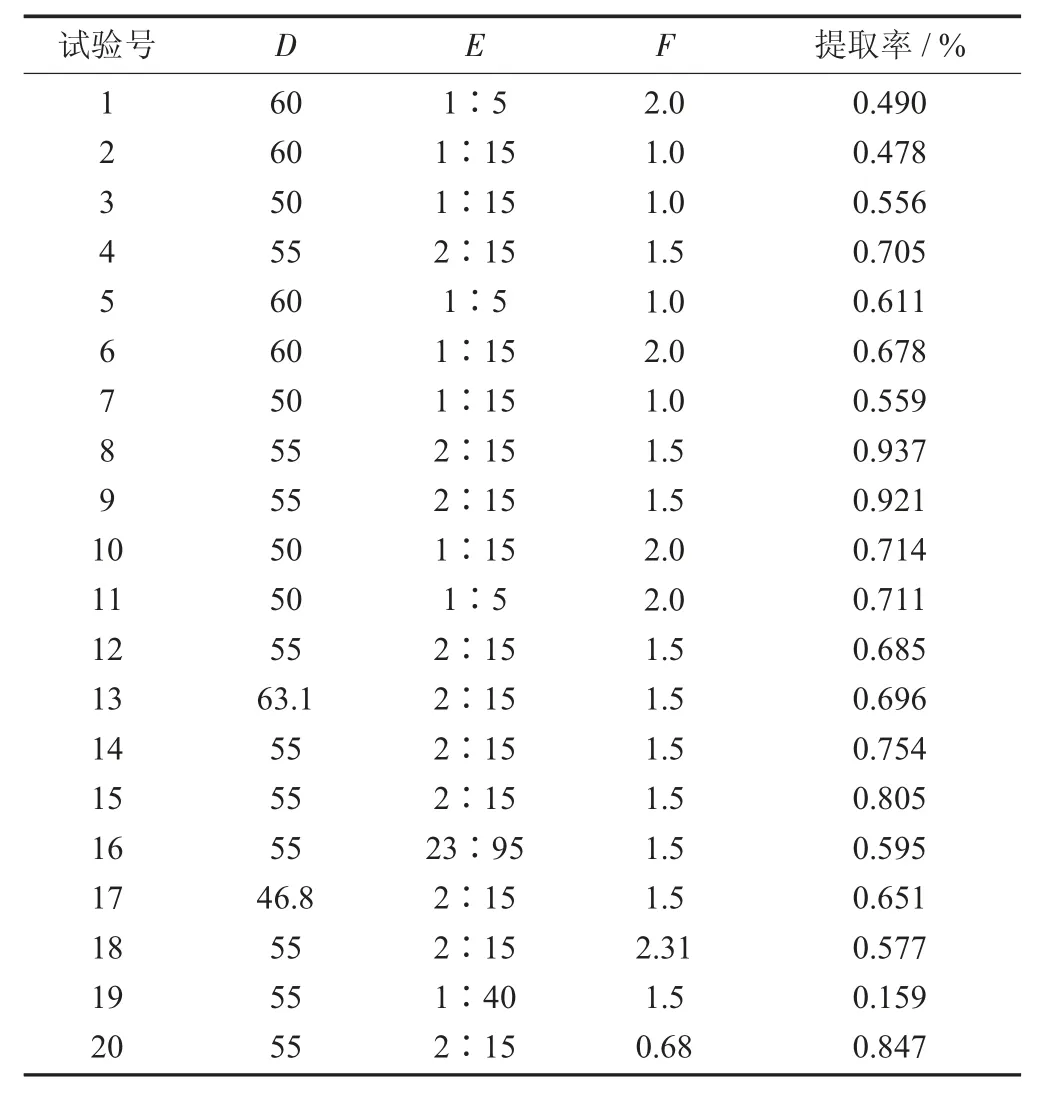
表5 响应试验结果
利用Minitab 19 软件对试验结果进行拟合。
3.4.2 响应面分析与优化
两因素交互作用对提取率影响的响应面图和等高线图见图10。

图10 两因素交互作用对提取率影响的响应面图和等高线图
利用Minitab19 软件通过响应面法分析了乙醇体值基本吻合,说明该试验基于响应面法优化得出的提取工艺准确可信。
3.5 抗氧化性检测
百香果原花青素对DPPH 自由基清除率的影响见图11。
由图11 可知,百香果原花青素对DPPH 自由基具有更高的清除能力,并且随着原花青素浓度的增加。在试验中还发现,百香果原花青素与DPPH 自由积分数、料液比和酶解时间之间的相互作用,绘制了以百香果中的原花青素为响应值的响应面3D 曲面图。依据图中各因素的趋势,可以直观地反映出该因子对百香果中的原花青素提取率的影响程度。由图10(a) (b) (e) (f) 可知,当原花青素的提取率随料液比先增大后减小。由图10(c) 和10(d) 可知,当料液比大于一定的乙醇体积分数时,适当延长提取时间有利于提高提取率。
由响应面的三维曲面图可知,响应值存在最大值。通过Minitab19 软件模拟优化,得到百香果原花青素提取最优的理论工艺为乙醇体积分数54%,料液比1∶6.8,反应时间1.44 h,该条件下提取率为0.94%。
3.4.3 响应面法的可靠性
为验证理论模型的可靠性,在经过酶解的最优方法处理后,选取乙醇体积分数54%,料液比1∶6.8,酶解温度70 ℃,酶解时间1.44 h,做3 次平行试验,提取率分别为0.959%,1.125%,1.096%,计算出3 次试验的平均提取率为1.06%,与模拟出理论基的反应十分迅速,滴入原花青素提取液立即褪为透明色。
4 结论
经试验研究发现,以百香果皮为原材料提取原花青素的最佳工艺为料液比1∶6.8,乙醇体积分数54%,先在果胶酶∶纤维素酶7∶3,pH 值4,40 ℃的条件下酶解0.75 h,再70 ℃提取1.44 h,在这种条件下原花青素的提取率可达到1.06%。同时,经检测发现百香果中的原花青素具有较强的抗氧化性。

图11 百香果原花青素对DPPH 自由基清除率的影响

