circRAD18/miR-516b/PDK1轴调节葡萄糖代谢重编程与结直肠癌增殖的关系
李威,唐云云,彭娟,蒋训归
(1.湖南省永州市中心医院 肛肠疝外科,湖南 永州 425006;2.永州职业技术学院 公共基础学部,湖南 永州 425100)
结直肠癌为消化道常见的恶性肿瘤之一[1],2020年全球结直肠癌新发病例数量超过193 万例,占全球新确诊恶性肿瘤例数的9.7%,约占全球癌症死亡病例的9.4%[2]。研究[3-4]显示,早期结直肠癌患者5年生存率可达90%,但晚期患者的中位生存期往往不足2年。因此结直肠癌患者的早期诊断及治疗就显得格外重要,近年来各种特异度强、敏感度高及侵袭性低的非编码RNA 生物标志物被发现并运用于临床[5],该类生物标志物的功能研究及运用将对结直肠癌的临床诊治具有重要意义。
非编码RNA 是一类重要的癌症生物学调节因子,其中环状RNA(circular RNA,circRNA)是近年来新发现的一种细胞内非编码RNA[6]。circRNA无3'-头或5'-尾的结构,该类环状结构在多种人类细胞中大量存在,其具有数十万个碱基,且可通过多种机制调控或改变多种重要基因的功能及表达,包括与蛋白质结合、 阻断微小RNA(microRNA,miRNA),甚至编码低分子量蛋白质等[7]。随着现今circRNA 测序技术和生物信息学方法的发展,越来越多的circRNA 被发现[8]。研究[9-10]显示circRAD18 可促进三阴性乳腺癌的增殖、通过多条生物轴调控乳腺癌的进展,也可促进甲状腺乳头状癌的恶性进展。目前circRAD18 在结直肠癌中的功能及可能的生物学作用尚无报道。笔者前期通过circinteractome 和TargetScan 数据库预测circRAD18 与miR-516b 存在结合位点,而丙酮酸脱氢酶激酶1(pyruvate dehydrogenase 1,PDK1)可能是miR-516b 的靶基因。本研究以上述研究背景为基础,初步探讨circRAD18 在结直肠癌细胞中的表达及作用,及其对靶miR-516b 及PDK1 的调控关系。
1 材料与方法
1.1 主要材料
Lipofectamine 3000 转染试剂、 TRIzol 试剂、RIPA 裂解液、PMSF (Thermo,美国,L3000001、15596026、89901、36978),DMEM 培养基、胎牛血清、抗生素(Gibco,美国,11965092、10100147、15140122),PDK1 和β-actin 抗体(Abcam,美国,ab202468、 ab8226),Anti-Ago2 抗体(Millipore,USA,03-110),RNA 抽提试剂盒 (Applied Biosystems,USA,AM1835)、TaqMan 逆转录试剂盒(4366597)、 qSYBR-Green-containing PCR 试剂盒(4349182),RNA 结合蛋白免疫沉淀试剂盒(Millipore,USA,17-371),双荧光素酶活性检测试剂盒(Qiagen,USA,59934),葡萄糖/葡萄糖氧化酶检测试剂盒Amplex Red Glucose/Glucose Oxidase Assay Kit(Invitrogen,USA,A22189)、乳酸检测试剂盒(Sigma,美国,MAK065),血细胞计数板(16×25 格),紫外可见分光光度计(Thermo,Nanodrop 2000,USA)。
1.2 实验方法
1.2.1 细胞培养结直肠癌细胞SW480、SW620、HT-29 及正常结直肠上皮细胞NCM460 (ATCC 来源)均根据供应商提供的说明书培养于含10% FBS的培养基中。所有细胞均置于37 ℃,含5% CO2的细胞培养箱内孵育。miR-516b 模拟物及其对照miR-CTR、circRAD18 敲除siRNA(si-circRAD18)及其对照(si-circCON)均由美国的Invitrogen 公司设计、构建及合成。突变型circRAD18-wt、PDK1-wt及野生型circRAD18-mut、PDK1-mut 的荧光素酶报告基因载体均由GeneCopoeia 公司构建。
1.2.2 circRAD18 敲除及质粒转染收集细胞,用含10% FBS 的DMEM 培养液稀释,吹打制成104/mL的细胞悬液,6 孔板中每孔铺2 mL 细胞,置于细胞培养箱中。细胞汇合度约60%~80%时准备转染,用无菌EP 管配制lipofectamin 3000 和转染试剂;两者混匀并室温放置20 min。将上述混合物加入到无血清培养液(不含抗生素)中混匀,加入到待转染的6 孔中;置于培养箱中,6 h 后换成常规培养基。48 h 后,收集细胞并抽提蛋白或进行其他实验。si-circRAD18 序列为:5'-AAU CAG ACU GCU CUC UCU GUA-3';其对照序列si-circCON 为:5'-UUC UCC GAA CGU GUC ACG UTT-3'。
1.2.3 RNA 提取和qRT-PCR 检测TRIzol 裂解液、氯仿、1∶2 的异丙醇-TRIzol、75%乙醇及4 ℃离心机用于细胞及组织的RNA 提取,提取的RNA 在紫外可见分光光度计上检测合格后置于4 ℃冰箱中保存备用。以提取的细胞或组织总RNA 为模板,按逆转录试剂盒说明书及qSYBR-Green-containing PCR 试剂盒的说明书进行操作,进行相对定量(BioRad IQTM5 Multicolor 实时荧光定量系统,美国)。其中miR-516b 引物由Invitrogen 公司合成,U6 为内参,2-ΔΔCT用于相对表达量的计算,其中ΔΔCT=(CTmiRNA-CTU6)靶基因-(CTmiRNA-CTU6)对照。反应体系为20 μL,每组实验设置3 个复孔。circRAD18 的引物碱基序列正向:5'-CAG CTC ATT AAA AGG CAC CA-3',反向:5'-CAC ACA GCA AGT TGG ACA CTG-3';内参U6 的引物序列正向:5'-TTA TGG GTC CTA GCC TGA C-3',反向:5'-CAC TAT TGC GGG TCT GC-3'。
1.2.4 CCK-8 细胞增殖将结直肠癌细胞经0.25%的胰酶消化后,将si-circRAD18 (细胞密度调至5×103/mL) 和si-circCON 细胞(细胞密度调至5×103/mL)置于96 孔板中。将培养板在37 ℃下孵育一定时间,然后加入CCK-8 溶液(10 μL),于450 nm 波长下检测吸光度值。
1.2.5 葡萄糖消耗和乳酸含量的测量将细胞接种到12 孔板中,每孔接种3×105个细胞。24 h 后收集培养基,并储存在-20 C°备用,直到进行测定。分别根据葡萄糖/葡萄糖氧化酶检测试剂盒Amplex Red Glucose/Glucose Oxidase Assay Kit 和乳酸检测试剂盒的说明书进行操作,检测结直肠癌细胞HT-29中上清液中葡萄糖的消耗量及乳酸的产生量。分别检测563 nm 及460 nm 波长处的吸光度值,并将结果标准化为与对照细胞相比的总蛋白量。
1.2.6 荧光素酶活性检测验证miR-516b 与circRAD18 结合的荧光素酶实验分为4 组,分别为:miR-516b 与circRAD18-wt、miR-CTR 与circRAD18-wt、miR-516b 与circRAD18-mut、miR-CTR 与circRAD18-mut;验证miR-516b 与PDK1 结合的荧光素酶实验也分为4 组,miR-516b 与PDK1-wt、miR-CTR 与PDK1-wt、miR-516b 与PDK1-mut、miR-CTR 与PDK1-mut。按上述分组分别转染HT-29 细胞,48 h 后收集细胞。根据试剂商提供的试剂盒说明书进行操作。相对荧光素酶活性为荧光素酶活性/海肾荧光素酶活性值,每组实验设置3 个复孔(Biorad 单光子检测仪,美国),验证circRAD18 与miR-516b 及miR-516b 与PDK1 之间的结合关系。
1.2.7 RNA 免疫沉淀(RIP)在RIP 分析之前,先使 用 MS2bs-circRAD18、 MS2bs-circRAD18-mt 和MS2bs-Rluc(对照载体)转染结直肠癌细胞。RIP实验根据RNA 结合蛋白免疫沉淀试剂盒、anti-Ago2抗体的说明书进行操作,miR-516b 需富集纯化后检测。也被使用,PDK1 mRNA、circRAD18 和miR-516b 均采用相对定量。
1.2.8 Western blot 分析从HT-29 细胞中分离蛋白质(RIPA 裂解液、PMSF),收集蛋白,用于SDSPAGE 凝胶分离。蛋白质在300 mA 条件下进行转膜,2 h 后将膜转移至4 ℃冰箱,并用PDK1 抗体处理过夜,次日于室温下使用特异性二抗孵育1 h。其中PDK1 和β-actin 抗体的使用浓度为1∶1 000。
1.3 统计学处理
SPSS 20.0 软件用于数据的记录与分析。实验结果采用计量资料以均数±标准差(±s)表示,t检验用于组间数据比较,单因素方差分析用于多组间数据比较。P<0.05 为差异有统计学意义。
2 结果
2.1 circRAD18在结直肠癌中的表达及功能
采用qRT-PCR 检测结直肠癌及正常结直肠上皮细胞中circRAD18 的表达水平,结果显示,相对正常结直肠上皮细胞NCM460,circRAD18 在结直肠癌细胞系中的表达均明显上调(均P<0.05)(图1A)。为进一步探究circRAD18 对结直肠癌细胞生长及代谢的影响,使用靶向circRAD18 的siRNA 来敲低结直肠癌细胞中circRAD18 的表达。si-circRAD18 的敲低效率在HT-29 结直肠癌细胞系中得到验证(图1B)。CCK-8 增殖检测实验显示circRAD18 的下调抑制结直肠癌细胞的增殖能力(图1C)。另外通过检测葡萄糖摄取量和乳酸产生量,发现circRAD18 的沉默可以明显抑制结直肠癌中的细胞葡萄糖摄取及乳酸产生,且其对正常结直肠上皮细胞NCM460 则没有影响(P>0.05)(图1D-E)。
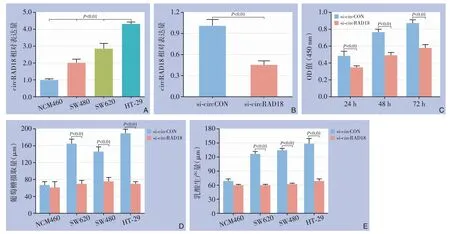
图1 circRAD18在结直肠癌中的表达及功能 A:circRAD18在结直肠癌细胞系中的相对表达;B:转染si-circRAD18后的沉默效能分析;C:CCK-8检测细胞增殖;D:细胞葡萄糖摄取量检测;E:细胞乳酸产生量检测Figure 1 Expression and function of circRAD18 in colorectal cancer A:Relative expression of circRAD18 in colorectal cancer cell lines;B:Analysis of silencing efficiency after transfection with si-circRAD18;C:Cell proliferation assessment using CCK-8 assay;D:Measurement of cellular glucose uptake;E:Measurement of cellular lactate production
2.2 结直肠癌中circRAD18对miR-516b的作用
在分离结直肠癌细胞HT-29 的细胞质和细胞核部分后,通过qPCR 检测明确了circRAD18 的亚细胞定位。结果显示circRAD18 主要存在于结直肠癌细胞的胞质中,也是miRNA 所处的主要位置,表明两者之间存在相互作用(图2A)。根据生物信息学软件预测,circRAD18 序列上可能存在2 个与miR-516b 结合的位点(图2B)。通过双荧光素酶报告基因实验证实circRAD18 能够与miR-516b 相互作用(图2C)。随后为进一步验证,进行了MS2 相关的RIP 实验以验证circRAD18 和miR-516b 之间的直接相互作用关系,结果显示miR-516b 在MS2bscircRAD18 组明显富集(图2D)。
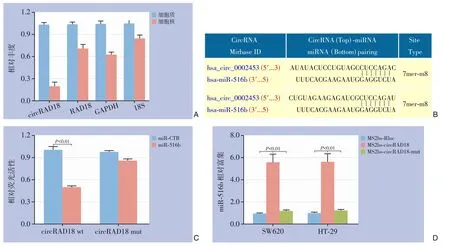
图2 circRAD18 与miR-516b 的关系 A:细胞不同部位中circRAD18、RAD18 mRNA、GAPDH 和18S 的相对比例;B:circRAD18序列中miR-516b的预测结合位点;C:双荧光素酶报告基因实验检测miR-516b模拟物和circRAD18之间的相互作用;D:MS2相关的RⅠP实验验证结合关系Figure 2 Relationship between circRAD18 and miR-516b A:Relative proportions of circRAD18,RAD18 mRNA,GAPDH,and 18S in different cellular compartments;B:Predicted binding sites of miR-516b in the circRAD18 sequence;C:Dualluciferase reporter gene assay to investigate the interaction between miR-516b mimic and circRAD18;D:MS2-related RⅠP experiment to validate the binding relationship
2.3 circRAD18对下游PDK1的调节作用
TargetScan 数据库预测PDK1 是miR-516b 的下游靶基因(图3A)。PDK1 是葡萄糖摄取过程中的一种代谢蛋白,多项研究证实其为一种癌基因,并在多种恶性肿瘤中存在过度表达,对癌症进展至关重要。荧光素酶报告基因实验证实miR-516b 能够直接结合PDK1 mRNA 的3'-UTR (图3B)。转染miR-516b 模拟物后,结直肠癌细胞HT-29 中PDK1的相对表达量明显降低(图3C),对AGO2 蛋白相关的RISC 复合物进行RIP 检测,结果显示circRAD18、PDK1 和miR-516b 均聚集在抗Anti-Ago2组中(图3D)。circRAD18 沉默可导致PDK1 向的RISC 聚集明显增加(图3E)。
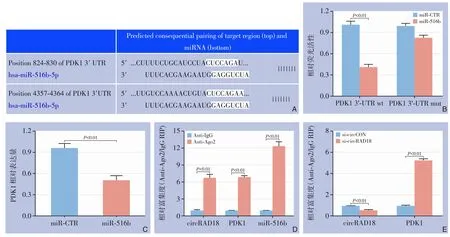
图3 miR-516b与PDK1的关系及circRAD18的调节作用 A:TargetScan数据库预测PDK1与miR-516b相互作用的mRNA 3'-UTR序列;B:双荧光素酶报告基因实验验证miR-516b模拟物和PDK1之间的相互作用;C:qRT-PCR分析miR-516b对PDK1的作用;D:circRAD18、PDK1和miR-516b在Ago2上的聚集;E:circRAD18沉默后,circRAD18与Ago2结合的丰度降低,而PDK1增加Figure 3 Relationship between miR-516b and PDK1 and the regulatory role of circRAD18 A:TargetScan database prediction of mRNA 3'-UTR sequences for the interaction between PDK1 and miR-516b;B:Dual-luciferase reporter gene assay to validate the interaction between miR-516b mimic and PDK1;C:qRT-PCR analysis of the effect of miR-516b on PDK1;D:Aggregation of circRAD18,PDK1,and miR-516b on Ago2;E:Decreased abundance of circRAD18 binding to Ago2 and increased PDK1 after circRAD18 silencing
2.4 circRAD18-miR-516b-PDK1 轴对结直肠癌代谢重编程的影响
通过检测葡萄糖摄取量和乳酸产生量,发现用miR-516b 模拟物及si-circRAD18 转染结直肠癌HT-29 细胞,可明显降低细胞葡萄糖的摄取率及乳酸产生量,且这种降低均可被PDK1 的补充所逆转(均P<0.05)(图4A-B)。另外,miR-516b 模拟物或si-circRAD18 的引入可以明显降低PDK1 的蛋白表达,且该过程可通过补充PDK1 蛋白来逆转(均P<0.05)(图4C)。
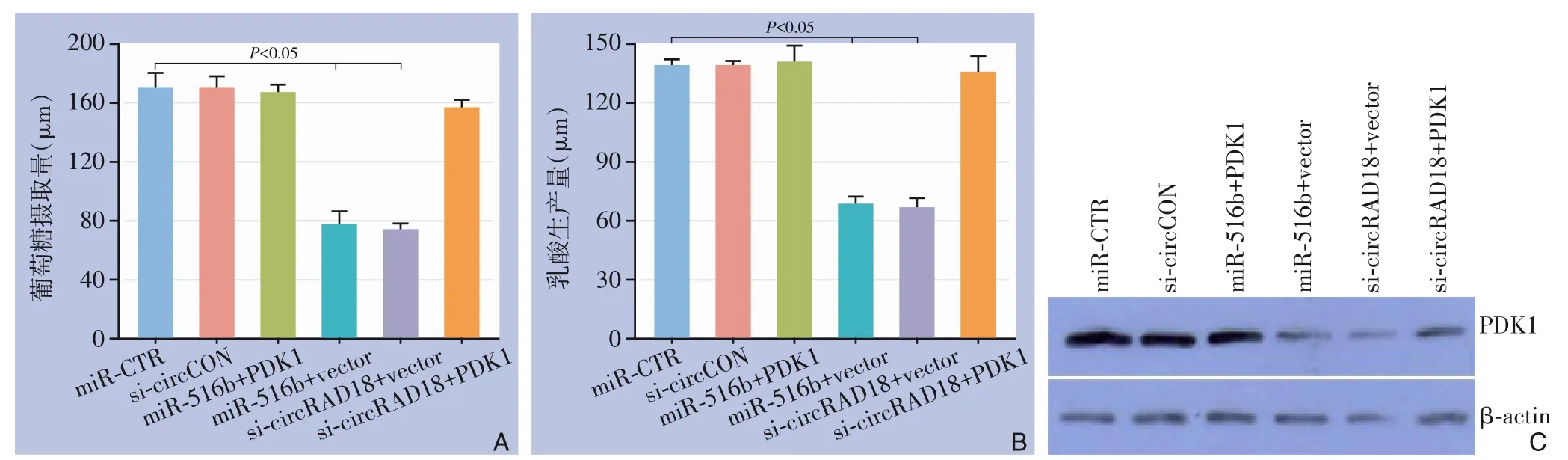
图4 circRAD18-miR-516b-PDK1 轴在直肠癌细胞中的作用 A:miR-516b 模拟物及si-circRAD18 的转染可抑制细胞葡萄糖摄取,PDK1 过表达后,葡萄糖摄取水平可恢复;B:miR-516b 模拟物及si-circRAD18 的转染可抑制细胞乳酸产生,PDK1 过表达后,乳酸产生水平可恢复;C:miR-516b 模拟物及si-circRAD18 的引入可以降低PDK1 的蛋白表达,补充PDK1可逆转Figure 4 The role of the circRAD18-miR-516b-PDK1 axis in colorectal cancer cells A:Transfection with miR-516b mimic and si-circRAD18 can inhibit cellular glucose uptake,and the overexpression of PDK1 can restore glucose uptake levels;B:Transfection with miR-516b mimic and si-circRAD18 can inhibit cellular lactate production,and the overexpression of PDK1 can restore lactate production levels;C:Ⅰntroduction of miR-516b mimic and si-circRAD18 can reduce the protein expression of PDK1,and supplementation with PDK1 can reverse this effect
3 讨论
随着高通量测序等多种生物信息学前沿技术的不断发展,越来越多的circRNA 被发现,并被深入研究[11]。研究[12-13]显示,5.8%~23%的具有转录活性的人类基因可产生circRNA,且这些circRNA在不同的组织及细胞类型间可保持动态平衡。circRNA 在哺乳动物中表达是高度保守的,其环状结构使其对RNase R 具有抗性,且结构比相应的线性RNA 要更稳定[14]。circRNA 可作为miRNA 海绵发挥调节功能,circRNA 具有miRNA 的结合位点,常作为miRNA 的活性调节者参与多种癌症的发生与发展;circRNA 可与RBPs 相互作用,其通过结合、储存或隔离RBP 到特定的亚细胞位置从而发挥作用;circRNA 也可发挥转录和选择性剪接的调节的功能,其位于核内的circRAN 及外显子-内含子环状RNA (Exon-intron circular RNA,ElciRNA) 可在转录水平发挥功能;另外circRNA 也可以直接发挥翻译功能,部分circRNA 具有直接编码蛋白的能力,可翻译蛋白[15-18]。研究显示,circRNA 在血液及其他体液中均具有较高的稳定性,因此circRNA也是多种疾病诊断的潜在生物标志物。
研究[18]显示,circAGO2 可通过促进RISC HUR而促进多种癌症的进展。circ133 及circHIPK3 是结直肠癌中的重要调控因子[19-20]。circITCH 被证实是癌症中的肿瘤抑制因子[21],circFAM120A 被证实可通过抑制FAM120A 与IGF2BP2 的结合而促进细胞的增殖[22]。但迄今为止,关于circRNA 在结直肠癌中作用和功能的研究较少,关于circRAD18 在结直肠癌中的研究目前未见报道。研究显示,circRAD18 在乳腺癌中高表达且敲除circRAD18 可抑制乳腺癌的进展,该过程可能是通过调节miR-613/HK2 轴来实现的[23],circRAD18 也可通过海绵吸附miR-208a/3164 调节IGF1 和FGF2 的表达来促进三阴性乳腺癌进展[24]。本研究发现circRAD18 在结直肠组织及细胞系中表达上调,且敲除circRAD18 显著抑制结直肠癌细胞的生长能力,该结果与上述乳腺癌中circRAD18 高表达及对肿瘤的促进作用一致。研究显示circRAD18 还可促进急性髓系白血病细胞的增殖、迁移和侵袭过程,并抑制细胞凋亡和细胞周期停滞,在急性髓系白血病中扮演癌基因的结果[23],另外circRAD18 也可促进甲状腺乳头状癌的生长和转移能力[10],说明circRAD18 可在多种恶性肿瘤中发挥促癌作用。
双荧光素酶报告基因实验及RIP 实验验证证实circRAD18 可与miR-516b 结合,而PDK1 是miR-516b的下游靶基因。即circRAD18-miR-516b-PDK1 轴在结直肠癌的进展中发挥重要作用。此外,本研究发现circRAD18 参与了结直肠癌的葡萄糖代谢重编程过程,circRAD1 的沉默显著抑制结直肠癌细胞的细胞葡萄糖摄取和乳酸产生,表明circRAD18 可直接阻断其下游的miR-516b,促进结直肠癌细胞通过刺激葡萄糖代谢蛋白PDK1 的表达而促进结直肠癌的进展。上述结果与已有研究[10]上调的circRAD18 通过甲状腺乳头状癌的葡萄糖代谢重编程促进肿瘤的进展相一致。
研究显示,miR-516b 是重要的肿瘤抑制因子,其在骨肉瘤中表达下调[25],在神经胶质瘤中,circCDC45 的表达显著上调,其可通过阻断miR-516b 而促进胶质瘤细胞的增殖和转移[26]。另外长链非编码RNA Linc-01123 可通过miR-516b-5p/Gli1 轴调控Hedgehog 通路而影响骨肉瘤的进程[27]。在天然产物和传统中药提取物相关的研究中,作为一个已经被证实的miR-516b 靶标,PDK1 被报道可调节葡萄糖和脂肪酸代谢以及体内平衡[28]。而PDK1 也被证实可促进黑色素瘤细胞的有氧糖酵解和增殖[29]。根据本研究的研究结果,PDK1 被证实是miR-516b 在结直肠癌中的下游靶基因,且circRAD18 可以增强PDK1 的蛋白表达水平。
综上,本研究探讨了circRAD18 在结直肠癌生长及葡萄糖代谢中的功能,并揭示了circRAD18/miR-516b/PDK1 轴在结直肠癌代谢重编程中的功能的分子机制,本研究可能对开发结直肠癌新的生物标志物及治疗策略具有重要意义。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:李威、蒋训归负责构思与设计;彭娟负责提供研究材料或患者;李威、唐云云负责数据收集和处理;李威、彭娟负责数据分析和解释;李威负责手稿写作;所有作者均审核并批准手稿。

