主动脉瓣复合体钙化分布密度是国产自膨式瓣膜TAVR术后传导障碍的危险因素
王蔚然,孙泽瑜,辛然,丁熠璞,刘子暖,王玺,王晶,单冬凯,刘长福
1中国人民解放军总医院第一医学中心心内科,北京 100853;2中国人民解放军总医院第六医学中心心血管病医学部,北京 100048;3南开大学医学院,天津300071
对患有严重主动脉瓣狭窄的中高危患者,经导管主动脉瓣置换术(TAVR)是一种可替代传统外科手术的介入方法[1]。TAVR手术需植入人工瓣膜假体,存在心脏传导系统受压而发生传导障碍(CB)的风险,严重者可能需要植入永久起搏器,也可能导致再住院和死亡[2,3]。虽然随着TAVR技术的发展和手术经验的积累,相关并发症报道日渐减少,但CB发生率没有显著降低[4,5]。研究发现,TAVR术后CB的预测因素,包括既往的右束支传导阻滞[2,6]、人工瓣膜直径/左室流出道直径[2]、左室舒张末期内径[6]、较大的瓣膜植入深度[7]及较短的室间隔膜部长度(MSL)等[8];另有研究指出,主动脉瓣环的大小、设备着陆区(DLZ)钙化等也是CB潜在的危险因素[9,10]。主动脉瓣膜复合体(AVC)钙化是目前较公认的TAVR术后新发CB的独立危险因素[4]。因钙化而融合的瓣叶及瓣环局部应力增加,加上人工瓣膜进一步挤压,致使过大的机械应力传递至心脏神经走行区域。然而,不同区域的钙化导致CB方面存在差异,研究曾报道DLZ区或左冠窦(LCS)瓣叶钙化是TAVR术后出现CB的预测因素[11,12],这表明了钙化分布对并发症的预测至关重要[13]。
随着TAVR 器械的改良,自膨式瓣膜(SEV)在TAVR手术中应用增多并不断更新迭代,逐渐超越球囊扩张瓣膜(BEV),成为TAVR手术中的主流。由于SEV自身的膨胀特性,其TAVR术后发生CB的原因可能与BEV有所不同[14];更为重要的是,即使在初始技术基础上不断改良的国产SEV瓣膜,设计更加合理,操作容错性更好,术中可校正调整,但仍然有相当比例的CB发生[15]。因此,探讨采用国产SEV的TAVR术后新发CB的危险因素极其重要。鉴于AVC钙化分布对术后CB的重要影响,我们将这一术前CT解剖指标作为关注焦点,充分考虑各冠状动脉窦的大小对钙化成分的容纳,提出了钙化分布密度的概念,分析其对国产SEV术后新发CB的影响。
1 资料和方法
1.1 研究对象
回顾性纳入2016年1月~2022年12月在解放军总医院心血管病医学部接受国产SEV-Venus-A人工瓣膜置换术的重度主动脉瓣狭窄患者共73例。入组标准:超声心动图检查发现主动脉瓣重度狭窄,经心血管内科专家评估具有TAVR 手术指征;随后为患者行TAVR术,并于术前进行心脏增强CTA扫描;心脏CTA扫描图像可用于主动脉根部参数分析。排除标准:既往植入永久起搏器;术前存在持续左束支传导阻滞;主动脉瓣为Type 0型二叶瓣;心脏CTA成像质量较差不满足参数测量需求。TAVR手术方案由专业的心血管专家团队依照共识制订[16],该团队由具有丰富临床和介入手术经验的心血管专家组成(包括心脏介入、心脏外科、重症、超声、CT影像和麻醉等学科专业具有副高以上职称的专家)。TAVR术后7 d内每日行心电图检查,由心电图专家(从事心电图检查判读工作10年以上,具有副高职称)判断术后持续性CB(>7 d不缓解)情况。CB包括完全性持续性左束支传导阻滞、二度Ⅱ型房室传导阻滞和三度房室传导阻滞[17]。此研究获得解放军总医院伦理委员会批准(伦理批准号:S2020-255-01),所有患者均签署知情同意书。
1.2 术前CTA成像方案
所有患者均在术前接受心脏增强CTA扫描。扫描采用双源Flash CT扫描仪(Siemens Healthcare)完成,应用回顾性心电门控扫描模式采集最佳收缩期图像,扫描范围从主动脉弓至心底。患者扫描前舌下含服硝酸甘油,并进行屏气训练。于肘前静脉预置套管针,采用团注的方式经双筒高压注射器以5.0 mL/s的速率注射碘造影剂,当升主动脉内CT阈值达到100 HU时触发扫描。设备参数设置如下:准直2 mm×64 mm×0.6 mm;层厚0.75 mm;层间距0.5 mm;管电压依据BMI调整;机架转速0.28 s。
1.3 主动脉根部CTA图像分析
应用Anythink 软件测量分析平台(CREALIFE,Structural heart&vessel 3.0)完成主动脉根部结构参数的测量。以30%~45%收缩期图像为基础,重建AVC三维结构,由测量者手动确定3个冠状动脉窦最低点,软件自动识别勾画主动脉瓣环,并确定为虚拟瓣环平面,当自动勾画与实际情况存在偏差时由手动逐层调整校正。随后自动测量计算瓣环的最大直径、最小直径、周长、面积,并测量左、右冠脉开口距离瓣环平面的高度。继而根据AVC中心线,分别确定左室流出道(LVOT)平面、升主动脉平面、窦管交界平面、冠状动脉窦平面,并测量各平面的最大直径、最小直径、周长、面积等。Oversize(%)定义为人工瓣膜的瓣环面积超过测量瓣环面积比值,计算公式为:(人工瓣环面积/测量瓣环面积-1)×100%[18]。国产SEV人工瓣膜(Venus-A)的瓣环面积分别为:23 mm型号-2.77 cm2,26 mm型号-3.83 cm2,29 mm 型号-4.52 cm2,32 mm 型号-5.30 cm2。LVOT Oversize(%)计算方法与之类似,人工瓣膜LVOT平面面积分别为:23 mm型号-3.10 cm2,26 mm型号-4.08 cm2,29 mm型号-4.94 cm2,32 mm型号-5.85 cm2。
1.4 AVC钙化定量
为细化钙化分布情况,我们将AVC区域纵向冠状位重建图像划分为瓣叶部、LVOT部和DLZ部。瓣叶部指从瓣环平面至瓣叶尖平面之间的区域,LVOT部指瓣环平面至其下5 mm的左室流出道区域,DLZ部指瓣环上3 mm至瓣环下2 mm之间的区域,DLZ部与瓣叶部、LVOT部之间存在重叠部分(图1A~C)。轴位重建图像上,采用冠状动脉窦分割工具对各个平面进行分割,将AVC分割为3个区域[LCS区、右冠窦(RCS)区和无冠窦(NCS)区](图1D)。由此,根据冠状位及轴位图像分割方法,最终将AVC划分为9个区域:瓣叶部-LCS区、RCS区和NCS区;LVOT部-LCS区、RCS区和NCS区;DLZ部-LCS区、RCS区和NCS区。以650~850 HU的CT阈值范围来标记钙化,并计算各区域的钙化体积[19]。采用各区域的钙化体积,除以瓣环平面对应冠状动脉窦投影面积,得到相应的区域钙化分布密度。

图1 AVC区域划分和钙化测量示意图Fig.1 AVC area division and calcification measurement.A: Diagram displaying the measurement range of calcification in the valve leaflets region.B: LVOT region.C: DLZ region.D:Measurement range of different coronary sinus calcification.
1.5 术后参数测量
人工瓣膜植入深度(ID)在TAVR术后造影图像上进行测量,定义为NCS最低端至LVOT内人工瓣膜框架下缘的垂直距离[7]。MSL则于CT图像上从NCS最低点起测量(图2)。二者差值(MSID)用公式MSID=MSL-ID计算[20]。

图2 人工瓣膜ID和MSL的测量Fig.2 Measurement of valve prosthesis ID and MSL.A:ID of valve prosthesis was 3.14 mm.B:MSLof this case was 10.10 mm measured on CT imaging.
1.6 统计学分析
连续变量表示为均数±标准差或中位数(四分位数),分类变量表示为频数和百分比。两组间比较,符合正态分布的采用Student'st检验,不符合正态分布的采用Wilcoxon符号秩和检验。分类变量组间比较采用卡方检验或者Fisher's精确概率。为了体现钙化指标测量的稳定性和一致性,采用顺序编号和随机数抽取的方式选择30例患者,由两名研究者(均具有2年以上心脏CT图像分析经验),进行观察者内和观察者间钙化主要指标的一致性分析,采用组内相关系数(ICC)来计算。单因素和多因素Logistic回归用以探索与CB存在关联的变量。依据多因素分析所得到的危险因素,以CB作为结局变量,应用单独、联合因素构建Logistic回归模型,采用模型的预测概率作为特征变量绘制受试者工作特征(ROC)曲线,计算各曲线下面积(AUC)并比较分析,AUC之间的比较采用DeLong检验[21]。根据Youden指数确定最优截断值,并计算在该截断值下的敏感性、特异性、阳性预测值(PPV)、阴性预测值(NPV)。所有数据分析采用SPSS 22.0或MedCalc 15.2.2完成。所有分析均采用双尾,P<0.05认为差异有统计学意义。
2 结果
2.1 患者基本情况
研究共纳入主动脉瓣狭窄行国产SEV的TAVR手术患者73例,其中18例患者(24.7%)在TAVR术后新发CB(表1),包括高度房室传导阻滞9例,持续性左束支传导阻滞9例。CB组与无CB组临床资料差异无统计学意义,超声心动图测量数据差异也同样无统计学意义(P>0.05)。两组在人工瓣膜的型号选择、手术相关的预扩张和后扩张比例差异无统计学意义。然而,CB组具有更大的ID(6.77±2.45 mmvs5.11±3.28 mm,P=0.027),且MSID 明显小于无CB 组(0.68±3.49 mmvs2.82±3.88 mm,P=0.036)。Oversize 及LVOT oversize差异无统计学意义(P>0.05)。
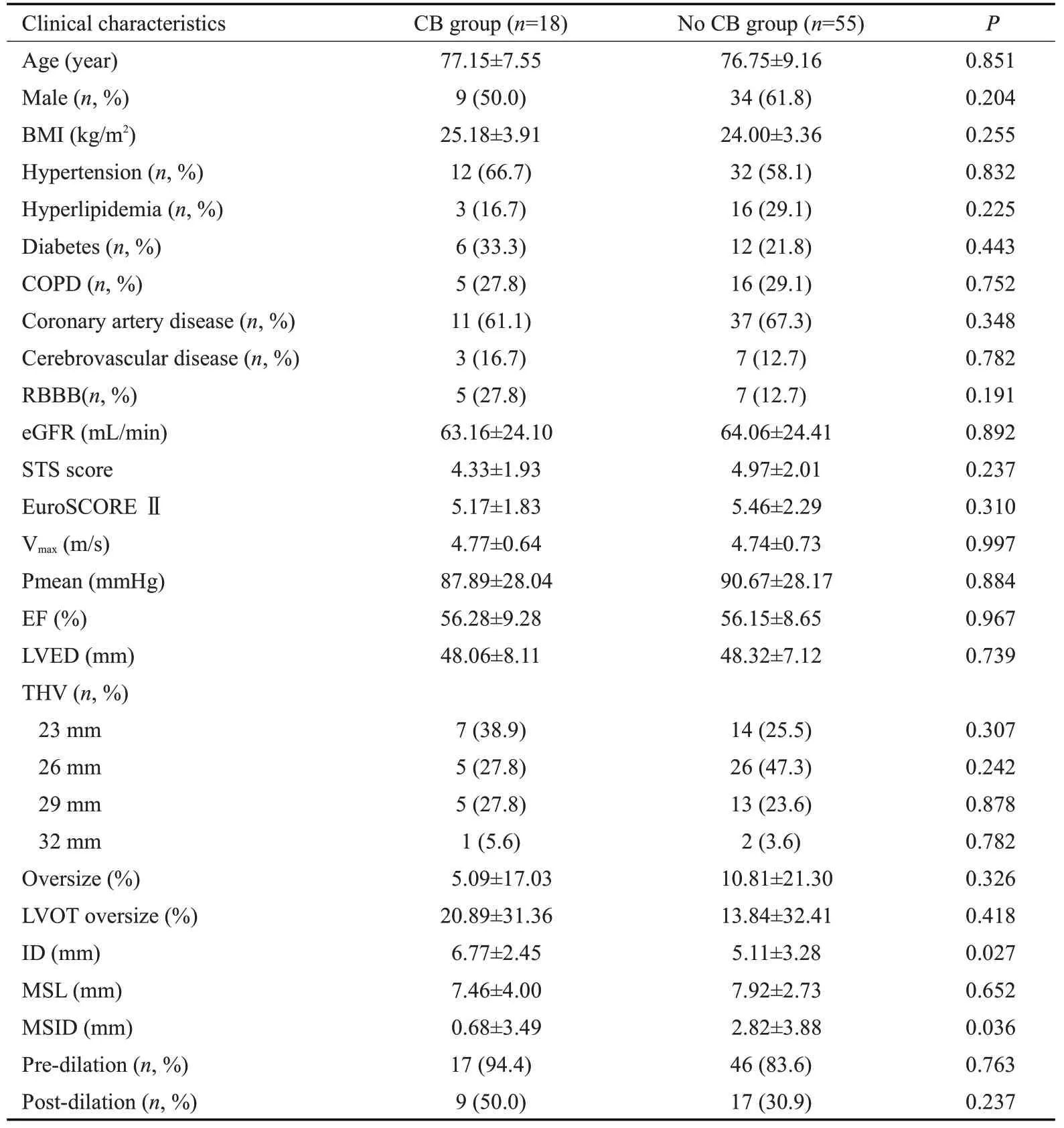
表1 患者临床、超声、CT影像及手术相关基本数据Tab.1 Clinical data,echocardiogram,CT images and intervention-related information of the patients
2.2 术前CTA影像钙化特征
对AVC的9个区域钙化体积测算后发现,尽管CB组和无CB组间的DLZ-LCS钙化体积存在一定差异,但无统计学意义,其余区域钙化体积差异无统计学意义。CB组的DLZ-LCS钙化分布密度明显高于无CB组(P=0.026),其余区域的钙化分布密度两组间差异无统计学意义(表2)。随机抽取30例患者,进行钙化指标观察者间和观察者内一致性分析,均得到较为理想的结果(观察者间ICC:0.98,P<0.05;观察者内ICC:0.92,P<0.05)。

表2 国产SEV的TAVR术前CTA钙化分布特征Tab.2 Preoperative CTAcalcification distributional characteristics of TAVR using SEV made in China
2.3 国产SEV的TAVR术后新发CB的独立危险因素
单因素分析发现,LVOT oversize、DLZ-LCS钙化分布密度、ID、MSID等因素与国产SEV的TAVR术后新发CB存在潜在关联。随后,将LVOT oversize、DLZ-LCS钙化分布密度、MSID 3个变量纳入多因素logistic回归分析后发现,在经过LVOT oversize校正后,DLZ-LCS钙化分布密度、MSID 是国产SEV 的TAVR 术后新发CB的独立危险(保护)因素(表3)。

表3 单因素和多因素logistic回归分析国产SEV的TAVR术后新发CB的独立危险因素Tab.3 Univariate and multivariate logistic regression analysis of the independent risk factors of postoperative new-onset CB following TAVR using SEV made in China
依据多因素分析所得到的2个独立危险(保护)因素,应用两因素单独、联合的方法分别构建模型并绘制ROC 曲线。经计算,联合指标预测具有最大的AUC(0.890),与单因素的比较差异均有统计学意义(P=0.041vsMSID,P=0.027vsDLZ-LCS钙化分布密度,图3)。联合指标对CB的预测效能较好(敏感性84.21%,特异性83.33%,PPV 64.00%,NPV 93.70%,表4)。

表4 单独和联合指标预测CB的效能评估Tab.4 Evaluation of single indicator and combined indicators for prediction of CB
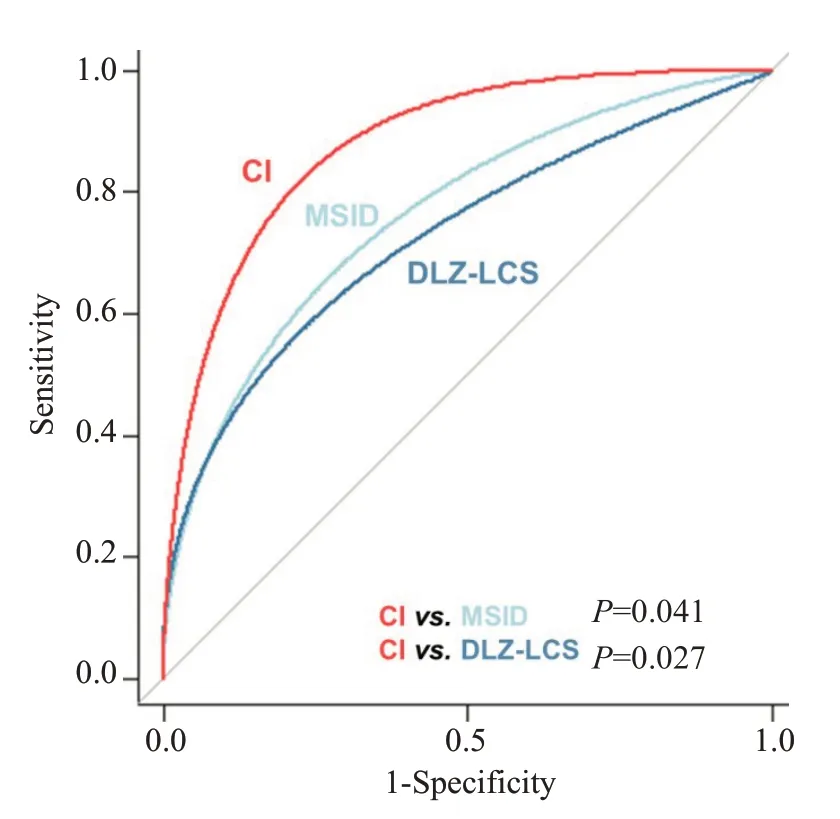
图3 联合MSID和DLZ-LCS钙化分布密度对CB的预测效能Fig.3 Predictive performance of the combined indicators.CI: Combined indicators of MSID and DLZ-LCS calcification distributional density.
3 讨论
目前国产SEV的TAVR术后新发CB的危险因素仍不明确。本研究发现,在73例国产SEV的TAVR患者中,CB的发生率约为25%,在对AVC进行精细区域划分和分析后发现,DLZ-LCS钙化分布密度和MSID是国产SEV术后新发CB的独立危险(保护)因素。通过进一步预测效能分析,本研究发现MSID与DLZ-LCS钙化分布密度联合指标具有最优预测效能,显著高于单独因素。
随着TAVR手术的适应症越来越多地拓展到年轻和低风险人群[22],更多的主动脉瓣疾病患者成为接受这种微创手术的潜在对象,因此探究TAVR术后并发症,尤其是新发CB的危险因素是一个重要且有意义的话题。相较于外科主动脉瓣置换,TAVR手术仍然存在较高的CB发生率[23]。心脏传导系统的特殊解剖结构与人工瓣膜植入位置决定了TAVR 手术后无法完全避免CB。心脏传导系统的左束支从室间隔膜部下方发出,走行于室间隔内,靠近分隔NCS和RCS主动脉瓣的小叶间三角底部[24]。由于左束支与主动脉根部的解剖关系密切,更容易受到机械应力的挤压,因此左束支传导阻滞或房室传导阻滞是常见的CB形式。相较BEV,SEV术后CB发生率更高[25],这可能是由于SEV瓣膜特征和植入操作所致:SEV的植入更深入LVOT,植入后对周围组织会产生更大的径向压力,损伤邻近走行的房室结或传导束[26];由于自膨式性质,在植入术后的一段时间内,人工瓣膜仍然存在持续的膨胀扩张倾向,可能加重组织水肿从而压迫传导系统[27]。
本研究之所以关注国产SEV的TAVR并发症,是由于随着TAVR手术技术和设备的不断更新,国产SEV逐渐在国内、国际舞台崭露头角,例如启明医疗研发的Venus-A瓣膜。此类型瓣膜在适应中国人群方面作了诸多技术改良,其在瓣膜结构设计上与以往SEV有很大不同,例如未释放瓣膜框架下端带有标记点,在LVOT流入端做收口设计,使得术者对于植入深度有更精准的把握,对术中精确定位释放人工瓣膜、精准调整位置角度、避免术后并发症具有重要作用。2022 年Venus-A Plus人工瓣膜获批上市,相较上一代产品,此SEV最大的特点在于可回收,对术中释放植入深度和位置不满意的情形,术者均可多次回收以便重新定位释放[28]。尽管各医疗机构对术后CB的处理、起搏器植入的指征和时机略有不同,致使国产SEV术后并发症的统计数据略有不同,但术后CB比例基本在20%左右,数量上不容忽视。即便如此,当前针对国产SEV术后新发CB的危险因素探讨方面,仅有少量的研究数据可以作为参考,因此,本研究将目光聚焦到这一关键问题上。
前期研究发现,SEV的TAVR术后新发CB的危险因素主要包括右束支传导阻滞,较低的瓣膜植入,原先存在的传导异常,以及人工瓣膜直径/LVOT直径比值等[2,6,29]。此外,有研究展示了MSL可以预测SEV的TAVR术后CB[8]。也有研究报道,较短的MSL和较深的ID与CB风险增加相关[8,9,30]。这些都表明了AVC结构对于术后CB发生的重要性。在钙化因素方面,相关研究发现,横向水平LCS内的钙化严重程度与CB之间存在关联[11],而纵向的DLZ部钙化亦是SEV的TAVR术后新发CB的重要危险因素[12]。基于以上研究发现,本研究针对国产SEV的TAVR术后新发CB的危险因素进行探讨分析,对既往发现进一步细化,发现了AVC钙化的精细分布对于术后CB的影响,证实了DLZ-LCS钙化分布密度是国产SEV术后新发CB的独立危险因素。之所以是LCS区钙化分布密度影响术后CB,而非NCS或RCS,可能是由于在严重钙化分布不均匀的瓣膜结构中,更严重的、融合增厚的钙化瓣膜会把人工瓣膜结构推向钙化的对侧,位于LCS对侧的、NCS和RCS之间下方的传导束更易受到人工瓣膜的挤压。既往研究与本研究分析相一致,主动脉瓣钙化模式不对称导致施加在主动脉瓣环及其周围结构上的径向力分布不均匀[24]。LCS的高钙化可能会导致人工瓣膜偏离中心线,从LCS移位到希氏束所在的RCS和NCS[11]。因此,从某种角度来讲,AVC钙化分布模式似乎比钙化总量更重要[10,31]。在此基础上,本研究进一步提出了钙化分布密度的概念,主要是考虑到了冠状动脉窦容积大小的影响。当DLZ-LCS 区存在较多钙化,而LCS 空间较小时,钙化分布密度升高,人工瓣膜更可能会被推向对侧,压力会通过人工瓣膜传导至房室结,从而导致传导系统的损伤;反之,DLZ-LCS区空间体积较大足以容纳一定的钙化时,则钙化分布密度降低,人工瓣膜被挤压至对侧的风险也相应较低。
本研究回归和预测效能分析显示,MSID也是影响CB的独立保护因素,这也与既往研究观点一致[8,13]。联合DLZ-LCS钙化分布密度和MSID可以更好的预测国产SEV的TAVR术后新发CB,表明了CB是多重因素联合作用的结果,其中DLZ-LCS钙化分布密度为术前影像的不可控因素,MSID则为术中可控因素。综合考量此关键参数,可为有效预防TAVR术后并发症的发生,为进行术前CT 影像综合评估、协助制定个体化TAVR手术策略提供极有价值的信息。
本研究仍存在一定的局限性,如研究性质为回顾性,总体样本量偏小,CB发生例数较少,无法纳入和校正更多潜在的危险因素;同时,钙化分布密度实际上是用区域的钙化体积除以瓣环分区面积,如果该参数的分母是冠状动脉窦对应的空间体积,可能更符合解剖实际情况;再者,本研究最终构建的联合指标模型缺乏外部验证,其真正的临床应用价值如何,还需要前瞻性的大样本队列研究来发现证实。
综上所述,DLZ-LCS钙化分布密度是国产SEV的TAVR术后新发CB的独立危险因素,联合MSID可以有效预测TAVR术后的传导并发症。
- 南方医科大学学报的其它文章
- 尿路上皮癌抗原1促进滋养细胞功能及对上皮-间质转化转化的调控作用
- Brain iron deposition increases in the bilateral substantia nigra of patients with medication-overuse headache: a quantitative susceptibility mapping analysis
- 益肺散结丸缓解小鼠癌因性骨骼肌萎缩的作用
- 环状RNA hsa_circ_0006834可作为肝细胞癌患者预后的潜在生物标志物
- 慢性间歇性低氧大鼠肾组织差异蛋白的定量分析:基于TMTPRM技术
- 不同滴度MOG-IgG 抗体在MOG 抗体相关疾病中的诊断和临床意义:一项单中心回顾性研究