利用产氢强化微生物降解原油产甲烷实验
侯兆伟 刘 洋 金 锐 李 蔚窦绪谋 任国领 张 琨
(1. 国家能源陆相砂岩老油田持续开采研发中心,黑龙江 大庆 163712;2. 中国石油大庆油田有限责任公司勘探开发研究院,黑龙江 大庆 163712;3. 大庆师范学院生物工程学院,黑龙江 大庆 163712)
0 引 言
大庆油田经过水驱、化学驱等开发阶段后,仍然有30%~40%的原油滞留在地下,现有技术无法经济、有效地开发[1]。利用微生物作用将残余油降解转化成甲烷,以天然气形式开采,为这部分残余油的开发提供了一条有益的技术思路[2]。目前普遍认为烷烃厌氧生物降解过程是多菌种参与、多步骤的反应,需要由不同功能菌群共同参与反应才能持续进行[3-5]。其中一些厌氧菌与产甲烷菌具有相似的氧化还原电位和可利用的营养底物以及电子受体,彼此间产生的竞争抑制削弱了产甲烷效率。根据代谢底物类型可将产甲烷菌分为3 类:乙酸营养型、甲基营养型以及氢营养型。除了部分专性乙酸营养型与甲基营养型产甲烷古菌外,在目前已培养的模式菌株中,3/4 以上的产甲烷古菌属于利用CO2和H2产甲烷的氢营养型[6]。3 种营养型产甲烷菌对应3 种代谢方式:乙酸发酵途径、甲基裂解途径、H2/CO2还原途径。理论上在反应前期(甲烷浓度不高的阶段)提供只能被产甲烷菌专一利用的底物,产甲烷效率就会进一步提高。鉴于H2和CO2只能被氢营养型产甲烷菌利用,特别是H2不易被其他菌群竞争利用的特点,若先激活微生物产氢再产甲烷,则能为氢营养型产甲烷菌提供充足的底物,产甲烷效率会进一步提高。
在产甲烷体系中,H2还可以作为电子载体进行种间电子传递,称为种间氢传递[7]。细菌将有机底物氧化后产生H2,作为可溶性穿梭体,将电子从供体细菌传递到受体产甲烷菌。H2是氢型产甲烷菌还原CO2生成甲烷的直接电子供体,最终H2在多种酶和辅酶的参与下,通过不同的代谢途径被氢营养型产甲烷菌消耗产甲烷。目前,H2对产甲烷效率的影响的相关研究报道较少,多见于有机固体处理[8]、有机废水处理[9]和煤矿预处理[10]等非石油领域的研究报道。鉴于自然条件下微生物作用原油产甲烷的周期较长,产甲烷速率较慢,因此本文开展利用微生物产氢来强化微生物作用原油产甲烷能力的实验,目的在于通过提高产甲烷的速率来进一步提高产甲烷能力,达到在短时间内利用微生物快速形成甲烷气的效果。
1 实验设计
1.1 材料和仪器
1.1.1 原油和水样
实验所用原油来自大庆油田第七采油厂某联合站脱水原油,黏度58.0 mPa·s,水样为第七采油厂油井采出液,水类型为NaHCO3型,总矿化度为5~8 g/L,所用活性污泥来自大庆石化公司污水处理厂N1、N2 曝气池的底部污泥。
1.1.2 实验试剂
蛋白胨、牛肉膏、酵母粉、氯化铵、硫酸镁、钼酸钠、柠檬酸、氯化钙、硫酸亚铁、硝酸钾、磷酸氢二钾、磷酸二氢钾、甲酸钠、乙酸钠、丙酸钠等均为分析纯,北京化学试剂厂。
1.1.3 仪器与材料
生化培养箱、无菌操作台、厌氧操作手套箱、气相色谱、灭菌锅、铁架台、试管架、厌氧玻璃瓶、厌氧试管、试管、平皿、三角瓶、烧杯、1 mL 无菌注射器、50 mL 玻璃注射器、水质测试瓶、PCR 仪、DNA 提取试剂盒、电泳仪。
1.2 实验步骤
1.2.1 产氢功能菌的分离
首先将各试剂按照一定比例配制液体产氢培养基后进行高压灭菌,将约100 mL 灭菌后的培养基分装到150 mL 无菌厌氧瓶中,放置室温后每瓶接入1 mL 活性污泥,放置45 ℃恒温培养箱培养。采用排水法收集不同时间所产气体,用岛津GC-14A气相色谱对气体组分的分析结果来确定是否产生大量氢气。再将发酵液进行梯度稀释,采用夹层平板培养法分离微生物单菌落。具体方法如下(在充满CO2的厌氧手套箱内进行):抽取1 mL 发酵液进行无菌10 倍稀释,采用夹层平板法涂布;涂好的平皿周围用塑料封口膜贴封后从厌氧手套箱里取出,放置45 ℃恒温培养箱培养3 d。此时夹层中间长出单菌落,挑选单菌落至含有液体产氢培养基的试管内培养并保存,每个单菌落对应一个试管培养。
夹层平板法:先在培养皿中倒一层灭菌后的固体细菌基础LB 培养基(蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L),待冷凝后涂布稀释后的不同浓度菌悬液,再在其上倒一层琼脂含量较基础LB 培养基低的半固体培养基,倒满整个平皿;由于培养基琼脂含量不同,静置降温后会在2 种培养基中间形成一个供厌氧细菌生长的夹层空隙,经培养出现单菌落后,用接种针穿过半固体培养基层,将单菌落挑出后即可进行下一步操作。
1.2.2 产氢功能菌群的筛选
在一次访谈中,她说:“我是一个对自己挺狠的人。而被‘狠’掉的第一条,是情绪。我早把情绪戒掉了,就是和自己死磕,对自己下命令。有一次,有件事让我很生气,我对自己说,给你二十四小时的时间,你必须把这件事压下去。这一天,什么都不做,让自己过去。”“杀不死我的只会让我更强大。”她用行动践行了这个道理。这样的姑娘,得到什么都不足为奇。想起稻盛和夫说过的一句话:“成功不要无谓的情绪。”深以为然。
将分离出的若干产氢功能菌落分别接种后,放置45℃恒温培养箱培养3 d,测量其所产气的气体组分,其中含氢量高的试管说明产氢菌产氢能力强,即为筛选目标,最终筛选5—7 株产氢效果较好的产氢单菌。
1.2.3 产氢发酵液菌群结构的鉴定
微生物群落基因组DNA 提取具体步骤见文献[11],提取的基因组DNA 储存于-20 ℃冰箱中以用于后续实验。DNA 浓度通过测定其在260 nm 下的吸光度确定,DNA 纯度通过比较260 nm/230 nm和260 nm/280 nm 的吸光度确定。细菌16SrRNA 基因扩增的是可变区V3-V4 区,细菌扩增引物序列为338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTATCTAAT-3'),古菌扩增引物序列为524F(5'-TGACAGCCGCCGCGGTAA-3')和958R(5'-ACCGGCGTTGAATCCAATT-3')。PCR反应体系以10 ng DNA 为模板。PCR 反应扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35 个循环之后,72 ℃延伸10 min。
使用Illumina 的MiSeq 测序仪对16SrRNA 基因的PCR 产物进行双端测序。使用QIIME 软件对测序数据进行过滤。通过flash 软件将有overlap 的一对reads 进行拼接。进行分子生物信息学序列对比分析。
1.2.4 产氢、产甲烷两阶段培养
(1)在含有液体产氢培养基和原油的厌氧瓶中接种所筛选的产氢菌,45 ℃下培养7 d 进行产氢阶段培养,获得产氢培养体系;
(2)配制液体产甲烷培养基,各组分及其质量分数为:w(玉米浆粉)0.1%;w(NaH2PO4)0.5%;w(Na2HPO4)0.5%;w(甲酸钠)0~0.01%;w(乙酸钠)0~0.01%;w(丙酸钠)0~0.01%;w(KNO3)0.7%;w(NH4Cl) 0.7%;w(柠檬酸) 0~0.4%;w(石油磺酸盐)0.01%;w(微量元素母液)0.1%;
微量元素母液各组分及其质量分数为:w(MnCl2·4H2O)0.50%;w(FeCl2·4H2O)1.50%;w(NiCl2·6H2O) 0.2%;w(CoCl2·6H2O) 0.5%;w(CaCl2·2H2O)0.1%;w(Na2MoO4·2H2O)0.01%;w(ZnCl2) 0.5%;w(AlCl3) 0.01%;w(H3BO3)0.02%;w(CuSO4·5H2O)0.1%。
产甲烷培养:将配制好的液体产甲烷培养基分装到厌氧玻璃瓶中后灭菌,室温下按照质量浓度1 g/L 比例添加原油后再接种1%活性污泥,45 ℃下培养90 d 获得产甲烷发酵液。
(3)配置pH 为10 的碱性A 饱和溶液,然后对已培养的产氢培养体系中加入碱性溶液A,将产氢发酵体系的pH 调解到6.5~7.0 后,分别再接种质量分数1%的N1、N2 产甲烷发酵菌液,再放置45 ℃培养。采用排水法对不同时间段所产气体进行收集。具体操作:在带有橡胶塞的厌氧管中装满饱和NaHCO3溶液,严密封口,采用50 mL 注射器收集培养体系顶空气体并将其注入到装满饱和NaHCO3溶液的厌氧管中,一端插入针管进行排液,将注射器内的气体注射进厌氧管中,最终收集到气体。再用气相色谱专用注射器将所收集到的气体从收集管取出,注射进气相色谱仪,对气体进行组分分析。
1.2.5 发酵液各理化参数的测定
(1)pH 测定,采用不同范围和精度的pH 试纸进行测定;(2)发酵液脱氢酶含量测定,采用2,3,5—氯化三苯基四氮唑法进行测定[12];(3)发酵液辅酶F420测定,采用分光光度法[13]测定辅酶F420的含量;(4)发酵液挥发性脂肪酸VFA 含量的测定,参考任南琪等[14]所著《产酸发酵微生物生理生态学》附录部分有关VFA 测定;(5)微生物种类与数量测定,采用MPN 法对水样及其污泥中内源微生物种类和数量进行检测(参考行业标准SY/T 0532—2012《油田注入水细菌分析方法绝迹稀释法》);(6)气体组分测定,采用气相色谱对所收集的气体组分进行分析(参考国家标准GB/T 13610—2020《天然气的组成分析 气相色谱法》)。
2 结果与分析
2.1 活性污泥中产氢菌的分离
采用MPN 法对活性污泥悬液中内源微生物种类和浓度进行检测。相比油井采出液中的内源微生物浓度,大庆石化公司污水处理厂的活性污泥悬液中含有大量消化功能的微生物,包括烃氧化菌(HOB)、腐生菌(TGB)、硝酸盐还原菌(NRB)、硫酸盐还原菌(SRB)、乙酸菌(APB)、铁细菌(FB)和产甲烷菌(MPB),其本源菌菌群组成见表1,其浓度为103~106个/mL,普遍较地层水采出液中的内源微生物浓度高出102~103个/mL。目前国内外已有关于活性污泥产氢的报道[15-16],但大多数都是基于污水废水生物处理的研究,很少涉及到原油等烷烃的微生物厌氧降解产甲烷的研究。本实验采用每支厌氧玻璃培养瓶中装入含有1 g/L 原油的液体产氢培养基,高温灭菌后接种体积分数1%的活性污泥,45 ℃恒温培养后,起到利用活性污泥所含有的微生物作用原油同时产氢的效果。

表1 不同污泥与采出液的内源微生物菌浓度Table 1 Endogenous microbial bacteria concentration in different sludge and produced liquid
由表2 可知,在N2 污泥培养后的第7 天每100 mL 发酵液所产主要气体中的氢气体积分数最高可达到43.04%,产气46 mL,产氢量0.89 mmol,具有较好的产氢能力。从其发酵液中筛选的产氢功能菌见图1(a)、(b),挑选6 个单菌落进行产氢培养,并对其发酵液的二次转接产氢能力进行测试,结果见图2。发现菌落产氢及其二次转接后的产氢量稳定在1.4 mmol 左右,说明菌株产氢能力稳定,可作为后续实验用菌株。另外从表2 可看出地层水的产氢能力较弱,不适合作为产氢菌的筛选目标。
图1 从活性污泥中分离的产氢菌照片Fig. 1 Photos of hydrogen produced bacteria separated from active sludge
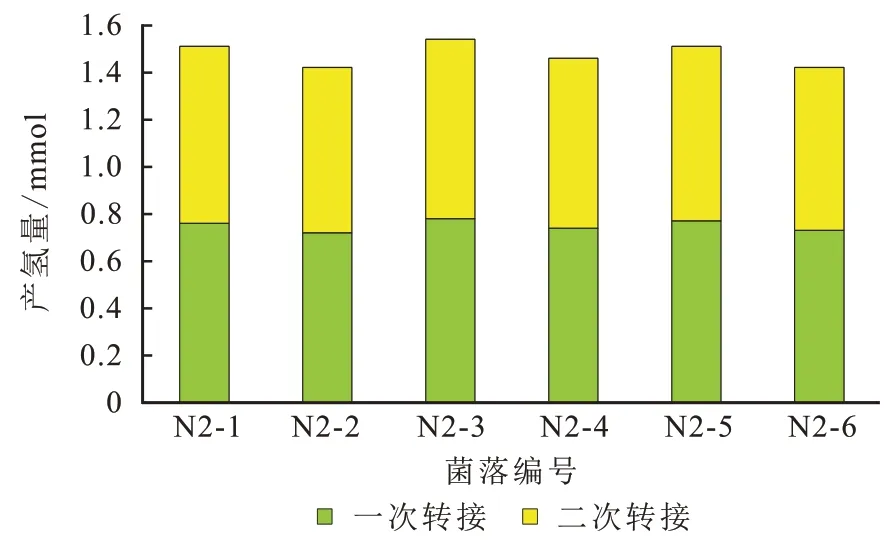
图2 不同单菌落的产氢量Fig. 2 Hydrogen production of different single bacteria colonies

表2 不同污泥与采出液产氢能力Table 2 Hydrogen production capacity of different sludge and produced liquid
对N2 污泥发酵液中细菌菌群结构进行分子生物学测序鉴定,检测结果表明:按照相对丰度由大到小排列,占比最多的是具有产酸产气功能的梭菌属(Clostridiumsp.)约占39%;其次是能够厌氧降解烷烃,生成小分子酸和H2的互营菌(norank_f_Synergistaceae)约占21%;其余是能利用葡萄糖产乙酸和H2的未命名菌属(norank_f_Lentimicrobiacenae)约占10%;产乙酸产气的厌氧杆菌(Anaerobaculumsp.)约占9%;具有互营降解脂肪酸能力的热厌氧杆菌(Tepidanaerobactersp.) 约占6%;能够分解碳水化合物产H2的(Mesotogasp.)约占5%和一些能够进行暗发酵厌氧产氢的丁酸芽孢杆菌属(Trdiumbutyricum)和脱硫弧菌属(Desulfovibrio)。证明了N2 污泥发酵液中含有丰富的产酸产氢功能菌群。
2.2 产氢培养基优化
为了提高产氢能力,对产氢培养基的组成进一步筛选调整(表3),发现N2 污泥的培养体系在添加微量物质(纳米四氧化三铁粉末A、L 半胱氨酸B)和糖蜜培养4 d 后,所产气体中氢气体积分数最高可达到51.84%。通过计算,其每100 mL 发酵液所产气体的总氢量达到1.63 mmol,与所分离菌株产氢0.8 mmol 左右相比,产氢量提高了1 倍左右。对发酵液的pH 和挥发性脂肪酸含量进行检测。发现在1~2 d pH 显著降低,最终4 d 后pH 达到3.5 左右(图3),呈现酸性。

图3 产氢发酵液pH与时间的关系Fig. 3 Relationship between hydrogen produced fermentation liquid pH and time

表3 不同有机物培养基组分及产氢能力的优化Table 3 Components and hydrogen production capacity optimization of different organic cultivation
通过测定挥发性脂肪酸(VFA)质量浓度曲线(图4),求得N1、N2 发酵液的挥发性脂肪酸质量浓度分别达到2 054 和2 260 mg/L,表明挥发性脂肪酸产生大量积累。已知可溶性碳水化合物,如葡萄糖、蔗糖、乳糖、淀粉等的产氢以丁酸型发酵为主[17],这是一种经典的发酵方式,发酵产生的末端产物主要为丁酸、乙酸、H2、CO2和少量的丙酸。丁酸型发酵途径主要是在梭菌属作用下进行的。而且根据已有研究结果表明:产甲烷菌较产氢菌适应的环境pH 较为严格,过酸或过碱的环境都会抑制产甲烷甚至不产甲烷[18],所以在产氢阶段过后,即使作为产甲烷的前体物质VFA 大量积累也不产甲烷,若转入产甲烷阶段,需要对产氢后的培养基pH 进行调解中和至中性后才能继续进行。

图4 挥发性脂肪酸质量浓度Fig. 4 VFA mass concentration
产氢过程中的小分子有机物氧化降解与脱氢酶活性相关。脱氢酶是一类能催化糖类、有机酸、氨基酸进行氧化还原反应的酶,其将底物氧化脱氢,成为氢供体或电子供体。通过测定脱氢酶活性的标准曲线(图5)来计算厌氧培养体系发酵液中脱氢酶活性值。利用此方法可以间接评价微生物产氢体系的反应活性。优化后的产氢体系脱氢酶酶活达到了168 mg/L,与优化前的酶活42.6 mg/L 相比,提高了2.95 倍,其活性值的提高与产氢能力的提高呈正比。

图5 脱氢酶活性曲线Fig. 5 Dehydrogenase activity curve
2.3 产甲烷培养效果
对活性污泥的产甲烷能力进行了验证,45 ℃培养后产生大量气体(图6),培养10 d 后产气量基本保持不变,其中接种N1 污泥培养产气56 mL,接种N2 污泥的培养产气60 mL。培养90 d 后对其所产气体进行气体组分分析,检测到甲烷气体,其中N1 样品甲烷体积分数为37.294%,N2 污泥样品甲烷体积分数可达到55.429%。结果表明活性污泥具有产氢能力的同时还具有产甲烷能力,根据甲烷总质量m甲烷=V甲烷ρ甲烷(ρ甲烷=0.717 g/L)计算得到N1、 N2 污泥所产甲烷总量分别为0.936 和1.49 mmol,相应的产甲烷速率平均为0.013 mmol/d,单位质量原油作用下的产甲烷转化率(m甲烷/m原油)平均达到19.4%,结果表明活性污泥作用原油具有良好的产气产甲烷效果。

图6 不同污泥体系的产气量Fig. 6 Gas production of different sludge systems
产甲烷菌是生命进化史上最古老的单细胞生命体。迄今为止,已发现的产甲烷古菌共有7 个目[19],包括Methanomicrobiales、Methanobacteriales、Methanococcales、Methanocellales、Methanopyrales、Methanosarcinales 以及近年发现的Methanomassiliicoccales,均属于广古菌门Euryarchaeota。对产甲烷效果较好的N2 培养体系激活后的产甲烷古菌进行检测。结果表明,丰度最高达45%的Methanothrix属于Methanosarcinales 目,是典型的乙酸营养型产甲烷菌,可以直接利用乙酸产甲烷;丰度达25%的Methanosarcina,也是一类乙酸营养型产甲烷菌;丰度达20%的Methanothermobacter属于Methanobacteriales 目,是一类嗜热氢营养型产甲烷菌;而Methanomassiliicoccus属于产甲烷菌“第七目”,存在于许多厌氧环境中,如海洋栖息地、土壤、湿地等,但从系统发育学角度而言,它与产甲烷菌的其他目均相距较远,该菌是一类甲基营养型产甲烷菌,即能利用甲基类物质,如甲酸、甲醇等来产甲烷。由此可以看出N2 发酵液的产甲烷菌以小分子有机酸(乙酸)代谢产甲烷为主,H2的存在增加了可利用的底物范围,氢营养型产甲烷菌进一步会提高体系的产甲烷能力。
2.4 产氢、产甲烷发酵结合实验
微生物产氢反应2〔H+〕+2e-→H2发生在细胞内,是由氢化酶催化的可逆反应,其中电子(e-)来源于有机物,还原氢〔H+〕(是由水产生转化)来源于细胞水,并在氢化酶的作用下所产H2的同位素组成与水介质之间迅速达到氢同位素的平衡[20]。即在有水的环境下,只要满足微生物的产氢条件即可产氢,可用来进一步产甲烷。产甲烷菌处于油藏微生物生态位的最末端,与其他地层微生物包括产氢微生物形成一种特殊的互营关系,油藏微生物各种群利用这种互营关系持续降解石油烃,所以可以将产氢、产甲烷两个阶段进行有机结合。
将优化后的产氢体系与产甲烷发酵液进行结合,设计出产氢与产甲烷两阶段结合培养产甲烷。氢营养型产甲烷菌利用已有的H2和CO2合成甲烷,乙酸营养型产甲烷菌利用发酵液中已有的小分子有机酸(盐)代谢产生甲烷。以N1、N2 产甲烷发酵液混合接种后再进行产甲烷培养的体系做对照,与同期非结合培养相比,两阶段结合途径的体系培养20 d 后便以甲烷和氢气为主(表4),且产氢量和甲烷含量显著提高。与同期非结合培养所产甲烷15.75%相比较,无论是N1 还是N2 的产氢产甲烷结合后所产气体中甲烷体积分数均达到79%以上,产气量也从25 mL 提高到50 和48 mL,提高了近1倍。最终计算每100 mL 产氢结合体系平均20 d 内产甲烷总量1.75 mmol 远高于同期非结合培养的0.176 mmol。

表4 产氢产甲烷结合培养20 d后不同样品气体组分Table 4 Gas components of different samples after 20 days of combined hydrogen production and methane production cultivation
辅酶F420是一类可以将化学基团从一个酶转移到另一个酶上的有机小分子,可作为一个衡量厌氧污泥活性的测定指标,可以反映污泥的产甲烷活性,各种甲烷菌中均含有辅酶F420,通过对发酵液中的辅酶F420含量测定,发现产氢产甲烷结合后产甲烷作用活性显著升高,体系培养20 d 的发酵液中辅酶F420含量比同期非结合培养增加10 倍左右,这与甲烷产量的增长呈正比(表5)。最终计算得出每100 mL 发酵液利用产氢、产甲烷结合的方法20 d 内产甲烷的速率为0.087 5 mmol/d,是同期非结合培养0.008 8 mmol/d 的近10 倍,且两阶段培养下的甲烷转化率达到28%,与N1、N2 污泥单一培养作用原油90 d 的产甲烷平均转化率19.4%相比,得到显著提升,结果表明产氢产甲烷两阶段培养法,能够大幅度提高微生物产甲烷速率,进而提高甲烷转化率,实现了利用产氢强化微生物作用原油产甲烷的效果。

表5 不同培养体系发酵液中辅酶F420Table 5 Coenzyme F420 in fermentation liquid in different cultivation systems
3 结 论
(1)来自大庆石化公司污水处理厂曝气池底部的污泥样品含有丰富的微生物种群,包括产氢菌和产甲烷菌,其浓度为103~106个/mL,在45 ℃培养条件下,分别接种在产氢培养和产甲烷培养基,培养7 d 和90 d 后可实现产氢和产甲烷的功能,为产氢、产甲烷两阶段结合培养提供了生物学基础。
(2) 所筛选的产氢菌,其产氢量可稳定在0.8 mmol 左右。通过对培养基的优化,每100 mL发酵液所产气体的总氢量达到1.63 mol,发酵液pH在1~2 d 内显著降低,挥发性脂肪酸(VFA)含量达到2 000 mg/L 以上,产生大量H2和CO2同时产生大量有机酸,为产氢、产甲烷两阶段结合培养提供了物质基础。
(3)利用产氢菌和产甲烷菌的互营代谢这一生物学特性,设计出产氢与产甲烷两阶段结合的方法,提高了产甲烷反应速率,与普通的非结合产甲烷体系的产甲烷速率相对比,可使产甲烷的速率短时间20 d 内提高近10 倍,达到0.087 5 mmol/d。打破了传统由于氢营养型产甲烷菌产甲烷过程中作为前体物质H2的缺乏从而导致产甲烷效率低的问题,有效地提高了产甲烷的反应速率和转化率。

