猕猴桃胶孢炭疽病菌的农杆菌介导遗传转化体系构建及荧光标记菌株鉴定
苏琦雅,邓 蕾,潘 慧,钟彩虹,刘德江*,李 黎#
(1.佳木斯大学 生物与农业学院,黑龙江 佳木斯 154007;2.中国科学院 武汉植物园,武汉 430074;3.中国科学院 植物种质创新与特色农业重点实验室,武汉 430074;4.中国科学院 猕猴桃产业技术工程实验室,武汉 430073)
近年来,随着猕猴桃产业的快速发展,猕猴桃炭疽病在我国四川、江西等多省份发现,部分园区感病超过30%,呈现同一园区多点发病的状况,对猕猴桃产量和品质造成了严重影响[1-2]。猕猴桃感病后叶片边缘卷缩,初期呈现水渍状病斑,后期为褐色不规则形病斑,病斑正面散生许多小黑点,病健交界明显。病情严重时多个病斑常连接成片,形成穿孔或大量落叶[3]。此外,该病还会导致猕猴桃果实硬度、维生素C含量迅速下降,果面出现褐色病斑直至完全腐烂,降低果实质量[4]。
胶孢炭疽菌[Colletotrichumgloeosporioides(Penz.) Sacc.],有性态为围小丛壳菌(Glomerellacingulata),属子囊菌门,无性态为胶孢炭疽菌。一般以菌丝体和分生孢子盘形式在宿主上越冬,翌年早春形成分生孢子,借风雨和昆虫传播,从气孔、伤口侵入,导致植物发病[5]。迄今为止,已报道该菌可导致苹果、桃、芒果、番木瓜、柑橘、黄柏、板栗、枇杷、麦冬、橡胶等200多种植物感染炭疽病,危害重大[6]。2016年9月,基于生物学特性、致病力验证及真菌的内转录间隔区(internally transcribed spacer,ITS)、β-微管蛋白(beta-tubulin,β-tubulin)及甘油醛-3-磷酸脱氢酶(glyceraldehydephos phate dehydrogenase,GAPDH)多序列实验,胶孢炭疽菌被首次鉴定为我国贵州六盘水及浙江泰顺等地猕猴桃炭疽病的主要致病菌[7],但该菌对猕猴桃的定殖侵染及致病机理并未得到深入研究。绿色荧光蛋白(green fluorescent protein,GFP)作为一种全新的非酶报告基因,具有荧光特性稳定、实时原位检测方便、受体细胞的种属和类型多样等优点,被广泛用于植物病原菌检测、侵染与定殖、基因表达及抗性植株筛选中[8]。然而,绿色荧光蛋白作为报告基因研究炭疽病菌对猕猴桃的侵染过程未见报道。
针对胶孢炭疽菌(C.gloeosporioides)菌株,李思蒙等[9]、张俊等[10]、曾泉等[11]及陆英等[12]分别成功建立了聚乙二醇(polyethylene glycol,PEG)介导的杨树、芒果、辣椒、咖啡胶孢炭疽菌的遗传转化体系,获得了对应的GFP荧光转化子。但PEG介导遗传转化具有一些缺点,譬如步骤繁琐且转化效率低、易产生部分瞬时转化子和多拷贝整合等。近几年,农杆菌介导构建绿色荧光蛋白菌株的技术因其操作简单、稳定性强、转化效率高、单拷贝插入突变体多等优点,也被用于胶孢炭疽菌的荧光菌构建中。李伟等[13]以筛选致病基因为目的,首次建立了农杆菌介导的芒果胶孢炭疽菌遗传转化体系,筛选到多株菌落形态异常或产孢能力下降的突变体;王海艳等[14]构建了农杆菌介导的苹果炭疽病菌遗传转化体系;但上述2项研究并未获得其荧光菌株。毕方铖等[15]首次筛选到GFP荧光的芒果胶孢炭疽病菌,得到了8株致病力减弱或缺失的转化子。因此,在毕方铖等[15]研究体系的基础上,拟针对猕猴桃胶孢炭疽病菌构建遗传转化体系,获得与野生型形态、致病力一致且可稳定遗传的GFP荧光转化子,为探究该菌对猕猴桃的侵染规律及致病机理奠定材料基础。该研究结果将有助于尽快减少该病对猕猴桃产业造成的经济损失。
1 材料与方法
1.1 供试材料
胶孢炭疽菌(C.gloeosporioides)菌株KFCG-W(KF为宿主猕猴桃缩写,CG为炭疽病拉丁名缩写,W代表野生菌株)分离自猕猴桃炭疽病感病果实[5]。含GFP基因和潮霉素B抗性基因的双元质粒pCAMBgfp及以其为转化载体的农杆菌EHA105菌株,均由广东省农业科学院果树研究所毕方铖研究员惠赠[15]。马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)、LB(Luria-Bertani)培养基、诱导培养基(induction medium,IM)及筛选培养基配方与邓蕾等[16]一致。
1.2 实验方法
1.2.1 含双元载体的农杆菌液制备 将上述含双元质粒的EHA105农杆菌菌株在LB平板上进行活化,28℃下培养48h后挑取单菌落至含50μg/mL卡那霉素(kanamycin,Kan)及25μg/mL利福平(rifampicin,Rif)的LB液体培养基中。将培养基混匀后放入恒温培养箱,以200r/min条件振荡培养48h后将菌液在离心机内以5000r/min离心5min,倒掉上清液,将剩余沉淀在IM液体培养基中重悬,调整重悬浓度至600nm波长下的溶液吸光度(optical density,OD600)为0.2,随后在28℃下以200r/min条件振荡培养6h,备用。
1.2.2 胶孢炭疽病菌的孢子悬液制备 将KFCG-W菌株在PDA平板上接种培养2周,观察平板产孢情况。用无菌涂布棒在平板表面多次轻轻刮擦,逐次加入无菌水,轻轻晃动平板,收集孢子液并用2层无菌纱布过滤,随后进一步用IM液体培养基将孢子重悬混匀,最终通过显微观察计数稀释得到浓度为1×106个/mL的孢子悬液。
1.2.3 孢子与农杆菌菌株共转化 准备铺有无菌玻璃纸的IM共培养基+200μmol/L乙酰丁香酮(acetosyringone,AS)平板,将1.0mL农杆菌液及1.0mL孢子悬液均匀混合,取100μL涂布于平板上,在25℃条件下避光共培养48h。随后,将玻璃纸转移至筛选培养基(含160μg/mL潮霉素和200μmol/L头孢霉素),置于25℃条件下培养。待长出新菌落后将单菌落挑至含160μg/mL潮霉素的培养基上反复继代培养,其中仍可稳定生长的菌落作为候选转化子[17]。
1.2.4 候选转化子的PCR检测及荧光验证 1) GFP基因的聚合酶链式反应(polymerase chain reaction,PCR)检测:收集转化子菌丝提取脱氧核糖核酸(deoxyribonucleic acid,DNA)。扩增引物序列为GFP-F/GFP-R:5′-AGCAAGGGCGAGGAGCTGT-3′/5′-TTGTACAGCTCGTCCATGCCG-3′。PCR扩增体系为模板1μL,10μmol/L正反向引物各0.5μL,2×phanta max master mix(Dye Plus) 12.5μL,加入灭菌超纯水补至25μL。反应程序为95℃预变性3min,95℃变性15s、60℃退火15s、72℃延伸1min,循环35次;72℃条件下保存10min。使用Tanon 1600全自动数码凝胶成像分析系统观察PCR产物的电泳检测结果,初步确定阳性转化子。2) 转化子的荧光检测:针对这些初步确定为阳性转化子的材料,在25℃条件下培养4d;先用LUYOR-3410手持荧光仪观察其菌落,如发现带GFP荧光,则挑取菌丝制作成玻片,进一步运用荧光显微镜Leica DFC550进行观察;如仍可观察到明确的荧光,则被确定为阳性转化子。
1.2.5 阳性转化子的菌落形态及致病性验证 1) 转化子的菌落形态观察及菌丝生长速率测定:将阳性转化子活化,用打孔器取直径为0.8cm的菌饼,接种置于PDA平板的中心,在25℃条件下培养4d后运用十字交叉法测量菌落的平均直径,观察菌落形态,计算标准误差。以野生型为对照,重复3次。2) 转化子的致病力测定:参照邓蕾等[16]的方法,用75%酒精对中华猕猴桃‘东红’品种果实进行消毒,消毒30s后立即用无菌水冲洗3次,自然晾干后用注射器针头在果实表面刺孔。以野生型KFCG-W菌株为对照,将直径0.8cm的转化子菌饼接种到果实表面上,菌丝面与果实接触,在25℃条件下培养6d后测定病斑直径,计算标准误差值,重复8次。将显著水平设定为0.05,运用SPSS 20.0软件进行方差分析。
2 结果与分析
2.1 转化子PCR检测
首先,为确定猕猴桃炭疽病菌KFCG-W菌株遗传转化的最佳潮霉素筛选浓度,设置了梯度筛选实验。野生型KFCG-W菌株在不同浓度潮霉素B平板上的菌丝生长情况如图1所示。由图1可知,野生型KFCG-W菌株在不含潮霉素的PDA平板上正常生长(A列);当潮霉素质量浓度分别为60μg/mL(B列)、120μg/mL(C列)时,菌丝受到不同程度的抑制但仍在生长,且随着潮霉素浓度的增加,菌丝受抑制的程度越来越明显。当潮霉素质量浓度增加至140μg/mL(D列)时,菌株已基本停止生长。当潮霉素质量浓度进一步增加至160μg/mL(E列)或180μg/mL(F列)时,菌株完全停止生长。基于实验结果可知,潮霉素质量浓度为160μg/mL时野生型菌株已完全无法生长,满足筛选要求,特将转化子筛选质量浓度设定为160μg/mL(E列)。
按照1.2.1~1.2.3步骤进行农杆菌介导的猕猴桃炭疽病菌KFCG-W菌株遗传转化,经潮霉素筛选及数次继代培养筛选,初步筛选获得11株转化子。为保证转化子的准确性,进一步利用GFP序列特异性引物对野生型KFCG-W菌株及11株转化子(CG1~CG11)进行PCR检测,PCR扩增后能得到目的GFP片段710碱基对(base pair,bp)的转化子被视为遗传转化成功的转化子。野生型KFCG-W菌株及转化子PCR检测电泳图如图2所示。由图2可知,与预期结果一致,对应泳道1的野生型KFCG-W菌株未扩增到目的荧光GFP基因条带中,分别对应泳道2~12的转化子CG1~CG11均可扩增得到710bp的GFP基因目的条带中,由此说明GFP片段已稳定插入转化子基因组中,可用于进行下一步研究。
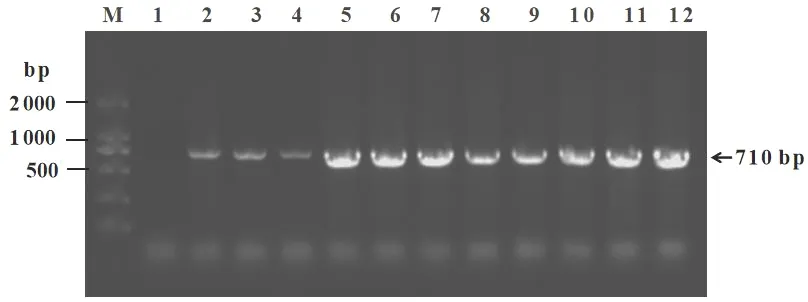
注:M为电泳;泳道1为KFCG-W野生菌株;泳道2~12依次对应转化子CG1~CG11。图2 野生型KFCG-W菌株及转化子PCR检测电泳图Fig.2 PCR verification for wild type stain and transformants of C.gloeosporioides
2.2 荧光显微检测
为进一步确定遗传转化子的荧光稳定性,对11株转化子在25℃条件下PDA培养基上培养4d后的菌丝生长状态、孢子及菌丝显微结构、接种果实后的感病症状进行分析。结果表明,11株转化子在激发光条件下均可表达稳定的绿色荧光,由此证实11株转化子中的外源GFP基因均能正常表达并遗传稳定。观察荧光强度发现大部分菌株的GFP表达水平一致,其中CG-10菌株的荧光强度最强烈。转化子CG-10的荧光显微观察结果如图3所示。

图3 转化子CG-10的荧光显微观察Fig.3 Fluorescence microscopic observation of transformant CG-10
由图3(a)可知,在明场条件下CG-10转化子在PDA平板上菌丝生长正常。由图3(b)可知,在紫外激发光条件下,该菌株的菌丝荧光明亮稳定,菌丝的轮纹较明场下更清晰。由图3(c)可知,将CG-10转化子接种果实后,在明场条件下果面出现典型的软腐症状,病部果肉呈水渍状腐烂,病健交界处明显。由图3(d)可知,在紫外激发光条件下,CG-10转化子的病斑呈现明亮的荧光,荧光形状面积与果实病斑完全一致,有利于更直观地观察软腐病菌对猕猴桃果实的侵染过程。由图3(e)可知,在明场条件下CG-10转化子菌丝结构正常,孢子萌发正常。由图3(f)可知,转化子的菌丝和孢子荧光稳定,较明场而言能更清晰地观察胶孢炭疽病菌的菌丝结构及孢子形态。
2.3 转化子的菌落形态分析
为进一步筛选出与野生型菌株菌落形态一致的荧光转化子菌株,对野生型菌株及11株转化子在PDA平板上的菌落特征进行了观察,结果如图4所示。观察接种4d后的平板菌落,由图4(a)可知,野生型菌株菌丝白色浓密,菌丝生长速度较快。与野生型菌株相比,CG-1(图4(b))、CG-4(图4(e))、CG-6(图4(g))、CG-8(图4(i))、CG-9(图4(j))5株转化子的菌落形态及菌丝生长速度基本一致;CG-2(图4(c))、CG-3(图4(d))、CG-5(图4(f))、CG-7(图4(h))、CG-10(图4(k))、CG-11(图4(l))6株转化子的菌落形态与野生型菌株存在显著差异,菌丝扭结或边缘不平整,生长速率明显下降,说明GFP片段的插入对菌丝生长造成了影响。其中,CG-10菌丝呈浅绿色,与转化子的荧光观察结果一致,可能与GFP基因显著高表达相关。

图4 野生型及转化子在PDA平板上的菌落形态Fig.4 The cultural characteristics wild type stain and transformants of C.gloeosporioides on PDA medium
2.4 致病力测定
为进一步筛选出与野生型菌株致病力一致的荧光转化子菌株,将野生型菌株及11株转化子的菌饼接种于猕猴桃果实上,接种6d后观察果实的感病症状,结果如图5所示。由图5(a)可知,野生型菌株会引起明显的感病症状,接种点为病部中心,呈浅褐色或褐色,病斑从接种点向外延展,果肉呈水渍状腐烂,病健交界处明显。相对于野生型KFCG-W菌株,11株转化子中CG-7转化子(图5(h))的致病力增加;CG-4(图5(e))、CG-5(图5(f))、CG-9(图5(j))、CG-10(图5(k))4株转化子与野生型菌株的致病力基本一致;CG-1(图5(b))、CG-2(图5(c))、CG-3(图5(d))、CG-6(图5(g))、CG-8(图5(i))及CG-11(图5(l))6株转化子的致病力减弱。

图5 野生型菌株及转化子菌株对猕猴桃果实的致病力表型Fig.5 The pathogenicity of wild type strain and transformants of C.gloeosporioides to kiwifruit
对果实病斑的致病力数据进行方差分析,以进一步确定筛选到的转化子与野生型无显著差异。将显著水平设定为0.05,根据差异显著性标注原理,如果2组标注的字母中没有重叠,说明在95%置信水平两者具有显著差异。如果2组标注的字母有1个相同标记字母,即表示2组差异不显著。野生型菌株及转化子菌株对猕猴桃果实的致病力差异分析结果如图6所示。由图6可知,与KFCG-W菌株相比,CG-7、CG-1、CG-6、CG-11、CG-3、CG-2、CG-8 7个菌株致病力与野生型差异显著;CG-5、CG-9、CG-4、CG-10 4个菌株的致病力差异不显著。

注:字母a~g代表差异显著性。图6 野生型菌株及转化子菌株对猕猴桃果实的致病力差异分析Fig.6 The pathogenicity analysis of wild type strain and transformants of C.gloeosporioides to kiwifruit
综合转化子的荧光观察、菌落形态观察及致病力测试结果,可知CG-4及CG-9转化子的菌落形态、菌丝生长速率、分生孢子形态、致病力与野生型无明显差异,且荧光稳定;其他9株转化子均与野生型KFCG-W菌株存在一定差异。
3 讨论
在丝状真菌的遗传转化过程中,载体的选择、潮霉素筛选浓度、农杆菌浓度、培养基及共培养条件等因素直接影响转化效率。此外,由于植物宿主及生存环境不同,不同宿主上分离得到的同一种真菌菌株在致病力、产孢能力及对潮霉素的敏感程度等均可能存在较大差异。研究主要针对在猕猴桃上分离到的胶孢炭疽病菌,摸索遗传转化体系条件及参数细节。
近年,针对从不同宿主上分离到的胶孢炭疽病菌构建的农杆菌介导的遗传转化体系研究十分有限。李伟等[13]针对芒果上分离到的胶孢炭疽菌建立了农杆菌介导的遗传转化体系,发现当潮霉素筛选质量浓度为200μg/mL,农杆菌在660nm处的吸光度值(optical density,OD660)为0.15,共培养时乙酰丁香酮摩尔浓度为200μmol/L时,选用pH值为5.5的IM共培养基转化效果最好;筛选到多个炭疽病的转移脱氧核糖核酸(transferred DNA,T-DNA)插入突变体,包含菌落形态异常突变体3个,产孢能力下降突变体6个。王海艳等[14]以苹果上分离到的胶孢炭疽病菌为转化受体,利用携带双元载体pBIG3C的农杆菌进行转化及体系优化,认为病菌分生孢子悬液浓度为1×105个/mL,共培养基中添加200μmol/L乙酰丁香酮,在共培养温度22℃条件下培养24h时转化效率较高;T-DNA均整合进病菌基因组中,以单拷贝形式整合且稳定遗传,筛选到多株生长速率、分生孢子萌发率、附着胞形成比例、致病力显著减低或形态异常的突变子。在此基础上,毕方铖等[15]构建了含潮霉素抗性基因和GFP基因的双元载体pCAMBgfp,以其为转化载体对芒果胶孢炭疽病菌进行了遗传转化,确定了最佳的潮霉素筛选质量浓度为150μg/mL,首次筛选得到8株致病力减弱或缺失的荧光转化子。实验首次针对从猕猴桃宿主上分离到的胶孢炭疽病菌进行了体系优化,为获得最佳的转化效果,选用了毕方铖等[15]构建的双元载体pCAMBgfp,并对病菌的分生孢子浓度、共培养温度、乙酰丁香酮摩尔浓度等条件进行了优化,发现适当的乙酰丁香酮诱导有利于载体的表达。当潮霉素质量浓度为160μg/mL,农杆菌菌液吸光度OD600调整为0.2,病菌分生孢子悬浮液浓度为1×106个/mL,共培养基中添加200μmol/L的乙酰丁香酮,在25℃条件下避光共培养48h时,转化效率相对较高且有利于单个转化子的分辨和挑取。
病原菌的侵染过程十分复杂,涉及一系列基因的表达,菌丝的快速生长、分生孢子的正常产生是病菌侵染和致病的前提。实验进一步对筛选获得的11个转化子进行荧光遗传稳定性、菌落形态、菌丝生长速率、分生孢子形态及致病力测定,发现与野生型菌株相比较,CG-4及CG-9转化子各方面无明显差异且荧光稳定,说明该遗传转化体系可有效用于构建猕猴桃胶孢炭疽病菌的荧光菌株,用于菌株侵染机制研究。此外,与野生型菌株相比,其他9株转化子或菌落形态改变,或菌丝生长速率变化,或致病力显著增减,推测可能是T4转座子的随机插入位点与菌丝生长或致病力密切相关,但还有待于进一步的深入研究加以证实。其中,CG-1、CG-6、CG-8转化子的菌丝生长速率虽未明显改变,但致病力显著减弱;CG-2、CG-3、CG-5、CG-7、CG-10、CG-11转化子的菌丝生长速率显著下降,对应CG-2、CG-3及CG-11致病力下降,但CG-5、CG-10转化子致病力差异不显著,CG-7转化子致病力反而增强,说明菌株致病性不仅与菌丝生长速率相关,还与产孢率、孢子萌发率、附着胞的形成等多因素综合关联,该现象与苹果胶孢炭疽病菌转化研究一致[14]。后续可进一步扩大猕猴桃胶孢炭疽病菌的转化子库容量,结合转化子的生物学特性及致病性分析,定位克隆病菌关键的生长发育及致病基因,为全面揭示其致病机理奠定基础。
4 结论
该研究首次建立了猕猴桃炭疽病菌的农杆菌介导遗传转化体系,为后续探索猕猴桃炭疽病菌功能基因组学研究奠定了技术基础。同时,获得了2株菌落形态、菌丝生长速率、分生孢子形态及致病力与野生型无明显差异且荧光稳定的转化子(CG-4、CG-9),为系统研究该菌的侵染定殖机理奠定了材料基础。此外,获得了9株菌落形态及致病力与野生型差异显著的突变体,可进一步用于开展关键致病基因验证。随着我国猕猴桃产业的迅猛发展、栽培面积急速增长,对炭疽病的研究需求也日益增加,该研究结果有助于尽快解析猕猴桃-胶孢炭疽病菌的分子互作机制,从而提高猕猴桃产业应对该病害的能力。

