两色金鸡菊中马里苷的肠道菌群代谢转化
石玉梦,杨佳璐,刘静,刘秀雪,霍栋娜,杨红霞,逄宇晴,陈晓鹏
(天津中医药大学中医药研究院,天津 301617)
黄酮类物质广泛地存在于食源性植物中,是存在于自然界中的重要天然有机化合物。富含黄酮类成分的膳食可调节多种生理过程,如细胞氧化还原电位、酶活性、细胞增殖和信号转导途径,其对预防慢性疾病、改善糖尿病和心脑血管疾病等有着一定积极作用。但由于黄酮类成分普遍口服生物利用度低[1],给其影响健康机制的研究带来了很大挑战。例如在水果和蔬菜中广泛分布的槲皮素与糖苷芦丁(槲皮素-3-O-芦丁)。越来越多的证据表明,槲皮素和芦丁具有良好的抗氧化、抗炎、抗癌、抗菌和神经保护等作用[2],但槲皮素和芦丁的水溶解度低,化学和代谢稳定性差,膜通透性受限使得它们在血浆中原型成分的含量极低[3]。由于黄酮类成分较好的生物活性,研究其在血清及组织中的存在形式及其代谢产物的情况一直是研究人员关注的热点[4],而肠道菌群正是黄酮类成分代谢的“主要器官”。肠道菌群是人和动物肠道内普遍存在且构成极为复杂的微生物群体,肠道代谢过程对人类健康有举足轻重的作用[5-7]。为了进一步探索成分与肠道之间的代谢关系,近年来建立了体外肠道菌孵育模型,其更方便对食品或药物的代谢条件进行控制,操作简便、花费时间较短且可以进行大量操作,排除了体内代谢研究法中浓度低、其它物质干扰较大、代谢产物不稳定的缺点[8]。
两色金鸡菊,又名昆仑雪菊(Coreopsis tinctoriaNutt.),为菊科金鸡菊属植物,始载于《新华本草纲要》,可作为药食两用类原料用于食品和药物的开发与应用[9]。两色金鸡菊在传统用途中主要作为茶饮起到清热毒,祛湿和降糖的作用[10]。在现代研究中其被证明具有多种促进人体健康的生物学活性,包括抗炎、抗氧化、抗菌、抗糖尿病和保护肝脏等,被认为是功能性食品[11,12]。两色金鸡菊中的主要活性成分为黄酮类化合物含量高达28.4%[13],其中马里苷(Marein,奥卡宁-4'-O-葡萄糖苷)为查尔酮主要的葡萄糖苷[14]。阿布拉等[16]研究表明马里苷可通过调控自噬保护db/db小鼠的心肌损伤等。Ma等[17]研究发现马里苷具有较强的α-葡萄糖苷酶抑制作用并且与其代谢产物奥卡宁被认为是有效的抗氧化剂。本课题组前期通过对大鼠口服马里苷后的血、尿、粪便进行检测,发现口服之后并未检测到原型成分,同时发现马里苷在体外肝微粒体孵育中稳定性良好,说明马里苷的主要代谢场所在胃肠道[18,19]。为了进一步研究黄酮类成分体内代谢转化规律,本实验以马里苷为例,从体外模拟胃肠道环境出发探索肠道菌群对马里苷的代谢规律,为阐明马里苷代谢过程和活性成分提供依据,为黄酮类成分的研究提供借鉴。
1 材料与方法
1.1 实验动物
雄性SD大鼠,180~200 g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2021-0008。SPF级动物实验室分笼饲养,自由摄食饮水。所有动物的实验研究均遵循《实验动物护理和使用指南》,并且经天津中医药大学动物伦理委员会批准,批号TCM-LAEC2021081。
1.2 试剂与药物
马里苷(批号:DST200311-132)、异绿原酸B(批号:DST200231-145)、奥卡宁(批号:DST191210-105)、黄诺马苷(批号:DST191102-240)、异奥卡宁(批号:DST200509-453)均购自成都德思特生物技术有限公司;脑心浸液肉汤,青岛高科技工业园海博生物技术有限公司;乙腈(色谱纯)、甲酸(色谱纯)、甲醇(色谱纯)均购自美国Fisher公司。
1.3 仪器与设备
Nexera超高效液相色谱仪系统,日本岛津公司;LCMS9030超高效液相色谱四极杆飞行时间质谱联用仪,日本岛津公司;超声波清洗机,天津知著科技有限公司;电子天平,瑞士METTLER TOLEDO;3K15型高速离心机,美国sigma公司;XW-80A型涡旋混合器,上海沪西分析仪器厂;高压灭菌锅,施都凯仪器设备有限公司;Milli-Q超纯水制备仪,Millipore公司;涡旋混合仪,美国Thermo Fisher Scientific公司;5424R低温高速离心机,德国Eppendorf公司。
1.4 马里苷在大鼠肠道菌培养液中的代谢
称取脑心浸液肉汤38.5 g,加热搅拌溶解于1000 mL蒸馏水中,121 ℃高压灭菌15 min,制备厌氧培养液。采集正常大鼠新鲜粪便样品,立刻与0.9%(m/V)氯化钠水溶液按比例1:4(g/mL)混合,涡旋,制成混悬液,在2 h内使用,以确保肠道菌群活性。粪便悬液静置分层10 min,所得上清液即为肠道菌液。取上清液(10 mL),按1:9(V/V)的比例,加入到90 mL厌氧培养液中,混匀得到肠菌孵育液。
实验分为给药组、空白组和对照组。取1 mL马里苷(1.3 mg/mL)加入5 mL肠菌孵育液中为给药组,5 mL肠菌孵育液(不含马里苷)为空白组,将马里苷加入5 mL厌氧培养液中为对照组。每组平行3份,将其放入厌氧培养袋中,加入厌氧产气袋后密封,于37 ℃恒温振荡器(150 r/min)中厌氧培养0、6、12、24、36 h。于各时间点取出样品1 mL,加入甲醇8 mL,涡旋振荡5 min,混匀,14000 r/min离心10 min,取上清液进样分析。
定性色谱质谱条件如下:色谱柱:Shim-pack GISS C18柱(100×2.1 mm,1.9 μm);流动相:A相0.1%甲酸水,B相乙腈,梯度洗脱,洗脱梯度为:0~1 min,5%~10% B;1~2 min,10% B;2~3 min,10%~15% B;3~5 min,15%~20% B;5~11 min,20%~40% B;11~13 min,40%~80% B;13~15 min,80%~95% B;15~17 min,95% B;17~20 min,5% B。流速:0.3 mL/min;柱温:40 ℃;进样量:2 μL。采用负离子模式监测的大气压电喷雾离子源(ESI-)进行质谱检测,ESI源温度设置为300 ℃,负(ESI-)电喷雾的接口电压为3.0 kV,雾化气流为3 L/min,加热气流为10 L/min,干燥气体流量为10 L/min。样品测定前,采用调谐液校准质量轴,MS Scan扫描为50~1000m/z,MS/MS为50~1000m/z。二级质谱碰撞能量(CE):(35±17)V。
1.5 对马里苷主要代谢产物进行含量测定
精密称取黄诺马苷、异奥卡宁、马里苷、异绿原酸B、奥卡宁对照品适量,加甲醇溶解并稀释,得到质量浓度分别为50、30、50、30、50 µg/mL的混合对照品溶液,于-20 ℃保存备用。分别配制空白孵育液、对照品溶液、含药孵育6 h的孵育液,同1.4样品处理方法,通过其色谱图,观察待测组分出峰位置,及空白孵育液中的内源性成分是否存在干扰。分别精密量取一定量的黄诺马苷、异奥卡宁、马里苷、异绿原酸B、奥卡宁对照品溶液,进行倍比稀释得到混合对照品系列溶液。取空白孵育液加入混合对照品系列溶液适量,按1.4样品处理方法操作后,依次进样,以浓度为横坐标,峰面积为纵坐标,得出标准曲线、回归方程及相关系数。取混合对照品溶液,按1.4样品处理操作得到供试品溶液,连续进样6次,选择3 d分别连续进样6次,计算日内、日间精密度。平行制备6份供试品溶液,进样测定,计算各个峰的保留时间、峰面积及RSD,考察其重复性。称取已测定样品9份,分为3组,每组3份,每组按1:0.8、1:1及1:1.2的比例分别加入对照品黄诺马苷、异奥卡宁、马里苷、异绿原酸B、奥卡宁,进样并记录峰面积,计算加样回收率。取混合对照品溶液,按1.4样品处理方法操作得到供试品溶液。在 0、2、4、8、12、24 h分别进样并计算各个峰的保留时间、峰面积及RSD,考察其稳定性。
定量色谱条件如下:色谱柱:Shim-pack GISS C18柱(100 mm×2.1 mm,1.9 μm);流动相:A相0.1%甲酸水,B相乙腈,梯度洗脱,洗脱梯度为:0~1 min,5%~10% B;1~2 min,10% B;2~3 min,10%~15% B;3~5 min,15%~20% B;5~11 min,20%~40% B;11~13 min,40%~80% B;13~15 min,80%~95% B;15~17 min,95% B;17~20 min,5% B。流速:0.3 mL/min;柱温:40 ℃;紫外波长:305 nm;进样量:2 μL。
1.6 数据分析
原始数据使用Labsolutions工作站处理;化合物结构碎片与成分预测使用Formula Predictor Server分析软件;代谢产物的含量测定数据处理使用Excel 2019。
2 结果与讨论
2.1 马里苷在大鼠肠道菌培养液中代谢产物的分析
将马里苷在正常大鼠肠道菌培养液分别在0、6、12、24、36 h下的样品在UHPLC-Q-TOF-MS/MS中进样分析,根据产物的相对分子质量、二级碎片、保留时间及与标准品对照确定其成分。通过与空白组比较,在肠道菌群培养液中共检测到11种代谢产物如表1,代谢产物提取色谱图如图1。在反应开始时可以检测到马里苷原型以及M2~M6,在6 h、12 h、24 h的样品中检测到了M7~M12,在孵育36 h的样品中检测到了M7、M9、M11、M12。

图1 马里苷代谢产物提取色谱图Fig.1 Chromatogram of marein metabolites extraction
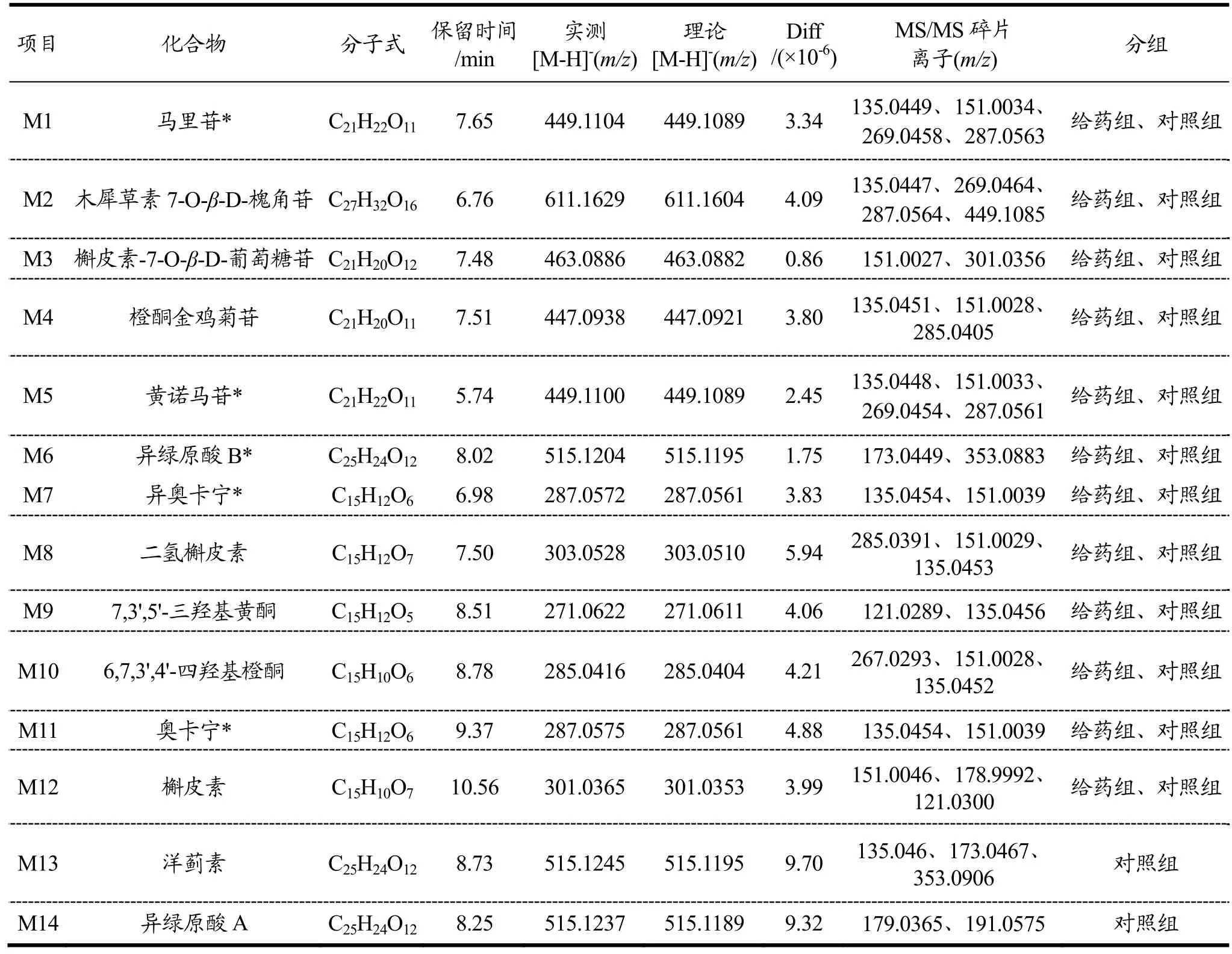
表1 基于UPLC-Q-TOF-MS/MS鉴定马里苷在给药组及对照组转化的代谢产物Table 1 Identification of metabolites transformed by marein in the administration group and control group based on UPLC-Q-TOF-MS/MS
M1(tR=7.65 min)在负离子模式下的准分子离子峰为[M-H]-m/z449.1104。其二级碎片离子m/z287.0563、269.0458、151.0034、135.0449与马里苷的裂解规律完全一致,与标品对照鉴定为马里苷。M2(tR=6.76 min)在负离子模式下的准分子离子峰为[M-H]-m/z611.1629。根据Formula Predictor Server预测,该化合物分子式为C27H32O16。根据二级碎片离子m/z449.1085 [M-H-Glu]-,287.0564 [M-H-2Glu]-,269.0464[M-H-2Glu-H2O]-,135.0447 [M-H-2Glu-H2O-C8H6O-O]-,推测M2为木犀草素7-O-β-D-槐角苷。M3(tR=7.48 min)在负离子模式下的准分子离子峰为[M-H]-m/z463.0886。根据Formula Predictor Server预测,该化合物分子式为C21H20O12。根据二级碎片离子m/z301.0356[M-H-Glu]-,151.0027 [M-H-Glu-H2O-C8H6O3]-。结合参考文献[20],推测M3为槲皮素-7-O-β-D-吡喃葡萄糖苷。M4(tR=7.51 min)在负离子模式下的准分子离子峰为[M-H]-m/z447.0938。根据Formula Predictor Server预测,该化合物分子式为C21H20O11。其二级碎片离子有m/z285.0405 [M-H-Glu]-,151.0028[M-H-Glu-C8H6O2]-,135.0451 [M-H-Glu-C8H6O2-O]-。推测M4为橙酮金鸡菊苷。M5(tR=5.74 min)在负离子模式下的准分子离子峰为[M-H]-m/z449.1100。其二级碎片离子m/z287.0561、269.0454、151.0033、135.0448与马里苷的裂解规律完全一致,但其保留时间与马里苷存在差异,经与标品对照后鉴定为黄诺马苷。M6 (tR=8.642 min)在负离子模式下的准分子离子峰为[M-H]-m/z515.1204。根据Formula Predictor Server预测,该化合物分子式为C25H24O12。其二级碎片离子主要有m/z353.0883 [M-H-C9H6O3]-,173.0449[M-H-2C9H6O3]-。对比对照品鉴定M6为异绿原酸B。M7(tR=6.98 min)在负离子模式下的准分子离子峰为[M-H]-m/z287.0572。根据Formula Predictor Server预测,该化合物分子式为C15H12O6。根据二级碎片离子m/z151.0039 [M-H-H2O-C8H6O]-,135.0454[M-H-H2O-C8H6O-O]-,并与标准品对照M7为异奥卡宁。M8(tR=7.50 min)在负离子模式下的准分子离子峰为[M-H]-m/z303.0528。根据Formula Predictor Server预测,该化合物分子式为C15H12O7。产生的二级碎片离子有m/z285.0391 [M-H-H2O]-,151.0029[M-H-H2O-C8H6O2]-,135.0453 [M-H-H2O-C8H6O2-O]-,结和文献参考[21]推测M8为二氢槲皮素。M9(tR=8.51 min)在负离子模式下的准分子离子峰为[M-H]-m/z271.0622。根据Formula Predictor Server预测,该化合物分子式为C15H12O5。根据其二级碎片离子m/z135.0456 [M-H-C8H8O2]-、121.0289[M-H-C8H8O2-CO]-,推测M9为7,3',5'-三羟基黄酮。M10(tR=8.78 min)在负离子模式下的准分子离子峰为[M-H]-m/z285.0416。根据Formula Predictor Server预测,该化合物分子式为C15H10O6。二级扫描裂解产生特征离子碎片m/z267.0293 [M-H-H2O]-,151.0028[M-H-C8H6O2]-,135.0452 [M-H-C8H6O2-O]-。推测该化合物26为6,7,3',4'-四羟基橙酮。
M11(tR=9.37 min)在负离子模式下的准分子离子峰为[M-H]-m/z287.0575。根据Formula Predictor Server预测,该化合物分子式为C15H12O6。其二级碎片离子主要有m/z151.0039 [M-H-H2O-C8H6O]-、135.0454 [M-H-H2O-C8H6O-O]-。所以认为M11为奥卡宁。M12(tR=10.56 min)在负离子模式下的准分子离子峰为[M-H]-m/z301.0365。根据Formula Predictor Server预测,该化合物分子式为C25H10O7。其二级碎片离子主要有m/z178.9992、151.0046、121.0300,符合槲皮素的裂解规律[22],故将M12鉴定为槲皮素。
Wu等[23]研究发现红花中羟基红花黄色素A(查尔酮苷类)的主要代谢途径有脱水、脱氢、羟基化、甲基化、葡萄糖醛酸化等。本实验中通过代谢产物推测同为查尔酮苷的马里苷的主要代谢途径也有脱氢、羟基化、甲基化、葡萄糖醛酸化,此外还有异构化、环裂解和乙酰化。对实验结果进行分析还发现在反应起始时肠菌液中除马里苷原型成分外还有黄诺马苷、木犀草素7-O-β-D-槐角苷、槲皮素-7-O-β-D-葡萄糖苷、橙酮金鸡菊苷、异绿原酸B五种代谢产物。说明马里苷在与厌氧培养液和肠道菌孵育液这类含有营养物质的培养液接触之后十分不稳定,容易发生异构化、糖苷化、葡萄糖醛酸等反应。但是不难发现,在反应起始时样品中存在的都时含有糖基的化合物。孵育6 h后在大鼠肠道菌孵育液中已经检测不到原型成分。在孵育6、12、24 h的样品中检测到了异奥卡宁、二氢槲皮素、7,3',5'-三羟基黄酮、6,7,3',4'-四羟基橙酮、奥卡宁、槲皮素。在孵育36 h的样品中检测到了异奥卡宁、7,3',5'-三羟基黄酮、奥卡宁、槲皮素。在肠道菌的作用下,马里苷及其黄酮苷类代谢产物被代谢为各种苷元。
2.2 马里苷在空白孵育液中代谢产物的分析
在不加肠菌的对照组中共检测到13种代谢产物,其中包含11种为与2.1中重合的代谢产物,M13、M14为差异代谢产物如表1,代谢产物提取色谱图如图1。M13(tR=8.73 min)在负离子模式下的准分子离子峰为[M-H]-m/z515.1245。根据Formula Predictor Server预测,该化合物分子式为C25H24O12。其二级碎片离子主要有m/z353.0906 [M-H-C9H6O3]-,173.0467[M-H-2C9H6O3]-,135.046 [M-H-2C9H6O3-H2O-CO]-。推测该M13为洋蓟素。M14(tR=8.25 min)在负离子模式下的准分子离子峰为[M-H]-m/z515.1237。根据Formula Predictor Server预测,该化合物分子式为C25H24O12。其二级碎片离子主要有m/z191.0575[M-H-2C9H6O3]-,179.0365 [M-H-C9H6O3-C10H6O3]-。推测其是与M13为同分异构体的异绿原酸A[24]。
2.3 马里苷主要代谢产物的含量测定结果
2.3.1 含量测定的方法学考察
空白孵育液、对照品溶液、含药孵育6 h的孵育液的色谱图如图2所示。空白孵育液中的内源性成分对待测成分不存在干扰。该色谱条件下待测物专属性良好。肠菌培养液中黄诺马苷、异奥卡宁、马里苷、异绿原酸B、奥卡宁的标准曲线、回归方程、相关系数、定量限及检测限结果如表2。结果表明各成分线性关系良好。日内精密度考察中各峰的保留时间RSD≤0.13%,峰面积RSD≤1.63%,日间精密度考察中各峰的保留时间RSD≤1.21%,峰面积RSD≤2.83%,表明该仪器的精密度良好。重复性考察中各峰的保留时间RSD≤0.08%,峰面积RSD≤1.58%,表明该方法的重复性良好。加样回收率实验结果如表3,结果表示各组加样回收率均在98.49%~102.15%之间,RSD≤3.11%,说明该方法加样回收率合格,所测定的含量测定方法准确度良好。稳定性考察中各峰的保留时间RSD≤1.02%,峰面积RSD≤1.08%,表明供试品溶液在24 h内的稳定性良好。
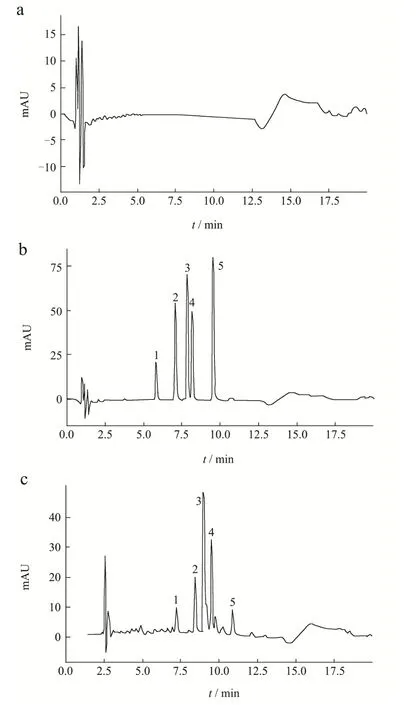
图2 专属性色谱图Fig.2 Specific chromatogram
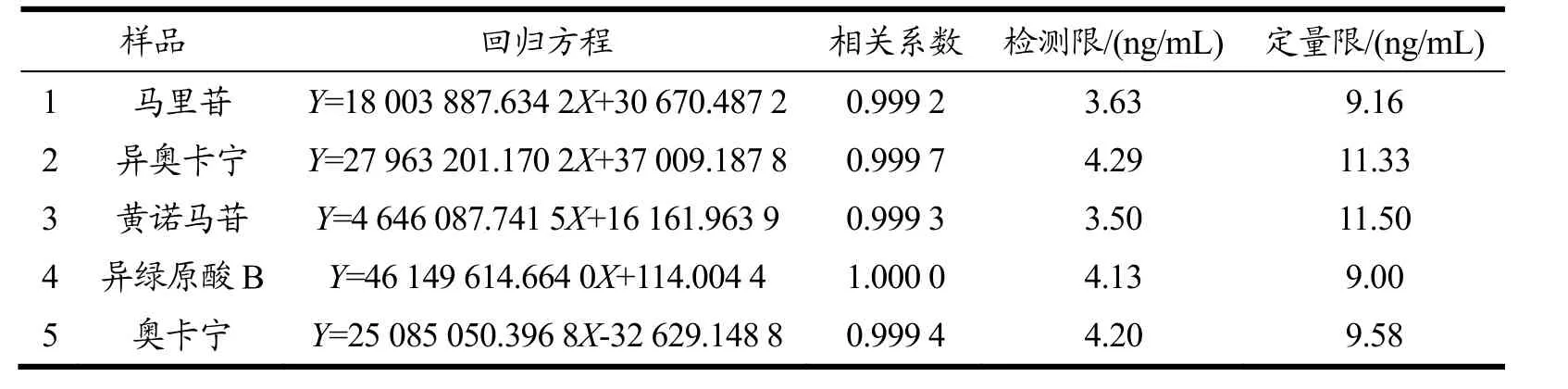
表2 马里苷在大鼠肠道菌培养液主要代谢产物的回归方程及相关系数Table 2 Regression equation and correlation coefficient of main metabolites of marein in rat intestinal bacteria culture medium
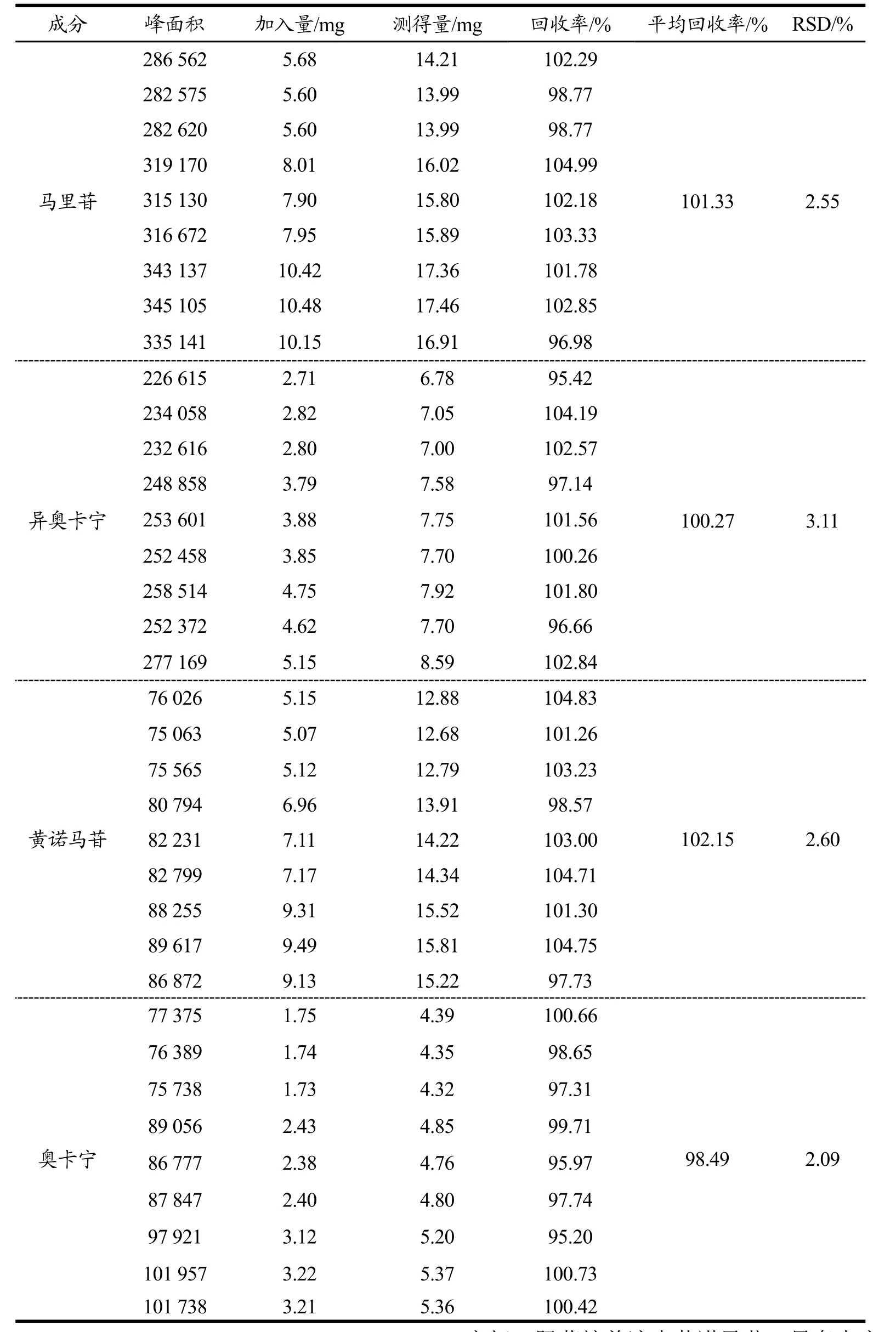
表3 加样回收率试验结果Table 3 Results of sample adding recovery rate
2.3.2 马里苷主要代谢产物的含量测定结果
由于马里苷肠道菌代谢产物和降解产物有一定的重合,为进一步研究肠道菌的代谢作用,选取了变化明显、含量可测的4种代谢产物进行定量研究。如表4、表5所示,利用得到的标准曲线计算给药组与对照组中马里苷、黄诺马苷、异奥卡宁、异绿原酸B、奥卡宁不同时间段的含量。

表4 马里苷在大鼠肠道菌培养液中主要代谢产物含量Table 4 Content of main metabolites of marein in intestinal bacteria culture medium of rats (ng/mL, mean±SD, n=3)

表5 马里苷在空白培养液中主要代谢产物含量Table 5 Content of main metabolites of marein in blank culture medium (ng/mL, mean±SD, n=3)
黄酮类物质在体内代谢主要通过肠道与肝脏两个部位。在胃肠道主要经过肠道菌群中的特异性糖苷酶水解、代谢反应形成相应黄酮苷或黄酮苷元,随即进入血液或肝脏进行代谢。肠道菌群是肠道复杂的生态系统中的微生物群落,它与宿主之间有着密不可分的互惠关系[25]。肠道菌群里含有许许多多不同类型的酶[26],黄酮苷类物质进入胃肠道后,其中的大多数会经肠道菌群中的特异性糖苷酶从而代谢转化为苷元,黄酮苷元比黄酮苷更容易吸收[27]。一些强亲水性的黄酮苷类物质会在胃肠道中发生水解反应或者经代谢除去糖基变为苷元,并且苷元相比糖苷更具有亲脂性,苷元可以以被动扩散的形式穿过肠粘膜细胞然后再进入血液循环[28]。马里苷有着结构不稳定的特点,容易与其互为同分异构体的黄诺马苷发生转化。肉苁蓉中的松果苷[29]以及莱菔子中的萝卜苷[30]也有类似特性,它们在甲醇溶液中就容易发甲基化和顺式/反式异构化的转化。从含量结果来看,马里苷在肠菌培养液与厌氧培养液中均快速发生了异构化、葡萄糖醛酸化反应。将两组的结果比较发现,反应进行到6 h时,马里苷和黄诺马苷两个黄酮苷在含有大鼠肠道菌的培养液中已经检测不到,而在不含大鼠肠道菌的空白培养液中仍能被检测到。在反应进行到12 h时,在大鼠肠道菌培养液中仅能检测到异奥卡宁和奥卡宁两个苷元,而在不含大鼠肠道菌的培养液中仍能检测到马里苷、黄诺马苷以及异绿原酸B这三种含有糖基的化合物。比较两组奥卡宁的含量,发现在含有肠道菌的培养液中奥卡宁出现的时间点提前,并且奥卡宁的含量在6~36 h为7.99~1.39 ng/mL先高后低,说明肠道菌加快了马里苷的代谢转化并且可能促进了其代谢产物奥卡宁的消化吸收。从异奥卡宁的含量变化上看能发现同样的规律,空白培养液中异奥卡宁的含量在12~36 h始终高于其在大鼠肠道菌培养液中的含量。
Yang等[31]在研究人肠道菌对芦丁代谢的影响中发现肠道菌种产生的鼠李糖苷酶可以将芦丁水解代谢为槲皮素-3-O-葡萄糖苷,此后又进一步被其它菌属代谢为苷元白矢车菊素。在本研究中通过代谢产物在肠菌液中出现的时间顺序来看,马里苷及其异构化产物黄诺马苷首先也是发生了水解反应。同时结合代谢产物的结构特点和含量变化趋势,推测马里苷的代谢途径如图3所示。
3 结论
本研究从肠道菌群代谢的角度模拟胃肠道体外代谢环境,在马里苷大鼠肠道菌群孵育的实验中共鉴定了11种代谢产物。马里苷在代谢过程中主要发生了异构化、葡萄糖醛酸化、环裂解、羟基化、脱氢、乙酰化等反应。综合定性结果以及对原型成分和部分代谢产物的定量结果来看,马里苷在肠道菌的作用下,6 h就已检测不到原型成分,6 h之后黄诺马苷以及异绿原酸B等糖苷也已经检测不到,而在6 h~24 h异奥卡宁、奥卡宁等由马里苷代谢产生的苷元含量经历了先增多后减少的过程。马里苷虽结构不稳定易发生异构化等反应,但并不会因此而脱糖水解。但在有肠道菌作用的情况下,马里苷会迅速脱糖,其代谢产物朝着结构更为稳定更易吸收的苷元方向发展并且代谢速度会加快,说明马里苷在胃肠道的代谢十分活跃。此次研究成果为两色金鸡菊的物质作用基础提供了科学依据,也为诸如绿茶、橘皮、大豆等富含黄酮具有保健作用的食品,提供了更好的研究思路。

