乳铁蛋白对肠道屏障保护作用的研究进展
吴洪亚,高亚男,王加启,郑楠
(中国农业科学院北京畜牧兽医研究所,农业农村部奶及奶制品质量安全控制重点实验室,农业农村部奶产品质量安全风险评估实验室(北京),北京 100193)
肠道是人体主要的消化器官,具有双重作用,一方面参与对营养物质的吸收和转运,维持机体健康,另一方面也能抵抗有害物质进入机体后造成的损伤和功能障碍[1]。肠道屏障系统包括肠上皮细胞和紧密连接在内的物理屏障,以免疫细胞和细胞因子为主的免疫屏障,以肠道菌群为主的生物屏障和以黏蛋白和抗菌肽为主的化学屏障。研究发现,由于应激、感染和病原体入侵等引起的肠道屏障功能失调与多种疾病有关,如炎症性肠病、肠应激综合症、腹腔疾病和糖尿病等[2,3]。近年来,有逐步增多的利用乳铁蛋白等天然产物达到保护肠道屏障的研究[4-6]。
乳铁蛋白(Lactoferrin,LF)是一种非血红素铁结合糖蛋白,属于转铁蛋白家族,存在于包括乳汁、唾液和精液等生物体液中[7],作为食源性天然产物,具有多种生物学活性。近年来研究发现LF通过修复肠黏膜、增强免疫功能以及调节肠道菌群等来维护肠道健康,对肠道物理、免疫、生物和化学屏障均有一定的保护作用。因此,本文基于最新的研究成果,主要对LF的生物学特性,LF对肠道屏障的作用和机制以及LF的应用进行了综述。
1 乳铁蛋白的生物学特性
1.1 乳铁蛋白的分布
LF广泛存在于人乳和牛乳中,其中人初乳中含量高达5 g/L,牛初乳中含量为1~3 g/L。随着泌乳时间的延长,哺乳动物合成LF的能力逐渐减弱,在成熟母乳中含量约为2~3 g/L,成熟牛乳中含量仅为0.03~0.49 g/L[8]。LF在猪、马、山羊和兔子等乳中的含量较人乳和牛乳低的多。此外,哺乳动物的唾液、泪液、精液、血液、胆汁和滑液等体液中同样存在LF,但其含量甚微[9]。
1.2 乳铁蛋白的结构
LF分子量约为80 ku,是由690个左右的氨基酸残基组成的单一多肽链。目前来源于人、鼠、牛、马、猪、山羊、绵羊、水牛和骆驼乳中的LF氨基酸序列已被报道,其中牛乳LF含有703个氨基酸残基,与人乳中的氨基酸序列具有高达69%的同源性[10]。LF的单一多肽链折叠成两个基本对称且高度同源的结构域(N端结构域和C端结构域),每个结构域分别包含两个亚结构域,即N-1、N-2、C-1、C-2,铁离子的结合位点位于每个结构域间缝隙内(图1)[11]。每个LF可结合两分子Fe3+和两分子HCO3-或者CO32-。根据结构上铁结合量的不同(2个、1个或无铁离子),LF理论上分为完全饱和型LF(holo-LF)、不完全饱和型LF(single-LF)和缺铁型LF(apo-LF)三类,含铁量的不同,往往会影响其三维空间结构、生物学功能和热稳定性。

图1 乳铁蛋白的三维结构图Fig.1 Three-dimensional structure of lactoferrin
1.3 乳铁蛋白的生物学功能
LF具有多种生理功能,如参与机体铁代谢[12]、广谱抗菌[13]、抗病毒[14]、抗寄生虫活性[15]、调节机体免疫力[16]等。LF还能螯合易引起氧化损伤的Fe3+,发挥抗氧化作用[17]。LF对成骨同样具有重要作用,可以防止骨质流失,增强骨密度和骨强度[18]。此外,LF是一种具有实用价值的抗肿瘤药物,可以作为抗肿瘤药物治疗多种肿瘤,还可以作为免疫调节剂应用于肿瘤的辅助治疗。除对肿瘤有作用外,对糖尿病、心血管疾病等代谢紊乱的疾病也有一定的预防作用[19,20]。除了以上提到的生物学功能外,有大量研究报道,LF可通过调节肠上皮细胞的增殖和分化、显著促进肠道中益生菌和常驻共生菌的生长等途径促进肠道健康[21,22]。
2 乳铁蛋白对肠道屏障的作用
LF对肠道屏障的作用主要体现在以下几个方面:通过促进肠上皮细胞增殖、提高紧密连接蛋白的表达、改善肠道组织形态修复受损后的肠道物理屏障;通过激活肠道免疫细胞、调节细胞因子的分泌发挥对肠道免疫屏障的保护作用;通过正向调控肠道菌群的分布保护肠道生物屏障;通过增强黏蛋白表达以及调节抗菌肽的分泌来发挥对肠道化学屏障的保护作用。
2.1 乳铁蛋白对肠道物理屏障的作用
如图2所示,物理屏障受损后,LF可从以下三个方面发挥对物理屏障的保护作用,分别为①促进肠上皮细胞增殖;②提高紧密连接蛋白的表达,修复紧密连接;③改善肠道组织形态,提高绒毛高度和隐窝深度的比值。
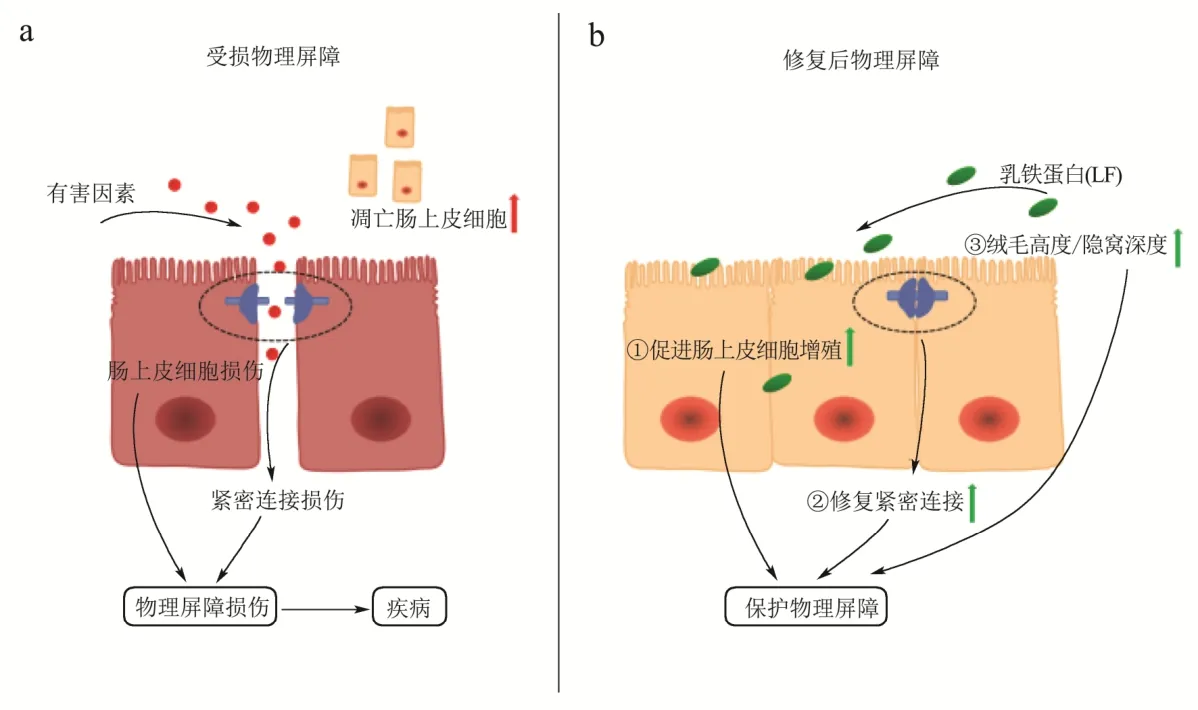
图2 受损肠道物理屏障(a)和乳铁蛋白修复后的肠道物理屏障(b)Fig.2 Damaged intestinal physical barrier (a) and intestinal physical barrier after lactoferrin repair (b)
2.1.1 肠道物理屏障的结构功能
肠道物理屏障由单层柱状上皮细胞以及上皮细胞之间的多蛋白复合物—紧密连接组成,它们位于细胞旁间隙的顶端区域,控制分子通过跨细胞和细胞旁途径的运输,是肠道抵御外来污染的第一道屏障[23]。各种危害因子都会影响肠道物理屏障的维持,一旦其功能失调或“渗漏”,内毒素和细菌等有害物质就会渗透到血流中,对机体造成严重伤害,甚至会引起疾病[24]。其中,肠上皮细胞(Intestinal Epithelial Cells,IECs)在食物消化、营养吸收(如离子、水、糖、肽和脂质)、保护人体免受微生物感染等方面发挥重要作用[25]。细胞旁的空隙被紧密连接(Tight Junction,TJ)所封闭,由复杂的蛋白质相互作用网络维持[26]。TJ是调节物理屏障的关键,由不同的连接分子组成,如跨膜蛋白(闭合蛋白Claudin、咬合蛋白Occludin和连接黏附分子)以及细胞质支架蛋白(闭合小环蛋白,Zonula Occludens,Zos),调节相邻细胞中水、离子和大分子的细胞旁通透性,其功能障碍与多种局部和全身疾病有关[27]。
2.1.2 乳铁蛋白促进肠上皮细胞增殖
肠上皮是人体最大的黏膜表面,覆盖约400 m2的表面积,单层细胞组织成隐窝和绒毛。在黏液层下方,IECs形成了连续的物理屏障,保护宿主免受感染和持续暴露于潜在的炎症刺激。Caco-2细胞源自于人结肠癌细胞系,其表现出许多与小肠上皮细胞相似的特性,具有微绒毛结构、刷状边缘以及细胞间紧密连接等,是目前应用最广泛、最经典的模型之一。研究发现,牛LF和人LF均能促进体外Caco-2细胞增殖,这可能归因于细胞凋亡的减少[28]。凋亡被发现与自噬密切相关,过度自噬会导致细胞凋亡的增加。LF可通过抑制过度自噬减少黄曲霉毒素诱导的IECs凋亡,具体表现在caspase-3、caspase-9等凋亡蛋白的表达量降低[29]。此外,LF可以通过减少丝裂原活化蛋白激酶途径介导的氧化应激来减轻IECs的细胞毒性和DNA损伤[30]。Nguyen等[31]发现,相比于高剂量(10 g/L)的LF,低剂量(0.1~1 g/L)的LF可以更好地发挥有益作用,上调参与糖酵解、能量代谢和蛋白质合成的丙酮酸激酶、丙酮酸羧化酶和丙酮酸脱氢酶的表达,促进能量产生并有助于IECs增殖,这表明可能存在最佳的LF浓度。在鲜牛奶中提取纯化的LF主要呈apo形式,具有高度的铁结合能力,可以与人IECs结合并内化[32],且apo-LF可以激活细胞增殖的主要途径,即ERK1/2信号通路与PI3K/Akt信号通路[33]。
2.1.3 乳铁蛋白提高紧密连接蛋白的表达
TJ在靠近顶端表面的相邻上皮细胞之间形成一条连续的包围带,使相邻的细胞紧密贴合在一起,形成细胞间天然的物理屏障,防止微生物和其他抗原在上皮细胞旁扩散。研究表明,肠内补充LF可以上调TJ蛋白Occludin和Claudin-4的表达,降低肠道通透性,从而保持肠道完整性[34]。此外,猪LF衍生肽LFP-20降低MyD88和AKT水平,抑制NF-κB信号通路,调节脂多糖(Lipopolysaccharide,LPS)刺激过程中TJ蛋白闭合小环蛋白1(Zonula Occludens 1,ZO-1)、Occludin和Claudin-1的表达,可以用作保护肠道屏障功能的预防剂[35]。在大鼠小肠隐窝上皮细胞IEC-6中,艰难梭菌毒素B导致TJ蛋白线性结构断裂明显,荧光显微镜下可见断续的线状片段,少见完整的网状结构,LF使TJ蛋白结构恢复完整,显微镜下呈连续的线状带分布[36]。
跨上皮电阻值(Trans-Epithelial Electrical Resistance,TEER)和细胞旁通透性通常被用来量化描述TJ的变化[37]。目前这部分的研究多集中于体外Caco-2细胞模型。Hirotani等研究发现,400 μg/mL和1000 μg/mL的LF显著抑制LPS诱导的Caco-2细胞层TEER降低与细胞单层通透性的增强[38]。与泌乳中期牛LF相比,泌乳早期牛LF可增加Caco-2细胞层的TEER,这也与促炎细胞因子白细胞介素(Interleukin,IL)-8的减少相关[39]。Gao等[40]研究发现,黄曲霉毒素M1诱导Caco-2细胞旁通透性增加,100 μg/mL的LF预处理后,显著抑制细胞旁通透性的增加,改善肠屏障功能。
2.1.4 乳铁蛋白改善肠道组织形态
小肠上皮是由数百万个隐窝-绒毛结构组成的,绒毛是肠黏膜皱襞的指状突起,周围有称为隐窝的多处内陷[41]。肠绒毛高度、隐窝深度以及两者的比值是衡量机体消化吸收功能的重要指标。其中绒毛高度与细胞数量呈显著相关性,绒毛变高时,肠上皮成熟细胞数量增加,与营养物质的接触和吸收面积增大,对养分的吸收能力增强。而隐窝深度的增加会减弱营养物质的吸收能力[42]。相关研究表明,补充牛LF增加了小鼠空肠绒毛高度以及几种肠刷状缘膜酶活性的表达[28]。出生后14 d饲喂含有牛LF配方奶的仔猪,其空肠隐窝细胞显著增殖[43]。此外,绒毛高度和隐窝深度的比值(V/C)综合反映了小肠的功能状态,比值下降表明黏膜受损,消化吸收能力下降。在断奶仔猪饲粮中添加250 mg/kg和500 mg/kg LF,十二指肠、空肠和回肠的V/C显著增加[44]。
2.2 乳铁蛋白对肠道免疫屏障的作用
LF发挥肠道免疫屏障的保护作用离不开其对免疫细胞和细胞因子的调节(图3),具体的作用机制如下所述。

图3 乳铁蛋白发挥肠道免疫屏障保护作用的机制图Fig.3 Mechanism diagram of lactoferrin exerting the protective effect of intestinal immune barrier
2.2.1 肠道免疫屏障的结构功能
肠道被认为是人体内重要的免疫器官,肠道免疫屏障主要由肠道浆膜层免疫细胞与免疫细胞因子组成,可通过参与自然免疫和适应性免疫来维持局部和系统内稳态。其中,免疫细胞是免疫系统中的“看门人”,对于启动预防感染的保护性反应非常重要,主要包括T淋巴细胞、B淋巴细胞、巨噬细胞、树突状细胞(Dendritic Cell,DC)、自然杀伤细胞和浆细胞等[45]。其中T淋巴细胞可分为CD4+T细胞和CD8+T细胞,介导病原体清除[46],CD4+T细胞因功能的不同,又可以分为Th1、Th2、Th3、Treg、Tr1、Tfh、Th17、Th9和Th22等Th细胞亚群,这些细胞具有独特的发育和调节途径,在免疫和免疫介导的病理中发挥着独特的作用[47]。除T细胞外,B细胞同样是适应性免疫系统的重要组成部分,其数量可以反映黏膜体液免疫的状态,在免疫系统中执行多重功能,包括递呈抗原,分泌抗体和各种细胞因子等[48]。此外,细胞因子被认为在免疫系统中起着决定和调节作用,可以结合相应的受体调节细胞的增殖和分化,促进或抑制炎症反应[49]。
2.2.2 乳铁蛋白激活肠道免疫细胞
受LF影响的主要免疫细胞群体为T细胞、B细胞和抗原呈递细胞(Antigen-Presenting Cells,APC),LF与免疫细胞之间的相互作用会对Th1和Th2反应、细胞因子微环境和体液反应的平衡产生显著影响[50]。研究发现,口服LF与不同小鼠小肠固有层中CD4+T细胞、CD8+T细胞和IgM+B细胞、IgA+B细胞增加有关,而结肠中仅有CD8+T细胞显著增加[51,52],表明小鼠LF处理对每个区域的影响不同。Wei等[53]研究发现,LF基因敲除小鼠的B细胞呈现早期发育障碍,其早期分化相关转录因子表达异常,同时还发现LF缺失会加剧B细胞相关疾病的病情,相应的补充LF具有减弱病症的疗效。APC,即单核细胞/巨噬细胞、DC等,对于维持组织稳态和对病原体的先天反应以及将先天免疫应答与适应性免疫应答联系起来至关重要。在LF的介导作用下,单核细胞在分化为DC的过程中触发耐受性程序,产生调节性细胞因子,抑制T细胞增殖,从而阻止了炎症反应,发挥强大的抗炎活性[54]。
2.2.3 乳铁蛋白调节细胞因子的分泌
细胞因子在肠道免疫系统中发挥着重要作用,其中一部分具有抗炎作用,如IL-4和IL-10等,而另一部分则具有促炎作用,如肿瘤坏死因子(Tumor Necrosis Factor,TNF)-α、IL-6、IL-8和IL-1β等,多个体内和体外研究报告了LF对其表达的控制。TNF-α是炎症性肠病和肠屏障功能障碍的诱发剂,已知它会引起细胞外凋亡,影响TJ结构,改变Claudin蛋白表达和亚细胞定位。Hering等[55]利用两种不同的体外肠道细胞模型证明了在TNF-α诱导的屏障功能扰乱期间,牛LF的屏障保护作用,包括恢复其TEER以及TJ蛋白的表达量。Hu等[56]研究发现,在猪体外IPEC-J2细胞(小肠上皮细胞)模型中,LPS处理诱导IL-1β、IL-8与TNF-α的分泌,降低IL-10的表达量,增加细胞通透性,并增强活性氧的产生。LF处理显著逆转上述趋势,可通过减弱NF-κB/MAPK途径维持肠道屏障完整性,缓解LPS诱导的炎症反应。在大鼠小肠隐窝上皮细胞IEC-6与人Caco-2细胞中同样发现了上述现象[57,58]。此外有研究表明,不同浓度的LF具有不同的炎症反应。低剂量LF通过细胞外信号调节激酶促进细胞增殖,限制IL-8分泌并阻止NF-κB和HIF1a活化,发挥抗炎作用,缓解患坏死性小肠结肠炎的猪的疾病程度,而高剂量LF则呈现相反的作用。推测可能是因为低剂量LF更有利于未成熟肠道发挥LF-LPS结合作用(LF-LPS复合物对许多病原体具有杀菌活性),并限制过量未结合的LF刺激不必要的免疫反应[59]。
2.3 乳铁蛋白对肠道生物屏障的作用
2.3.1 肠道生物屏障的结构功能
微生物遍布人体,主要分布在外表面和内表面,包括胃肠道、皮肤、唾液、口腔黏膜和结膜[60]。最近的一项研究估计,以年龄在20~30岁之间,体质量70 kg,身高170 cm的人作为参考,其体内的细菌总数为3.8×1013CFU[61],另外绝大多数细菌居住在结肠中,估计约有1014种[62]。肠道菌群形成了一种相互依赖并与其他微生物相互作用的微生物系统,其生态平衡形成了生物屏障,而共生微生物群和致病微生物群之间的不平衡容易引起肠道菌群的失调,导致感染以及各种代谢疾病。
2.3.2 乳铁蛋白正向调控肠道菌群的分布,保护生物屏障
LF通过破坏细胞膜的稳定性、螯合细菌所需要的三价铁、抑制微生物与宿主细胞的黏附和防止生物膜形成等机制具有广泛的抗菌活性。一系列体内和体外研究揭示LF可以正向调控肠道菌群的分布,发挥生物屏障保护作用(表1)。与喂养普通全脂牛奶相比,喂食含重组人LF的牛转基因奶的仔猪其十二指肠至结肠的微生物多样性呈增加趋势,结肠中沙门氏菌以及整个肠道中大肠杆菌的浓度降低,回肠中的双歧杆菌和整个肠道中的乳酸杆菌的浓度也随着人LF的增加而增加[63]。重组猪LF具有与上述同样的效果[64]。此外,无菌小鼠饮食牛奶中添加2%牛LF,可以显著抑制依赖碳水化合物的肠杆菌科的增殖[65]。体外研究发现,牛LF,尤其是apo-LF,对体外食源性病原体的生长具有抑制作用,对鼠李糖乳杆菌ATCC 7469、罗伊氏乳杆菌ATCC 23272、发酵乳杆菌ATCC 11739、棒状乳杆菌ATCC 25602、嗜酸乳杆菌BCRC 14065、婴儿双歧杆菌ATCC 15697、双歧杆菌ATCC 29521和乳酸片球菌ATCC 8081等8种益生菌菌株没有抑制作用,可能是因为益生菌的特殊细胞结构或代谢物质保护细胞免受牛LF的活性影响[66,67]。LF对大肠杆菌不仅具有重要的抑制和杀菌效果,还表现出强大的抗黏附作用,可以抑制大肠杆菌对肠道上皮细胞和肠黏膜的黏附作用[68]。此外,即使在pH值为2.5~3.5的酸性条件下,LF仍可对大肠杆菌和枯草芽孢杆菌发挥较好地杀灭作用[69]。以上提示我们LF或可作为潜在的益生元,正向调控肠道菌群的分布,为预防炎症性肠病和肠易激综合症等消化道疾病提供新的思路。

表1 乳铁蛋白对肠道生物屏障的影响Table 1 Effect of lactoferrin on intestinal biological barrier
2.4 乳铁蛋白对肠道化学屏障的作用
经一系列体内和体外研究证明(表2),乳铁蛋白主要通过增强黏蛋白表达以及调节抗菌肽的分泌来发挥对肠道化学屏障的保护作用。

表2 乳铁蛋白对肠道化学屏障的影响Table 2 Effect of lactoferrin on intestinal chemical barrier
2.4.1 肠道化学屏障的结构功能
肠道化学屏障主要指由肠黏膜上皮细胞分泌的抗菌相关蛋白质(如黏蛋白和抗菌肽)的黏液层,该黏液层厚且复杂,可防止肠道微生物与宿主肠上皮细胞的直接接触[70]。其中,黏蛋白是由一种特化的肠上皮细胞-杯状细胞分泌,覆盖于肠道表面黏液层,促进了肠道内容物的清除,隔离并控制肠道微生物的入侵和定植,对维持肠道内稳态具有关键作用。此外,为了应对病原菌、真菌和寄生虫等的挑战,潘氏细胞产生了多种抗菌蛋白,其具有广泛不同的一级序列并能快速杀死或灭活微生物[71]。
2.4.2 乳铁蛋白增强黏蛋白的表达
迄今为止,共鉴定出22种黏蛋白,主要分为两类:分泌性黏蛋白(MUC2、MUC5AC、MUC5B和MUC6等)以及跨膜黏蛋白(MUC1、MUC3A、MUC3B、MUC4、MUC12和MUC17等)[72]。
黏蛋白在正常组织内稳态中起着至关重要的作用,一旦异常表达就会导致慢性炎症,甚至癌症[73]。在小肠和大肠中,MUC2是杯状细胞合成和分泌的主要分泌性黏蛋白。此前一项研究发现,MUC2基因敲除小鼠在四周大时出现营养不良现象,微生物群落的丰度比正常小鼠更为复杂,且在第178天,出现慢性结肠炎、增生、腺瘤和腺癌,且结肠上皮细胞中促炎细胞因子显著增加[74]。Wang等[75]用右旋糖酐硫酸钠(DSS)构建小鼠结肠炎模型,牛LF进行干预,发现与单独DSS组相比,DSS与牛LF联合处理组中MUC2显著升高,表明牛LF可以促进结肠黏膜的修复。此外,赵方舟[76]对新生仔猪进行LF干预发现,其盲肠黏蛋白MUC1和MUC4的相对基因表达量显著提高,结肠黏蛋白MUC4的相对基因表达量同样出现了显著提高现象,在一定程度上提高了肠道化学屏障的防御功能。LF同样可以提高体外模型IPEC-J2细胞中目标基因MUC1、MUC4和MUC20的表达量,可能是通过MEK1/2和p38信号通路来发挥肠道屏障保护作用,维持肠道环境的稳定[77]。
2.4.3 乳铁蛋白调节抗菌肽分泌
抗菌肽具有抗菌和免疫调节特性,可保护肠道免受感染。目前关于LF影响肠道中抗菌肽分泌的报道并不多。相关研究发现,β-防御素2(HumanβDefensin 2,HBD-2)在细菌、TNF和LPS等刺激下,其表达量会显著增强。而在结肠炎小鼠模型中,牛LF可显著抑制HBD-2的表达[75]。王燕[78]通过体内仔猪饲养实验发现,LF可以提高抗菌肽(PMAP、Prophenin、PR-39和Protegrin-1)基因的表达,发挥屏障保护作用,在体外细胞实验中同样发现了上述结果。
3 乳铁蛋白的应用
肠道是一个复杂的环境,暴露于多种饮食成分。当前,人们越来越认识到饮食成分在基本营养之外发挥的各种有益作用,这也导致了功能性食品概念的发展。LF是最具特征的多功能生物活性蛋白,鉴于其对肠道健康和宿主的整体福祉产生的有益影响,已经在以下几个领域得到了广泛应用。
3.1 婴儿配方奶粉
母乳被公认为是婴儿的最佳营养来源,但是全世界仍有大部分婴儿接受部分或全部婴儿配方奶粉的喂养,对于无法母乳喂养的婴儿,进一步改善婴儿配方奶粉的成分就显得格外重要。同时,因母乳中LF含量明显高于牛乳,所以刺激了在以牛乳为基础的婴儿配方奶粉中添加牛LF的趋势。
LF对婴幼儿的健康益处被广泛熟知。一项前瞻性研究显示,在中国四川省成都市6家妇幼保健院随机选取260名4~6个月的婴儿(前期为纯母乳喂养),分别喂养含牛LF的强化配方奶粉和不含牛LF的强化奶粉。结果显示,在纯母乳喂养的婴儿中,摄入含牛LF的强化乳与更高的全身铁含量和更有效的肠道铁吸收有关[79]。同时,六项随机对照试验证明,LF对极低出生体重婴儿的坏死性小肠结肠炎II期或III期和迟发性败血症具有有益作用[80]。
LF在1939年首次分离得到,而第一款销售的含牛LF的婴儿配方奶粉可追溯到1986年[81]。2013年起实施的,中国国标GB 14880-2012《食品安全国家标准食品营养强化剂使用标准》已将LF列为营养强化剂,允许其添加在婴儿配方奶粉中,添加量应小于1.0 g/kg。遗憾的是,因LF分离纯化的难度以及价格高昂,中国近几年才开始逐渐在婴儿配方奶粉中添加LF。但随着市场的发展,相信LF的添加技术会越来越成熟。
3.2 食品添加剂
来自牛乳的LF为人类所使用的主要LF,已被美国食品药品监督管理局(FDA)指定为公认安全的食品添加剂。作为天然抗菌剂,LF可抑制食源性病原菌的生长,如肠出血性大肠埃希氏菌(O157:H7)[82]、沙门氏菌[83]、志贺氏菌等[84];作为保鲜剂,LF质量浓度超过3 mg/mL会令冷鲜肉表面呈现为亮红状态,提高其色泽及感官效果,其原因在于LF可以抑制氧合肌红蛋白的氧化速度,保护高铁肌红蛋白的还原系统,抑制丙二醛和硫代巴比妥酸的生成[85];作为乳化剂,LF与多酚生成的共价复合物可以提高β-胡萝卜素乳状液的稳定性[86];作为防腐剂,LF已被FDA批准用于新鲜肉类,可以有效防止微生物的生长,延长货架保质期[87]。
3.3 饲料添加剂
目前,传统抗生素在养殖业滥用造成的药物残留等问题已成为困扰全世界的难题。而LF因其强大的生物活性,被认为是一种极具开发潜力的绿色饲料添加剂。作为饲料添加剂,LF的优点主要包括以下几点:(1)耐热性良好,加工过程不易变性。牛LF的热变性温度为70 ℃,且加热后,其热稳定性高于山羊LF[88]。(2)提高饲养动物免疫力与身体机能。研究表明,市售的牛LF可作为有益的营养补充剂,支持健康羔羊的免疫系统,提高雏鸡的生产性能[89,90]。(3)增强饲养动物抗病能力。与其它的天然蛋白质和肽相比,牛LF对于牛病毒性腹泻的疗效最高,且在病毒感染的早期和整个过程中都有效[91]。这也给相关企业和技术人员以启示,如果能将LF广泛应用于动物饲养中,其带来的经济效益和市场价值将不容小觑。
4 结语
肠道是人体消化吸收的主要场所,每天摄入食物的99%靠肠道吸收。因此,一个完整的肠道屏障对肠道健康具有举足轻重的作用。肠道屏障功能出现异常会使不该进入体内的物质(如病原菌和毒素等)入侵,造成消化吸收功能紊乱,肠道内细菌、内毒素易位,促进感染发生,引发各种疾病。LF作为一种多功能生物活性蛋白,对保护肠道物理屏障、免疫屏障、生物屏障和化学屏障具有显著的效果。本文主要对乳铁蛋白作用于单独肠道屏障的作用进行了综述,但随着研究的进一步深入,不少研究者逐渐认识到,肠道四种屏障并不是单纯独立地存在于肠道中,而是互相影响,协同参与宿主免疫反应。目前关于LF对四种屏障发挥协同作用的相关研究还比较匮乏,这也提示我们未来或许需要更多的基础研究和临床研究来揭示此部分的作用机制。相信在LF活性功能的不断阐明以及生产纯化工艺逐渐成熟的背景下,LF将会进一步造福于食品加工业和畜牧业发展。

