物质结构与性质核心考点测试题(A 卷)
■江西师范大学附属中学 徐 丹
1.下列化学用语表示正确的是( )。
A.Al Cl3的价层电子对互斥模型:
C.H2O 分子的球棍模型:
D.基态Ni原子价电子排布式:3d10
2.下列说法正确的是( )。
A.铜或铜盐的焰色试验为绿色,该光谱是吸收光谱
B.电子云通常是用小黑点来表示电子的多少
C.d区元素的原子一定都有d轨道电子
D.22Ti的电子排布式1s22s22p63s23p10违反了能量最低原理
3.价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是( )。
A.SO3和NF3均为极性分子
C.键角由大到小的顺序:N H3>PH3>As H3
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.4.4 g C2H4O 中含有σ键数目最多为0.7NA
B.11.2 L CO2含π键数目为NA
C.28 g N60(分子结构如图)中含有的N—N 键数目为1.5NA
D.金刚石中碳原子的杂化类型为sp3杂化,12
g 金刚石中含有的C—C 数目为1.5NA
5.X、Y、Z、W 四种短周期主族元素,原子序数依次增大。X、Y 与Z 位于同一周期,且只有X、Y 元素相邻。X 基态原子核外有2个未成对电子,W 原子在同周期中原子半径最大。下列说法不正确的是( )。
A.第一电离能:Y>Z>X
B.电负性:Z>Y>X>W
C.Z、W 原子形成稀有气体电子构型的简单离子的半径:W<Z
D.W2X2与水反应生成产物之一是非极性分子
6.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法正确的是( )。
A.配位体是Cl-和H2O,配位数是8
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中Cl-的数目比是1∶2
D.在1 mol 该配合物中加入足量Ag NO3溶液,可以得到3 mol Ag Cl沉淀
7.利用超分子可分离C60和C70。将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如下。下列说法正确的是( )。
A.第二电离能:C>O
B.杯酚分子中存在π键
C.杯酚与C60形成氢键
D.C60与金刚石晶体类型相同
8.下列说法正确的是( )。
B.硬度由大到小:C60>碳化硅>铁>氯化钠
C.熔点由高到低: BN>Mg Br2>SiCl4
D.含有手性碳原子的分子叫做手性分子
9.检验Ni2+反应的一种生成物为丁二酮肟镍,是一种鲜红色沉淀,其分子结构如下所示。下列说法正确的是( )。
A.Ni2+核外有14 种运动状态不同的电子
B.该分子内微粒之间存在的作用力有共价键、配位键、离子键、氢键
D.H2O 中有2个由s轨道与sp3杂化轨道形成的σ键
10.砷化镉晶胞结构如图1。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为。已知砷化镉的摩尔质量为Mg·mol-1,NA为阿伏加德罗常数的值。下列说法正确的( )。

图1
A.砷化镉中Cd 与As 原子个数比为2∶3
11.硅元素是很多重要材料的主要元素之一,请回答下列问题:
(1)基态硅原子最外层的电子排布图为_____。
(2)图2所示是碳化硅(SiC)的一种晶体的晶胞。该晶体的类型是____,C 的杂化类型为_____,其熔点比晶体硅_____(填高或低)。
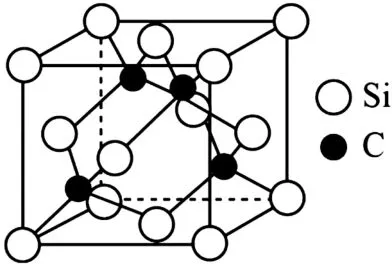
图2
(3)硅和卤素单质反应可以得到Si X4,其熔沸点如表1所示。
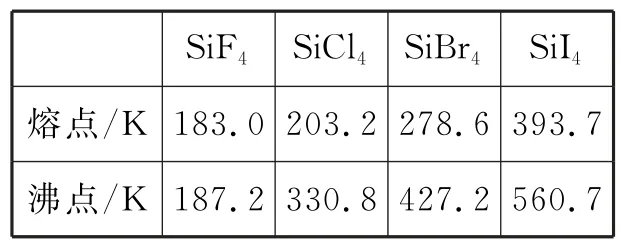
表1
0 ℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是____(填化学式),沸点依次升高的原因是____,SiX4气态分子的空间构型是____。
(4)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是_____。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
12.第四周期的铁、钴、铜等金属及其化合物在工业上有重要用途,回答下列问题:
(1)[Cu(N H3)4]SO4和Cu Cl是两种重要的铜的化合物
①向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间结构都是三角锥形,但NF3不易与Cu2+形成配离子的原因是____。
②Cu Cl的盐酸溶液能吸收CO 生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2 H2O] ,其结构如下所示。下列说法不正确的是____(填字母)。
A.该复合物中只含有离子键和配位键
B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO 和H2O 作为配体
D.CO 与N2的价层电子总数相同,其结构为C≡O
(2)配位化学创始人维尔纳发现,取Co Cl3·6 NH3(黄色)、Co Cl3·5 NH3(紫红色)、Co Cl3·4N H3(绿色)和Co Cl3·4 NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
①请根据实验事实用配合物的形式写出它们的化学式:Co Cl3·6 N H3___,Co Cl3·4NH3(绿色和紫色)___。
②上述配合物中,中心离子的配位数都是_____。
(3)配合物Fe(CO)5的熔点为-20 ℃,沸点为103 ℃。可用于制备纯铁。Fe(CO)5的结构如图3所示。
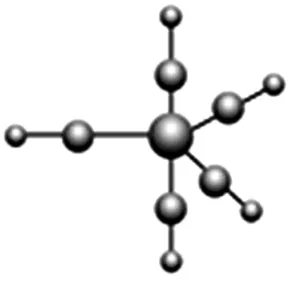
图3
①Fe(CO)5是____(填“极性分子”或“非极性分子”)。
②Fe(CO)5中Fe原子以____杂化方式与CO成键,且1 mol Fe(CO)5含有____mol配位键。
13.氮化硼是一种性能优异的新型材料,主要结构有六方氮化硼(图4)和立方氮化硼(图5)。前者与石墨结构类似,后者的硬度仅次于金刚石,但热稳定性远高于金刚石。

图4

图5
(1)50.0 g六方氮化硼晶体中含有六元环的数目为_____,晶体中氮原子的杂化方式为_____,氮化硼晶体不导电的原因是____。
(2)立方氮化硼属于_____晶体,其中N的配位数为_____。
(3)已知立方氮化硼密度为dg·cm-3,NA代表阿伏加德罗常数的值,立方氮化硼晶胞中面心上6 个N 原子相连构成正八面体,该正八面体的边长为_____pm(列式即可)。
14.黄铜矿(主要成分为Cu FeS2)是一种天然矿石。中国在商代或更早就掌握了由它冶炼铜的技术。医药上,黄铜矿有促进骨折愈合的作用。请回答下列问题:
(1)基态Cu+比Cu2+稳定,写出基态Cu+的价层电子排布式:____。
(3)金属铜的某些参数如表2所示。

表2
根据上述数据计算,Cu 的原子半径为_____pm(列出计算表达式,设NA是阿伏加德罗常数的值)。
(4)四方晶系的Cu FeS2晶胞结构如图6所示。

图6
①Cu FeS2中各元素电负性数值从小到大的顺序为_____,晶胞中S 原子的杂化方式为_____。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图6 中原子1 的坐标为,则原子2 的坐标为____。晶体中距离Fe最近的S有____个。
15.Ⅰ.TiO2和Mn O2均可以催化降解甲醛、苯等有害物质,具有去除效率高,且无二次污染等优点,广泛应用于家居装潢等领域,其中一种催化机理如图7 所示。
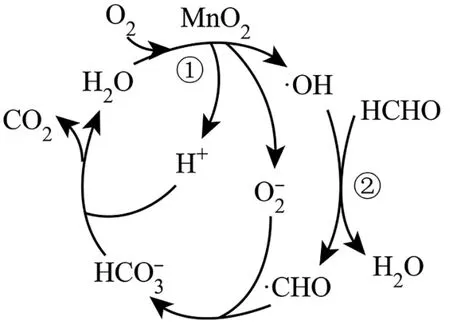
图7
回答下列问题:
(1)基态Ti和Mn原子中未成对电子数之比为_____。
(2)CO2和·CHO 中碳原子的杂化形式分别为_____、___。
(3)HCH O 的空间构型为____。
(4)金属钛和锰可导电、导热,有金属光泽和延展性,这些性质都可以用理论解释。已知金属锰有多种晶型,y型锰的面心立方晶胞俯视图符合下列____(填图8 中的编号)。
图8
Ⅱ.LiFePO4、聚乙二醇、LiPF6、Li As F6和LiCl等可作锂离子聚合物电池的材料。
回答下列问题:
(5)Fe 的基态原子的价电子排布式为____。
(6)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2O H)相近,但沸点高出100 ℃,原因是____。
Ⅲ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3 H2O 属正交晶系(长方体形)。晶胞参数为0.72 nm、1.0 nm、0.56 nm。如图9所示为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。LiCl·3 H2O 的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值。
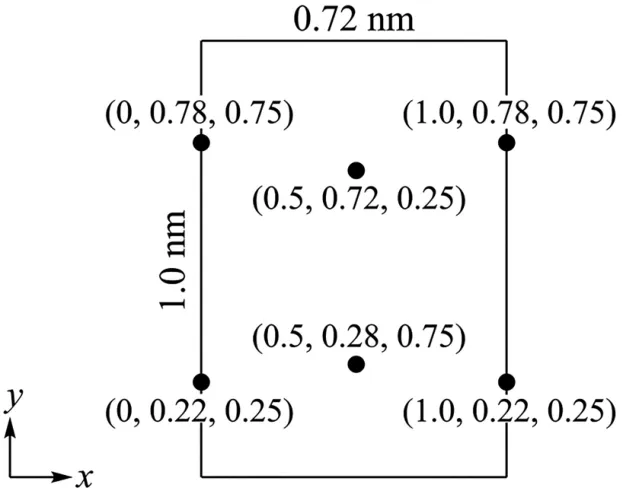
图9
(7)该晶胞中Cl原子的数目为_____,LiCl·3 H2O 晶体的密度为____g·cm-3(列出计算表达式)。

