丝胶蛋白源Tn和T抗原的释放制备及质谱分析
满丽娟,叶佳佳,张德锋,邹籽华,黄琳娟,王仲孚,王承健
(1.陕西省天然多糖资源利用工程研究中心,西北大学食品科学与工程学院,西安 710069;2.西北大学生命科学学院,西安 710069)
糖基化是常见的蛋白质翻译后修饰方式之一,人体中大多数蛋白质均可能被O-(Ser/Thr残基上)或N-(Asn 残基上)糖基化修饰,其在多种生物学过程和疾病的发生发展中发挥着重要作用[1,2].研究发现,很多肿瘤细胞中糖基转移酶的表达会发生改变,导致部分糖蛋白上糖链的结构和数量也随之发生变化,而这些异常表达的糖链有可能成为一类重要的肿瘤早期诊断生物标志物或药物治疗特异性靶标分子[3].最典型的例子是多种癌症细胞表面高表达的糖蛋白Mucin-1(MUC1),其O-糖链具有截断现象,从而产生只由一个或少数几个单糖残基构成的较短O-糖链,而在正常细胞上这些糖链并不表达或表达量极低[3~6].其中,一个GalNAc通过α型O-糖肽键连接到Ser/Thr残基上形成的结构被称为Tn抗原(GalNAc-α-Ser/Thr),而在Tn 抗原上通过β1,3 糖苷键连接一个Gal 残基形成的结构被称为T 抗原(Galβ1,3GalNAc-α-Ser/Thr),是最常见的癌细胞糖链抗原,可被免疫系统特异性识别[5,6].目前,已有大量研究利用此类癌细胞特异性糖类抗原结构来合成糖肽类抗癌疫苗候选分子,使机体产生较强的免疫反应,以达到预防肿瘤或延缓肿瘤复发时间的目的.同时,与细胞毒性疗法(如放疗和化疗)相比,这类免疫疗法对人体副作用更小,因此已成为癌症预防和治疗中最有前景的手段之一[7~11].然而,在糖肽疫苗合成过程中,所需关键原料Tn 抗原或T 抗原需要具有正确的异头构型,导致其合成难度较大,生产成本较高,影响了广泛应用.因此,对天然来源Tn 和T 抗原的开发利用成为一种重要替代途径.
丝胶蛋白是蚕茧中的一种水溶性糖蛋白,占总重的15%~35%,是丝绸工业的副产品,主要存在于缫丝厂废水中,产量较大,具有重要的回收利用价值[12,13].早期研究发现,以蛋白酶对丝胶蛋白进行水解可获得带有多个氨基酸残基的糖肽,其中包括带有单糖或二糖结构的O-糖肽,并且通过化学方法和糖苷酶法降解后分析推测,这些O-糖肽具有与肿瘤细胞Tn 和T 抗原一致的小分子糖链结构[14,15].然而,由于所用分析手段的局限性,尚无更直接、更明确的丝胶蛋白完整O-糖链结构分析数据,而且不同O-糖链的丰度分布情况仍不清楚,更缺乏对这一O-糖链资源进行开发利用的相关技术方法.
基于此,本文以丝胶蛋白为研究对象,以电喷雾质谱(ESI-MS)、串联质谱(MS/MS)和在线液相色谱-质谱联用仪(Online LC-MS)为主要检测手段,对其O-糖链的结构、丰度分布及含量进行了分析,并进一步建立了对其O-连接单糖进行非还原性释放和分离制备的新方法,发展了以其为原料通过链霉蛋白酶E(Pronase E)释放制备Tn抗原和T抗原的新方法,为丝胶蛋白O-糖链资源的开发利用提供了理论依据和技术基础,对癌症糖肽疫苗及靶向检测试剂的合成制备有重要的潜在价值.
1 实验部分
1.1 试剂与仪器
家蚕蚕茧,初级农产品,四川藏曦堂生物科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)、氢氧化钠(NaOH)、苯磺酰肼(BSH)、吉拉德试剂P(GP)和二甲亚砜(DMSO),分析纯,德国Merck KGaA 公司;乙腈(ACN),色谱纯,美国Thermo Fisher Scientific 公司;PNGase F,纯度≥95%(SDS-PAGE),德国Merck KGaA公司;链霉蛋白酶E(Pronase E),7000 U/g,北京拜尔迪生物技术有限公司;C18固相萃取小柱,250 mg/4 mL,美国Waters 公司;多孔石墨碳(PGC)固相萃取小柱,250 mg/3 mL,天津博纳艾杰尔科技有限公司;其它试剂均为国产分析纯.
LC-2010A 型高效液相色谱(HPLC)仪,日本Shimadzu 公司;LTQ-XL 型液相色谱-质谱联用仪(LC-MS)仪,美国Thermo Scientific公司.
1.2 实验过程
1.2.1 蚕茧丝胶蛋白的提取 参照文献[16]方法,将2 g 蚕茧剪碎后用二次蒸馏水清洗3 次,加入400 mL二次蒸馏水,于100 ℃水浴中加热40 min,冷却过滤,将滤液减压浓缩至50 mL,冷冻干燥后得到白色丝胶蛋白粉末.
1.2.2O-糖链的“一釜法”释放及纯化 参照文献[17]报道的“一釜法”对丝胶蛋白O-糖链进行释放并同时进行PMP标记.将5 mg丝胶蛋白粉末溶于2 mL含2.5 mol/L PMP 和2.0 mol/L NaOH 的50%(体积分数)甲醇溶液中,置于80 ℃水浴中密闭反应24 h.反应结束后,将样品溶液转移至4 mL离心管中,用0.3 mL12 mol/L浓盐酸将pH值调至中性,然后加入1.5 mL二氯甲烷萃取多余的PMP,再用20 μL冰乙酸调节pH值至4~5,并用二氯甲烷重复萃取2次.通过真空浓缩对所得上层清液进行干燥,并用1 mL水复溶,用于C18固相萃取小柱分级纯化.在纯化过程中,先用体积分数分别为20%和25%的ACN溶液各50 mL依次对C18固相萃取小柱进行清洗,然后用12 mL ACN进行活化,用15 mL水进行平衡.加入样品溶液并等待其被小柱充分吸附后,以6倍柱体积的水洗柱除盐,再依次用25%和35%的ACN溶液各3 mL洗脱目标物,洗出液经离心浓缩仪干燥后在-20 ℃保存备用.
1.2.3O-糖链PMP 衍生物的全甲基化 参考文献[18]方法,将100 mg 干燥的NaOH 颗粒研磨成粉末后加入1 mL 无水DMSO,充分混合均匀后将400 μL 该混合液加入冷冻干燥后的糖链样品中,并加入100 μL 碘甲烷(CH3I),室温下避光、振荡反应30 min.反应结束后,加入1 mL 水终止反应,然后加入1 mL 二氯甲烷,充分振荡后以18313g的转速离心3 min,弃去上层清液.向所得有机相中加入1 mL 0.5 mol/L NaCl溶液,充分混合均匀后以18313g转速离心3 min,弃去上层清液,重复此萃取操作3次.最后,将所得有机相减压浓缩干燥,并用甲醇重新溶解,用于多级串联质谱(MSn)分析.
1.2.4O-糖链PMP 衍生物的反相高效液相色谱(RP-HPLC)分离分析 采用Supersil ODS2 C18 反相柱(4.6 mm×250 mm,5 μm)对O-糖链PMP衍生物样品进行RP-HPLC分离,检测波长为254 nm,进样量为10 μL,流动相A 和B 分别为ACN 和10 mmol/L 乙酸铵(pH=4.5),洗脱梯度:0 min,86%A+14%B;30 min,84%A+16%B.流速为0.8 mL/min.
1.2.5O-连接单糖的氨水催化法非还原性释放 将10 mg丝胶蛋白置于10 mL密闭玻璃小瓶中,加入3 mL氨水(质量分数25%~28%)并摇匀,在一定温度水浴中进行反应,最佳条件为40 ℃反应16 h.反应结束后,经真空浓缩除去氨水,然后用1 mL水重新溶解样品,用PGC固相萃取小柱进行分级纯化.在纯化过程中,将样品溶液加载到PGC 小柱上,收集洗出液并重复上样3 次,然后用10 mL 水洗脱糖链,并以每管0.5 mL对洗出液进行分部收集,最终通过ESI-MS进行检测分析.
1.2.6 还原性O-单糖的苯磺酰肼(BSH)衍生化 参照文献[18]方法,将1 mg从丝胶蛋白中释放的还原性O-糖链样品和10 mg BSH溶解于1 mL乙醇/水/冰乙酸(体积比10∶9∶1)混合液中,摇匀后置于60 ℃水浴中反应45 min,再加入1 mL二氯甲烷萃取过量的BSH,重复萃取操作3次,最后收集上层清液并干燥,用100 μL体积分数为50%的ACN水溶液重新溶解,用于HPLC分离分析.
1.2.7O-单糖BSH 衍生物的亲水相互作用液相色谱(HILIC)分离 用TSK-GEL Amide-80 酰胺柱(4.6 mm×250 mm,5 μm)对O-糖链BSH 衍生物样品进行HILIC 分离,检测波长为254 nm,进样量为10 μL,流动相A 和B 分别为ACN 和10 mmol/L 乙酸铵(pH=4.5)溶液,流速为0.8 mL/min,洗脱梯度:0 min,86%A+14%B;30 min,84%A+16%B.对所有色谱峰组分分别进行收集并干燥,以ESI-MS 检测分析.
1.2.8 还原性O-单糖单体的再生 参照文献[18]方法,将HILIC分离后收集到的O-糖链BSH衍生物组分溶于1 mL 体积分数为5%的冰乙酸溶液中,在70 ℃反应30 min.反应结束后,加入2 mL 二氯甲烷,振荡混合均匀并以18313g的转速离心3 min,收集上层清液且重复萃取操作3次.最终将所得水相溶液减压浓缩干燥并用水重新溶解,用于ESI-MS检测.
1.2.9 丝胶蛋白源Tn 和T 抗原的Pronase E 水解法释放及纯化 参照文献[19]报道的反应条件,将10 mg 丝胶蛋白和10 mg Pronase E 置于4 mL 离心管中,加入1 mL 1 mol/L(pH=8.0)磷酸盐缓冲液溶解后,于37 ℃反应24 h,然后以C18 固相萃取小柱进行分级纯化.在纯化过程中,首先用5 mL ACN 对C18小柱进行活化,再用10 mL水平衡,然后加载样品溶液,并用20 mL水洗脱糖链,以每管0.5 mL对洗出液进行分部收集,最终通过ESI-MS和MS/MS对收集的样品进行检测分析.
1.2.10 质谱分析条件 利用LTQ XL 线性离子阱液相色谱-质谱联用仪进行ESI-MS,MS/MS 和LC-MS分析.一级质谱采用正离子模式扫描,质荷比(m/z)范围为100~2000,离子传输毛细管温度为275 ℃,管透镜电压为350 V.二级质谱(MS2)和多级质谱(MSn)采用碰撞诱导裂解(CID)方法进行,归一化碰撞能量设置为25.0~35.0,激活q值为0.25,激活时间为30 ms,其它质谱参数设置参照文献[20]方法.以Supersil ODS2 C18反相色谱柱(2.1 mm×150 mm,5 μm)进行在线LC-MS分析,进样量为10 μL,流动相A 和B 分别为ACN 和10 mmol/L 乙酸铵(pH=5.5),采用等度洗脱:0 min,19%A+81%B;70 min,19%A+81%B,流速为0.2 mL/min.此过程中质谱参数同上.质谱分析完成后,借助GlycoWorkbench软件[21]对采集到的数据进行解析和注释.
2 结果与讨论
2.1 丝胶蛋白O-糖组的定性和定量分析
为了在已有研究[14,15]基础上进一步从完整分子的角度确定丝胶蛋白O-糖链的具体种类和结构,采用“一釜法”[17]对其同时进行了非还原性释放与PMP标记,样品经过富集纯化后,以ESI-MS进行检测分析.由图1(A)可见,在ESI-MS正离子模式下共检测到4个质谱峰,其中m/z552.33和574.33处分别为O-连接单糖HexNAc 的PMP 衍生物的[M+H]+和[M+Na]+信号峰,而m/z714.42 和736.42 处为分别为O-连接二糖HexHexNAc 的PMP衍生物的[M+H]+和[M+Na]+信号峰,表明丝胶蛋白中仅有这两种O-糖链,而且都是小分子.相比之下,其它已报道的许多糖蛋白[22]中的O-糖链种类通常更加多样,分子量也更大,与丝胶蛋白明显不同.
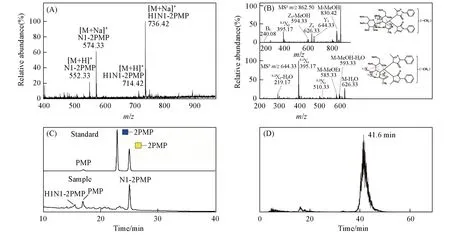
Fig.1 Structural identification and quantification of intact O-glycans as PMP derivatives released from sericin by ESI-MS,MS/MS,RP-HPLC and LC-MS
为了从完整分子的角度解析丝胶蛋白O-连接二糖HexHexNAc 内部的糖苷键连接方式,对“一釜法”释放的O-糖链PMP衍生物全甲基化修饰后,以MSn进行分析,结果如图1(B)所示.该糖链全甲基化衍生物的理论分子量为839,m/z62.50处为其[M+Na]+信号峰,将其作为母离子进行MS2分析,产生的碎片离子m/z626.33(Y1)和644.33(Z1)均为糖苷键断裂所形成的碎片峰.进一步对m/z644.33(Z1)进行MS3分析,获得了碎片离子m/z510.33(0,3A1),其为该糖链中1,3-连接糖苷键的特征信号峰.根据O-糖链生物合成过程[23]以及相关文献[15]报道可知,该糖苷键应为β构型,可以判断该O-糖链的糖苷键为β1,3-连接.
为了确定丝胶蛋白O-连接单糖的种类以及不同O-糖链的丰度比例,以GlcNAc和GalNAc的PMP衍生物为参照标准品,对丝胶蛋白O-糖链PMP衍生物进行了RP-HPLC定性定量分析,结果如图1(C)所示.通过对比单糖PMP衍生物的保留时间发现,丝胶蛋白O-连接单糖HexNAc的PMP衍生物的保留时间与GalNAc的PMP衍生物保留时间高度一致,而与GlcNAc的PMP衍生物保留时间差异较大,因此可以确定丝胶蛋白中只存在一种O-连接单糖,即O-GalNAc.因为丝胶蛋白中的O-糖链只有这一种核心单糖,所以结合文献[15]报道可以判断,其O-连接二糖的结构应为Galβ1,3GalNAc.由此可见,丝胶蛋白中含有与癌症Tn抗原和T抗原相同的O-糖链结构.此外,通过对RP-HPLC洗脱组分进行ESI-MS检测确定了丝胶蛋白O-Galβ1,3GalNAc 的PMP衍生物所对应的色谱峰,进而通过色谱峰面积计算可知,丝胶蛋白中O-GalNAc与O-Galβ1,3GalNAc的丰度比约为5.3∶1.
为了进一步测定这两种O-糖链在丝胶蛋白中的含量,参照文献[17]报道的O-糖链稳定同位素试剂标记及质谱定量分析方法,向来源于5 mg丝胶蛋白的O-糖链PMP衍生物中加入0.11 μg GalNAc 标准品的氘代PMP(d5-PMP)衍生物作为定量内标,然后进行LC-MS 定性定量分析,所得丝胶蛋白O-Gal-NAc的PMP衍生物的提取离子流图(EIC)如图1(D)所示.根据分析得到的内标与O-GalNAc的EIC峰面积比值计算可知,丝胶蛋白中O-GalNAc 的含量为1.58 μg/g,并且根据丝胶蛋白中不同O-糖链的丰度比值进一步计算得出O-Galβ1,3GalNAc的含量为0.54 μg/g.以上结果为Tn抗原和T抗原的释放提供了重要理论依据.
2.2 丝胶蛋白还原性O-连接单糖的释放及分离制备
在癌症O-糖肽疫苗候选分子合成过程中,通常需要以单糖GalNAc为原料合成用于增强免疫响应的糖簇配体[10,11].为了从天然原材料中获取高纯度GalNAc,进一步建立了一种在氨水中从丝胶蛋白中释放制备还原性O-GalNAc 的新方法.首先,参考本课题组[24]已建立的氨水催化释放糖蛋白N-糖链的反应条件,将丝胶蛋白溶于体积分数为25%~28%的氨水中,浓度为1 g/L,反应时间设为16 h,对不同温度(25,30,35,40,45,50和55 ℃)下释放并纯化获得的糖链产物进行ESI-MS检测,以GalNAc的质谱峰信号强度为指标来判断其释放效率,从而对反应温度进行考察,结果如图2(A)所示.可见,最佳反应温度为40 ℃,而继续升高温度时糖链产率反而会下降,其原因可能是产物发生了降解.在此最佳温度下以类似方法进一步对反应时间(4,8,12,16,20和24 h)进行了考察,结果如图2(B)所示,最佳反应条件下所释放糖链样品的质谱图如图2(C)所示.由图2(B)可见,当反应时间从4 h延长至16 h,GalNAc 的释放产率不断升高,而反应16 h 后产率不断下降,因此最佳反应时间为16 h.由图2(C)可知,以该方法从丝胶蛋白中释放出的糖链为O-GalNAc,而未发现O-Galβ1,3GalNAc 的质谱信号,其原因可能是释放的二糖因含有1,3-连接糖苷键而在碱性条件下发生了剥皮降解反应[25],而释放的单糖在相同条件下则具有相对较高的稳定性.此外,发现样品虽已通过固相萃取柱分级纯化,但糖链纯度依然不高,在质谱图中观察到许多杂质信号峰.
为了进一步对氨水催化法释放的丝胶蛋白还原性O-糖链样品进行精细分离纯化,利用本课题组[18]已建立的还原性糖链HPLC分离制备策略,对其进行BSH标记后,再进行HILIC分离和组分收集,最后对收集到的糖链BSH衍生物组分进行了脱标记,检测结果如图2(D)~2(F)所示.如图2(D)所示,从丝胶蛋白释放的O-GalNAc 标记上BSH 后,其质谱图中信号峰为m/z398.08([M+Na]+)和m/z414.08([M+K]+).图2(E)为该样品的HILIC 分离色谱图,可见多种杂质成分与目标糖链被有效分开.在HILIC分离过程中,根据保留时间对样品中的GalNAc BSH衍生物组分进行收集和干燥,然后在弱酸性水溶液中加热脱除BSH,产物的ESI-MS检测结果如图2(F)所示.可见,GalNAc 的BSH衍生物已完全转化为还原性GalNAc,且其中杂质信号峰极低,说明样品纯度显著提高.以上结果表明,氨水催化法释放的丝胶蛋白GalNAc 可通过色谱方法实现精细分离纯化,此释放纯化策略的建立为获取高纯度GalNAc提供了一种重要天然来源,同时也为丝胶蛋白资源的深度利用提供了一种新的可能途径.
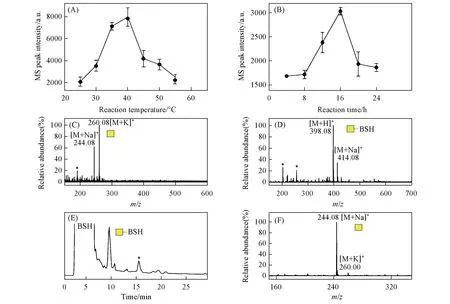
Fig.2 Reaction condition optimization and product chromatographic separation of the ammoniacatalyzed method for non-reductive release of sericin O-linked monosaccharide
2.3 丝胶蛋白源Tn和T抗原的释放纯化及质谱分析
Tn抗原和T抗原是合成癌症特异性糖肽疫苗的关键原料,其易得性和结构可靠性对癌症疫苗的合成和生产有重要影响[8~11].丝胶蛋白作为一种天然糖蛋白,由于其小分子O-糖链在结构上与癌症Tn抗原和T抗原完全相同,因而理论上可作为制备这两种癌症抗原的天然原材料.为了进一步从丝胶蛋白中提取Tn抗原和T抗原,利用不同量的Pronase E对丝胶蛋白进行水解,并以C18固相萃取小柱对样品进行分级纯化,最终在不同时间段的水洗液中分别获得了Tn抗原和T抗原组分,产物的ESI-MS检测结果如图3所示,其结构的MS/MS分析鉴定结果如图4所示.

Fig.3 ESI-MS profiles of Tn antigen(A) and T antigen(B) derived from sericin
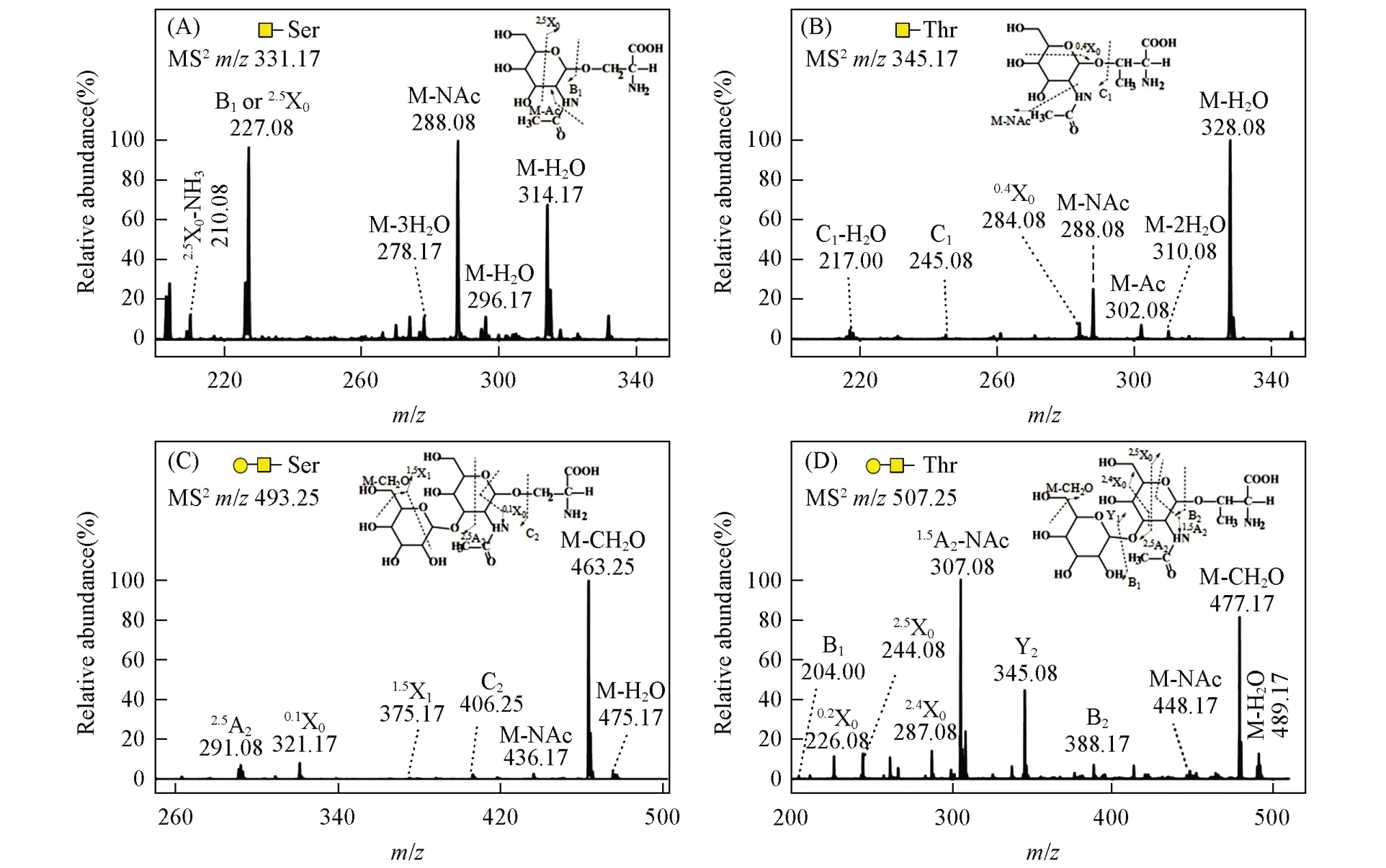
Fig.4 MS/MS analysis of Tn antigen and T antigen derived from sericin
从丝胶蛋白中释放的Tn 抗原的理论相对分子质量为308(GalNAc-Ser)和322(GalNAc-Thr),图3(A)中m/z331.17和353.17处分别为GalNAc-Ser的[M+Na]+和[M+2Na-H]+信号峰,而m/z345.17和367.17处分别为GalNAc-Thr的[M+Na]+和[M+2Na-H]+信号峰.同时,从丝胶蛋白中释放的T抗原的理论相对分子质量为470(GalGalNAc-Ser)和484(GalGalNAc-Thr),图3(B)中m/z493.25和515.25处分别为GalGalNAc-Ser的[M+Na]+和[M+2Na-H]+信号峰,而m/z507.25和529.25处分别为GalGalNAc-Thr的[M+Na]+和[M+2Na-H]+信号峰.进一步以m/z331.17,345.17,493.25 和507.25 作为母离子进行MS/MS分析时,产生的碎片离子信号均能够与Tn抗原和T抗原结构相对应(图4).由于已确定T抗原中的二糖为β1,3-连接,而且现已发现的天然糖蛋白中的O-糖肽键均为α-构型,文献[15]报道的丝胶蛋白O-糖肽键也同样具有此构型,因此可以判断产物的结构为GalNAc-α-Ser/Thr 和Galβ1,3GalNAc-α-Ser/Thr,与癌症Tn抗原和T抗原的结构相同.
此外,研究中还发现当Pronase E用量较少时无法从丝胶蛋白中释放出Tn抗原和T抗原,而当该酶的用量增加至与丝胶蛋白原料等重时才能够得到较多的Tn抗原和T抗原,说明利用Pronase E 法可从丝胶蛋白中有效释放出Tn抗原和T抗原,并且对丝胶蛋白肽链的水解程度明显影响产物产率.同时,在产物的质谱图(图3)中还有少量低丰度未知物的信号,其可能是样品中未除净的少量肽段杂质,说明样品纯化方法仍有必要进一步改进.此外,目前该方法中Pronase E的用量较大,未来可考虑与其它蛋白酶联合使用,并实现对产物产率的准确估算,以进一步提高反应效率,并降低成本,为Tn抗原和T抗原的大量生产制备奠定基础.
3 结论
以ESI-MS,MS/MS及在线LC-MS为主要检测手段,通过O-糖组学分析发现,蚕茧丝胶蛋白中仅存在GalNAc和Galβ1,3GalNAc两种小分子O-糖链,二者在结构上分别与Tn抗原与T抗原相同,丰度比约为5.3:1,其中GalNAc 的含量约为1.58 μg/g,Galβ1,3GalNAc 的含量为0.54 μg/g.利用氨水催化法从丝胶蛋白中释放O-糖链,获得了还原性O-连接单糖,而O-连接二糖被降解,最佳反应条件为在体积分数为25%~28%的氨水中于40 ℃反应16 h,并通过液相色谱实现了样品的精细分离纯化,得到了高纯度的还原性单糖GalNAc,由此表明丝胶蛋白中的O-连接单糖在氨水中被释放的过程中具有较好的稳定性.通过Pronase E水解法可从丝胶蛋白中有效释放出Tn抗原和T抗原,并发现丝胶蛋白肽链的水解程度对产物产率有重要影响.该研究为获取高纯度GalNAc,Tn 抗原和T 抗原提供了一种重要天然来源,同时也为丝胶蛋白资源的开发利用提供了一种新的可能途径.

