Ghrelin通过调控NF-κB/NLRP3焦亡信号通路抑制前交叉韧带成纤维细胞焦亡的机制研究
王宗帅 蔡显义 朱旭 刘刚 冯世杰 车伟伟 邹宇聪
前交叉韧带(anterior cruciate ligament,ACL)损伤是膝关节损伤的常见类型,占膝关节损伤的50%以上[1]。ACL 损伤破坏了膝关节的稳定性,常常发展为膝骨关节炎[2]。这给病人的生活质量、职业发展带来极大的负面影响。前交叉韧带重建术是目前临床治疗ACL损伤的主要手段,但也存在着发展为继发性骨关节炎以及二次损伤和撕裂的风险[3]。因此,如果能够寻找一种促进ACL损伤自我愈合的方法,将为ACL损伤治疗提供新的策略。
多项研究表明,ACL 损伤无法愈合的原因主要与韧带的血供不足、缺氧以及炎症等有关[4-7]。细胞焦亡是一种新发现的细胞炎症性死亡,表现为炎症小体NOD 样受体热蛋白结构域相关蛋白3(NODlike receptor thermal protein domain associated protein 3,NLRP3)等在上游因子的刺激下活化含半胱氨酸的天冬氨酸蛋白水解酶-1(cysteinyl aspartate specific proteinase,Caspase-1),Caspase-1切割白细胞介素18(Interleukin-18,IL-18)、白细胞介素1β(Interleukin-1β,IL-1β)、消皮素D(gasdermin D,GSDMD)的前体,切割后的GSDMD 在细胞膜上“打孔”,从而释放出大量炎症因子,如IL-18、IL-1β等,最终引起细胞和组织的炎症反应[8-10]。最近的研究发现细胞焦亡与创伤性膝骨关节炎中的软骨降解、炎症反应和滑膜的破坏等都有一定的关系[11],但细胞焦亡是否参与前交叉韧带的损伤修复还未有相关研究。
胃饥饿素(Ghrelin)是生长激素促分泌素受体(GHSR)的唯一内源性配体,主要由胃黏膜X/A样内分泌细胞分泌,在身体内广泛分布[12-13]。Ghrelin 在生长素分泌、肥胖、能量稳态、炎症的发生中起着重要的作用[14]。我们的前期研究表明膝关节滑液Ghrelin 的表达与创伤性膝骨关节炎的严重程度负相关[15]。考虑到ACL 损伤与创伤性膝骨关节炎联系的紧密性,Ghrelin在ACL损伤修复中的作用值得进一步研究。
本实验通过获取临床病人的前交叉韧带组织,提取前交叉韧带成纤维细胞(Anterior cruciate ligament fibroblasts,ACLFs),肿瘤坏死因子α(Tumor necrotic factor-α,TNF-α)干预模拟ACL 损伤的炎症模型[16],观察细胞焦亡的发生情况,Ghrelin处理后,检测细胞迁移能力的变化以及细胞焦亡蛋白的表达。探究Ghrelin 对前交叉韧带成纤维细胞的作用,为ACL损伤修复提供新的理论依据和治疗手段。
材料与方法
一、组织获取与成纤维细胞分离
样本取自我院前交叉韧带重建的病人(取得书面知情同意),PBS 清洗组织5 次。将组织放入1.5 mL EP管,手术剪剪碎,加入复合胶原酶消化4 h,含血清培养基终止。70 μm过滤网过滤,离心1 500 r/5 min,DMEM-F12培养基重悬,铺板在T-25培养瓶,细胞培养箱培养(37 ℃、5%CO2、95%相对湿度)。
二、试剂与仪器
试剂:蛋白marker、qPCR Master Mix、Trizol来自诺唯赞(中国);PBS、DMEM-F12 培养基来自Gibco(美国);胰酶、抗体稀释液、蛋白酶和磷酸酶抑制剂来自新赛美(中国);复合胶原酶来自赛默飞(美国);TNF-α来自派普泰克(PeproTech,美国);Ghrelin 来自protein specialists 公司(美国);抗体来自affinty 公司(美国);逆转录试剂盒来自TaKaRa 公司(日本);FBS 来自康宁(美国)。仪器:细胞培养箱(一恒科学,中国),离心机(湘仪,中国),摇床(江苏新康,中国),天平(三爱思,中国),恒温水浴锅(上海一恒,中国);96孔板、24孔板、6孔板(康宁,美国),多功能酶标仪(赛默飞,美国),qPCR 仪(罗氏,瑞士),电泳仪(伯乐,中国),化学发光仪(赛默飞,美国),超净工作台(苏州安泰,中国)。
三、ACLFs培养
将细胞置于细胞培养箱中培养(37 ℃、5%CO2、相对湿度为95%),待细胞生长融合至80%~90%时,用PBS清洗3遍后再用0.25%胰蛋白酶消化,1 000 r/min离心5 min后用培养基重悬细胞,并按1∶2将细胞悬液接种于培养瓶中,继续置于细胞培养箱中培养(培养条件不变)。3~5代细胞用于后续实验。
四、CCK-8 确定TNF-α和Ghrelin 的干预浓度和时间
Ghrelin和TNF-α五个药物浓度(0、5 ng/mL、10 ng/mL、20 ng/mL、40 ng/mL),五个复孔,四块板(24 h、48 h、72 h、120 h),配置所需浓度的细胞悬液(2.5×104/mL),转移至培养箱中培养,相应的时间后吸弃旧的培养基,并配置对应孔数含CCK-8的培养基(每孔含10 μL CCK-8与100 μL培养基),混匀后每孔加入110 μL,避免气泡产生,气泡可能影响测定值。培养箱孵育2 h后,读板。使用多功能酶标仪在450 nm波长下测定吸光度,并统计测得的数据。Ghrelin在20 ng/mL时对细胞的正性作用较明显,12~48 h干预时间处理细胞状态较平稳;TNF-α在20 ng/mL 时负性作用较明显,24~72 h 干预时间细胞状态较平稳,最终以20 ng/mL、48 h 作为Ghrelin 和TNF-α的干预剂量和时间用于后续实验。
五、细胞分组
本研究收集临床病人前交叉韧带组织,提取ACLFs用于后续细胞实验,TNF-α处理细胞,模拟损伤的炎症环境,Ghrelin 干预处于炎症环境的细胞。通过CCK-8 确定TNF-α细胞炎症模型和Ghrelin 干预的最佳条件,将细胞分为对照组、TNF-α炎症模型组(TNF-α:20 ng/mL,培养48 h 加入)、TNF-α+Ghrelin干预组(TNF-α和Ghrelin均为20 ng/mL,培养48 h时先后加入)。
六、Transwell检测各组ACLFs迁移
在干预后24 h,24 孔板中每孔加入1 mL 10%FBS 的细胞培养液;将Transwell 小室放于24 孔板中;细胞计数,将5 000 细胞分散于500 μL 2%FBS细胞培养液;将500 μL中的细胞加入Transwell小室中,放入细胞孵箱培养48 h;实验完成后将Transwell小室取出,PBS 清洗,擦去Transwell 小室内部的细胞;4%多聚甲醛室温固定30 min,PBS 清洗3 次,结晶紫染色5 min,PBS清洗3次;显微镜下收集数据。
七、Western Blot检测各组ACLFs相关蛋白表达情况
在干预后24 h,收集细胞并加入含蛋白酶和磷酸酶抑制剂的裂解液裂解细胞,提取总蛋白后采用BCA 法测定蛋白浓度,SDS 上样缓冲液与蛋白按比例混合,在沸水浴中加热5 min致蛋白变性,取30 μg蛋白样品加到上样孔中,行SDS-PAGE电泳,并将蛋白转移至PVDF 膜上,5%BSA 室温封闭1 h,分别加入相应的抗体,4 ℃孵育过夜,TBST 洗膜后,加入二抗室温孵育1 h,随后洗膜显影,化学发光仪呈像,以GAPDH为内参计算目的蛋白IL-1β、IL-18、Caspase-1、GSDMD、磷酸化P65(p-P65)、NLRP3相对表达量。
八、q-PCR检测各组ACLFs相关分子mRNA表达
在干预后24 h,根据RNA提取试剂盒上的操作步骤提取各组细胞总RNA,提取的RNA经逆转录试剂盒逆转录为cDNA,q-PCR 反应以GAPDH 作为内标基因,设计目的分子的引物序列。见表1。根据反应条件循环40次。应用比较阈值法即2-△△Ct处理数据。

表1 引物序列
九、统计学分析
应用GraphPad Prism 8.0 软件(Graphpad 公司,美国)进行统计学分析,计量资料以均数±标准差表示,两组间比较用学生t检验,多组间比较用单因素方差分析。所有实验均重复3 次。以P<0.05 为差异有统计学意义。
结果
一、Ghrelin对ACLFs迁移的影响
本研究发现,与对照组相比,TNF-α干预细胞后,ACLFs 穿过Transwell 小室的数目明显减少(P<0.001),表明TNF-α抑制了ACLFs 的迁移能力。在Ghrelin干预后,与TNF-α炎症模型组相比,ACLFs穿过Transwell 小室的数目明显增多(P<0.001),表明Ghrelin能够改善TNF-α对ACLFs迁移能力的抑制作用,见图1。

图1 Transwell细胞迁移结果 a:对照组;b:TNF-α炎症模型组;c:TNF-α炎症模型+Ghrelin干预组;d:各组间迁移数目比较(***P<0.001)
二、Ghrelin对ACLFs焦亡的影响
我们进一步检测了各组细胞焦亡蛋白以及mRNA的表达,发现与对照组相比,TNF-α炎症模型组的细胞焦亡分子IL-1β、IL-18、Caspase-1、GSDMD蛋白及mRNA的表达量显著增高(P<0.05),这表明前交叉韧带的损伤可能伴随着细胞焦亡的发生。在Ghrelin干预后,细胞焦亡分子IL-1β、IL-18、Caspase-1、GSDMD 蛋白及mRNA 的表达量显著降低(P<0.05,P<0.01),这表明Ghrelin能够抑制ACLFs焦亡的发生。见图2、3。
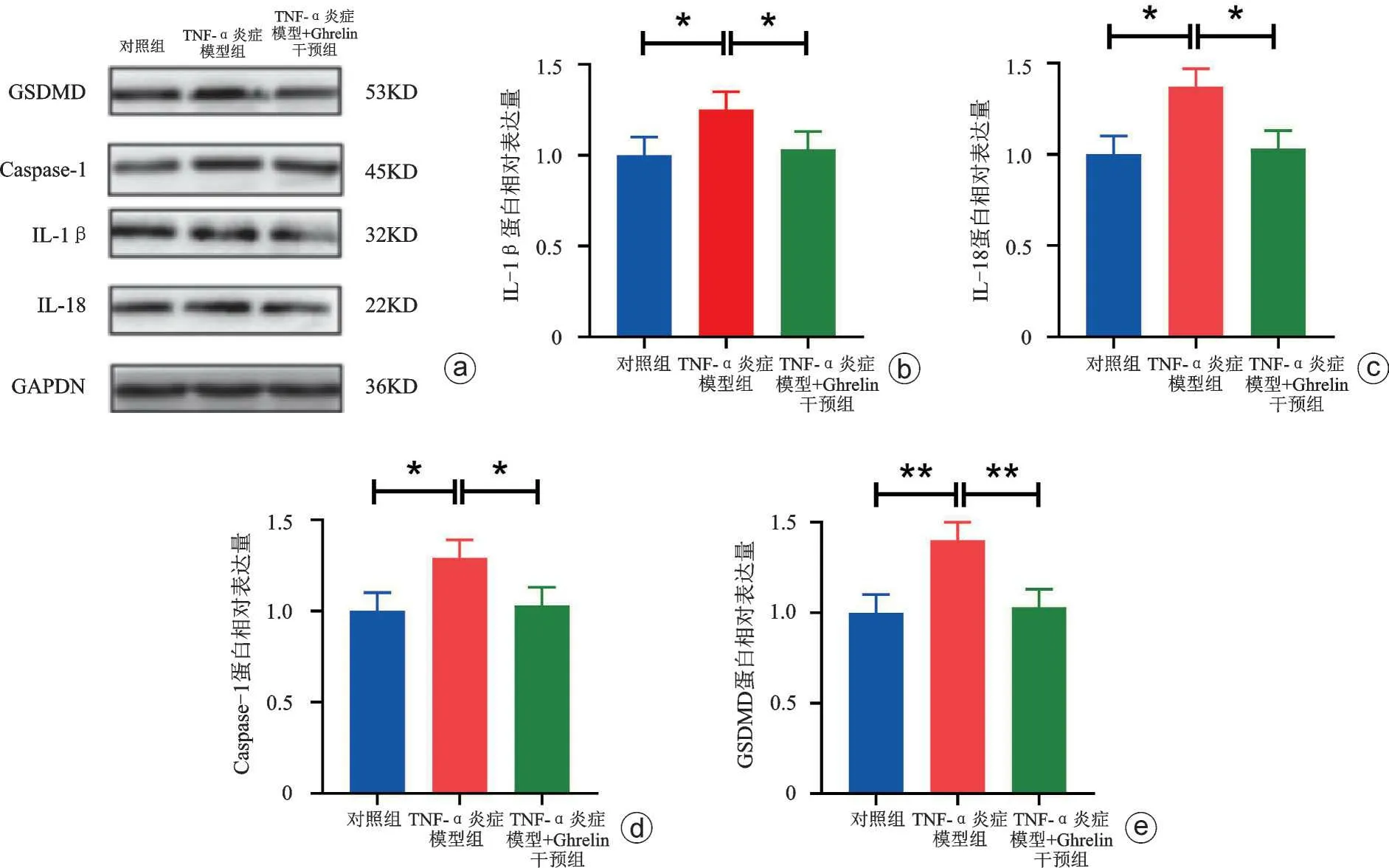
图2 细胞焦亡蛋白Western Blot 结果及相对定量 a:Western Blot条带代表图;b:IL-1β条带相对定量图;c:IL-18 条带相对定量图;d:Caspase-1 条带相对定量图;e:GSDMD 条带相对定量图,*P<0.05,**P<0.01

图3 细胞焦亡蛋白mRNA相对表达量比较 a:IL-1β mRNA相对表达量;b:IL-18 mRNA相对表达量;c:Caspase-1 mRNA相对表达量;d:GSDMD mRNA相对表达量,*P<0.05,**P<0.01
三、Ghrelin对ACLFs NF-κB/NLRP3通路蛋白的影响
为了进一步探索,Ghrelin 抑制ACLFs 焦亡的机制,我们检测了可能的通路蛋白,研究发现,与对照组相比,TNF-α炎症模型组的通路蛋白磷酸化P65(在NF-κB 的活化过程中P65 发生磷酸化,p-P65)、NLRP3的表达量显著增高(P<0.05),这表明炎症环境下促进了NF-κB/NLRP3通路的开放,而在Ghrelin干预后,通路蛋白显著降低(P<0.05),这表明Ghrelin 能够抑制NF-κB/NLRP3 通路的开放。即Ghrelin能够促进ACLFs 的迁移,抑制细胞焦亡的发展,这一过程可能是通过抑制NF-κB/NLRP3 这一通路实现的。见图4。

图4 NF-κB/NLRP3的Western Blot结果及相对定量 a:Western Blot条带图;b:p-P65相对定量统计图;c:NLRP3相对定量统计图,*P<0.05
讨论
相关研究表明,ACL 损伤每年影响20 多万人,直接和间接成本超过70亿美元[1]。ACL损伤后愈合困难,这与ACLFs 的迁移能力弱以及损伤后前交叉韧带所处的炎症环境有着密切联系。Ghrelin 是一种人体广泛分布的内分泌调节肽,其表现出良好的抗炎作用[17]。因此,本研究旨在探讨Ghrelin对ACL损伤修复的作用及具体的机制。
正常情况下,细胞焦亡是机体的一种免疫防御机制,但过度的细胞焦亡所引起的异常炎性反应和免疫细胞的大量死亡会导致宿主机能的严重损害。研究表明,电针可以通过减少滑膜组织细胞焦亡的发生,从而减轻炎症反应[18]。滑膜成纤维细胞焦亡的发生则会加重滑膜的纤维化,从而进一步导致膝骨关节炎的恶化[19]。本研究发现,在用TNF-α干预ACLFs 模拟ACL 损伤的炎症环境后,ACLFs 的焦亡蛋白IL-1β、IL-18、Caspase-1、GSDMD的表达量显著增加,细胞迁移能力明显降低。这个结果提示前交叉韧带的损伤可能伴随着ACLFs 焦亡的发生,炎症环境会抑制细胞的迁移能力。
在骨关节炎中,软骨细胞凋亡活动增加,自噬水平下降[20-21],而多项研究表明Ghrelin 可以在各种状态下抑制细胞凋亡,增强自噬[22-23],起到保护细胞,及时清除代谢废物的作用。近年来发现Ghrelin 可作为软骨细胞生长因子,有助于软骨代谢,对于保护软骨具有重要的作用。而进一步发现Ghrelin 在软骨的合成和分泌中表达均升高,证实了Ghrelin在软骨合成和代谢中的重要地位[24]。有研究表明Ghrelin能够抑制炎症因子IL-1β、TNF-α的表达以及软骨细胞的凋亡,从而改善膝骨关节炎[25]。研究发现损伤后的前交叉韧带中自噬的高表达更为显著,这种更强的自噬活性导致更多的细胞死亡,从而导致其内源性修复障碍[26]。在兔横断模型中,前交叉韧带横断损伤早期产生的炎症细胞因子并上调诱导型一氧化氮合酶的表达,诱导一氧化氮的产生,刺激p38 MAPK 途径启动ACLFs 的凋亡,抑制前交叉韧带的修复[27]。Ghrelin能够调节细胞的凋亡和炎症,保护软骨,抑制骨关节炎发展,因此,笔者推测在前交叉韧带的损伤修复中Ghrelin 也极有可能扮演着重要的角色。本研究发现,在用Ghrelin 干预ACLFs 后,Ghrelin能够抑制细胞焦亡蛋白的表达,改善细胞迁移能力。这个结果提示Ghrelin 可以抑制ACLFs 焦亡的发生,进一步改善细胞的迁移能力。
近些年来对NF-κB/NLRP3 通路研究的不断深入,发现在各种因素的刺激下,p-P65 能够促进炎症小体NLRP3 的活化,进而引起细胞的凋亡和炎症[28]。有研究表明NF-κB/NLRP3 通路可以抑制炎症和上皮细胞-间充质转化,从而有效改善肺纤维化[29]。在体外D-半乳糖和尼日利亚菌素诱导的PC12 细胞损伤模型中,通过抑制NF-κB/NLRP3 通路,抑制了细胞焦亡的发生,从而改善阿尔茨海默病的症状[30]。研究发现NF-κB/NLRP3 能够促进骨关节炎软骨细胞外基质降解和细胞焦亡的发生,从而加重骨关节炎的症状[31]。本研究结果显示,经Ghrelin 干预后的ACLFs 中NF-κB/NLRP3 通路p-P65 和NLRP3的表达显著抑制,这表明Ghrelin 可能是通过NF-κB/NLRP3 通路抑制细胞焦亡的发生,改善细胞的迁移能力。
本研究也存在一些不足之处,首先本研究仅在细胞层面进行,缺少动物实验方面证据;其次,我们未能通过CCK-8试验确定最佳干预条件下各组之间细胞增殖程度的差异对比;再次,我们未能进行免疫荧光实验对Ghrelin表达进行定位分布检验,且只研究了Caspase-1 介导的典型途径,对Caspase-4、Caspase-5 及Caspase-11 介导的非典型途径未做研究;最后,ACL损伤修复的机制复杂,本研究仅从一方面分析,下一步将从多角度模拟ACL 损伤的环境,对其机制进行充分探讨。
但总体而言本研究初步发现Ghrelin 能够促进损伤ACLFs 的迁移,抑制其细胞焦亡的发生,这可能是通过抑制NF-κB/NLRP3通路发挥作用的。

