向海湿地不同植被土壤碳代谢相关酶活性分布特征
赵明宇,沈诗颖,王小丫,吕茜茜,张梦瑶,邹元春,于秀丽
(1.吉林工程职业学院,吉林 四平 136000;2.白城师范学院旅游与地理科学学院,吉林 白城 137000;3.中国科学院东北地理与农业生态研究所,吉林 长春 130102)
土壤酶是土壤生物化学过程的主要调节者[1],是反映土壤环境变化的敏感指标,对土壤理化性质、肥力和生物状态有重要影响.在土壤碳循环中,土壤酶参与了土壤中腐殖质的合成与分解,有机化合物、动植物和微生物残体的水解与转化以及土壤中有机、无机化合物的各种氧化还原反应等生物化学过程[2],是调控土壤新陈代谢和养分平衡的关键因子.其中蔗糖酶、淀粉酶、纤维素酶等土壤碳代谢酶则是参与有机质分解过程中的关键酶类.土壤碳代谢酶能将纤维素、木聚糖等土壤糖类充分水解,并将碳源提供给微生物,促进土壤碳循环的正常进行;能溶解矿物质,具有养分辅助剂和土壤分散剂的作用.湿地土壤酶活性受到干湿交替等物理因子的影响,会使土壤微生物体分解并释放营养元素,从而影响它们活性的高低[3].湿地土壤蔗糖酶的活性是指示湿地生态系统物质分解强度的重要指标.目前,已有大量的国内外研究者对土壤酶在湿地生态系统中的作用、湿地生态系统土壤酶的时空分布特征、气候变化和湿地氮营养环境变化对湿地土壤酶活性的影响、植被类型和土壤理化性质以及人类活动对酶活性的影响等方面开展了大量的工作,为研究湿地在全球气候变化中的作用奠定了基础.目前关于向海湿地土壤酶活性的研究较少,为此本文对向海湿地土壤酶活性的分布情况进行了研究,以进一步揭示湿地土壤酶活性的变化特征,对研究土壤酶在湿地生态系统中的作用提供理论支持.
1 研究区概况及样地的选择
向海湿地位于吉林省白城市松嫩平原西部边缘(44°55′~45°9′N,122°5′~122°31′E),是以保护丹顶鹤等珍稀水禽和蒙古黄榆等稀有植物群落为主要目的内陆沼泽湿地.湿地由众多大型水库、芦苇沼泽、泡沼、内陆水系及盐沼、季节性泛洪区草甸平原组成,面积为40 379.97 hm2[4].气候呈典型的温带大陆性季风气候特征,年平均气温为5.1 ℃,年降水量约为400 mm,降水主要集中在夏季的7—8月份,年蒸发量为1 945 mm.地势由西向东微微倾斜,海拔156~192 m.湿地水源由霍林河、额穆泰河、洮儿河、向海水库、兴隆水库等地表水和大气降水补给,植被以芦苇沼泽、羊草草原等类型为主;土壤主要为栗钙土、草甸土、盐碱土和风积沙土,土壤中腐殖质含量较少,含盐碱量偏高,pH值为7.5~8.7.湿地土壤水分季节性变化十分明显.
在向海湿地内选取无人干扰的地带,该区位于泡沼的外缘,由泡沼边缘向外围按一定距离分别选取4个不同类型的样地.样地内代表性植物分别是芦苇(Phragmitesaustralis)、碱蓬(Suaedaglauca)、碱草(Leymuschinensis)、黄花蒿(ArtemisiaannuaLinn).芦苇可净化水质,涵养水源,生长区地表常年积水;碱蓬为盐生植物,可降低土壤盐分及重金属含量,碱草耐盐碱,可抵御风沙,碱蓬和碱草生长于地表季节性积水区域;黄花蒿对生境适应性强,生长区地表常年无积水.
2 材料与方法
2.1 材料与仪器
实验材料:芦苇、碱草、碱蓬、黄花蒿植被下不同深度土壤样品.
主要仪器:紫外分光光度计(岛津UVMINI-1240)、JM-B5003电子天平、离心机(DD-5MC/LDZ4-1.2,北京京力)、恒温水浴锅(HH-4)等.
2.2 实验方法
2.2.1 土壤采集及预处理
2022年9月上旬,在已选择的样地内,以芦苇、碱草、碱蓬、黄花蒿植被下的土壤为对象,按4个不同深度(0~10,10~20,20~40,40~60 cm)进行土壤采集,每一植被下取3个采样点,每一采样点分别取4个层次的土壤,然后将采集的相同土层的3个土样进行混合,取1 kg作为一个土壤样品装袋保存[5-6].采样后立即测定土壤的电导率和pH值.将采集的土壤装在恒温泡沫箱运回实验室,去除杂质后测定土壤含水量,样品编号后储存在-80 ℃冰箱中备用[5-6].
2.2.2 土壤碳代谢相关酶样液制备及酶活性测定
称取2 g样品,加入10 mL 8%的蔗糖溶液、5 mL磷酸缓冲液(pH=5.5)和5滴甲苯,摇匀,放入37 ℃恒温箱培养24 h后,迅速过滤,定容即为蔗糖酶样液.称取2 g样品,加入10 mL 1%的淀粉溶液,再加10 mL磷酸盐缓冲液(pH=5.5)和5滴甲苯,摇匀,在37 ℃恒温箱中培养24 h后,过滤、定容即为淀粉酶样液.称取2 g 样品加入2 mL甲苯,放置15 min后加入5 mL醋酸盐缓冲液(pH=5.5)和5 mL 1%羧甲基纤维素,将反应混合物充分震荡,在 35 ℃恒温箱中培养72 h后,加热至100 ℃终止反应,然后加入适量铝钾矾,静置、过滤、定容即为纤维素酶样液.
土壤碳酶活性测定参照《土壤酶及其研究方法》[7]进行.蔗糖酶活性测定采取DNS葡萄糖法,以24 h后1 g风干土中所含葡萄糖的毫克数为酶活性单位(mg/(g·d));淀粉酶活性测定采取DNS麦芽糖法,以24 h后1 g风干土中所含麦芽糖的毫克数为酶活性单位(mg/(g·d));纤维素酶活性测定采取蒽酮葡萄糖法,以24 h后1 g风干土中所含葡萄糖的毫克数为酶活性单位(mg/(g·d)).每个土壤样品测定3次后取平均值.
2.2.3 数据处理
使用Microsoft Excel 2013对实验数据进行统计、处理及作图.运用SPSS软件,进行单因素多重比较分析及相关分析.
3 结果与分析
3.1 土壤碳代谢相关酶活性单因素多重比较分析
3.1.1 不同植被土壤碳代谢相关酶活性差异
由同一深度土层不同植被土壤酶活性测定结果(见图1)可见,0~10,10~20,20~40 cm 3个土层芦苇、碱草、碱蓬、黄花蒿植被下土壤蔗糖酶活性差异均显著(P<0.05);40~60 cm土层碱草和碱蓬植被下土壤蔗糖酶活性差异不显著(P>0.05),其余差异显著.同种植被下0~60 cm土层土壤蔗糖酶活性取均值后,土壤蔗糖酶活性表现为黄花蒿>碱草>碱蓬>芦苇.

注:不同小写字母表示差异显著(P<0.05),下同.图1 土壤蔗糖酶水平方向比较分析
由图2可见,10~20和20~40 cm两个土层,芦苇、碱草、碱蓬、黄花蒿植被下土壤淀粉酶活性差异均显著(P<0.05);0~10 cm土层芦苇和黄花蒿植被下土壤淀粉酶活性差异不显著(P>0.05),其余差异显著;40~60 cm土层芦苇和碱蓬植被下土壤淀粉酶活性差异不显著(P>0.05),其余差异显著.同种植被下0~60 cm土层土壤淀粉酶活性取均值后,土壤淀粉酶活性表现为黄花蒿>碱草>芦苇>碱蓬.
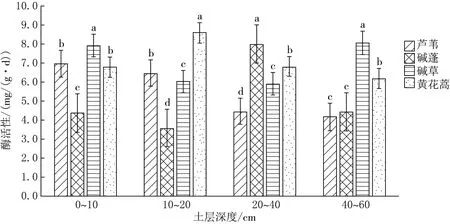
图2 土壤淀粉酶水平方向比较分析
由图3可见,0~10,10~20,20~40和40~60 cm 4个土层芦苇、碱草、碱蓬、黄花蒿植被下土壤纤维素酶活性差异均显著(P<0.05).同种植被下0~60 cm土层土壤纤维素酶活性取均值后,土壤纤维素酶活性表现为黄花蒿>碱蓬>碱草>芦苇.

图3 土壤纤维素酶水平方向比较分析
通过比较分析可知,同深度土层4种植被下土壤碳代谢相关酶活性多表现为差异显著(P<0.05).
3.1.2 不同深度土壤碳代谢相关酶活性差异
对比同一植被不同深度土壤酶活性测定结果(见图4)可见,芦苇植被下10~20和40~60 cm之间土层的土壤蔗糖酶活性差异不显著(P>0.05),其余差异显著.碱草植被下0~10和20~40 cm土层之间的土壤蔗糖酶活性差异不显著(P>0.05),10~20和40~60 cm之间的土层土壤蔗糖酶活性差异不显著(P>0.05).碱蓬植被下20~40和40~60 cm土层之间的土壤蔗糖酶活性差异不显著(P>0.05),其余差异显著.黄花蒿植被下0~10和40~60 cm之间的土层土壤蔗糖酶活性差异不显著(P>0.05),其余差异显著.从整体来看,0~40 cm土层随土层深度的增加,芦苇、碱蓬植被下土壤蔗糖酶活性呈上升趋势,芦苇、碱草、黄花蒿植被下土壤蔗糖酶活性最低值出现在40~60 cm土层.

图4 土壤蔗糖酶垂直方向比较分析
由图5可见,芦苇植被下20~40和40~60 cm之间土层的土壤淀粉酶活性差异不显著(P>0.05),其余差异显著.碱草植被下0~10和40~60 cm 之间土层的土壤淀粉酶活性差异不显著(P>0.05),10~20和20~40 cm之间土层的土壤淀粉酶活性差异不显著(P>0.05).碱蓬植被下0~10和40~60 cm之间土层的土壤淀粉酶活性差异不显著(P>0.05),其余差异显著.黄花蒿植被下0~10和20~40 cm之间土层的土壤淀粉酶活性差异不显著(P>0.05),其余差异显著.从整体来看,随土层深度增加,芦苇、黄花蒿植被下土壤淀粉酶活性呈下降趋势,这与李红琴等[8]的研究结论一致.

图5 土壤淀粉酶垂直方向比较分析
由图6可见,芦苇、碱草、碱蓬、黄花蒿植被各土层之间的土壤纤维素酶活性差异均显著(P<0.05).从整体来看,0~40 cm土层随土层深度增加,芦苇、碱蓬植被下土壤纤维素酶活性呈上升趋势,芦苇、碱草、黄花蒿植被下土壤纤维素酶活性最低值出现在40~60 cm土层.
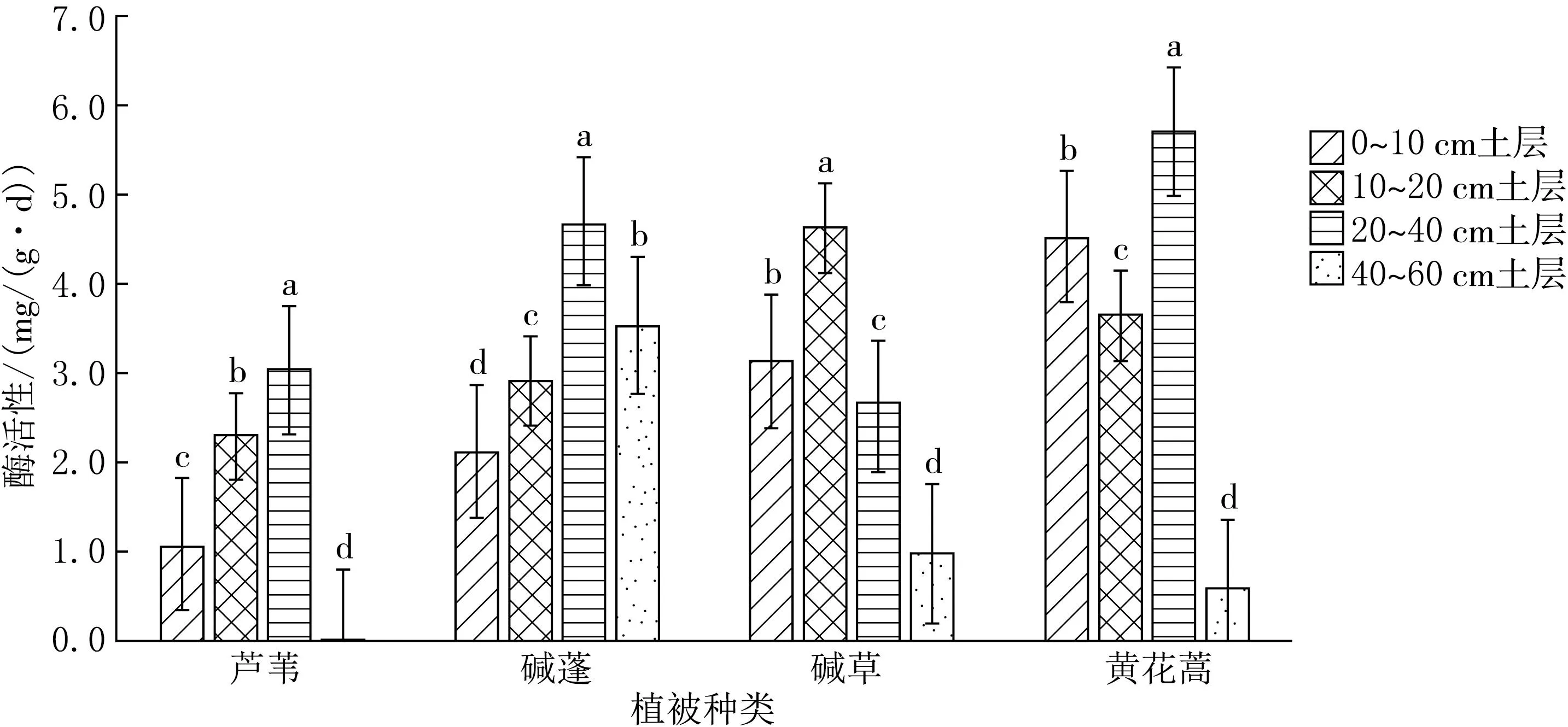
图6 土壤纤维素酶垂直方向比较分析
通过比较分析可知,不同深度土层4种植被下土壤碳代谢相关酶活性差异多表现为显著(P<0.05).
3.2 土壤含水量、电导率及pH值的测定结果与分析
土壤含水量测定结果表明,芦苇、碱蓬、碱草3种植被下土壤含水量最大值均出现在0~10 cm土层,最小值均出现在40~60 cm土层,表现为随土层深度增加含水量降低的趋势;黄花蒿植被下土壤含水最大值出现在40~60 cm土层,最小值出现在0~10 cm土层,表现为随土层深度增加含水量升高的趋势.芦苇植被下土壤含水量为24.5%~14.8%,垂直变异系数为20.84%;碱草植被下土壤含水量为19.4%~12.9%,垂直变异系数为17.85%;碱蓬植被下土壤含水量为14.1%~12.5%,垂直变异系数为5.9%;黄花蒿植被下土壤含水量为9.2%~12.5%,垂直变异系数为13.38%.
土壤电导率测定结果表明,碱草植被下土壤电导率最高,为(551.50±127.75)μS/cm;其次为芦苇植被下土壤,电导率最高值为(317.05±136.10)μS/cm;碱蓬植被下土壤电导率为(110.85±41.25)μS/cm;黄花蒿植被下土壤电导率最低,为(56.22±19.63)μS/cm.芦苇植被下土壤电导率最低值出现10~20 cm土层,总体上呈现出随着土层深度的增加而逐渐上升的现象;其他3种植被下土壤电导率均随着土层深度的增加而逐渐升高.土壤含盐量、土壤中的金属离子含量、土壤中有机物质(如腐殖酸)含量对土壤电导率具有重要影响[9].土壤的电导率能直接反映出土壤混合盐的含量[10],碱蓬和黄花蒿植被下土壤电导率较低,表明了碱蓬和黄花蒿可降低土壤盐分的作用.从土壤电导率随着土层深度的增加而升高这一现象来推测,深层土壤比浅层土壤含盐量高,且随土层深度的增加,金属离子发生沉积.
土壤 pH 值测定结果表明,4种植被下土壤 pH 值为7.6~8.7,偏碱性.其中,芦苇植被下土壤pH 值为8.1~8.3,碱草植被下土壤pH 值为7.7~8.7,碱蓬植被下土壤pH 值为7.6~8.3,黄花蒿植被下土壤pH 值为7.6~8.0,且均表现为随着土层深度的增加而逐渐升高.向海湿地受干旱气候影响,大气降水量远远低于蒸发量,大量盐分积累[11];降雨时,盐分下移到一定深度,蒸发时又不易溶解,致使4种植被下土壤 pH 值呈碱性,且随土层深度的增加呈现小幅度上升的趋势.
3.3 土壤碳代谢相关酶与土壤含水量、电导率及pH值的相关分析
相关分析结果(见表1)表明,3种土壤酶活性与土壤含水量均呈负相关关系,其中土壤蔗糖酶活性与土壤含水量呈显著负相关,相关系数为-0.586(P<0.05);土壤淀粉酶和纤维素酶活性与土壤含水量之间的相关关系不显著.土壤蔗糖酶和纤维素酶活性与土壤电导率均呈负相关关系,但土壤淀粉酶活性与土壤电导率呈正相关关系,相关性均不显著.3种土壤酶活性与土壤pH值均呈负相关关系,相关性也不显著.

表1 土壤酶活性与土壤环境要素相关性分析
对比分析不同植被下土壤酶活性与土壤含水量之间的关系(见表2)可见,芦苇植被下土壤蔗糖酶活性与土壤含水量呈负相关关系,土壤淀粉酶和纤维素酶活性与土壤含水量呈正相关关系,相关性均不显著;碱草植被下3种土壤酶活性与土壤含水量均呈正相关关系,相关性均不显著;碱蓬和黄花蒿两种植被下3种酶活性与土壤电导率均呈负相关关系,其中碱蓬下土壤蔗糖酶活性与土壤含水量呈显著负相关关系,相关系数为-0.980(P<0.05),其他各指标之间相关性均不显著.

表2 不同植被下土壤酶活性与土壤环境要素相关性分析
对比分析不同植被下土壤酶活性与土壤电导率之间的关系(见表2)可见,芦苇和黄花蒿两种植被下3种酶活性与土壤电导率均呈负相关关系,相关性不显著;碱草植被下土壤蔗糖酶和纤维素酶活性与土壤电导率均呈负相关关系,但土壤淀粉酶活性与土壤电导率呈正相关关系,相关性均不显著;碱蓬植被下3种土壤酶活性与土壤电导率均呈正相关关系,其中土壤蔗糖酶活性与土壤电导率呈显著正相关,相关系数为0.968(P<0.05).
对比分析不同植被下土壤酶活性与土壤pH值之间的关系(见表2)可见,芦苇和黄花蒿两种植被下3种酶活性与土壤pH值均呈负相关关系,相关性不显著;碱草植被下土壤蔗糖酶和纤维素酶活性与土壤pH值均呈负相关关系,但土壤淀粉酶活性与土壤pH值呈正相关关系,相关性均不显著;碱蓬植被下土壤蔗糖酶和纤维素酶活性与土壤pH值均呈正相关关系,但土壤淀粉酶活性与土壤pH值呈负相关关系,相关性均不显著.
4 结果与讨论
以上分析结果表明,3种土壤碳代谢酶活性平均值大体呈现为黄花蒿植被土壤最高、芦苇植被土壤最低的现象.有研究[12]表明,土壤水分、养分、温度和酸碱度改变时,都会引起土壤酶活性的变化,如土壤含水量过大会限制土壤酶活性,碱性土壤pH值与土壤酶活性有显著负相关关系.由本文的研究结果可见,4种植被土壤中芦苇土壤含水量最大、pH值最高、酶活性最低,而黄花蒿土壤含水量最小、pH值最低、酶活性最高,这一现象与大多研究结果一致.另外,芦苇植被土壤因渍水条件及较高pH值的影响,土壤通透性最差,影响了土壤酶的稳定性,也可能是导致芦苇植被土壤碳代谢酶活性低的原因之一.本研究中黄花蒿植被土壤碳代谢相关酶活性最高,这可能是因为采样时间为9月初,此时黄花蒿已停止长高,通过植株残体腐解、淋溶、根系分泌等途径向土壤释放出多种化感物质[13],促使土壤微生物数量和活性增强,导致其土壤酶活性较高.
从垂直分布看,土壤淀粉酶活性从土壤表层至深层呈逐渐递减的规律,这可能与土壤表层因积累较多的植物残体和腐殖质而导致的土壤有机质含量过高有关.张丽娜等[14]研究发现,土壤有机质含量对土壤淀粉酶活性具有强烈的直接效应.土壤淀粉酶和纤维素酶活性最低值出现在深层(40~60 cm)土壤中,表明随着土层深度的增加,土壤地下生物量随之下降,土壤有机质含量也逐渐降低,土壤根系分泌物也减少,土壤淀粉酶活性亦受到限制.在芦苇和碱蓬土壤中,土壤蔗糖酶和纤维素酶活性表现为从土壤表层至深层逐渐升高,显示芦苇和碱蓬土壤酶在深层土壤中活性较高、表层土壤相对较低,与许多其他相关的研究结果不一致,这可能与研究区土壤环境条件差异有关.土壤中的酶主要来源于土壤微生物[15],芦苇区土壤表层因积水条件导致根系正常生长活动受到抑制,也限制了土壤微生物的数量及其活性,降低了土壤酶活性;碱蓬区表层土壤板结坚硬,限制了微生物的活性,降低了土壤酶活性.土壤酶活性表层低而向深层逐渐升高的具体原因及机理尚待深入研究.
本文通过对向海湿地4种植被下土壤碳代谢相关酶活性及与环境影响因素的分析,结论如下:
(1) 4种植被土壤比较,3种土壤碳代谢酶活性大体呈现为黄花蒿植被土壤最高、芦苇植被土壤最低的现象.土壤蔗糖酶和纤维素酶活性最低值出现在芦苇植被土壤中、土壤淀粉酶活性最低值出现在碱蓬植被土壤中.多重比较分析表明3种酶酶活差异大都显著(P<0.05).
(2) 从垂直分布看,土壤蔗糖酶和纤维素酶活性在芦苇和碱蓬区表现为从土壤表层至深层(0~40 cm)逐渐升高,但在碱草和黄花蒿区土壤酶活性垂直规律不明显;芦苇、碱草和黄花蒿土壤淀粉酶活性从土壤表层至深层逐渐递减,碱草蓬区土壤淀粉酶活性垂直规律不明显.
(3) 研究区芦苇、碱草、碱蓬土壤含水量随土层深度增加而降低,但黄花蒿土壤含水量表现为随土层深度增加含水量升高的趋势,土壤含水量:芦苇土壤>碱草土壤>碱蓬土壤>黄花蒿土壤,但垂直变异系数:芦苇>碱草>黄花蒿>碱蓬.土壤电导率:碱草土壤>芦苇土壤>碱蓬土壤>黄花蒿土壤,芦苇植被下土壤电导率最低值出现10~20 cm土层,总体上呈现出随着土层深度的增加而逐渐上升的现象,其他3种植被下土壤电导率均随着土层深度的增加而逐渐升高.土壤 pH 值:芦苇>碱草>碱蓬>黄花蒿,均随着土层深度的增加土壤pH 值逐渐升高.
(4) 3种土壤酶活性与土壤含水量和土壤pH值均呈负相关关系,土壤蔗糖酶和纤维素酶活性与土壤电导率均呈负相关关系,但土壤淀粉酶活性与土壤电导率呈正相关关系.其中土壤蔗糖酶活性与土壤含水量呈显著负相关(-0.586,P<0.05),其他相关性均不显著.

