基于MRI列线图模型对乳腺良恶性结节的预测价值研究
杨巧飞, 杨 普, 毕孝杨, 李正亮, 杨璐帆, 唐艳隆*
1. 大理大学第一附属医院放射科, 云南 大理 671000; 2. 大理市第二人民医院放射科, 云南 大理 671003
据最新癌症负担数据显示,乳腺癌的发病率已超过肺癌,跃居女性癌症发病率第一位[1,2],是我国45岁以下女性癌症死亡的主要原因[3]。在以往的乳腺检查中,主要以超声、钼靶检查为主要筛查手段。随着影像检查技术的发展,磁共振成像(MRI)检查无辐射,且软组织分辨率高,能进行多参数、多方位动态增强磁共振成像(DCE-MRI),对病灶的形态学和动力学特征显示具有明显的优势,同时磁共振多功能成像(fMRI)[4]在乳腺良恶性病变的诊断及鉴别诊断中也发挥着非常重要的作用。故乳腺MRI检查已被公认为是对X线及B超不能确定的病灶的首选检查方法[5]。虽然目前有大量的研究结果显示,DCE-MRI、DWI及时间-信号强度曲线(TIC)在乳腺良恶性病变鉴别中均具有重要的鉴别诊断价值,但基于病灶具体影像特征出发构建诊断预测模型,并以此得出回归方程及列线图来预测乳腺癌风险的文献较少。本研究旨在探讨动态增强磁共振多参数成像、TIC曲线类型、ADC值在乳腺良恶性疾病中的鉴别诊断价值,并通过逻辑回归分类器构建乳腺结节的诊断预测模型,对比分析并验证联合诊断预测模型在鉴别乳腺良恶性结节的诊断效能。
1 资料与方法
1.1 一般资料
本研究经本院伦理委员会批准,所有患者均签署知情同意书。收集2019年8月至2022年10月在大理大学第一附属医院首次就诊,外科手术后均有病理结果的153位乳腺结节患者,年龄21~83岁,中位年龄48岁。入组标准:患者未行穿刺活检、乳导管造影等有创检查;未行放疗、化疗等特殊治疗。排除标准:患者病历资料不齐全者;患者图像质量差者;无术后随访者。总共205个病灶:其中恶性病灶113个,分别为浸润性导管癌72例、导管内癌21例、导管原位癌6例、小叶原位癌3例、黏液癌3例、浸润性小叶癌3例、导管内乳头状癌1例、浸润性微乳头状癌1例、恶性叶状肿瘤(含多形性脂肪肉瘤、骨肉瘤)1例、交界性叶状肿瘤1例、“Paget病”1例。良性病灶共92个,分别为纤维腺瘤27例、腺病伴导管上皮普通型导管增生15例、乳腺增生13例、纤维腺病伴囊肿12例、肉芽肿性小叶性乳腺炎8例、导管内乳头状瘤8例、慢性化脓性乳腺炎并脓肿6例、良性叶状肿瘤伴梗死2例、错构瘤1例。
1.2 扫描方法
采用TOSHIBA Vangtage Titan 3.0T MRI-3010磁共振扫描,俯卧位,使用乳腺专用相控表面线圈,双乳自然放松悬垂于线圈的双孔内。横轴位扫描采用SE序列T1WI、脂肪抑制T2WI,矢状位脂肪抑制T2WI。DWI采用单次激发自旋平面回波序列,分别选择b=0 s/mm2以及b=800 s/mm2进行扫描。采用脂肪抑制序列行横轴位及矢状位动态增强扫描,高压注射器经过肘正中静脉团注钆喷酸葡胺(Gd-DTPA),0.1 mmol/kg,流速2.0 mL/s,后用20 mL生理盐水冲管;连续扫描8期,连续无间隔采集8个时相;每个时相采集60 s。
1.3 图像后处理
所有图像传至后处理工作站,由我院3名不同年资的放射科诊断医师读片分析,当诊断意见不一致时,经协商达成一致。征象描述参照美国放射学会的乳腺影像报告和数据系统(BI-RADS)标准[6]。TIC的绘制及ADC值测量时,对照增强扫描序列,选择病灶强化最明显区域作为感兴趣区(ROI),ROI选取时应尽力避开病灶有坏死、囊变、出血或者钙化的区域,面积≥10 mm2,在分别经不同医师测量3次后取平均值作为该病灶的ADC值;TIC曲线类型,则用同样的方法放置ROI,自动生成TIC曲线。
1.4 统计学分析
数据统计分析及作图使用R3.6.3和python3.7版本联合制作完成。使用χ2检验对两组分类变量进行差异性分析,使用t检验、秩和检验对两组连续性数值进行差异性分析。采用最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)回归分析对组间差异显著(P<0.05)的所有变量进行数据降维,筛选出预测乳腺癌的独立危险因素。用训练集数据建立多因素Logistic回归分析的诊断预测模型,采用外部验证测试集数据验证模型的一致性,通过统计软件绘制受试者操作特征(ROC)曲线,并计算其曲线下面积(AUC)来评价模型区分度[7]。
2 结果
2.1 模型指标筛选
良性组与恶性组的组间差异显著指标如表1所示,对组间差异显著的指标进行Logistic单因素回归分析,保留可疑影响因素(P<0.01)。

表1 乳腺良恶性病变基线对比
由表1可知,经单因素分析显示,MRI影像特征对良恶性鉴别有统计学意义的指标数量较多,由于无法将全部影像学特征纳入预测模型,同时也为了提高分类性能,防止模型过度拟合[8],则进一步采用LASSO回归分析对众多指标进行筛选,结果如图1所示。其中ADC值、年龄、TIC曲线、病灶大小、强化特征5个变量的P<0.05,说明这几个指标是预测乳腺癌风险的独立危险因素,将其保留用于后续构建预测模型。预测模型中良恶性病变的强化程度、ADC值及TIC曲线类型对比如图2所示。

图1 LASSO分析进行数据降维结果
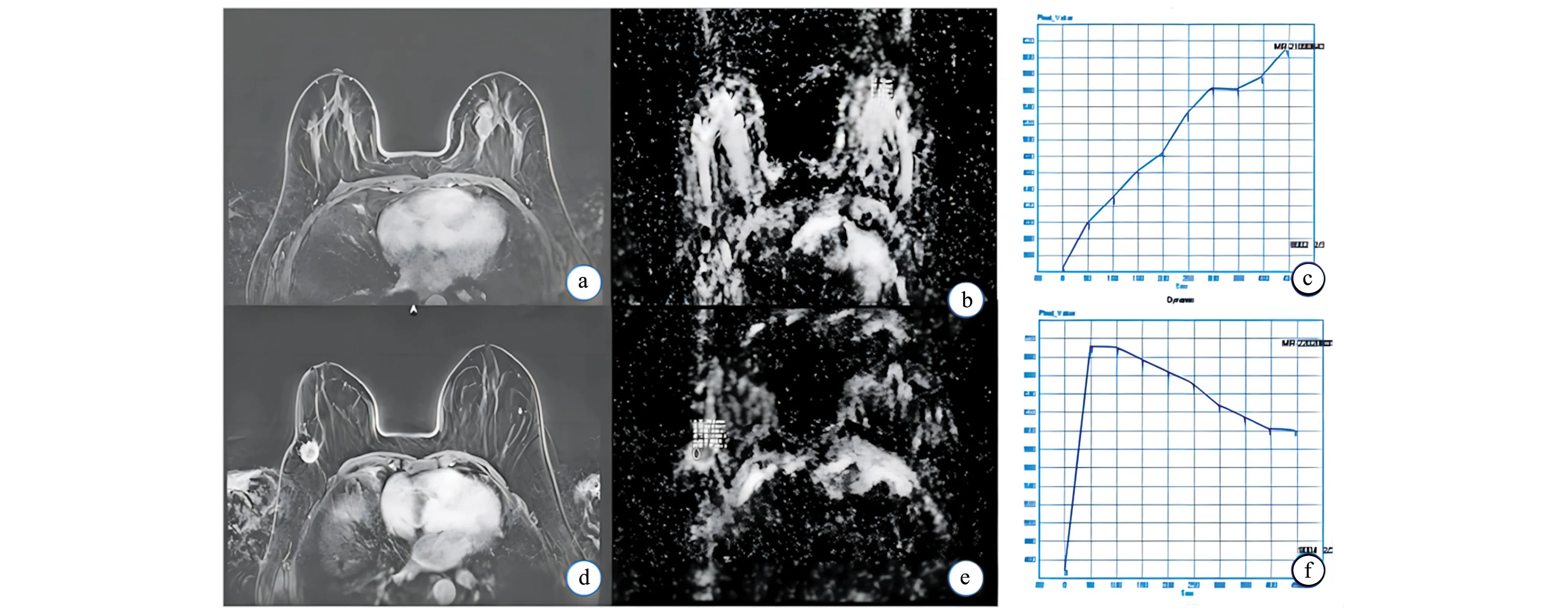
图2 良恶性病变的强化程度、ADC信号及TIC曲线类型(a)~(c) 乳腺纤维腺瘤轻度环形强化、边缘光滑,ADC高信号(1.79×10-3 mm2/s),TIC曲线呈Ⅰ型;(d)~(f) 浸润性导管癌环形强化、边缘毛刺,ADC低信号(0.88×10-3 mm2/s),TIC曲线呈Ⅲ型
2.2 模型的建立
以术后病理诊断为金标准,用分类器将205个病灶随机(测试集比例为0.15,随机种子为1)分为训练集样本(174例)和外部验证测试集样本(31例)。将上述筛选出的5个变量在训练集中使用多因素Logistic回归分析建立乳腺结节的诊断预测模型。模型各变量及对应系数输出结果见表2。
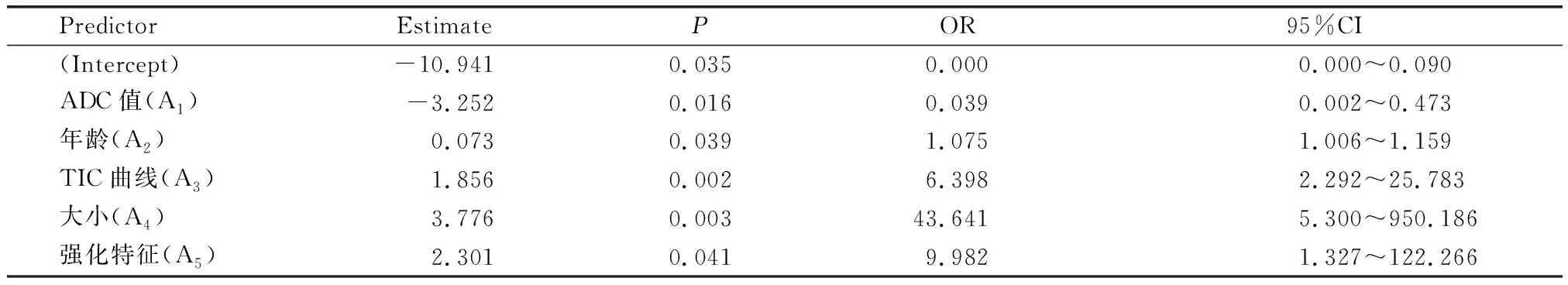
表2 Logistic回归分析模型系数表
则由表2中数据可以得出Logistic回归分析乳腺结节的预测模型回归方程[9],即:Logit(p)=-10.941-3.252×A1+0.073×A2+1.856×A3+3.776×A4+2.301×A5。模型中分类变量具体赋值见表3。此回归模型列线图如图3所示。
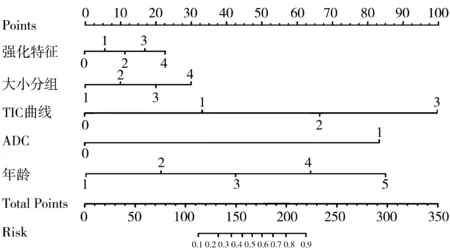
图3 预测模型列线图
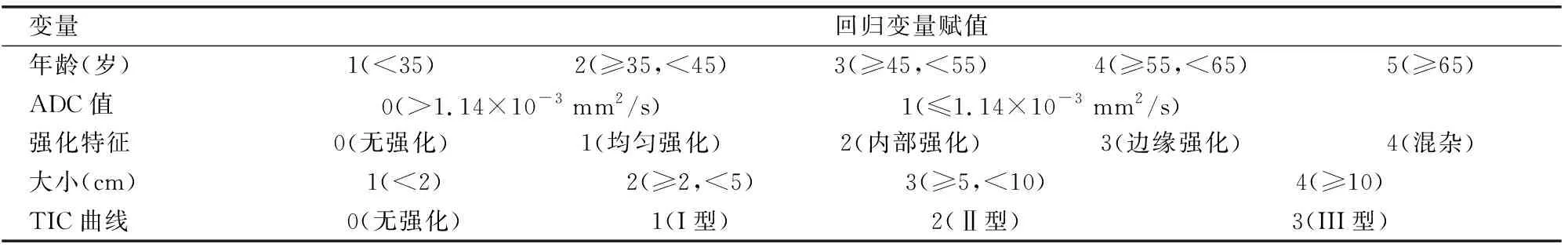
表3 预测模型各变量赋值表
2.3 模型的验证
2.3.1模型区分度验证
采用外部验证,预测模型在测试集数据中的ROC曲线见图4(a),其诊断敏感度、特异度、阳性预测值、阴性预测值分别为0.89、0.92、0.94、0.85,其AUC值为0.98;联合模型在整体样本量中较各单变量的诊断效能对比见图4(b)。由图4可知模型具有较高的区分度,其诊断效能高,且联合模型的诊断效能较各单变量诊断模型明显提高。

图4 模型在测试集数据与总样本量中的ROC曲线对比
2.3.2模型的一致性检验
预测模型系数的Omnibus检验,χ2=154.894,P<0.05;模型Hosmer-Lemeshow检验χ2=5.387,P=0.72;Cox-SnellR2=0.579,NagelkerkeR2=0.777;模型校准曲线[图5(a)]中的Briser Score=0.078;整体模型质量[图5(b)]中Briser Score可达0.93,由此说明模型显著,且拟合优度、整体模型质量均较好。

图5 预测模型校准曲线和质量对比(a)预测模型校准曲线;(b)预测模型与各单变量间整体模型质量对比
模型在研究总样本中预测结果(表4),其诊断灵敏度、特异度、AUC值分别为0.95、0.90、0.95,约登指数为0.83,最佳阈值为0.513;总体准确率达92.2%;模型Kappa值为0.695(P<0.05)。由此可知该诊断预测模型对乳腺良恶性病变的预测结果与病理结果保持高度一致性,其预测价值较高。

表4 模型在本研究样本中预测乳腺良恶性病变与实际病理诊断良恶性结果对比
3 讨论
乳腺多参数磁共振扫描在乳腺良恶性病变的诊断及鉴别诊断中具有十分重要的价值。单春辉等[10]研究显示,鉴别良恶性病变时病灶的形态学特征特异性更高,而动力学特征则敏感度更高。由于恶性肿瘤血管的生成、微血管密度的增加、肿瘤毛细血管的通透性增加,则恶性肿瘤早期可出现明显强化,而良性肿瘤则呈缓慢强化或者不强化[11,12]。本研究中良性病变以不强化、轻度强化或者均匀明显强化为主,恶性病变则以分隔强化、环形边缘强化、混杂强化为主,这与单春辉等[10]学者的研究结果一致。时间-信号强度曲线(TIC)可以直接反映肿瘤微血管的数量和组织的血供情况,而微血管的数量是良恶性肿瘤生物学特性的一个重要区别[13,14],故TIC曲线类型是乳腺良恶性病变诊断及鉴别诊断的重要标准,本研究中良性病变的TIC曲线约58.3%为Ⅰ型,恶性病变的TIC曲线约80.3%为Ⅲ型,而Ⅱ型曲线中良恶性病灶互相重叠,此时需结合其他指标进行综合分析鉴别。ADC值对鉴别良恶性有非常重要的价值,当b=800 s/mm2时,ADC值的大小依次为正常腺体>良性病变>恶性病变[14,15]。本组研究中良性病变平均ADC值为1.58×10-3mm2/s,恶性病变平均ADC值为0.87×10-3mm2/s,本次建模以1.14×10-3mm2/s为阈值鉴别良恶性病变具有较高的诊断效能,其鉴别诊断的敏感度为0.87,特异度为0.81,AUC值为0.97,约登指数为0.78。
通常影像报告出具是参照美国放射学会的乳腺影像报告和数据系统(BI-RADS)标准[6]对病变进行定性评价,但由于依靠影像特征评价病变,缺乏具体的定量指标,重复性较差,对于诊断者的要求较高。因此本次模型针对患者年龄、病灶大小、ADC值、TIC曲线类型、强化特征这5个可直接从PACS系统中读取的特征,将这些指标赋值转化为具体的量化数值列入预测模型,可预测病灶恶性的概率值,以0.51为阈值。对照模型列线图(图3),将模型中每个变量对应的分值相加得出最后的预测模型总得分,以165分为阈值,病灶总得分越高恶性概率越大,总得分越低恶性概率越小;当总得分<110分,则病变为恶性的风险为<10%;病变总分>230分时,病灶为恶性的风险为>90%。
目前已有诸多学者建立了基于影像组学特征分析不同疾病的影像诊断预测模型。影像组学需要借助自动提取工具在3D图像上提取众多肉眼无法识别的影像组学特征后统计分析建立相应的模型,而目前部分基层医院的影像诊断流程仍以借助PACS系统直接识别分析患者图像为主,有时MRI后处理及功能成像未被完全掌握时,无法通过自动提取工具获得影像组学特征,此时诊断医师只能依靠手动提取二维特征并肉眼识别进行诊断工作。故本研究中拟建立的模型主要是结合临床诊疗工作中可以直接获得的患者检查图像数据,基于快速、准确地进行乳腺MRI诊断的角度出发而构建预测模型。将影像特征诊断指标定量化、标准化,可以提高诊断的可重复性,降低诊断难度,更利于基层工作者或缺乏相应诊断经验的医师提供诊断参考[4]。
本研究存在的不足:首先,本研究中的样本均来自我院病历,为单中心研究;其次,本研究中样本量较少,虽纳入了较多乳腺良恶性病变,含“良、恶性叶状肿瘤”“Paget病”“乳腺畸胎瘤”等这类较少见的肿瘤,但数量较少,不能准确地代表这一类病变的特征,故有待进一步收集更多数目的该类病例进行多中心、前瞻性研究,使结果更具有可靠性与临床相关性[6-13],同时进一步验证此类模型列线图的诊断价值;再次,本次模型建立采用手动提取并分析二维图像特征存在一定的主观性偏倚;最后,本次研究纳入的指标仅为影像观察部分指标,因此在参照此模型预测乳腺癌风险时,还需结合其他临床相关指标综合分析。
总之,本研究基于Logistic回归分析法构建的联合乳腺多参数MRI诊断预测模型,对研究样本量中乳腺癌的预测准确率达92.2%,预测价值较高,且联合模型诊断效能明显高于各单参数指标的诊断效能,模型列线图的准确度在其他样本量中是否完全适用有待进一步研究验证,但至少说明此类型的模型搭建具有一定的潜在研究价值以及临床应用前景。

