核桃青皮在土壤重金属植物修复中的应用
朱晓丽,赵锦绣,程燕萍,张 星,寇 兵,王军强
(1.西北大学 城市与环境学院,陕西 西安 710127;2.西安金博瑞生态科技有限公司,陕西 西安 710065)
核桃是我国第二大木本油料作物,年产量超过300×104t,在核桃生产过程中会产生1 100×104t的核桃青皮[1]。然而,目前的研究大多关注核桃青皮中可利用物质的提取,无法有效满足大产量背景下核桃青皮的资源化利用。相关研究已发现[2-4],核桃青皮在修复重金属污染土壤方面具有一定的潜力,同时作为有机肥可以改善土壤肥力、提高营养元素含量和生物多样性。但核桃青皮中存在大量难降解的木质纤维素,若不进行有效处理也会对土壤造成不良影响[5-6]。
土壤是地表生态系统维持植物生长、能量循环的基础,其中蕴含着多种物理、化学以及生物变化过程[7-8]。近年来,高强度的工农业发展导致重金属污染愈发严重[9-11]。据统计,截止2014年,我国土壤重金属总体超标率超过16%,其中镉、汞、砷、铜、铅、铬、锌、镍8种重金属点位超标率分别为7.0%、1.6%、2.7%、2.1%、1.5%、1.1%、0.9%、4.8%[12]。此外,由于土壤颗粒对重金属的强吸附作用,促使其污染具有持久性和隐蔽性等特点[13],更易通过食物链传输对人体健康造成不可逆的伤害[14-15]。研究表明,长期暴露在重金属环境中会诱发心血管疾病、肺损伤、肾衰竭、胃痛、骨折、不孕不育和心理障碍等疾病[16-18]。因此,土壤重金属污染治理已迫在眉睫。
目前常用的修复方法中,微生物技术因其操作简单、成本低等独特优点,受到国内外学者的关注[19],被广泛应用于污染土壤的改良[20-23]。相关研究表明,硫酸盐还原菌可以将环境中的硫酸根离子还原成硫离子,并与重金属离子结合生成沉淀物,从而达到钝化重金属的目的。研究显示,接种硫酸盐还原菌后,土壤中生物可利用Cu和Cd的含量分别下降了85%和31.26%[24-25]。然而,微生物修复存在周期长、存活率低等局限性[26]。选择合适的载体固定功能微生物,能够有效改善微生物原有的栖息环境,提高其活性。因此,本研究以核桃青皮有机肥为对象,探讨了接种硫酸盐还原菌对土壤重金属固定化、植物生长及重金属富集能力的影响。
1 实验材料与方法
1.1 实验原材料及培养基
核桃青皮来源于陕西省西安市,品种为香玲;供试土壤采自西北大学校园树林园地;供试植物为青菜,种子购置于北京奇新农业科技发展有限公司,品种为四月慢;实验所用木质纤维素及胡桃醌多功能降解菌(M2、M7、X1、X2)为核桃青皮发酵过程中筛选得到的优势菌株,其中M2为纺锤形赖氨酸芽孢杆菌,M7为微白黄链霉菌,X1为杂色曲霉,X2为球孢白僵菌;硫酸盐还原菌(SRB 15-3-2)为课题组前期从陕西省宝鸡市凤县铅锌矿周围土壤筛选并驯化的Cu和Cd耐受菌株,经鉴定为肠杆菌[27]。
碱木质素培养基(M7):硫酸铵2 g,七水合硫酸镁 0.5 g,磷酸氢二钾 1 g,氯化钠 0.5 g,碱木质素5 g,蒸馏水1 000 mL。
LB培养基(M2、X1、X2):氯化钠 10 g,蛋白胨10 g,酵母提取物5 g,蒸馏水1 000 mL。
硫酸盐还原菌培养基:磷酸氢二钾 0.5 g,硫酸铵 2.5 g,碳酸铵 0.5 g,氯化钙 0.2 g,硫酸镁 1.0 g,酵母膏 1.5 g,乳酸钠 2 mL,在烧杯中用蒸馏水溶解至1 000 mL,调节pH为7.2,温度为121 ℃,灭菌30 min。使用前将L-半胱氨酸盐酸盐置于紫外灯下射杀4 h,用无菌水配制成溶液,再加入灭过菌的培养基中,使其浓度为0.5 g/L。
植物生长营养液:铁盐溶液,七水合硫酸亚铁 2.78 g,乙二胺四乙酸二钠3.73 g,500 mL蒸馏水,pH为5.5;微量元素液,碘化钾0.83 mg,硼酸 6.2 mg,硫酸锰 22.3 mg,硫酸锌 8.6 mg,钼酸钠 0.25 mg,硫酸铜 0.025 mg,氯化钴 0.025 mg,定容至1 000 mL;Holand营养液,二水硝酸钙 0.95 g,硝酸钾0.51 g,硝酸铵 0.08 g,磷酸二氢钾0.136 g,硫酸锰 0.49 g,上述铁盐溶液2.5 mL,上述微量元素液5 mL,定容至1 000 mL。
1.2 实验方法
1.2.1 核桃青皮发酵产物
将前期筛选出的菌株X1、X2、M2、M7分别置于碱木质素培养基和LB培养基中,在25 ℃、120 r/min培养箱中培养1 d,成为菌剂。取粉碎至半固体状态的核桃青100 g,分别皮置于12个250 mL锥形瓶中,高温灭菌后,将菌液(OD=1)按照5%的比例分别添加菌剂X1、X2、M2、M7于对应的锥形瓶中,在25 ℃、120 r/min培养箱中发酵21 d,得到核桃青皮发酵产物(W)。
1.2.2 核桃青皮发酵产物性质及功能测定
含水率:称取鲜样10 g,105 ℃烘干至恒重后测定干重,计算含水率。
pH:核桃青皮发酵产物风干后研磨并过1 mm筛,按照1∶10(m/V)的比例加入去离子水混合,常温下静置30 min,用pH计测定。
堆肥产物营养物质(N+P2O5+K2O)参照有机肥料标准(NY/T 525—2021)[28]测定。
种子发芽指数和种子发芽率[28]:称取试样(鲜样)10 g,置于250 mL锥形瓶中,按照含水率折算后的固液比1∶10(m/V)加入相应质量的水,在25 ℃的恒温振荡器中浸提1 h,取下静置1 h后,进行过滤收集浸提液,浸提液当天使用。在培养皿上放置1张定性滤纸,放入50粒大小一致、颗粒饱满的青菜种子,加入上述浸提液10 mL,盖上培养皿盖,在25 ℃培养箱中避光培养48 h,统计发芽种子的粒数,并用游标卡尺逐一测量主根长。通过公式(1)计算种子发芽指数(GI),通过公式(2)计算种子发芽率(GR)。
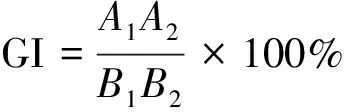
(1)
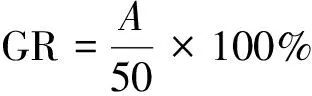
(2)
式中:A为核桃青皮发酵产物中浸提液培养下的种子发芽粒数;A1为核桃青皮发酵产物中浸提液培养下的种子中发芽粒数百分比(%);A2为核桃青皮发酵产物中浸提液培养的种子平均根长(mm);B1为水培种子中发芽粒数百分比(%);B2为水培种子的平均根长(mm)。
1.2.3 核桃青皮土壤改良剂的制备
有机肥(F): 将核桃青皮冲洗, 105 ℃烘干后粉碎, 过1 mm筛, 备用。 核桃青皮置于马弗炉内, 700 ℃条件下缺氧炭化2 h, 研磨过1 mm筛后制备得到生物炭[29]。 将核桃青皮发酵产物与生物炭分别按照0.8∶0.2、 0.6∶0.4、 0.4∶0.6、 0.2∶0.8的比例混合均匀,制备有机肥(F)。以有机肥料标准(NY/T 525—2021)中对pH、含水率要求作为考察指标,优选最佳核桃青皮发酵产物与生物炭配比。
固定化菌剂(XF): 将SRB15-3-2接种于有机肥(F)共同发酵7 d, 得到固定化菌剂。 以1%的接种量分别向Cu和Cd污染的土壤中添加固定化菌剂。
1.2.4 盆栽实验
土壤风干、研磨过2 mm筛,按1∶3比例混合沙土作为盆栽供试土壤。分别添加有机肥(F)和固定化菌剂(XF),同时以不添加物料作为对照组(CK),探究F和XF对土壤肥力提升、重金属钝化及植物生长的影响,具体见表1。
选用籽粒饱满、 大小均匀的青菜(四月慢)种子, 经5%过氧化氢(H2O2)溶液消毒5 min后, 用去离子水冲洗3~5次, 用吸水纸吸干种子表面水分, 置于育苗盘中育苗, 待长出3~4片叶子后, 挑选长势一致的幼苗移植至盆中。 幼苗移栽后保持土壤含水量为田间最大持水量的60%, 并定期施用Holand营养液。 生长45 d后收获青菜植株,测量其株高, 并分别记录地上和地下的鲜重和干重[30]。
1.2.5 重金属分析方法
将待测样品烘干,磨碎过1 mm筛,称0.5 g加入适量HNO3-HClO4,采用微波消解仪消解,通风橱赶酸后稀释,以空白消解液为对照,ICP-OES测定重金属含量[26]。采用Tessier连续提取法分析土壤样品中 Cu和Cd的赋存形态。
2 结果与分析
2.1 发酵过程中核桃青皮性质的变化
2.1.1 pH和含水率
pH和含水率是影响发酵效果的重要参数。图1(a)是接种不同菌株后核桃青皮发酵21 d的pH变化情况,发酵产物pH呈弱酸性,范围为4.23~4.86。主要原因在于微生物通过矿化或腐解作用将核桃青皮中的有机物转化为有机酸、腐殖质类物质[31]。

图1 发酵过程中pH和含水率的变化Fig.1 Changes in pH and moisture content during fermentation
核桃青皮发酵产物的含水率变化情况如图1(b)所示,发酵过程中含水率维持在85%以上,且随着发酵过程进行,产物含水率变化不显著。本研究在室内锥形瓶中进行堆肥,微生物在分解核桃青皮有机组分过程中会产生水等产物,而锥形瓶通风效果差,水分无法扩散,这与常规堆体发酵过程中含水率下降趋势不同[32-34]。
2.1.2 营养元素含量
氮、磷、钾和有机质是维持微生物生存的基本物质条件。如图2(a)所示,发酵后的核桃青皮中的总氮含量均增加,产生此现象的原因可能为接种菌剂后促进了核桃青皮发酵过程中的氨化和硝化反应[35]。此外,与CK组相比,M7发酵前后总养分含量没有显著性差异,且总钾+总氮+总磷含量大于4%,符合有机肥料标准(NY/T 525—2021)要求。如图2(b)所示,添加菌剂后,由于微生物分解蛋白质、糖类等营养物质,使得发酵产物中有机质含量均出现下降[36]。与CK组相比,接种M7和X2的核桃青皮发酵产物无显著性差异,仍保持了较高的有机质含量,分别为56.09%和61.37%。综上可知,经M7发酵后的核桃青皮更适合开展后续的研究。
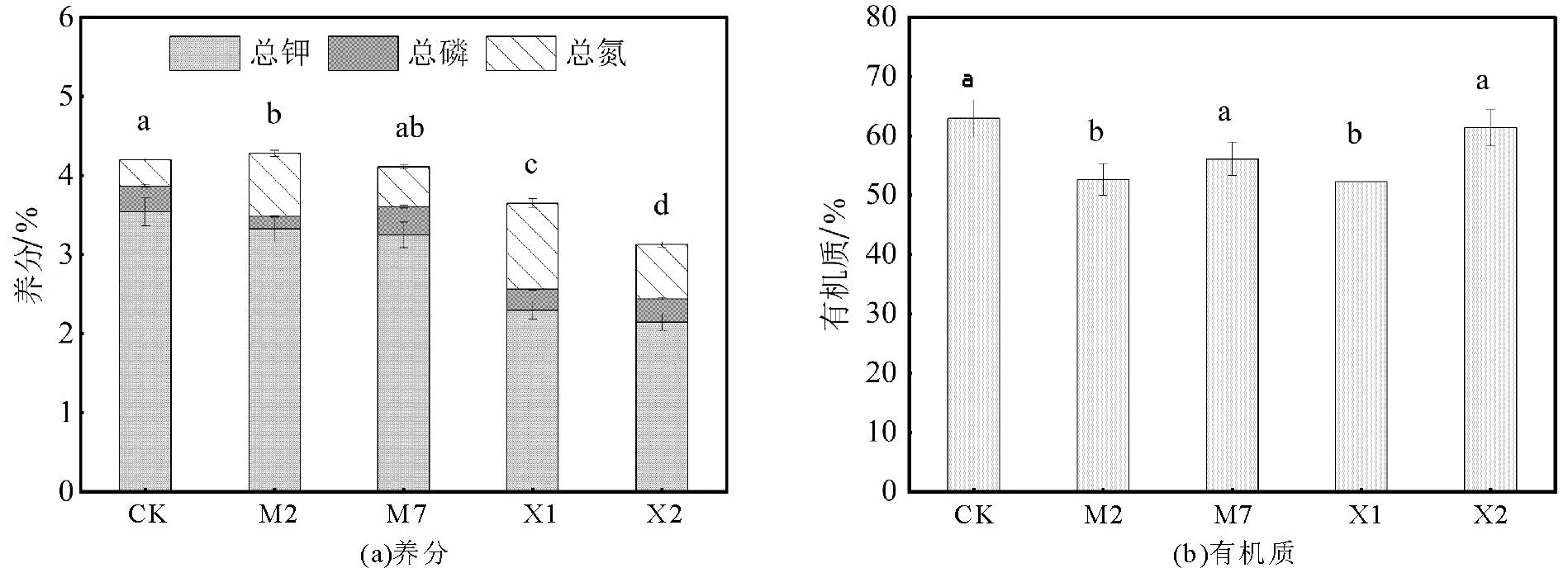
图2 发酵过程中总养分和有机质的变化Fig.2 Changes in total nutrients and organic matter during fermentation
2.1.3 腐熟度
发芽率及发芽指数(GI)是判断堆肥腐熟度的重要指标[37]。相关研究表明,GI达50%以上时,可认为该堆肥产物对种子无害;GI大于70%时,将满足有机肥标准对肥料腐熟度的要求[38]。随着发酵过程的进行,种子发芽指数和发芽率均显著提高(见图3)。这主要是由于发酵初期堆肥样品中含有高浓度的酚酸等生长抑制物质[39],这些物质在发酵过程中会逐渐被微生物转化或降解[40]。当发酵到第21 d时,接种菌剂M7的核桃青皮发酵效果最好,GI值最高,相比于CK组,接种M7菌剂使发酵产物GI提高了15%。
综合上述,M7菌株在营养元素提升和核桃青皮腐熟过程中均具有较好的效果,因此,选取木质纤维素及胡桃醌多功能降解菌M7作为核桃青皮发酵菌株。
2.2 核桃青皮发酵产物与生物炭配施
上述发酵实验结果表明,核桃青皮发酵产物(W)的pH低、含水率高,不符合土壤有机肥的施用标准。生物炭(B)是一种在缺氧环境下由生物质热化学转化而来的碱性固体材料,具有丰富的微孔结构和保水性,与核桃青皮发酵产物配施能够改良其特性[41-42]。如表2所示,当生物炭配施比例从20%提升至80%时,核桃青皮发酵产物的pH从5.46增加至9.28,含水率从70.41%降低至16.41%。其中,在生物炭配施比例为60%时,制备的有机肥(F)满足土壤有机肥施用标准要求(pH为5.5~8.5,含水率≤30%)。
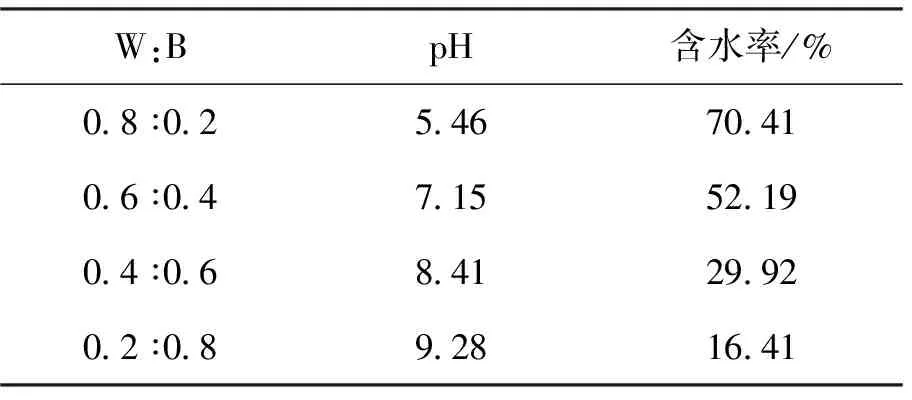
表2 发酵产物和生物炭的配比Tab.2 Proportion of fermentationproducts and biochar
2.3 固定化菌剂对青菜生长的影响
硫酸盐还原菌是一类具有还原特性的厌氧微生物, 将SRB15-3-2接种于有机肥(F)共同发酵7 d, 得到固定化菌剂(XF)。 株高和生物量是反应植物对环境耐受性的重要指标[43]。 固定化菌剂对植物生长的影响如图4所示, 相比于对照处理(CK), 施加有机肥(F)提高了青菜的株高及地上部分生物量, 分别增加了0.18%和6.74%。 研究表明, 有机肥能够改善土壤理化性状, 加强土壤有益微生物的活动, 促进有机物分解转化, 产生多种营养物质和刺激性物质, 这又反过来刺激微生物的生长发育, 促进作物生长[44-46]。 因此, 有机肥为青菜生长及生物量累积提供了必要的营养源。

图4 植物生理指标的变化Fig.4 Changes in plant physiological indicators
重金属在进入作物体内后,会产生氧化应激反应,从而对作物生长产生抑制作用[47-48]。与CK组相比,Cu CK和Cd CK处理组中青菜的株高分别降低了13.24%和14.40%,鲜重分别降低了31.22%和10.52%,地下干重分别降低了50.39%和37.64%,均表现为显著的抑制作用。相较之下,施加XF后,Cu XF和Cd XF处理组青菜的株高和生物量均有所提升,该结果表明固定化菌剂抑制了Cu和Cd对青菜的毒性作用,并对青菜生长产生显著的促进作用。Li等人研究发现,硫酸盐还原菌可以通过产生的硫化物形成沉淀使重金属Cu2+和Cd2+离子转化为高稳定性的硫化物[49],从而降低了Cu2+和Cd2+对植物的抑制作用。表明接种SRB15-3-2后的有机肥对植物生长及缓解土壤重金属毒性具有良好的作用。
2.4 固定化菌剂对土壤Cu和Cd形态的影响
各处理组土壤中Cu和Cd的形态分布结果如图5所示。添加固定化菌剂后,土壤中Cu和Cd的可交换态占比均出现下降,残渣态占比均出现提升,这与王晓宇等的研究结果一致[50]。相比于CK组,Cu XF处理组可交换态Cu含量下降了26.67%,残渣态Cu含量升高了74.23%;Cd XF处理组可交换态含量下降0.68%, 残渣态含量升高21.74%。 因此, 有机肥的高比表面积和多孔特性可能在Cd的钝化过程中起着更重要的作用[51-52]。 与常规研究不同, 本研究发现固定化菌剂处理导致重金属碳酸盐结合态升高, 这可能是由于生物炭材料的加入使得pH值升高,使土壤中部分无机碳向CO32-转化[53-54]。 此外, 固定化菌剂处理对不同种类重金属的形态转化能力存在差异, 相比于Cd, Cu可交换态及残渣态含量变化幅度更为显著。 Cu XF处理组中未检出可交换态含量,残渣态含量从48.02%升高至83.67%。 综上所述, 添加固定化菌剂后促进了重金属向更稳定的形态转化, 从而降低了土壤Cu和Cd的可利用性。

图5 土壤重金属形态的变化Fig.5 Changes of heavy metal forms in soil
2.5 固定化菌剂对青菜富集Cu和Cd能力的影响
2.5.1 固定化菌剂对青菜Cu和Cd含量的影响
施加固定化菌剂后,青菜地上和地下部分重金属含量变化结果如图6所示。Cu XF和Cd XF处理组青菜的地上与地下部分的重金属含量均出现下降低。相比于CK处理组,施加固定化菌剂(XF)后,青菜地下部的Cu和Cd含量分别降低了92.9%和72.8%,表明固定化菌剂对重金属有显著的固定作用;地上部的Cu含量降低了34.0%,而Cd含量降低了3.3%,表明固定化菌剂对Cu的固定作用比Cd显著。产生此现象的主要原因有2个:①固定化菌剂处理改变了土壤中重金属的赋存形态,促使Cu和Cd从可交换态向碳酸盐结合态和残渣态转化(见图5),降低了Cu和Cd的生物可利用性;②微生物群落在植物富集重金属过程中也扮演着重要作用, 发酵过程接种的微白黄链霉菌株(M7)及核桃青皮本身赋存的肠杆菌株(M2)均属于典型的根际促生细菌[55], 它们能够通过分泌有机酸、 氨基酸和固醇等小分子有机物, 缓解重金属对植物的毒性胁迫, 降低植物对重金属的吸收、 富集和迁移能力, 协助植物在劣势环境中生长, 最终提高植物修复效率[56]。
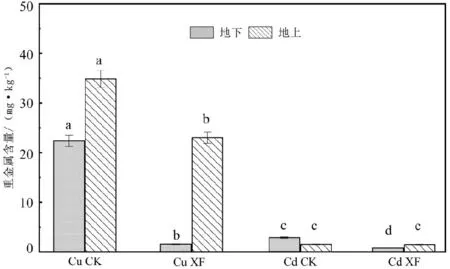
图6 固定化菌剂对青菜重金属含量的影响Fig.6 Effect of restorative on heavy metal content in Chinese cabbage
2.5.2 固定化菌剂对青菜中转运系数的影响
生物富集系数(bioaccumalation factro, BCF)是植物体内重金属含量和土壤重金属含量的比值[57], 代表植物对土壤中重金属Cu和Cd的富集程度[58]。 固定化菌剂处理后的青菜地上可食用部分Cu和Cd富集系数如表3所示, 添加固定化菌剂后, 生物密集系数均低于CK组, 这表明SRB15-3-2抑制了青菜对重金属的富集。青菜对土壤中不同重金属的富集能力也存在差异,青菜对Cu和Cd的富集系数分别为0.49和2.62,表明相比于Cu, 对Cd的富集能力更强。转运系数(translocation factor, TF)[59]是植物地上部分和地下部分重金属含量的比值,反映了植物对重金属的移位能力[60]。实验结果表明(见表3),添加固定化菌剂后,青菜对Cu和Cd的转运系数均低于CK组,进一步证明本研究的固定化菌剂抑制了重金属从地下部向地上部的转运。

表3 青菜对重金属的富集系数和转运系数Tab.3 Bioaccumulation factors and translocation factor of Cu and Cd in Chinese cabbage
3 结论
1)接种4种菌剂后的核桃青皮发酵产物中,氮、磷、钾的总含量均大于4%,满足有机肥料标准(NY/T 525-2021)中对营养元素含量的要求。4种菌剂中M7对总养分和有机质含量的综合提升效果最佳,发酵效果最好,GI值最高。因此,优选出M7作为核桃青皮发酵菌株,并与生物炭按照0.4∶0.6的比例配施制备成有机肥(F)。
2)当土壤中Cu和Cd含量分别达到100 mg/kg和1 mg/kg时,青菜生长受到重金属胁迫的抑制。固定化菌剂施加促进了青菜生长及生物量累积,并且缓解了Cu和Cd对青菜的毒性作用。与CK组相比,Cu XF和Cd XF处理组中青菜的株高分别增加了12.62%和5.42%,地上部分干重分别增加了95.05%和 47.93%。
3)施加固定化菌剂后,土壤中Cu和Cd的可交换态占比均出现下降,残渣态占比出现提升。固定化菌剂降低了土壤中Cu和Cd的生物活性,缓解了重金属对植物的毒性作用。同时固定化菌剂在重金属的稳定化过程中起到了核心作用。相比于CK组,施加固定化菌剂后青菜根部的Cu和Cd含量分别降低了92.92%和72.83%,叶部的Cu和Cd含量分别降低了34.00%和3.30%。
综上,固定化菌剂促进了青菜生长,提高了生物量。有效降低了土壤重金属的生态风险,并抑制了青菜对重金属的富集作用。本研究结果为重金属污染土壤修复和蔬菜作物安全生产提供了理论支撑及科学依据。

